Similar presentations:
§14.Оксиды
1.
Из атомов мир создавала Природа.Два атома лёгких взяла водорода.
Прибавила атом один кислорода
И получилась частица воды,
Море воды, океаны и льды…
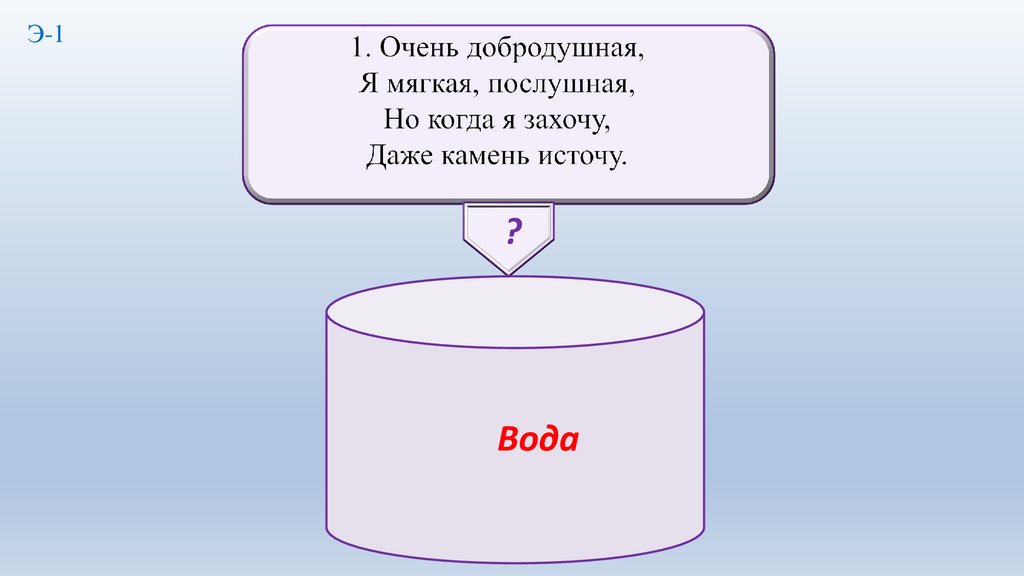
2.
Э-1?
3.
Э-1?
Вода
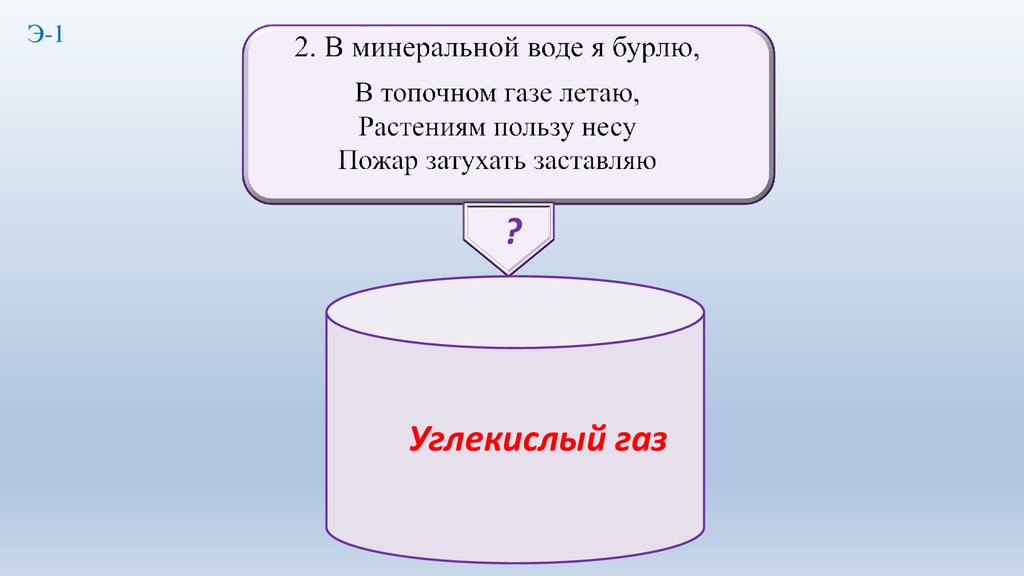
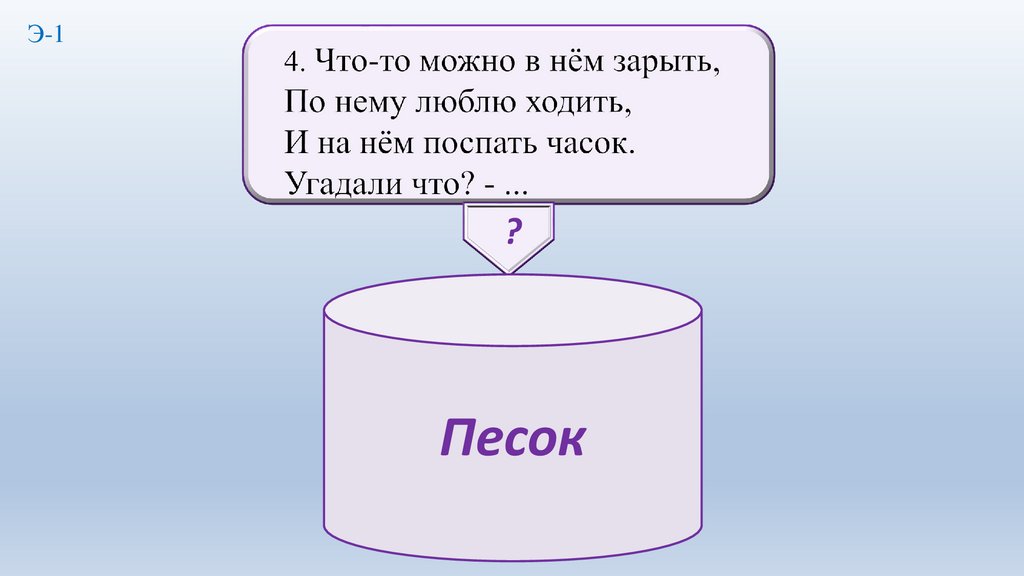
4.
Э-1?
5.
Э-1?
Углекислый газ
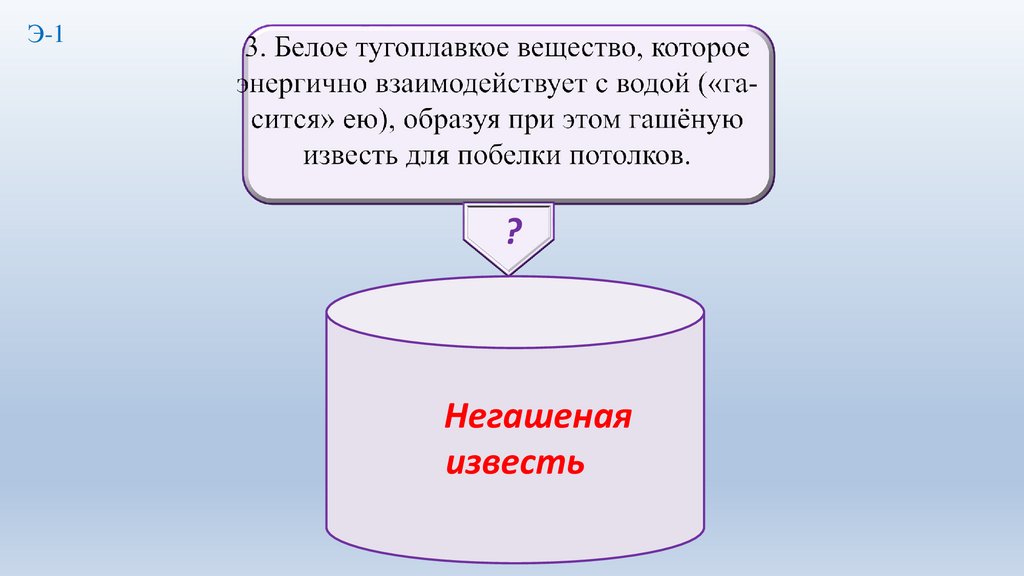
6.
Э-1?
7.
Э-1?
Негашеная
известь
8.
Э-1?
9.
Э-1?
Песок
10.
SiO2CO2
CaO
11.
§14.Оксиды.12.
План урока:1.Определение понятия «оксиды»
2.Классификация оксидов
3. Представители класса оксидов
13.
Э-1.Актуализация знанийЧто такое степень окисления?
14.
Э-1.Актуализация знанийЧто такое степень окисления?
Степень окисления-условный заряд, который приобретают
атомы, отдавая или присоединяя электроны
15.
Э-1.Актуализация знанийКак определить степень окисления у металлов?
Неметаллов?
16.
Э-1.Актуализация знанийКак определить степень окисления у металлов?
Неметаллов?
Металлы в соединениях всегда имеют положительную
степень окисления.
17.
Э-1.Актуализация знанийКак определить степень окисления у металлов?
Неметаллов?
Металлы в соединениях всегда имеют положительную
степень окисления.
Неметаллы в соединениях могут проявлять
положительную и отрицательную степени окисления.
18.
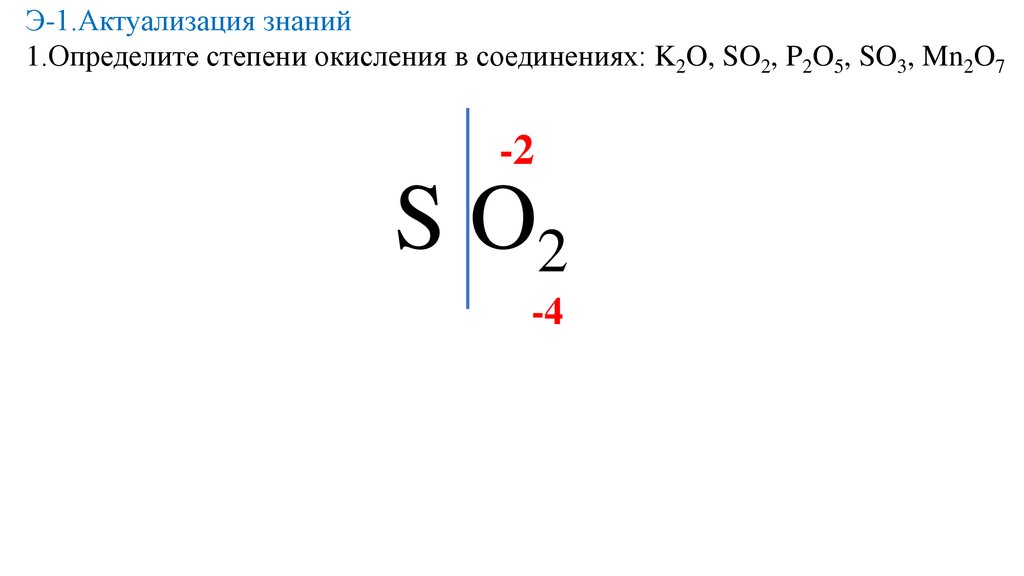
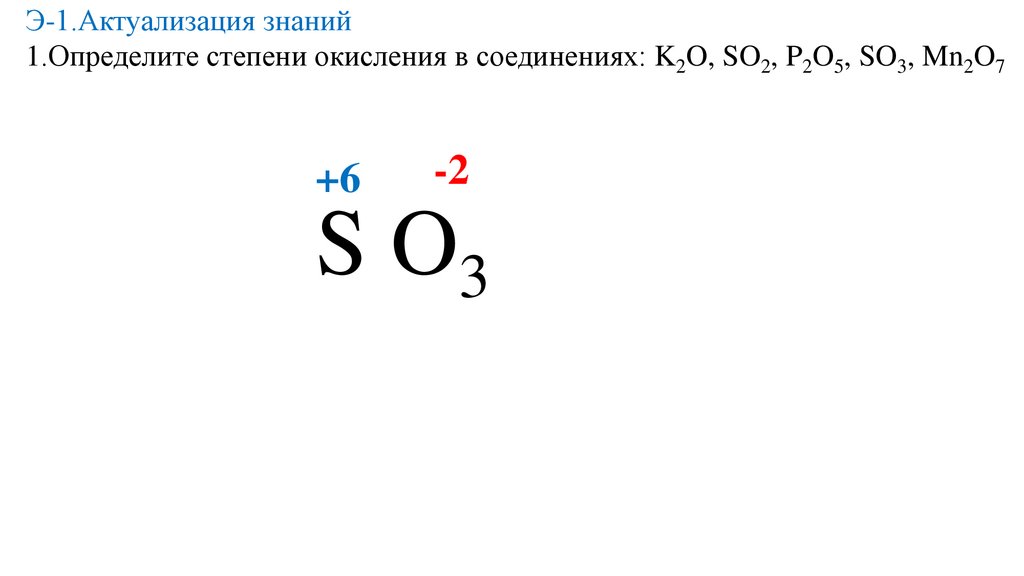
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
K2O
19.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
K2O
20.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
K2O
21.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
K2O
-2
22.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
K2O
+2
-2
23.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+1
-2
K2O
+2
-2
24.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
S O2
-4
25.
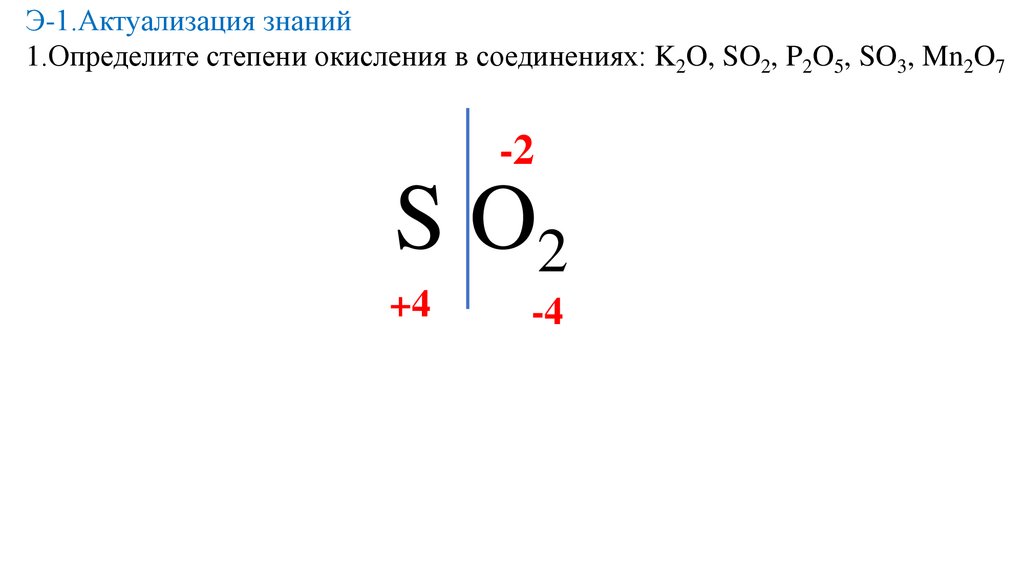
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
S O2
+4
-4
26.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+4
-2
S O2
+4
-4
27.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+4
-2
S O2
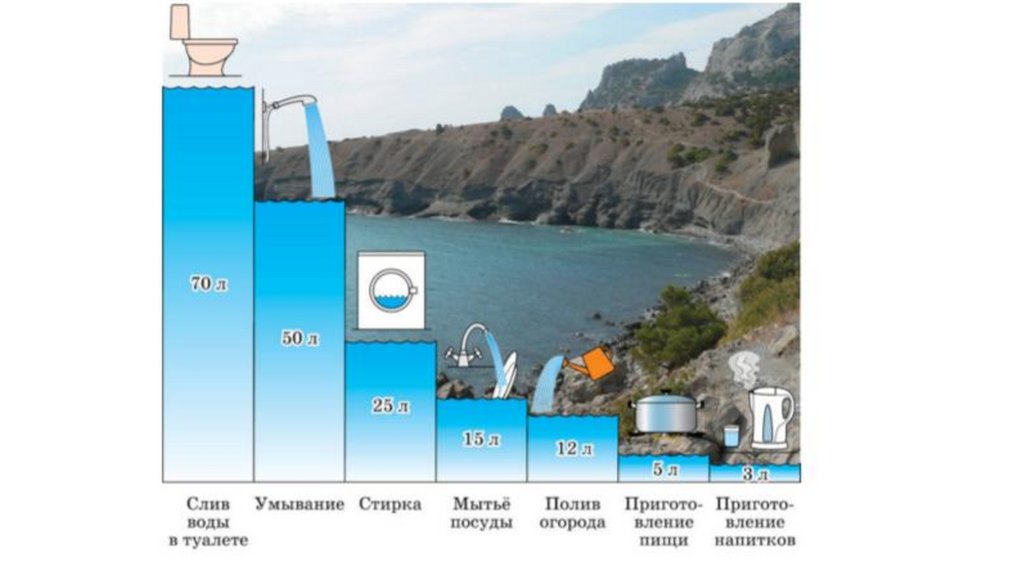
28.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
P2 O5
29.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
P2 O5
30.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
P2 O5
-10
31.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
P2 O5
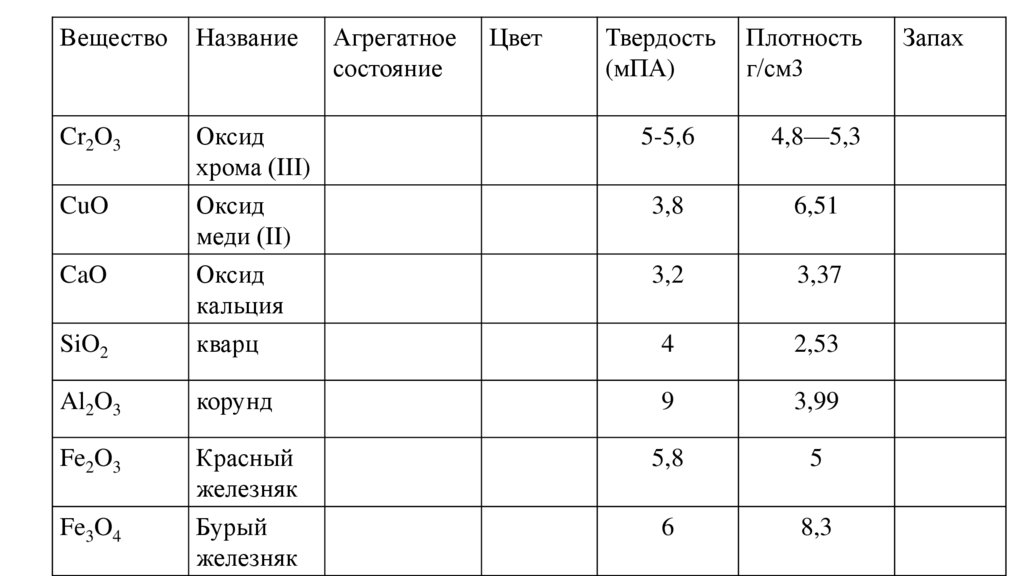
+10
-10
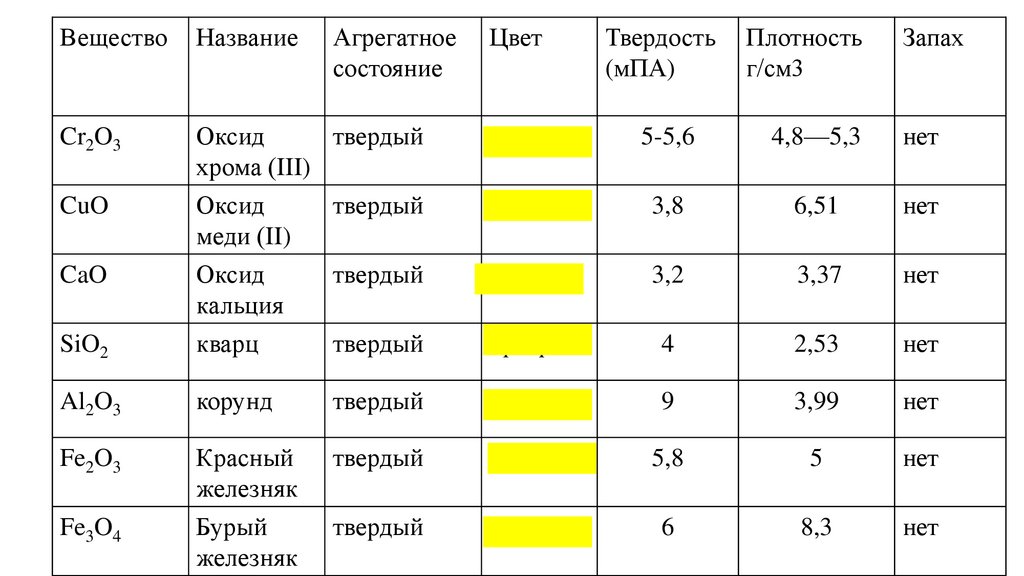
32.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+5
-2
P2 O5
+10
-10
33.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+5
-2
P2 O5
34.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
S O3
35.
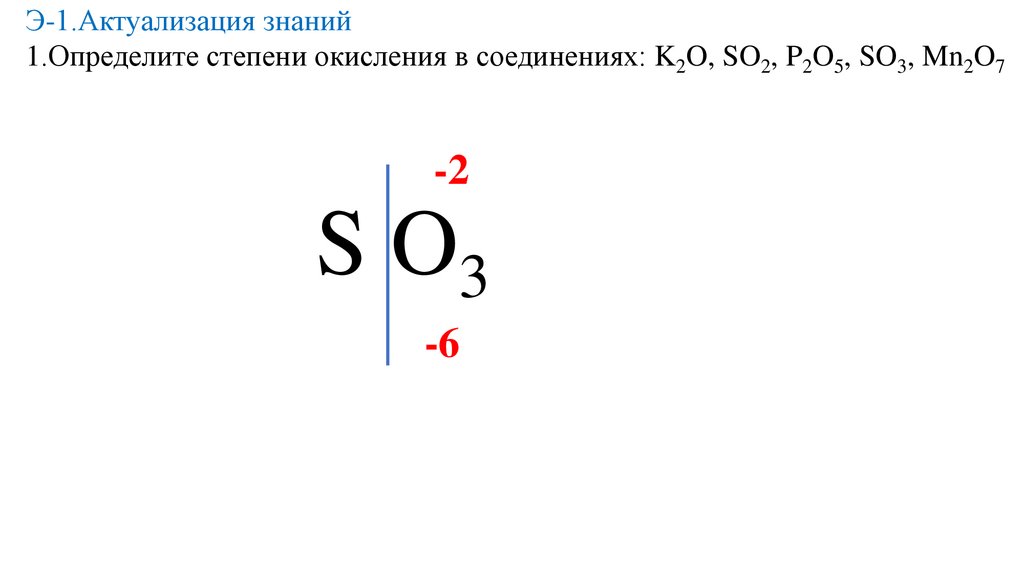
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
S O3
-6
36.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
S O3
+6
-6
37.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+6
-2
S O3
+6
-6
38.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+6
-2
S O3
39.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
Mn2O7
40.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
Mn2O7
41.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
Mn2O7
-14
42.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
-2
Mn2O7
+14
-14
43.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+7
-2
Mn2O7
+14
-14
44.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+7
-2
Mn2O7
45.
Э-1.Актуализация знаний1.Определите степени окисления в соединениях: K2O, SO2, P2O5, SO3, Mn2O7
+1
+4
-2
+5
-2
P2 O5
S O2
K2O
+7
+6
-2
S O3
-2
-2
Mn2O7
46.
Э-1.Актуализация знанийКакие соединения называют бинарными?
Бинарные соединения - это
47.
Э-1.Актуализация знанийКакие соединения называют бинарными?
Бинарные соединения - это сложные
вещества, состоящие из двух химических
элементов.
48.
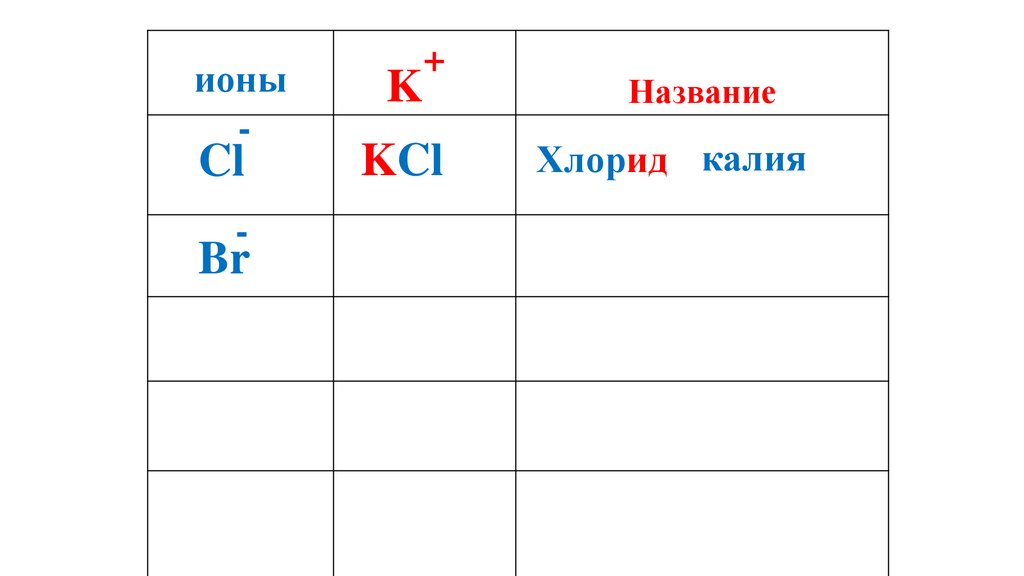
ионы-
Cl
K
+
Название
49.
ионы-
Cl
K
+
KCl
Название
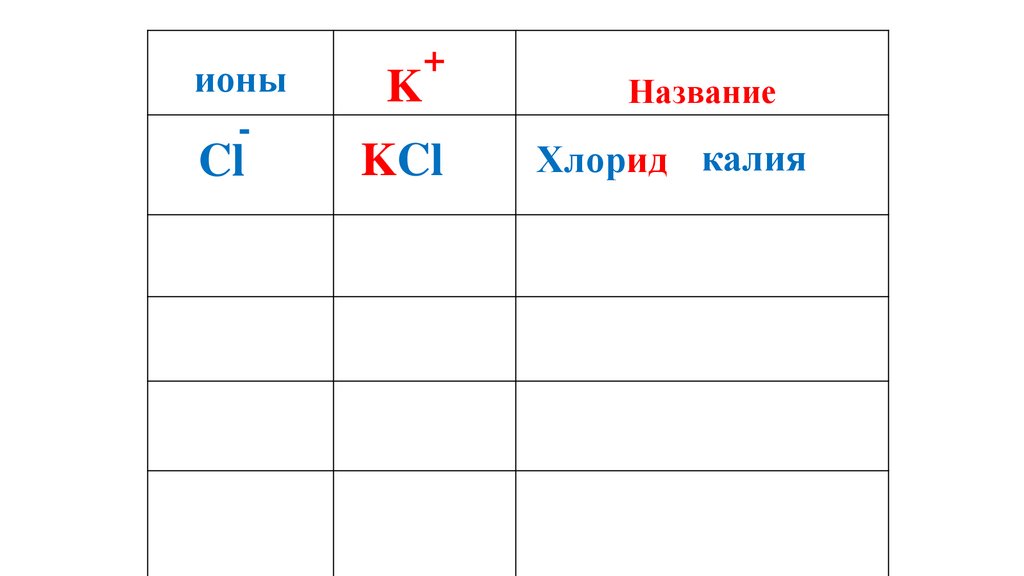
50.
ионы-
Cl
K
+
KCl
Название
Хлорид калия
51.
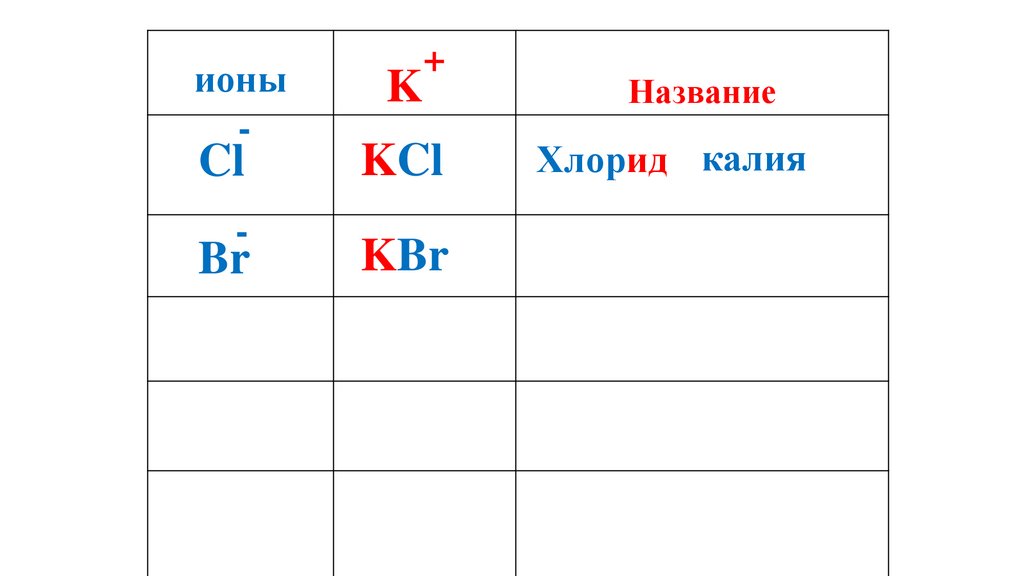
ионы-
Cl
-
Br
K
+
KCl
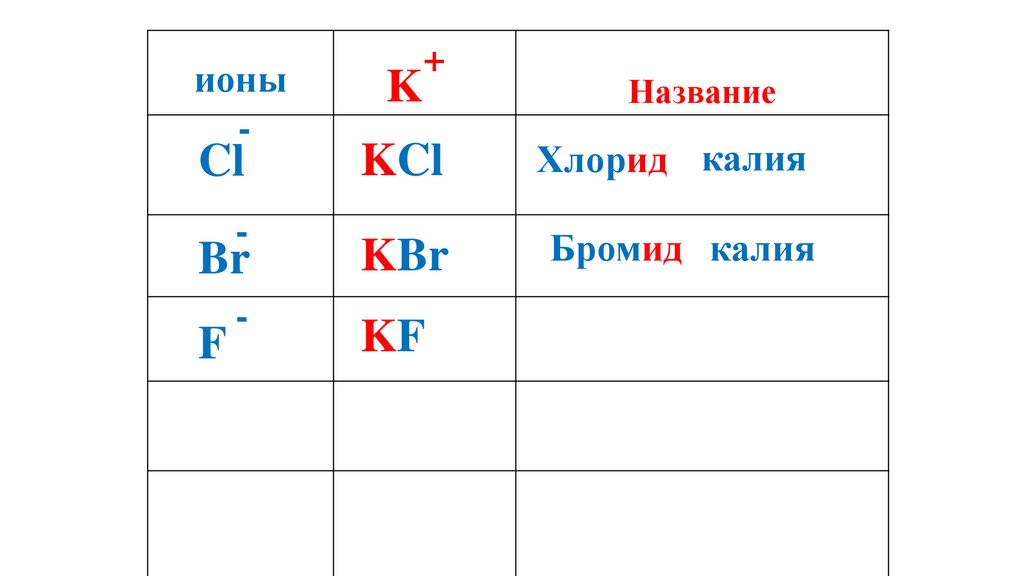
Название
Хлорид калия
52.
ионы-
Cl
-
Br
K
+
KCl
KBr
Название
Хлорид калия
53.
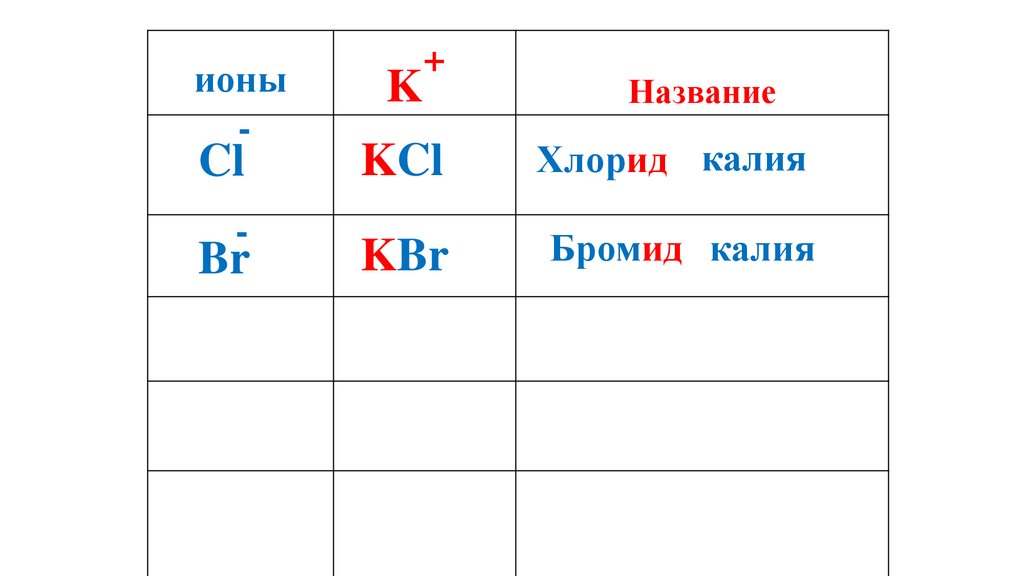
ионы-
Cl
-
Br
K
+
Название
KCl
Хлорид калия
KBr
Бромид калия
54.
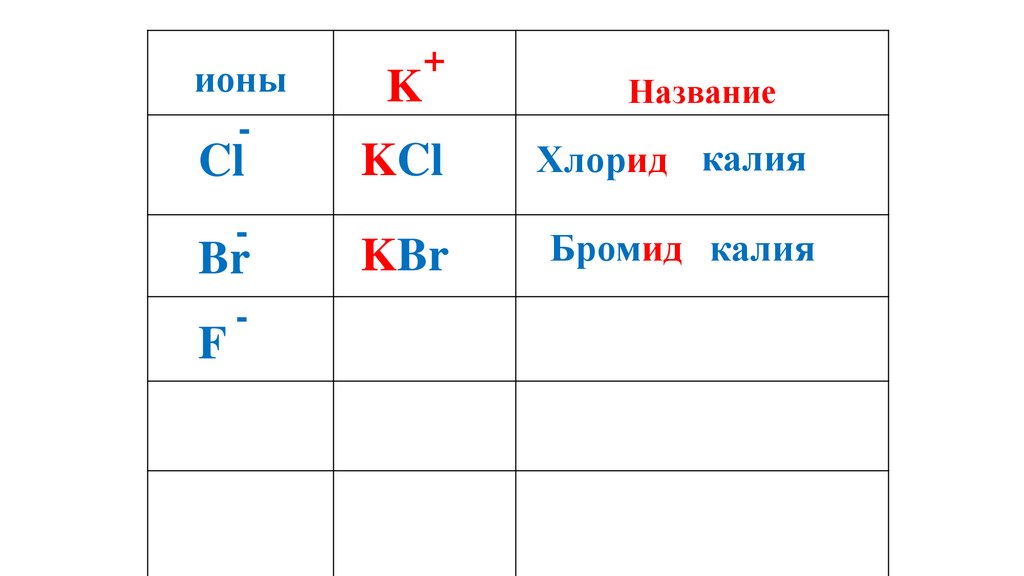
ионы-
Cl
-
Br
F
-
K
+
Название
KCl
Хлорид калия
KBr
Бромид калия
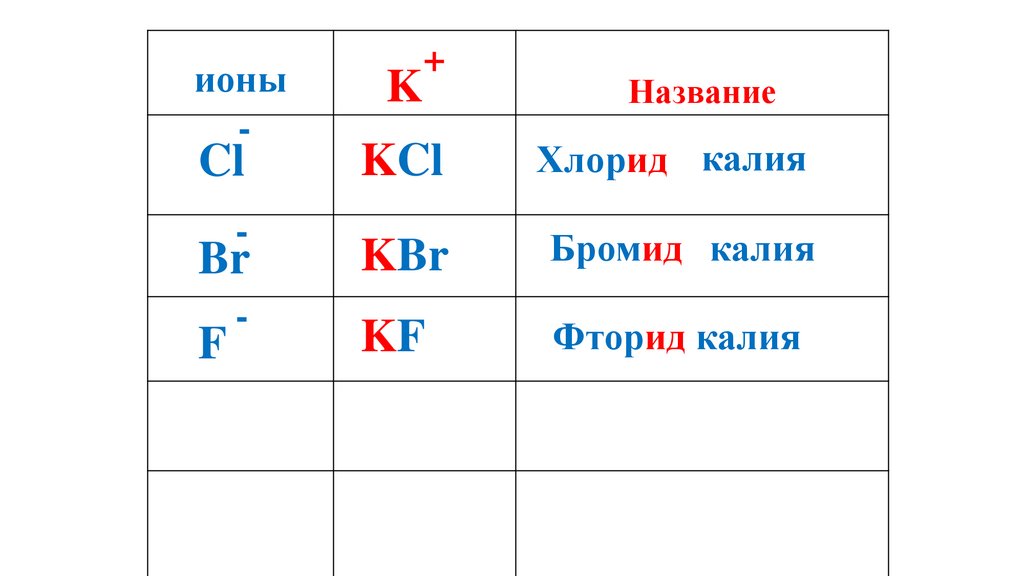
55.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Cl
-
F
56.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
Cl
-
F
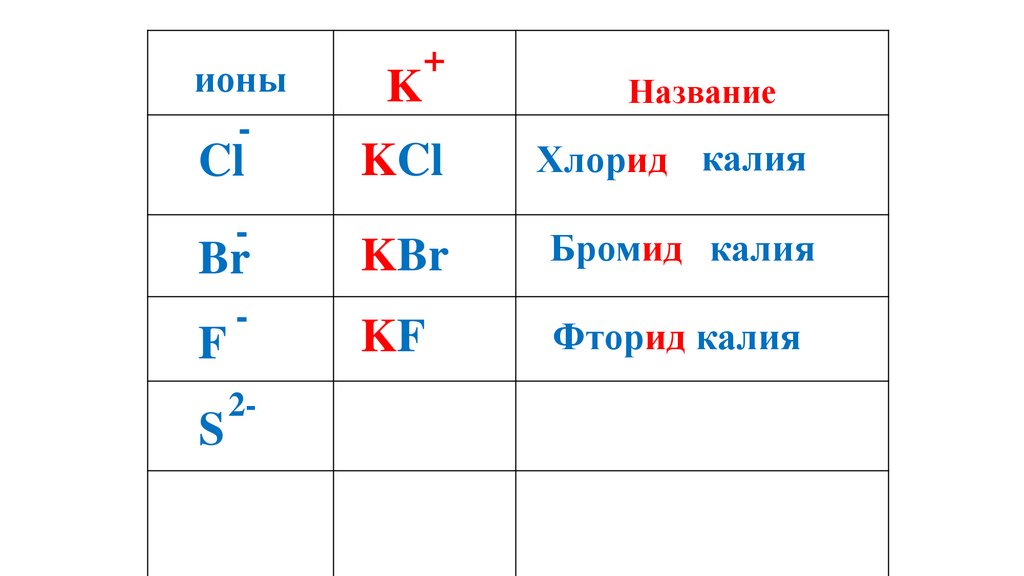
57.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
Cl
-
F
S
2-
58.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
Cl
-
F
S
2-
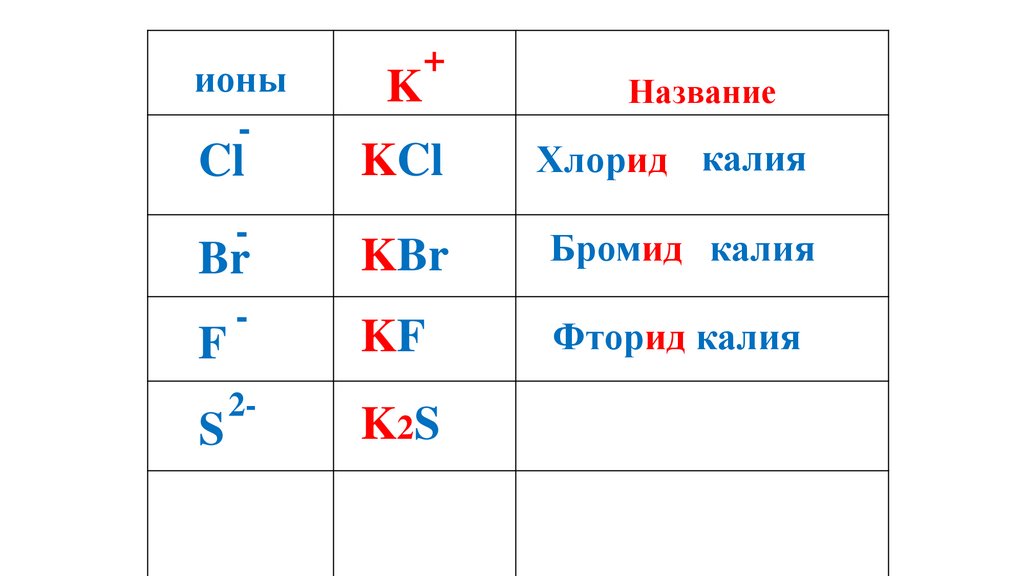
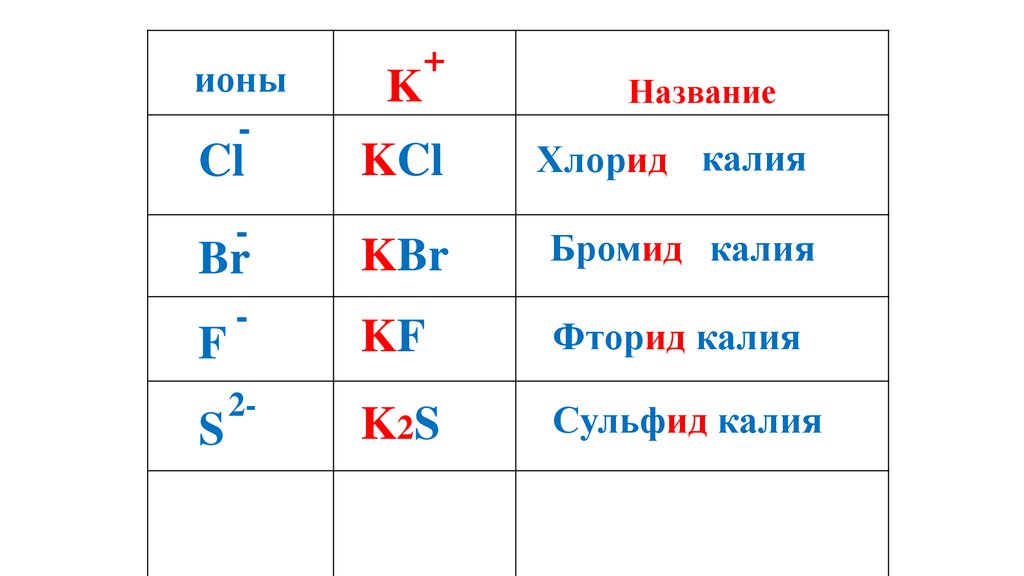
K2S
59.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
K2S
Сульфид калия
Cl
-
F
S
2-
60.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
K2S
Сульфид калия
Cl
-
F
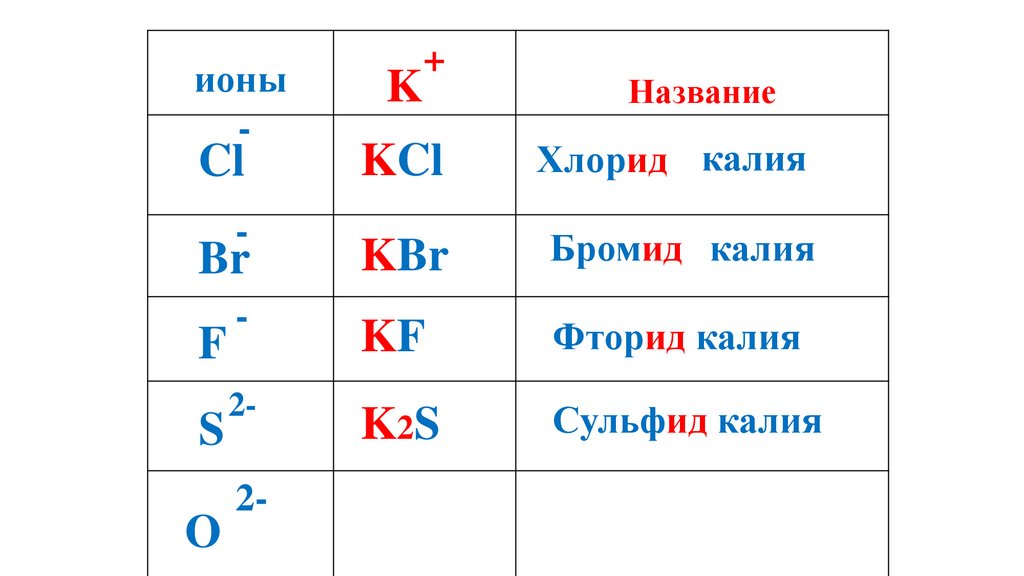
S
O
2-
2-
61.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
K2S
Сульфид калия
Cl
-
F
S
O
2-
2-
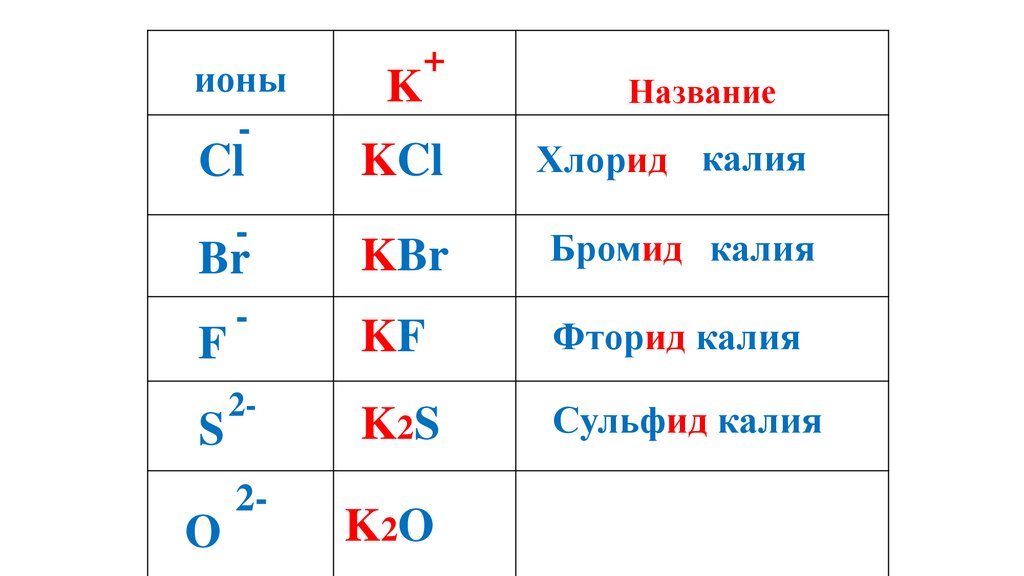
K2O
62.
ионы-
K
+
Название
KCl
Хлорид калия
Br
KBr
Бромид калия
-
KF
Фторид калия
K2S
Сульфид калия
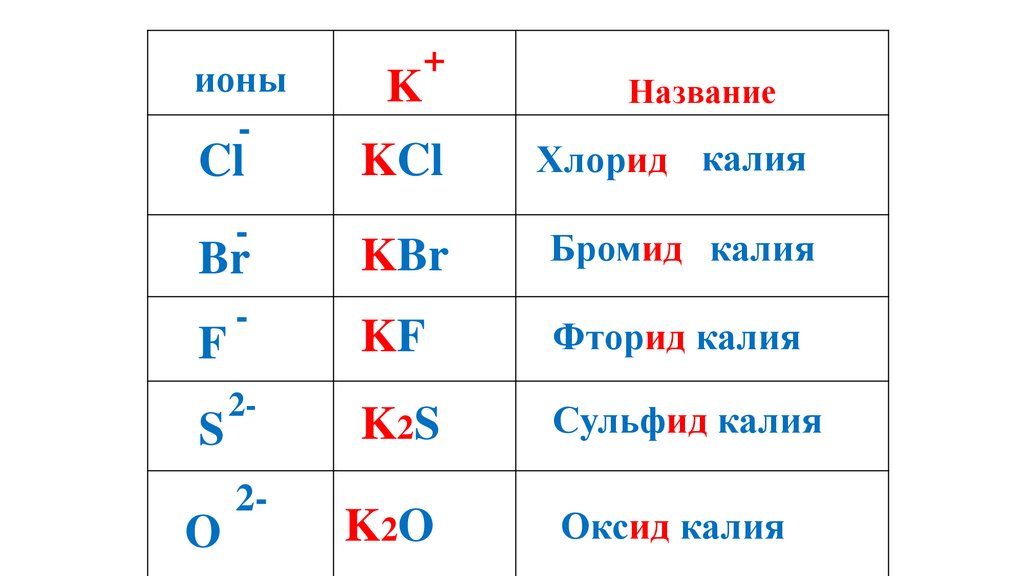
K2O
Оксид калия
Cl
-
F
S
O
2-
2-
63.
Э -1. Актуализация знаний2.Дайте названия бинарных соединений, формулы которых:
+2
FeCl 2 –
+3
FeCl3
+3
FeF3
64.
Э -1. Актуализация знаний2.Дайте названия бинарных соединений, формулы которых:
+2
FeCl 2 – хлорид железа(II),
+3
FeCl3
+3
FeF3
65.
Э -1. Актуализация знаний2.Дайте названия бинарных соединений, формулы которых:
+2
FeCl 2 – хлорид железа(II),
+3
FeCl3 - хлорид железа(III)
+3
FeF3
66.
Э -1. Актуализация знаний2.Дайте названия бинарных соединений, формулы которых:
+2
FeCl 2 – хлорид железа(II),
+3
FeCl3 - хлорид железа(III)
+3
FeF3 - фторид железа(III)
67.
Э -1. Актуализация знанийЗадание 3 . Дан список веществ: Найдите среди них лишнее, объясните свой
выбор.
CuO, SiO2, H2O, CaO, S, CO2
68.
Э -1. Актуализация знанийЗадание 3 . Дан список веществ:. Найдите среди них лишнее, объясните свой
выбор.
CuO, SiO2, H2O, CaO, S, CO2
69.
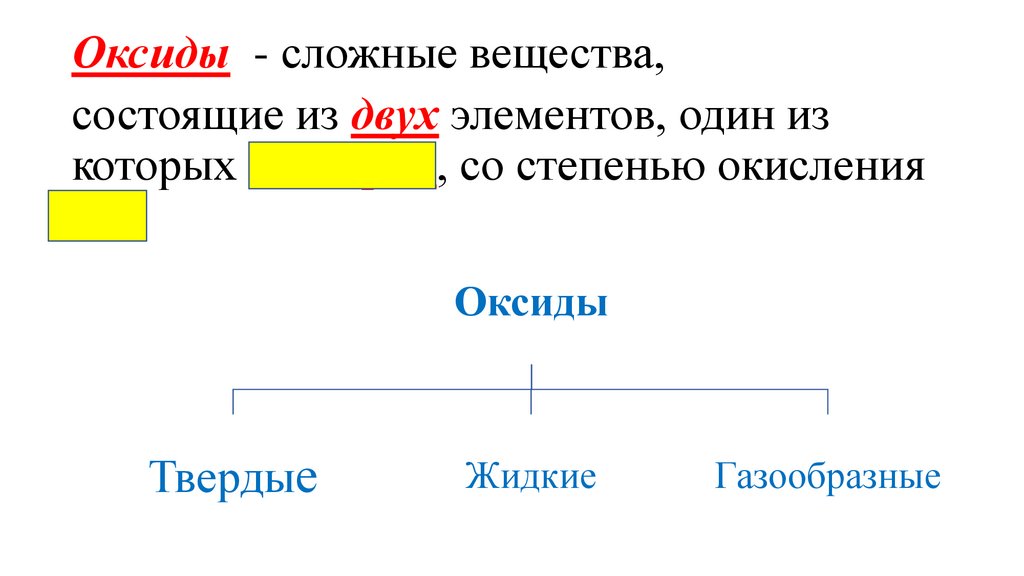
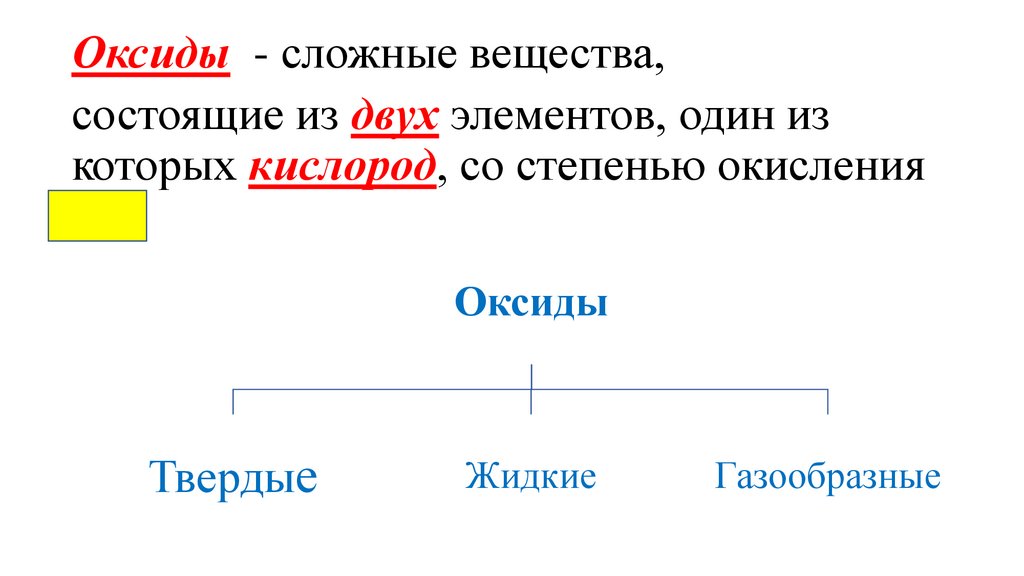
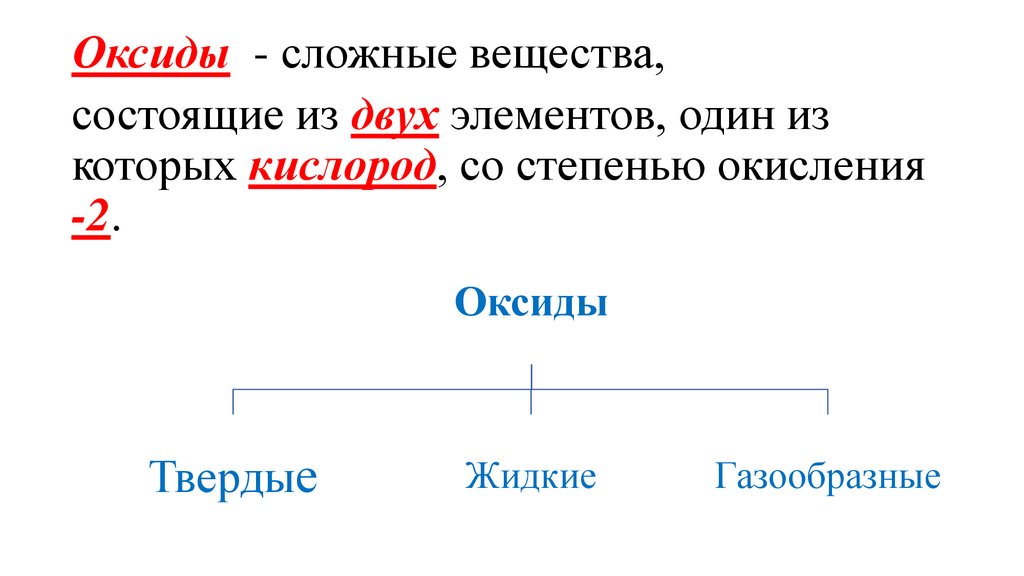
Оксиды - сложные вещества,состоящие из двух элементов, один из
которых кислород, со степенью окисления
-2.
Оксиды
Твердые
Жидкие
Газообразные
70.
Оксиды - сложные вещества,состоящие из двух элементов, один из
которых кислород, со степенью окисления
-2.
Оксиды
Твердые
Жидкие
Газообразные
71.
Оксиды - сложные вещества,состоящие из двух элементов, один из
которых кислород, со степенью окисления
-2.
Оксиды
Твердые
Жидкие
Газообразные
72.
Оксиды - сложные вещества,состоящие из двух элементов, один из
которых кислород, со степенью окисления
-2.
Оксиды
Твердые
Жидкие
Газообразные
73.
Оксиды - сложные вещества,состоящие из двух элементов, один из
которых кислород, со степенью окисления
-2.
Оксиды
Твердые
Жидкие
Газообразные
74.
Составить формулы оксидов.75.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
KO
76.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
-2
KO
77.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+1 -2
KO
78.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+1 -2
KO
79.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+1 -2
KO
2
80.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+1 -2
KO
2
Оксид калия
81.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
MgO
82.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
-2
MgO
83.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+2
-2
MgO
84.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+2
-2
MgO
85.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+2
-2
MgO
Оксид магния
86.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
CaO
87.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
-2
CaO
88.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+2
-2
CaO
89.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+2
-2
CaO
90.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+2
-2
CaO
Оксид кальция
91.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
SO
92.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
-2
SO
93.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
6
+6
-2
SO
94.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
6
+6
-2
S O3
95.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
6
+6
-2
S1 O3
96.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+6
-2
S O3
Оксид серы (VI)
97.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
СO
98.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
-2
СO
99.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
+2
-2
СO
100.
Составить формулы оксидов калия, магния, кальция, серы(IV),углерода (II)
2
+2
-2
СO
Оксид углерода (II)
101.
Вода H2O - самое распространённое и самое необходимоевещество на нашей планете. Почти ¾ поверхности земного
шара занято водой морей и океанов. Льдом покрыто 20%
суши: ледники гор, арктическая и антарктическая шапки
планеты.
102.
103.
Знаете ли вы, что….В стаканеводы – около 8 септиллионов
молекул. Это 8 000 000 000
000 000 000 000 000
молекул(8·1024)
104.
Как вода влияет на климат планеты?Нагреваясь, вода поглощает теплоту, а остывая, отдаёт
тепло, тем самым «выравнивая» климат. А от
космического холода предохраняют Землю те молекулы
воды, которыерассеяны в атмосфере — в облаках в виде
пара...
105.
Как вода влияет на климат планеты?106.
Как вода влияет на климат планеты?Вода составляет до 80% массы клетки и
выполняет в ней чрезвычайно важные
функции: определяет объём и упругость
клеток, транспортирует в клетку и из неё
растворённые вещества, предохраняет клетку
от резких колебаний температур. Тело человека
на 2/3состоит из воды. Почти все химические
реакции в живой клетке протекают в водных
растворах.
107.
108.
Во время чистки зубов вы обычно незакрываете кран, считая, что не так уж и
много убежит воды? За минуту теряется
чуть больше 7 литров, соответственно,
если каждое утро вы будете отключать
кран, то сэкономите за год примерно 5
тысяч, 475 литров. При условии, что на
чистку вам достаточно двух минут.
109.
Углекислый газ CO2,или диоксид углерода, содержится в воздухе в концентрацииоколо 0,03% (по объёму).
110.
111.
При увеличении давления до 60 атм онпревращается в бесцветную жидкость.
При испарении жидкого углекислого газа
часть его может превратиться в
твёрдую снегообразную массу. Её
прессуют и получают так называемый
сухой лёд, который при обычном
давлении возгоняется, не плавясь,
причём температура
его понижается до –78,5 °C.
112.
113.
114.
115.
В мифах и легендах греческиеолимпийские боги пили амброзию
только из хрустальных кубков. Римский
император Нерон имел несколько
кубков из цельных кристаллов горного
хрусталя. Выбор материала был
неслучаен. Имеющий высокую
теплопроводность кварц, сохранял
напитки прохладными даже в жару
116.
Некоторые разновидности кварца – ценные ювелирные или поделочные камниАметист (обработанный)
Аметист (природный)
117.
118.
Разновидности оксида кремния (IV): а — аметист; б — кварц; в —опал; г — агат; д — кремнезём
119.
Разновидности оксида алюминия: а — корунд; б —боксит; в — рубин; г — сапфир
120.
корундбоксит
121.
Разновидности оксида алюминиякорунд
боксит
В 1821-м году французский геолог Пьер
Бертье Близ деревеньки Ле Бо, Бертье
обнаружил скалу, сложенную не вполне
обычным камнем. А через несколько
десятилетий боксит (в названии камня
увековечена прованская деревня Ле Бо)
122.
Разновидности оксида алюминиякорунд
боксит
123.
Лабораторный опыт«Ознакомление с оксидами» c.112
124.
Ознакомьтесь с оксидами. Запишитеформулы представленных оксидов.
Опишите их физические свойства.
125.
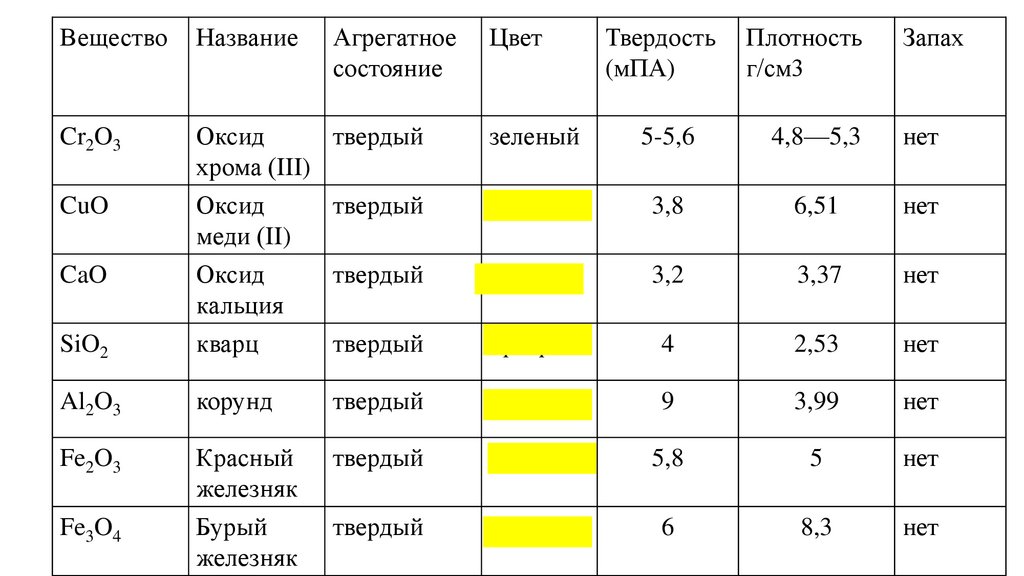
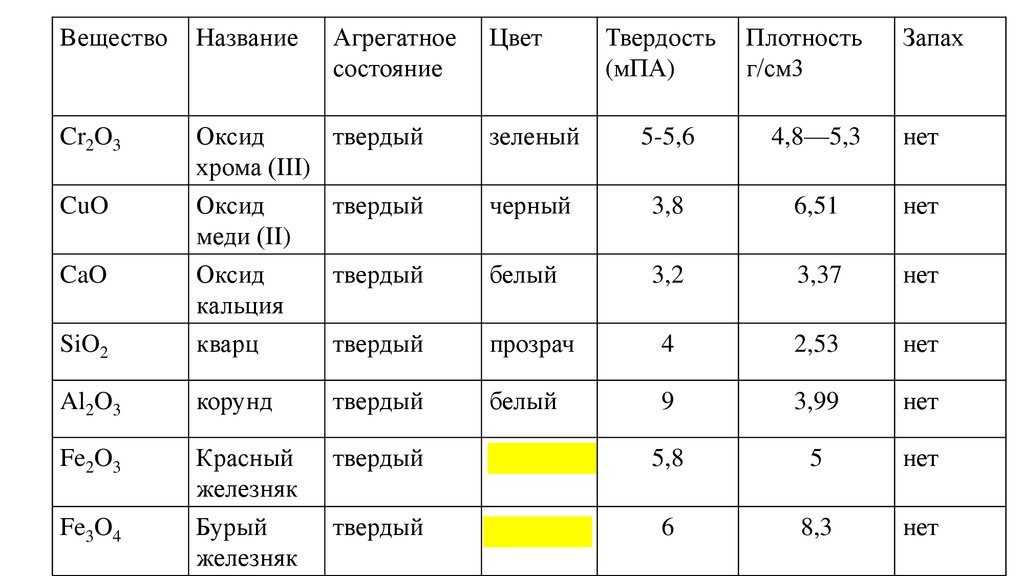
ВеществоНазвание
Cr2O3
CuO
Твердость
(мПА)
Плотность
г/см3
Оксид
хрома (III)
5-5,6
4,8—5,3
3,8
6,51
3,2
3,37
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
4
2,53
Al2O3
корунд
9
3,99
Fe2O3
Красный
железняк
Бурый
железняк
5,8
5
6
8,3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Запах
126.
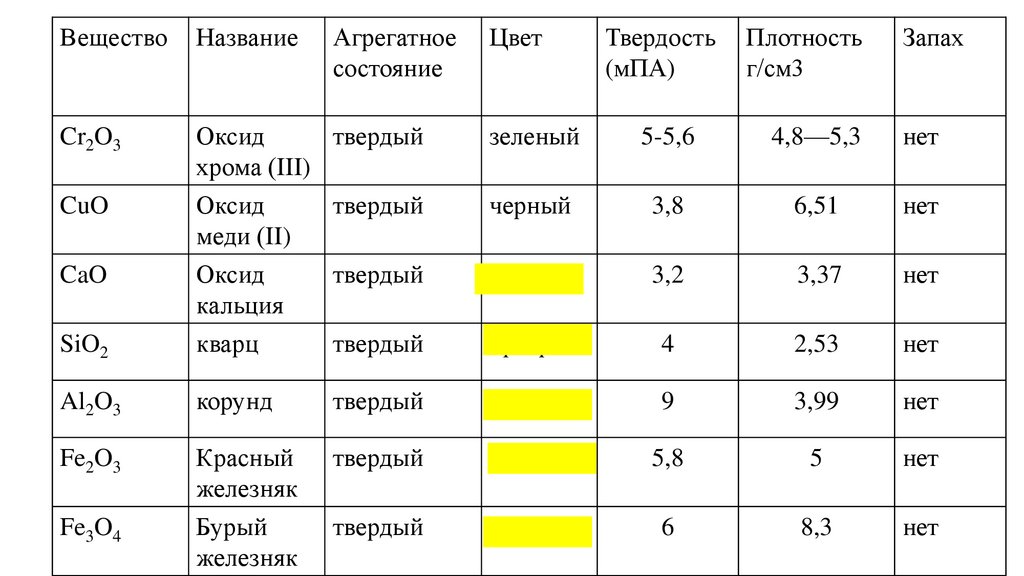
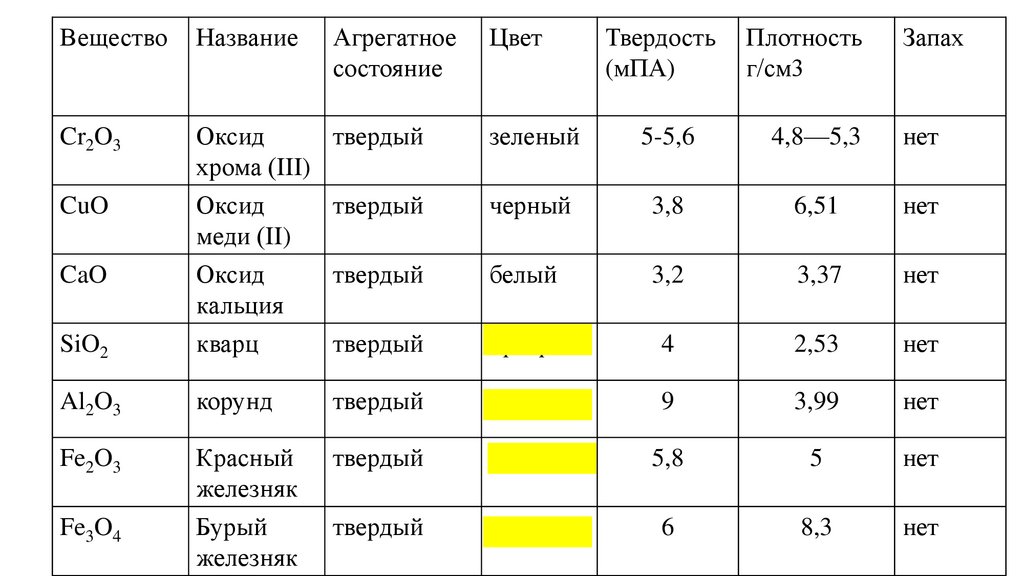
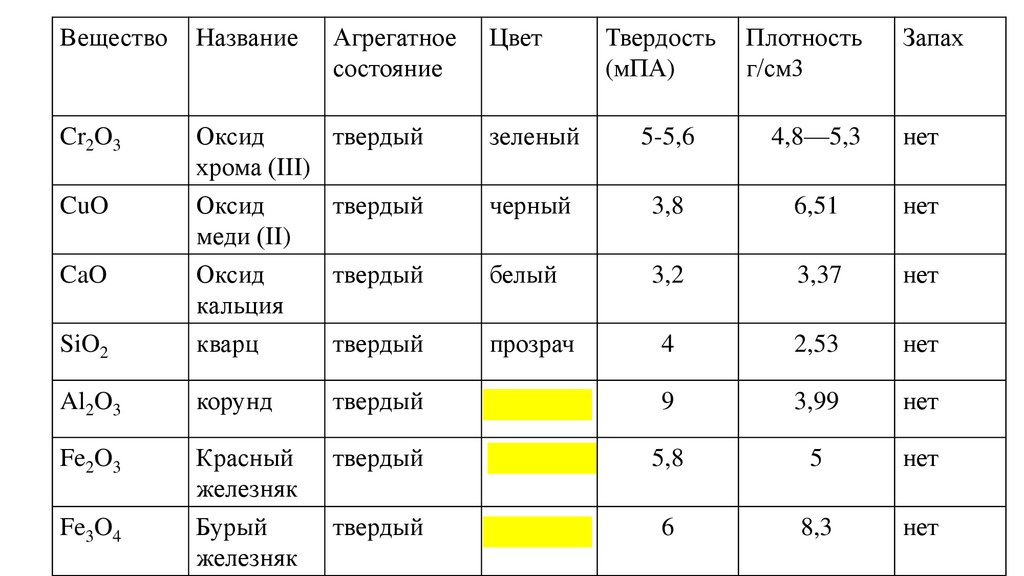
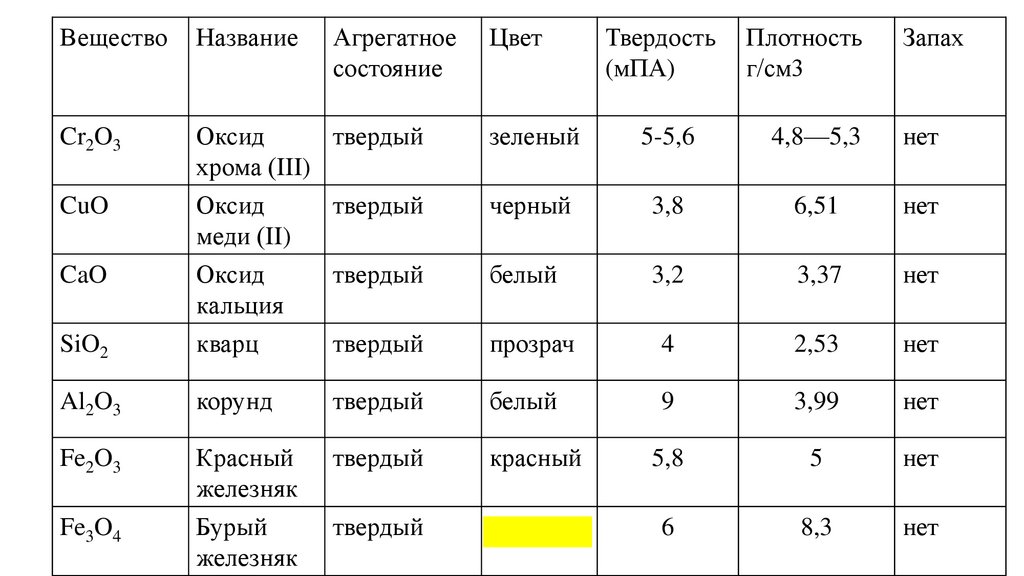
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
127.
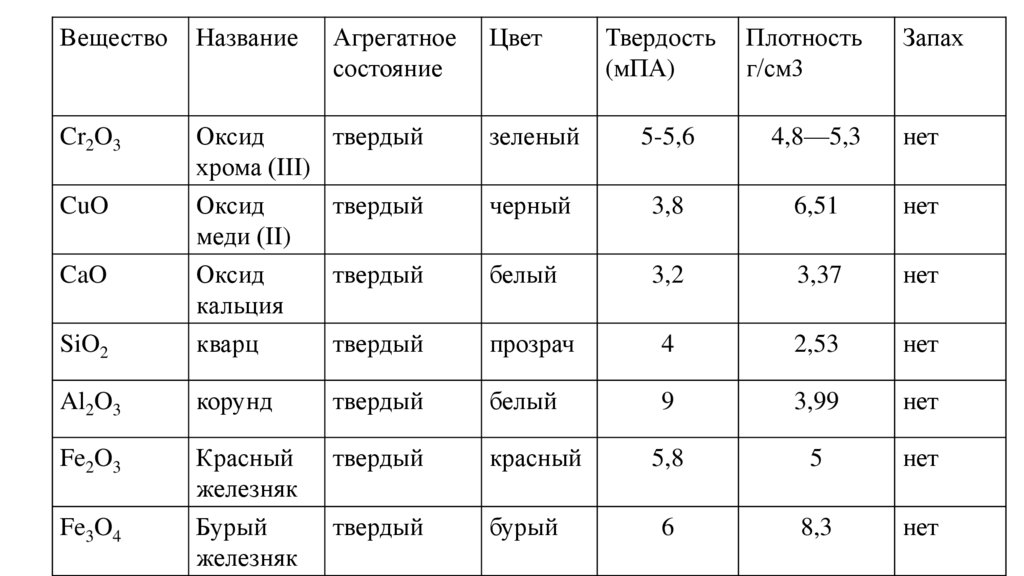
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
128.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
129.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
130.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
131.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
132.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
133.
ВеществоНазвание
Cr2O3
Оксид
твердый
хрома (III)
CuO
SiO2
Оксид
меди (II)
Оксид
кальция
кварц
Al2O3
Fe2O3
CaO
Fe3O4
Агрегатное
состояние
Цвет
Твердость
(мПА)
Плотность
г/см3
Запах
зеленый
5-5,6
4,8—5,3
нет
твердый
черный
3,8
6,51
нет
твердый
белый
3,2
3,37
нет
твердый
прозрач
4
2,53
нет
корунд
твердый
белый
9
3,99
нет
Красный
железняк
Бурый
железняк
твердый
красный
5,8
5
нет
твердый
бурый
6
8,3
нет
134.
Смотреть вдальпрямо перед собой
2-3сек. Перевести
взгляд на кончик
носа на 3-5 сек.
Повторить 6-8 раз.
Закрыть глаза,
представить, что нос
стал как у Буратино и,
обмакнув нос в
чернильницу написать,
например слово
«химия».
135.
136.
Э-3.Закрепление пройденного материалаЗадание 5.Соотнесите правильно формулу вещества и его тривиальное название
Задание выполняется при помощи материала учебника.
Формула вещества
Тривиальное название
1 Fe2O3
А. угарный газ
2 Al2O3
Б. красный железняк
3 CaO
В. Песок
4 CO2
Г. глинозем
5 CO
Д. углекислый газ
6 SiO2
Е. негашеная известь
137.
Э-3.Закрепление пройденного материалаЗадание 5.Соотнесите правильно формулу вещества и его тривиальное название
Задание выполняется при помощи материала учебника.
Формула вещества
Тривиальное название
1 Fe2O3
А. угарный газ
2 Al2O3
Б. красный железняк
3 CaO
В. Песок
4 CO2
Г. глинозем
5 CO
Д. углекислый газ
6 SiO2
Е. негашеная известь
Ответы: БГЕДАВ
138.
1.2
3.
4.
5.
6.
139.
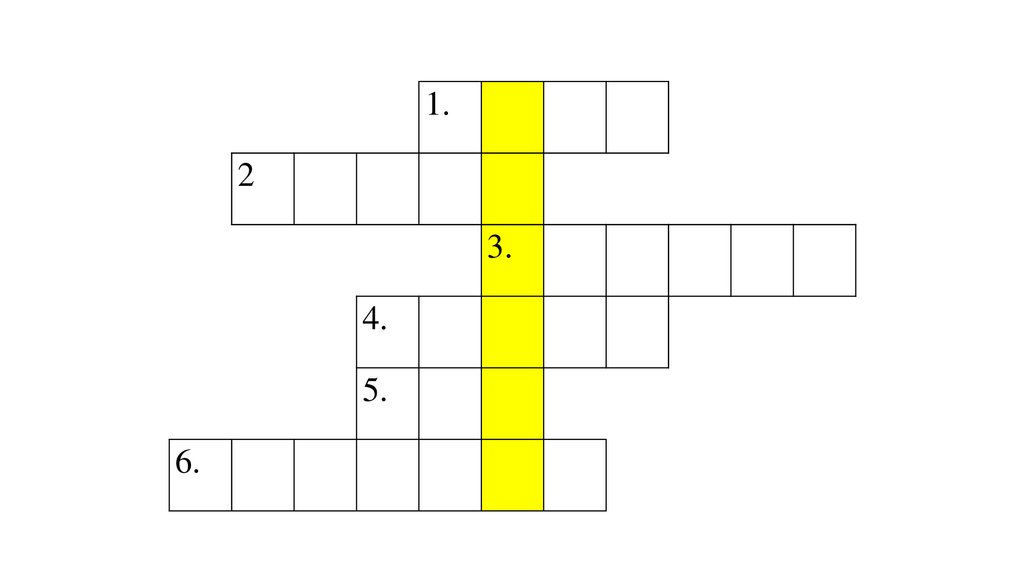
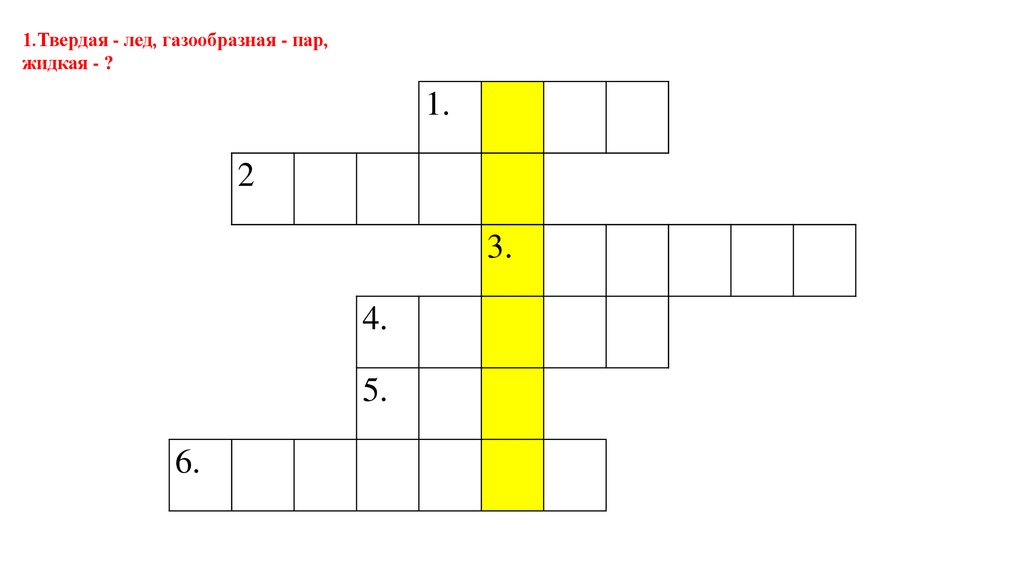
1.Твердая - лед, газообразная - пар,жидкая - ?
1.
2
3.
4.
5.
6.
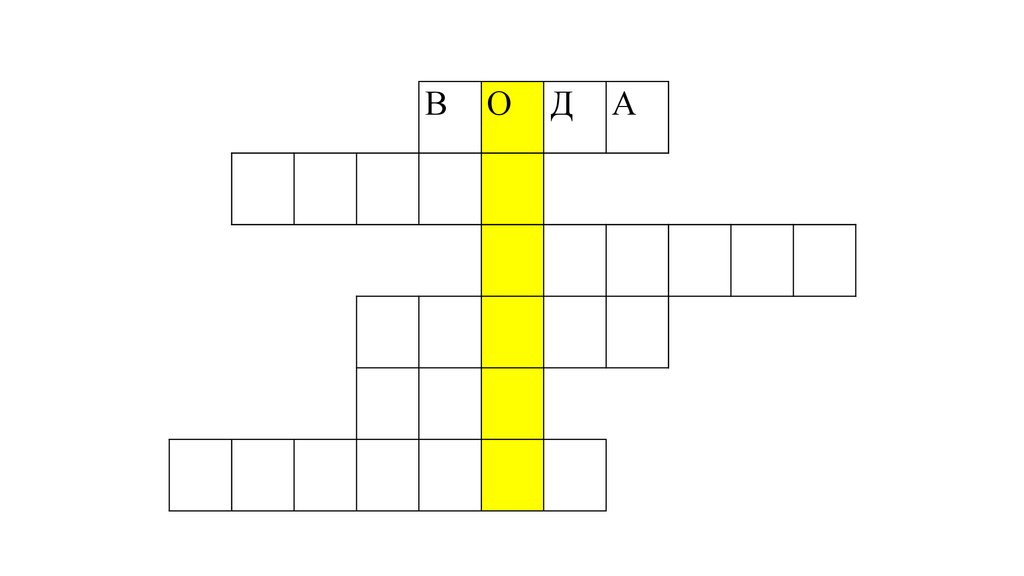
140.
ВО
Д
А
141.
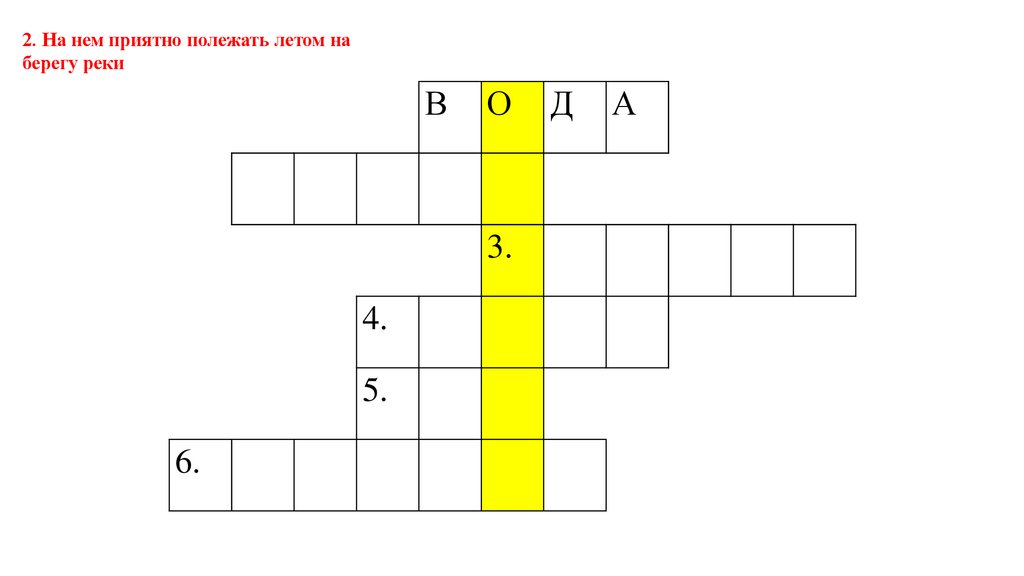
2. На нем приятно полежать летом наберегу реки
В
О
3.
4.
5.
6.
Д
А
142.
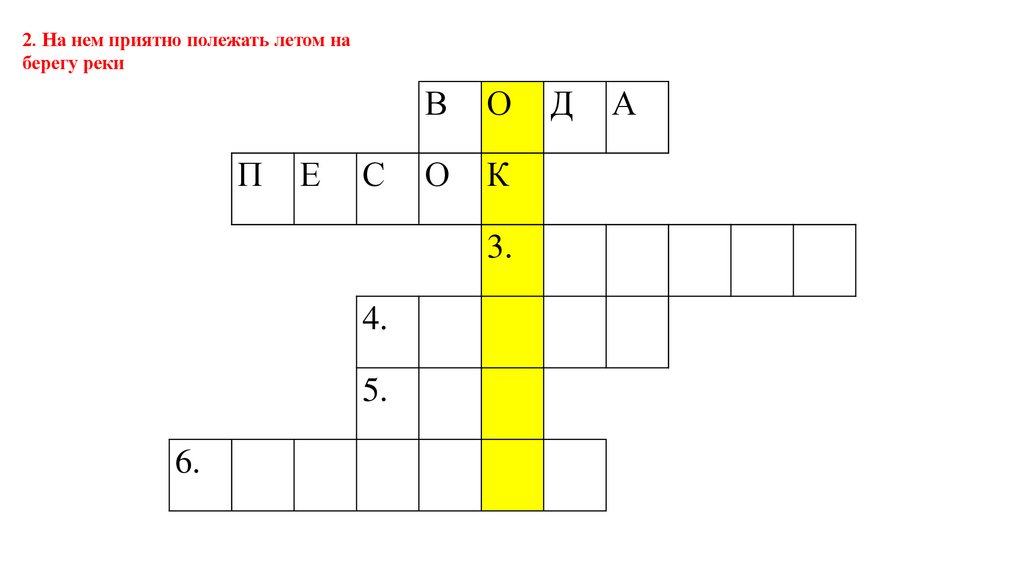
2. На нем приятно полежать летом наберегу реки
П
Е
С
В
О
О
К
3.
4.
5.
6.
Д
А
143.
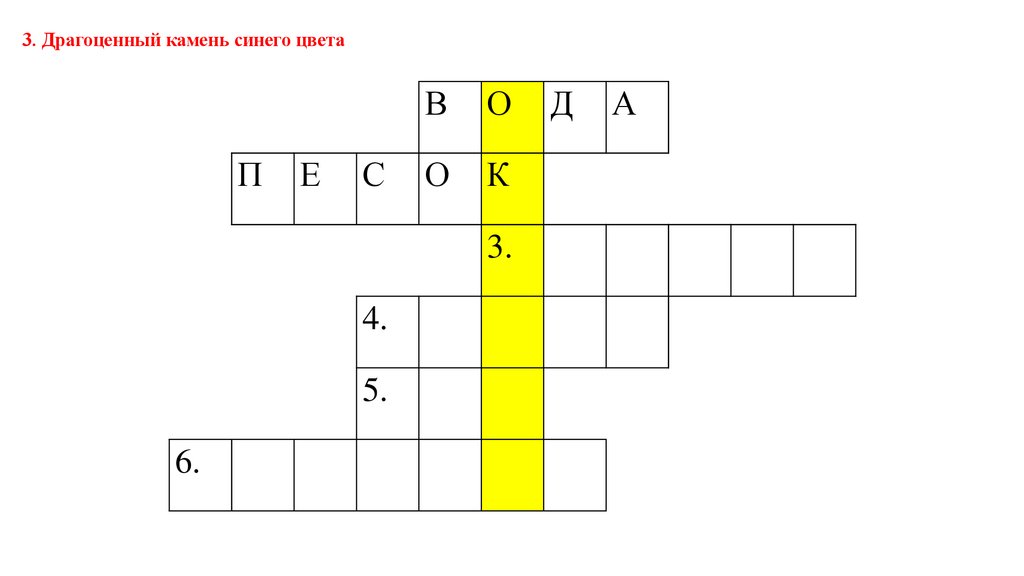
3. Драгоценный камень синего цветаП
Е
С
В
О
О
К
3.
4.
5.
6.
Д
А
144.
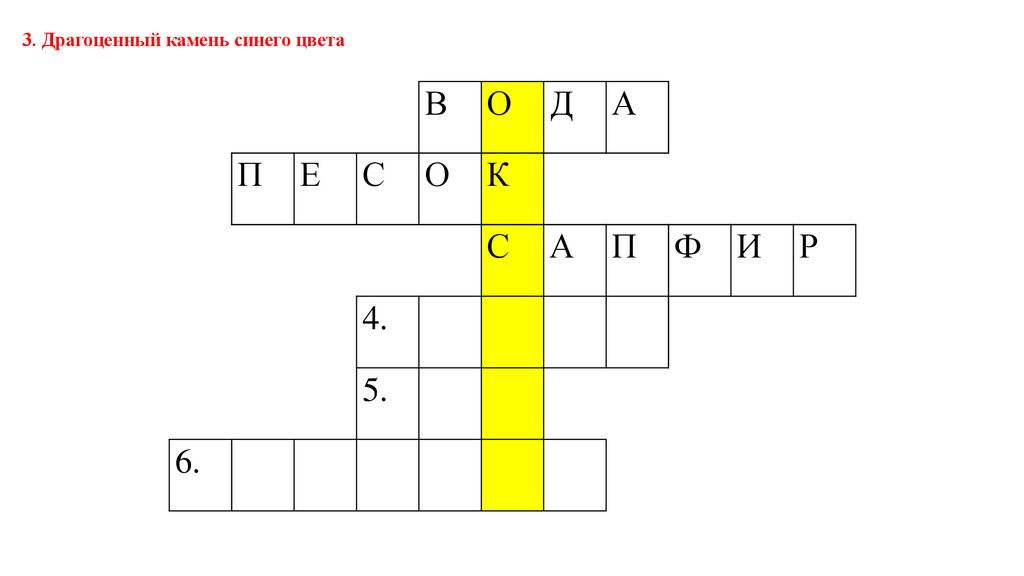
3. Драгоценный камень синего цветаП
Е
С
В
О
О
К
С
4.
5.
6.
Д
А
А
П
Ф
И
Р
145.
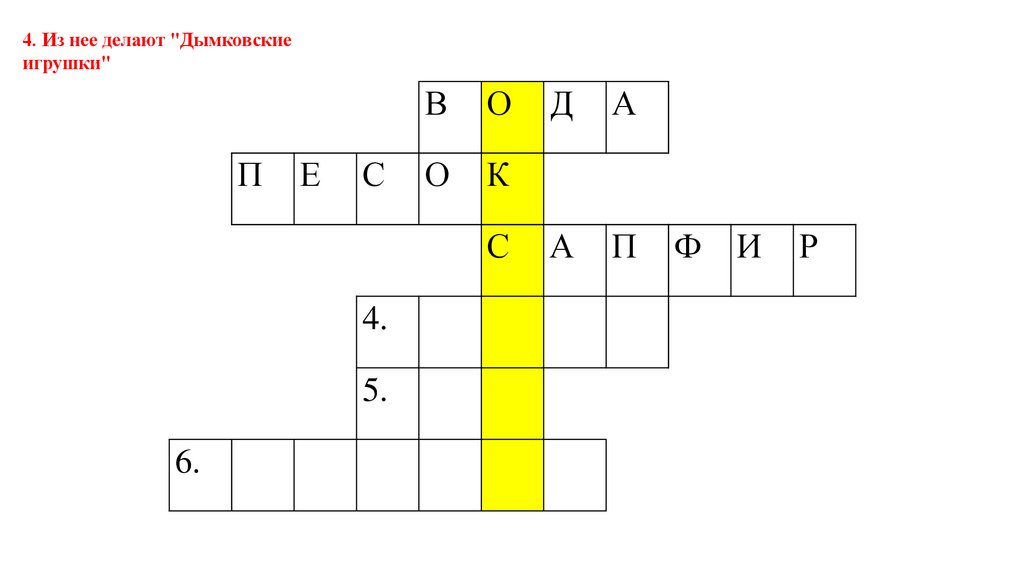
4. Из нее делают "Дымковскиеигрушки"
П
Е
С
В
О
О
К
С
4.
5.
6.
Д
А
А
П
Ф
И
Р
146.
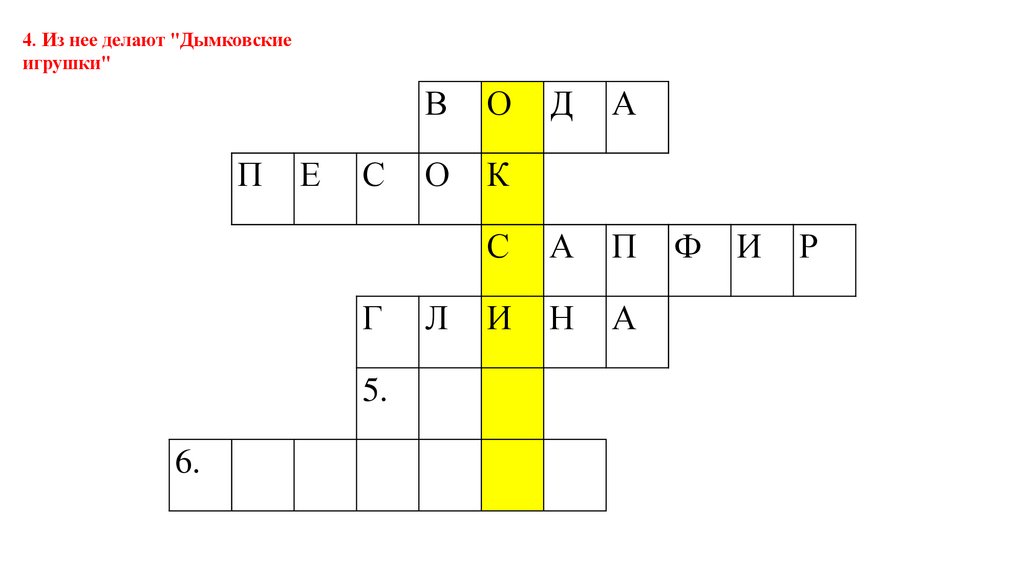
4. Из нее делают "Дымковскиеигрушки"
П
Е
С
Г
5.
6.
В
О
О
К
Л
Д
А
С
А
П
И
Н
А
Ф
И
Р
147.
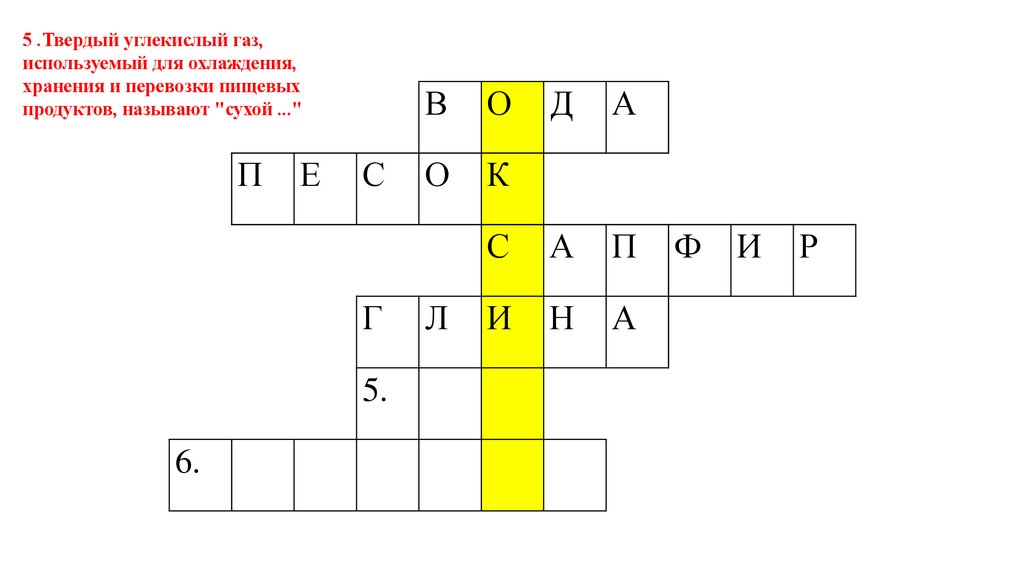
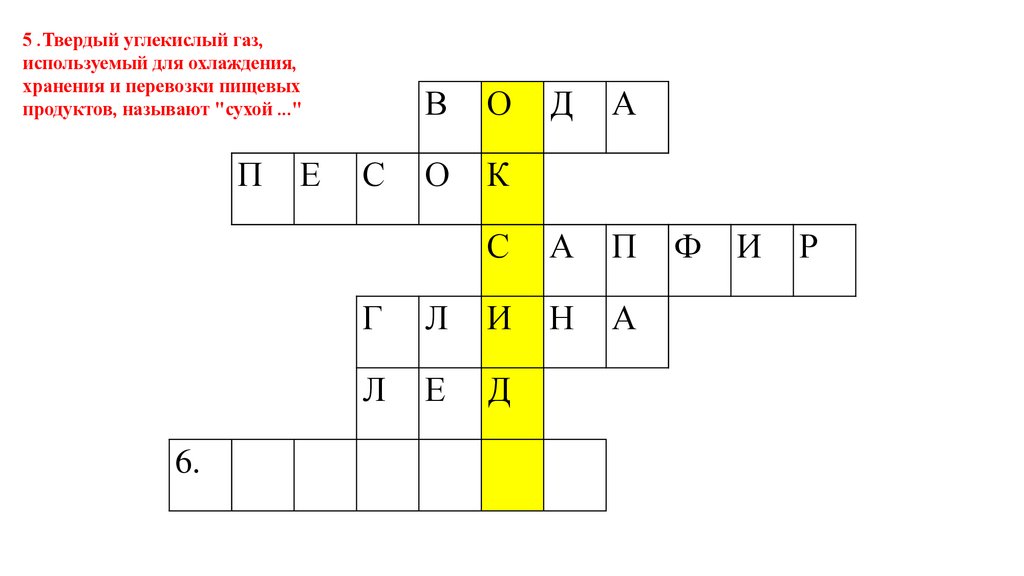
5 .Твердый углекислый газ,используемый для охлаждения,
хранения и перевозки пищевых
продуктов, называют "сухой ..."
П
Е
С
Г
5.
6.
В
О
О
К
Л
Д
А
С
А
П
И
Н
А
Ф
И
Р
148.
5 .Твердый углекислый газ,используемый для охлаждения,
хранения и перевозки пищевых
продуктов, называют "сухой ..."
П
6.
Е
С
В
О
Д
А
О
К
С
А
П
Н
А
Г
Л
И
Л
Е
Д
Ф
И
Р
149.
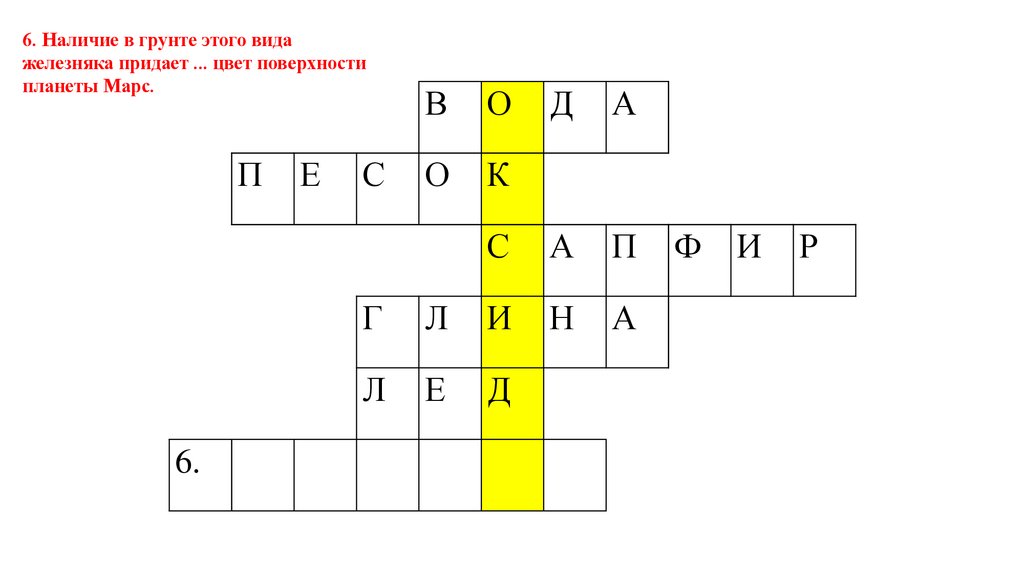
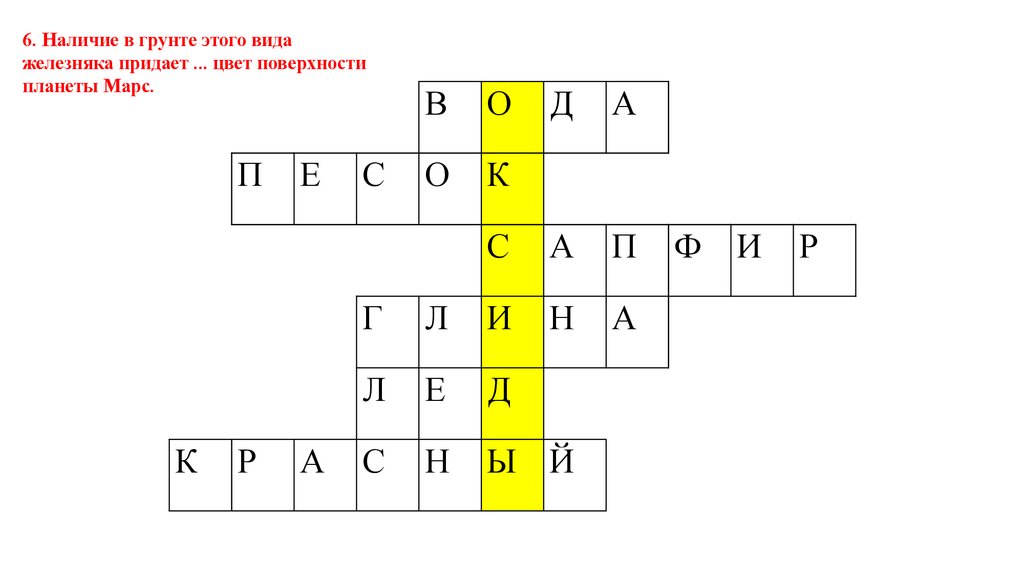
6. Наличие в грунте этого видажелезняка придает ... цвет поверхности
планеты Марс.
П
6.
Е
С
В
О
Д
А
О
К
С
А
П
Н
А
Г
Л
И
Л
Е
Д
Ф
И
Р
150.
6. Наличие в грунте этого видажелезняка придает ... цвет поверхности
планеты Марс.
П
К
Р
Е
А
С
В
О
Д
А
О
К
С
А
П
Н
А
Г
Л
И
Л
Е
Д
С
Н
Ы Й
Ф
И
Р
151.
Оцените свою деятельность по лестнице знанийВсе понимаю,
все получится
5
Понимаю, но
нужно еще
доработать
4
Плохо понимаю
материал
3
152.
IV. Подведение итоговДомашнее задание: § 14 упр.№ 1—4 после § 14
153.
Дайте названия бинарных соединений, формулыкоторых:
а) Cl2O7, Cl2O, ClO2;
б)FeCl2, FeCl3;
в) MnS, MnO2, MnF4, MnO, MnCl4;
г)Cu2O, Mg2Si, SiCl4, Na3N, FeS.




































































































 chemistry
chemistry








