Similar presentations:
Растворы электролитов и ионные равновесия
1.
Растворы электролитови ионные равновесия
2. План лекции
1. Свойства растворов неэлектролитов иэлектролитов;
2. Ионное произведение воды. pH;
3. Протолитическая теория кислот и
оснований;
4. Гидролиз солей;
5. Буферные растворы.
3.
НеэлектролитыЭлектролиты
(растворы и расплавы
не проводят ток)
(растворы и расплавы
проводят ток)
Сера, сахар, бензин
Соли, кислоты,
основания
Распад на ионы за счет
электролитической
диссоциации
4.
Степень электролитической диссоциацииN
N0
N – количество молекул, распавшееся на ионы
N0 – общее количество растворенных молекул
0<α<1
или
0<α<100%
5.
Факторы влияющие на α:1) Полярность химической связи
2) Диэлектрическая проницаемость среды
(полярность растворителя)
6.
3) Концентрация раствора4) Температура
(электролитическая диссоциация
обычно эндотермическая)
7.
5) Влияние общего иона и противоиона8.
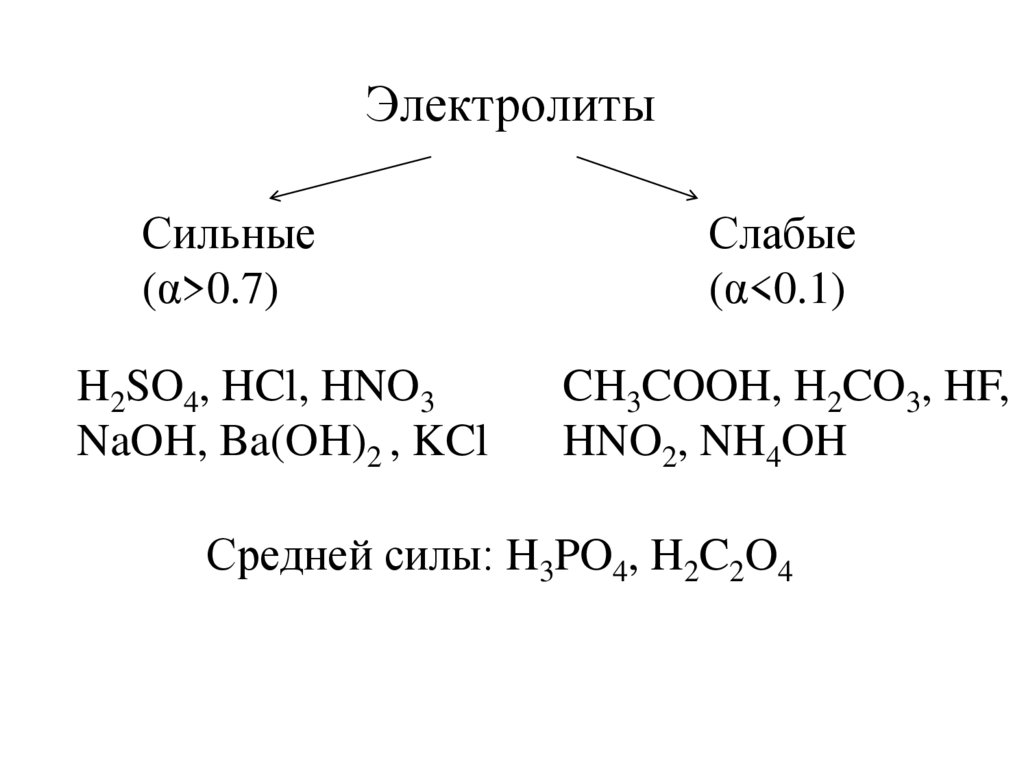
ЭлектролитыСильные
(α>0.7)
H2SO4, HCl, HNO3
NaOH, Ba(OH)2 , KCl
Слабые
(α<0.1)
CH3COOH, H2CO3, HF,
HNO2, NH4OH
Средней силы: H3PO4, H2C2O4
9.
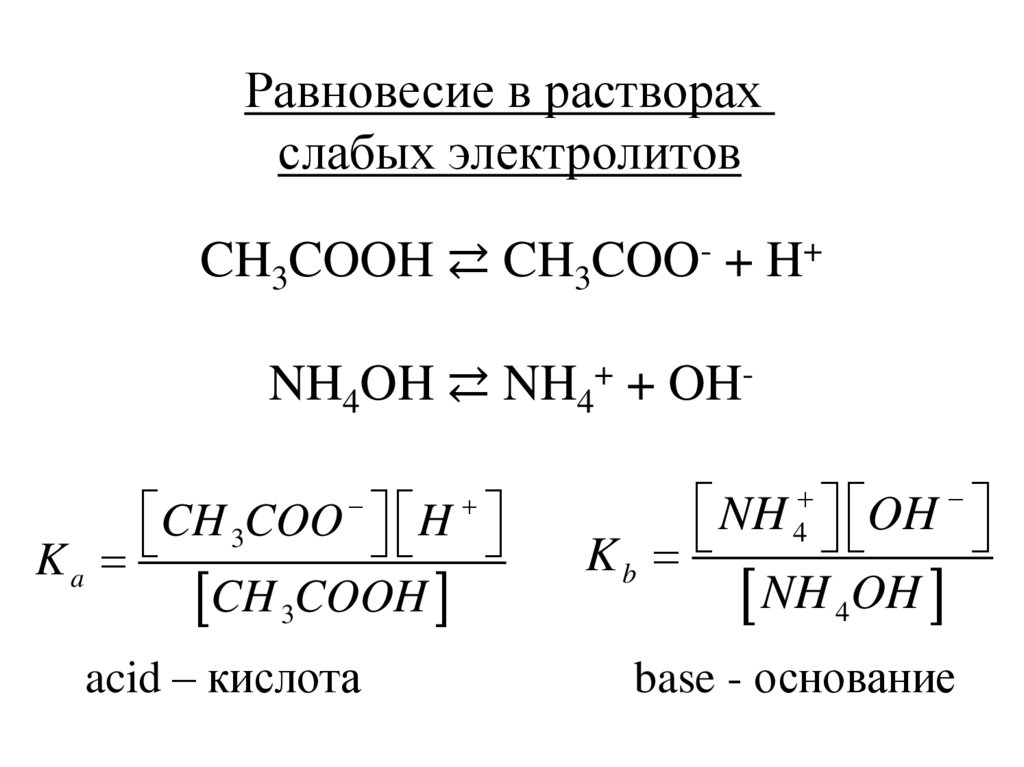
Равновесие в растворахслабых электролитов
CH3COOH ⇄ CH3COO- + H+
NH4OH ⇄ NH4+ + OH CH 3COO H
Ka
CH 3COOH
acid – кислота
NH 4 OH
Kb
NH 4OH
base - основание
10.
Факторы, влияющие на К:1) природа вещества
2) природа растворителя (с увеличением ε
константа диссоциации возрастает)
3) температура (при повышении температуры
константа диссоциации увеличивается)
11.
pK a lg K apK b lg K b
12.
13.
Закон разбавления ОствальдаCH3COOH ⇄ CH3COO- + H+
Исходная
концентрация
Равновесная
концентрация
С
0
0
С(1-α)
Сα
Сα
CH 3COO H C C C 2
Ka
C 1 1
CH 3COOH
Для слабых электролитов: α << 1
K C
2
K
C
14.
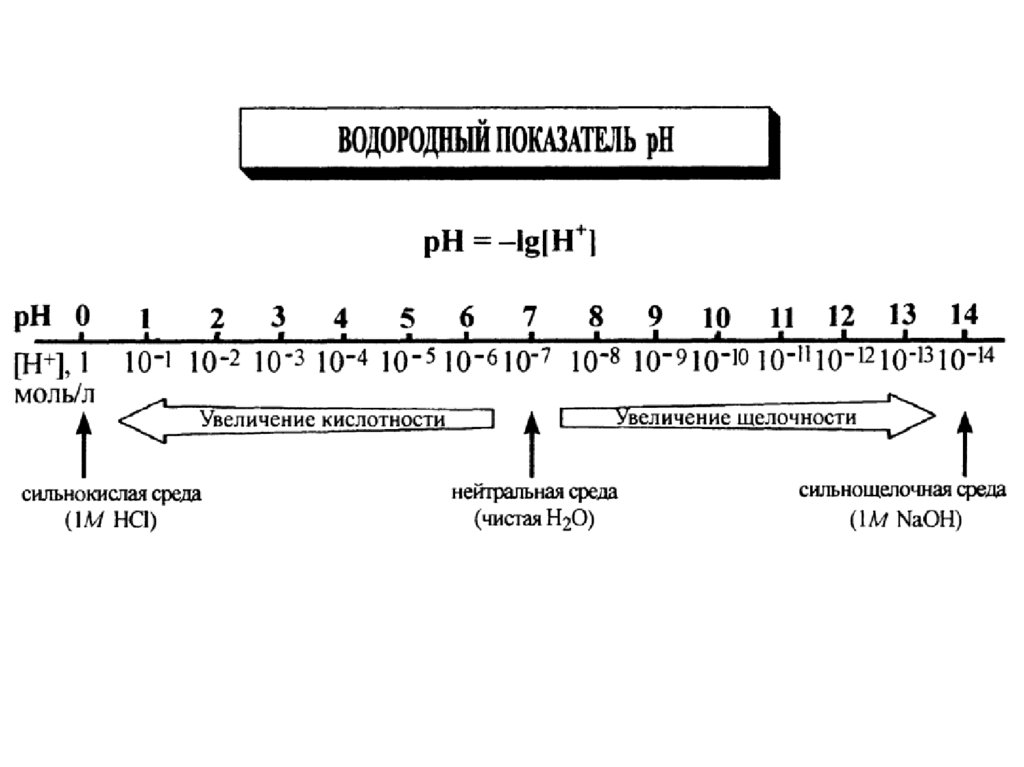
Ионное произведение воды.Водородный и гидроксильный показатели
H OH
Ka
H 2O
H 2O const
KH2O – ионное произведение
воды
K H 2O (или K w ) K a H 2O H OH const
K w 1 10 14
15.
Нейтральная средаH OH K w 1 10 14 10 7 моль / л
Кислая среда
H OH ,
H 10 7 моль / л
Щелочная среда
H OH ,
H 10 7 моль / л
16.
pH lg HpOH lg OH
H OH 1 10 14
lg H lg OH 14
pH pOH 14
Нейтральная среда
pH = 7 (pOH = 7)
Кислая среда
pH < 7 (pOH > 7)
Щелочная среда
pH > 7 (pOH < 7)
17.
18.
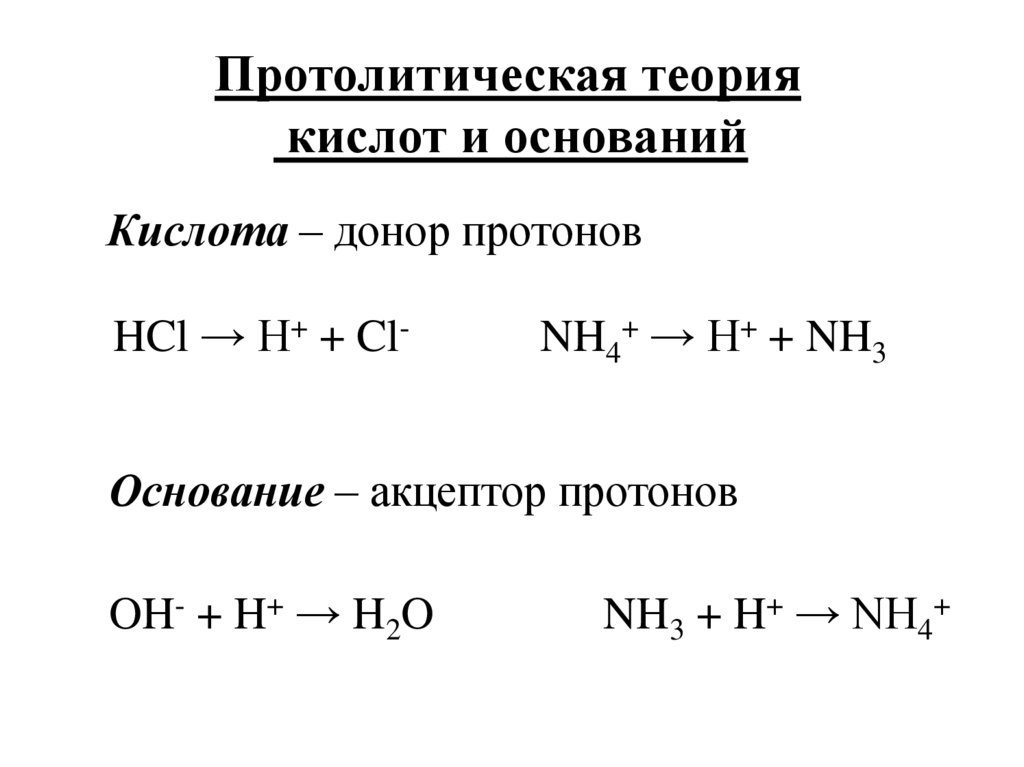
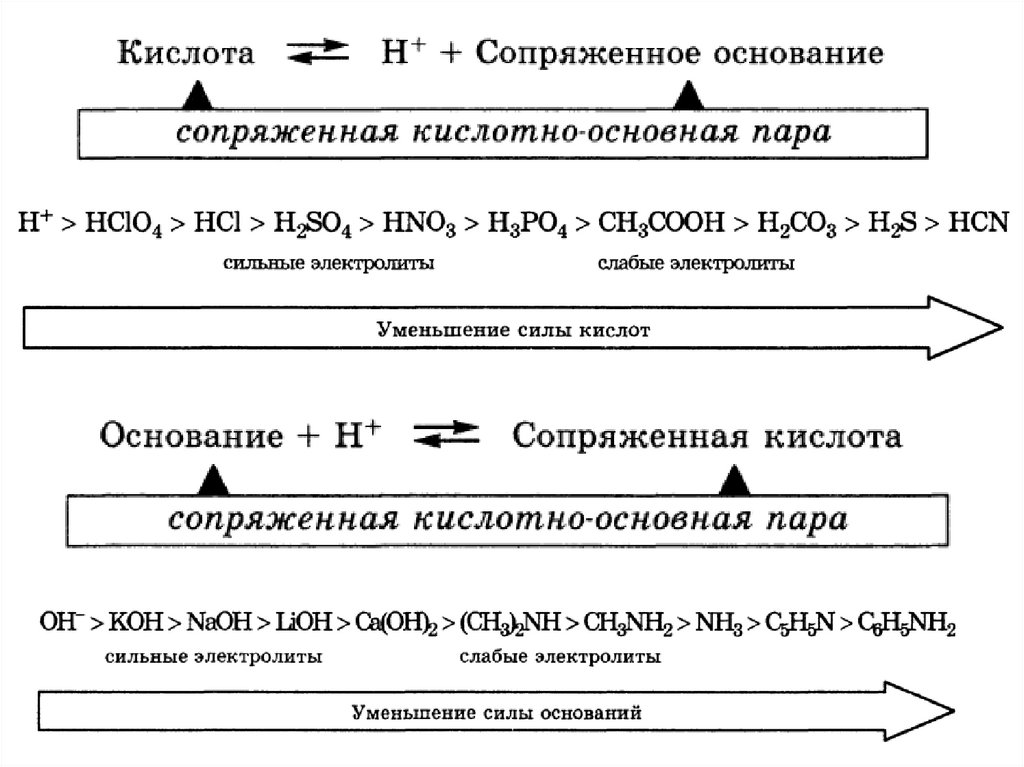
Протолитическая теориякислот и оснований
Кислота – донор протонов
HCl → H+ + Cl-
NH4+ → H+ + NH3
Основание – акцептор протонов
OH- + H+ → H2O
NH3 + H+ → NH4+
19.
20.
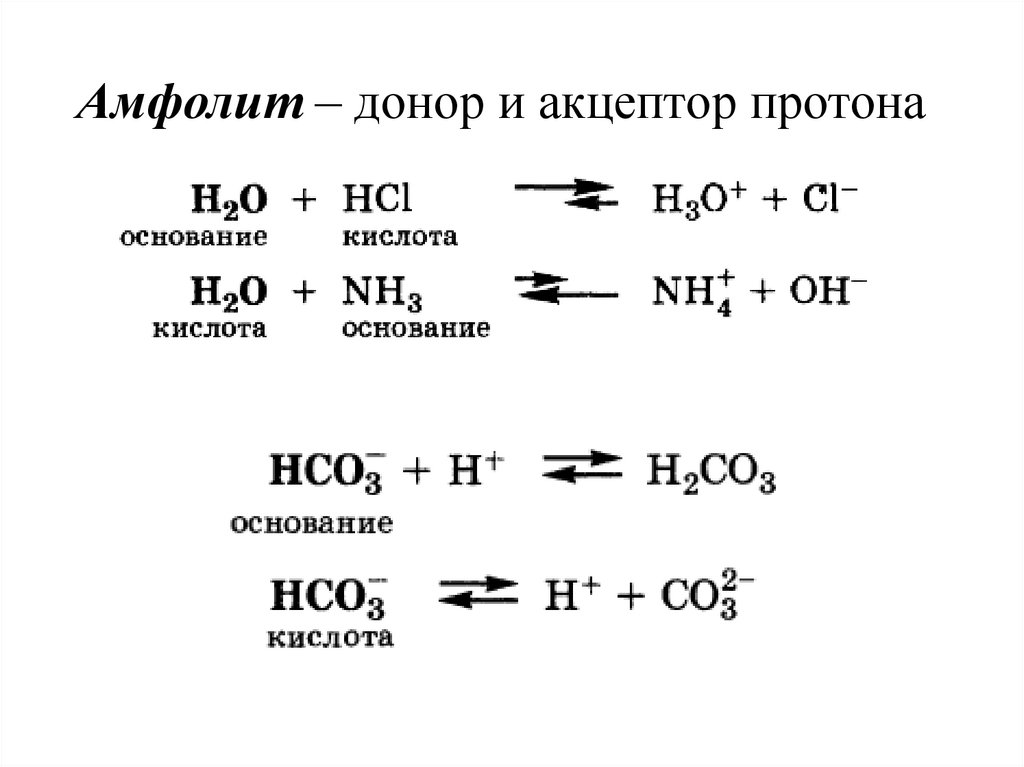
Амфолит – донор и акцептор протона21.
Переход протона всегда происходит в сторонуобразования более слабых кислот, имеющих
большее значение pKa.
протолиз
Протолиты – кислоты,
основания, амфолиты
протолиз
pKa + pKb = 14
pKb(NH3) = 4,76
pKa(NH4+) = 14 - 4,76 = 9,24
рKа(НNO3) = -1,53; рKа(NН4+) = 9,24.
22.
Типы протолитических реакцийРеакция нейтрализации
Сильная кислота + сильное основание
Слабая кислота + сильное основание
Сильная кислота + слабое основание
23.
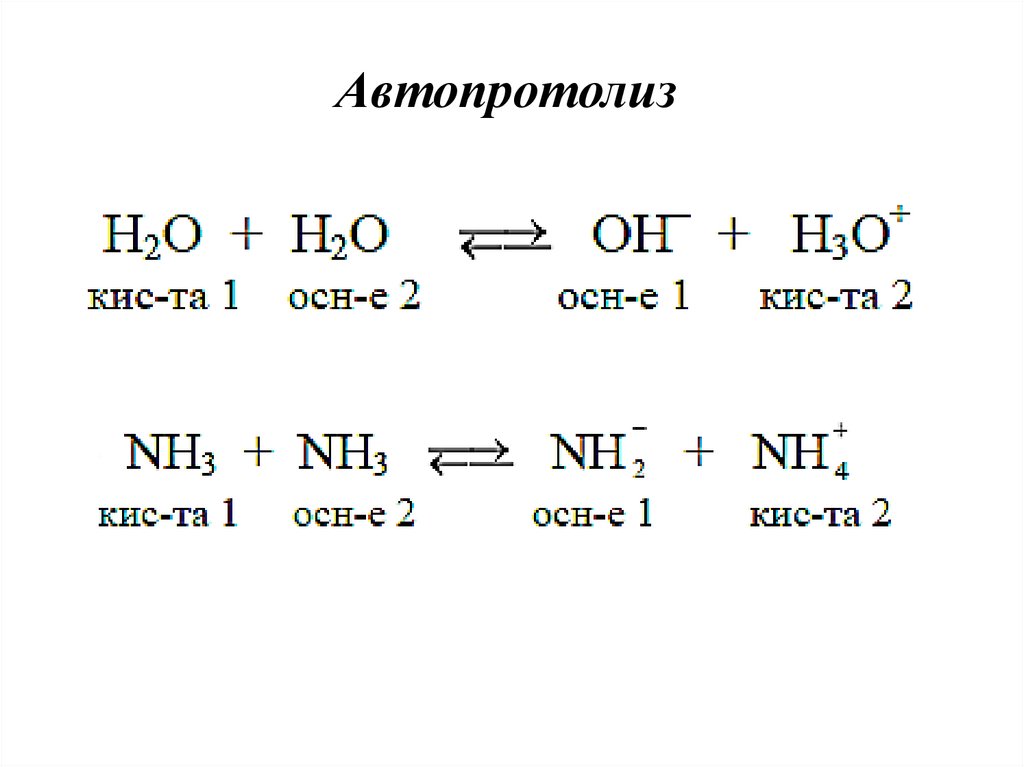
Автопротолиз24.
Гидролиз солейГидролизу не подвергаются:
1) Соли сильных кислот и оснований (NaCl, KNO3, KClO4)
2) Малорастворимые соли (PbCl2, BaCO3)
Варианты гидролиза:
1) по аниону (слабая кислоты + сильное основание)
2) по катиону (сильная кислота + слабое основание)
3) по катиону и аниону
(слабая кислота + слабое основание)
25.
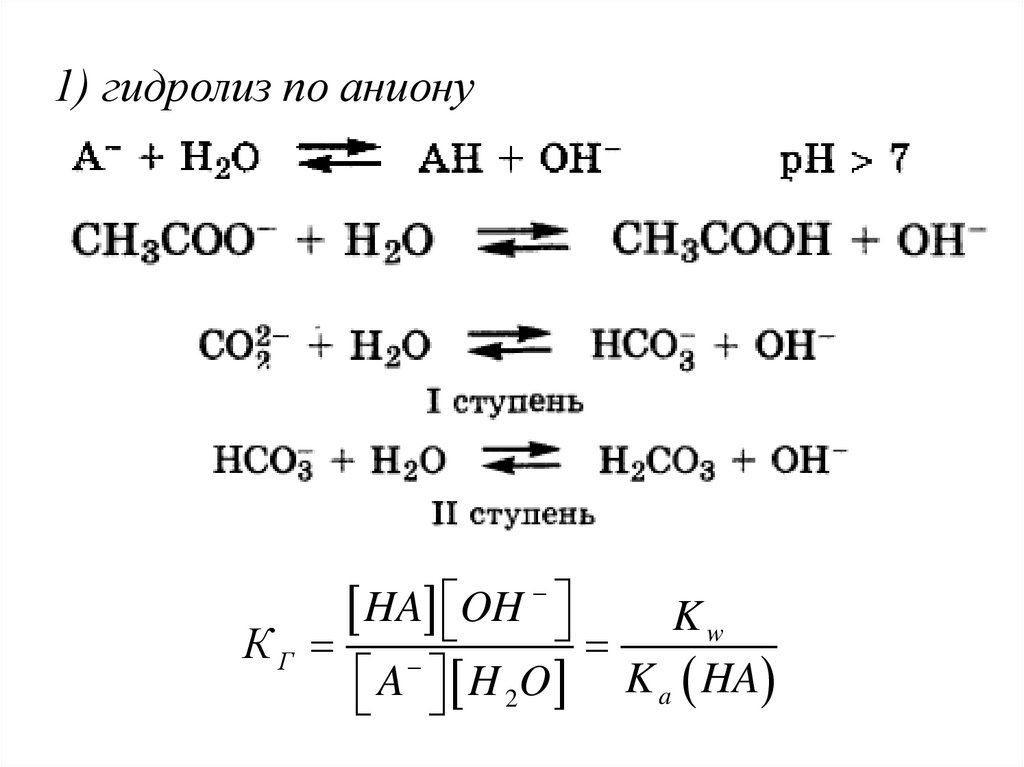
1) гидролиз по анионуHA OH
Kw
КГ
A H 2O K a HA
26.
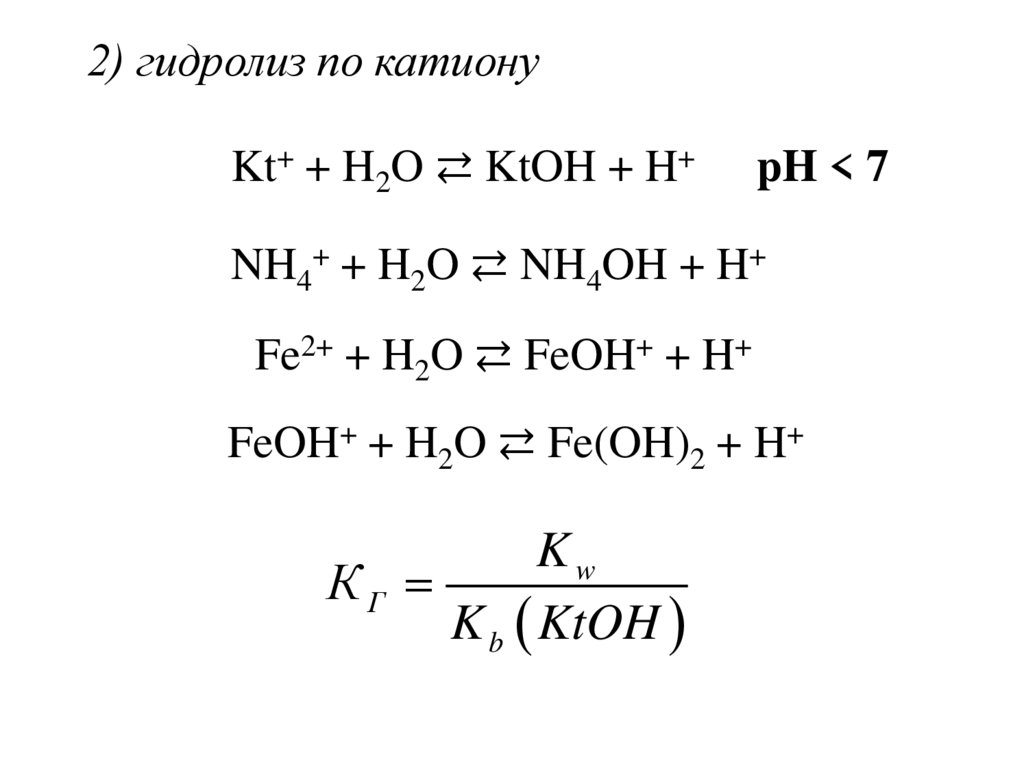
2) гидролиз по катионуKt+ + H2O ⇄ KtOH + H+
pH < 7
NH4+ + H2O ⇄ NH4OH + H+
Fe2+ + H2O ⇄ FeOH+ + H+
FeOH+ + H2O ⇄ Fe(OH)2 + H+
Kw
КГ
K b KtOH
27.
3) гидролиз по катиону и анионуKt+A- + H2O ⇄ KtOH + HA
CH3COONH4
pKa(CH3COOH) = 4,76
pH = 7
pKb(NH4OH) = 4,76
NH4NO2
pH < 7
pKa(HNO2) = 3,29
NH4CN pH > 7
pKa(HCN) = 9,31
28.
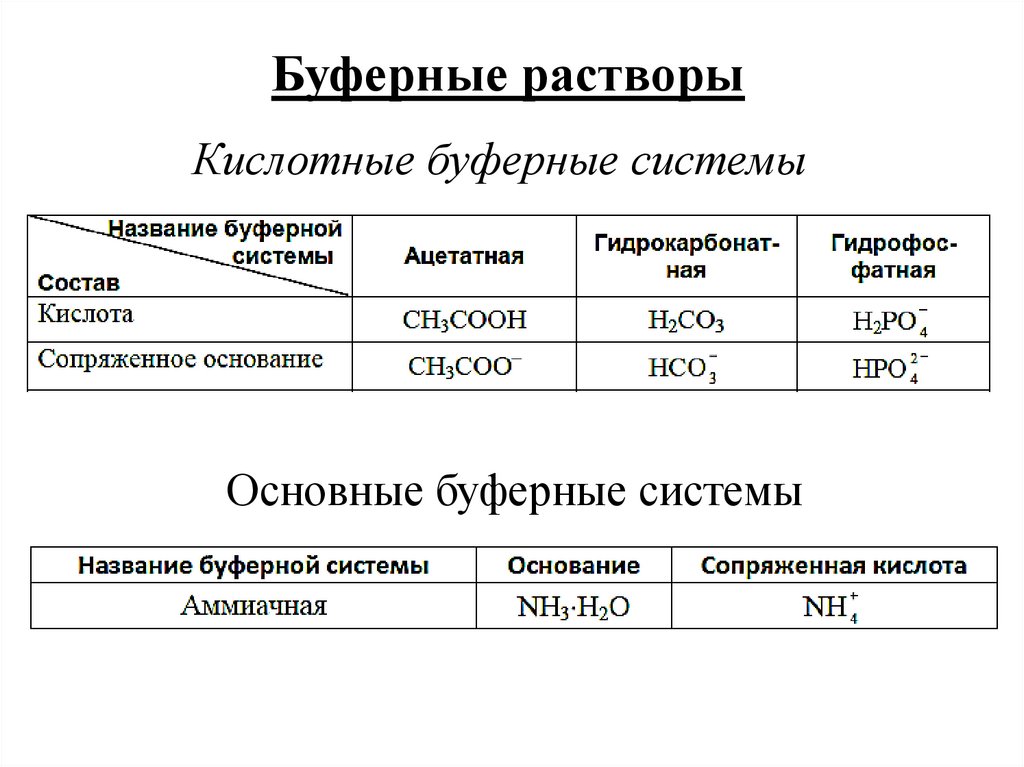
Буферные растворыКислотные буферные системы
Основные буферные системы
29.
Механизм буферного действияКатионы Н+ связываются основанием (акцептор протона)
Анионы ОН- связываются кислотой (донор протона)
30.
Уравнение Гендерсона-ГассельбахаКислотная буферная система
pH pK a lg
соль
кислота
Основная буферная система
основание
pH 14 pK b lg
соль
31.
Буферная емкостьБуферная емкость по кислоте
С Э ( HA) V ( HA)
Ba
pH Vбуф. р ра
Буферная емкость по основанию
С Э ( B) V ( B)
Bb
pH Vбуф. р ра

















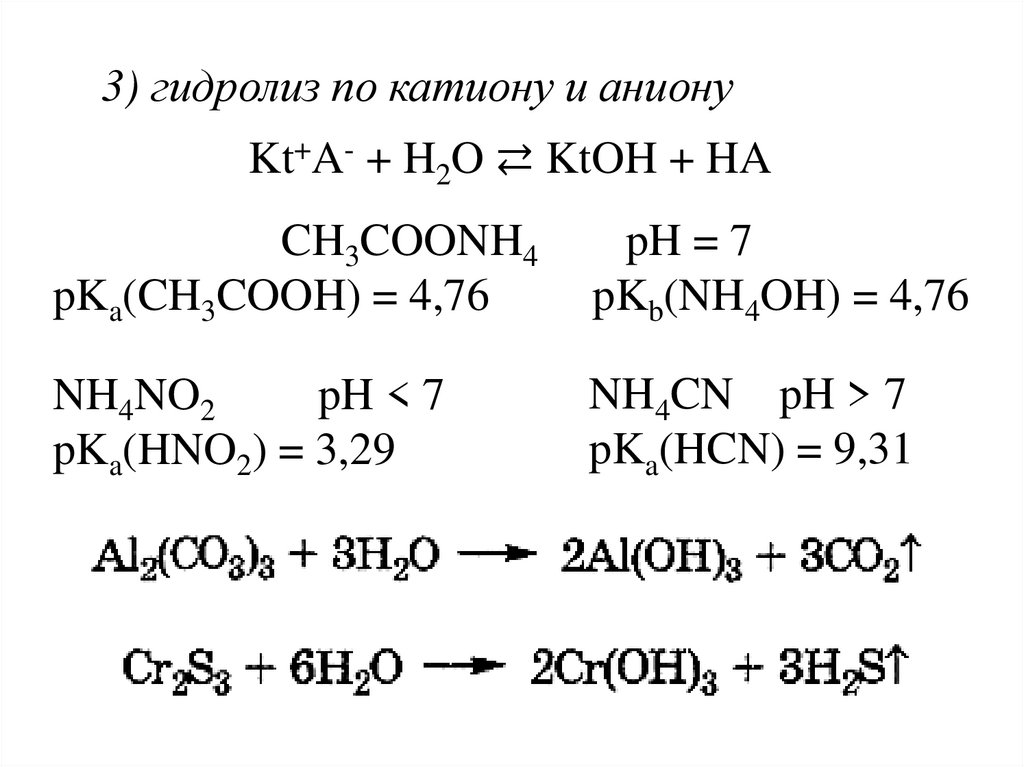



 chemistry
chemistry








