Similar presentations:
Степень окисления, валентность и электроотрицательность
1. Степень окисления, валентность и электроотрицательность
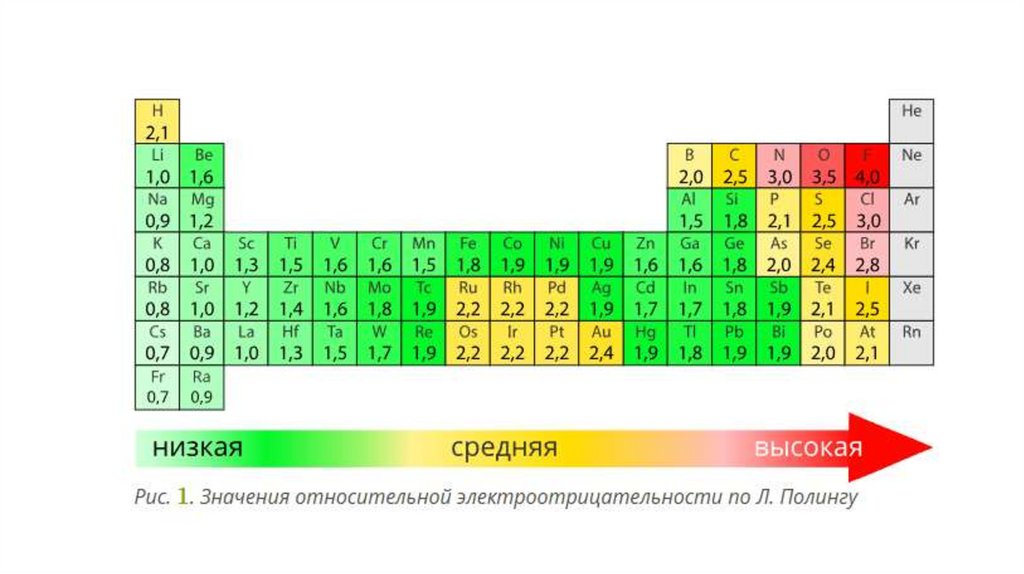
2. Электоотрицательность (ЭО)-способность атомов притягивать валентные электроны других атомов.
Понятие электроотрицательности атомов введено в году американским учёным ЛайнусомПолингом. Существует несколько шкал электроотрицательности, однако чаще всего
используется шкала относительных значений электроотрицательности, разработанная Л.
Полингом. По шкале Полинга за единицу принята электроотрицательность лития (ЭО ),
наиболее электроотрицательным химическим элементом является фтор (ЭО ), за ним следуют
кислород и хлор. Высокими значениями электроотрицательности обладают активные
неметаллы, атомам которых не хватает до завершения внешнего уровня одного или двух
электронов. Наименьшей электроотрицательностью обладают активные щелочные металлы
— литий, натрий, калий. Электроотрицательность водорода имеет промежуточное значение
(ЭО ).
Электроотрицательность элементов изменяется периодически, в периодах и главных
подгруппах её изменение совпадает с изменением неметаллических свойств, т. е. она
возрастает в периоде слева направо и убывает в подгруппе сверху вниз.
3.
4. Фтор является самым электроотрицательным элементом в периодической таблице по нескольким причинам:
1. Структура электронной оболочки: Фтор имеет семь электронов на внешнем энергетическом уровне(валентном уровне) и стремится заполнить свою оболочку, получив еще один электрон. Это делает его
очень реакционноспособным и способным притягивать электроны из других атомов.
2. Размер атома: Фтор имеет относительно небольшой атомный радиус. Это означает, что его ядро
находится ближе к внешним электронам, что усиливает притяжение между ядром и электронами, делая
фтор более эффективным в привлечении дополнительных электронов.
3. Заряд ядра: Фтор имеет высокий положительный заряд ядра (9 протонов), что также способствует
увеличению его способности притягивать электроны. Чем больше заряд ядра, тем сильнее оно может
притягивать электроны.
Эти факторы в совокупности делают фтор самым электроотрицательным элементом, что обозначается в
шкале Полинга значением 4.0.
5.
6. Электронная конфигурация атомов благородных газов
7. Валентность-число химических связей который может образовать атом с другими атомами.
8.
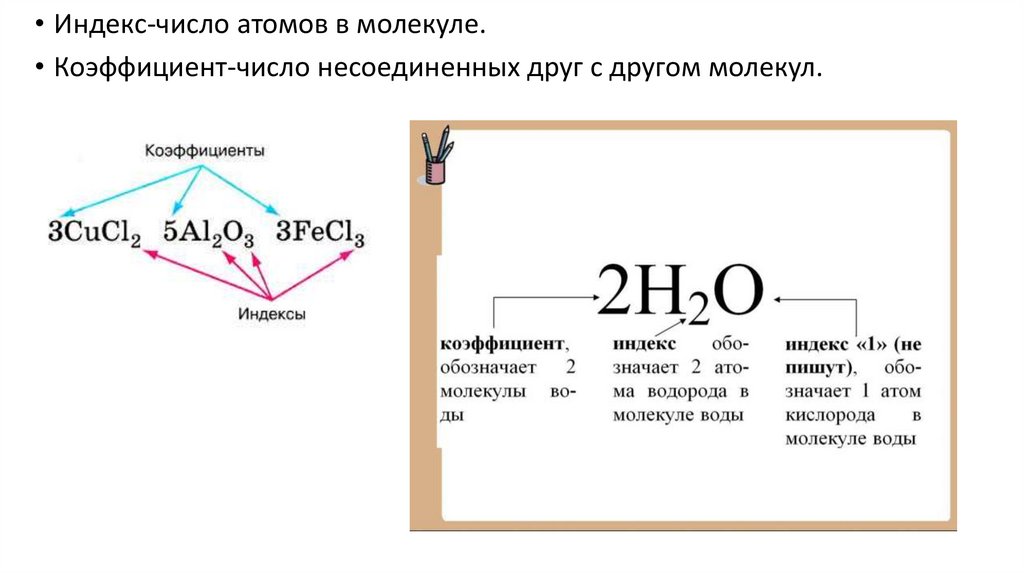
• Индекс-число атомов в молекуле.• Коэффициент-число несоединенных друг с другом молекул.
9. Как определить валентность по формуле?
1. CuCl22. Al2O3
3. FeCl3
4. H2O
5. Na2CO3
6. NO
7. Cr2O3
8. ZnCl2
9. I(NO3)3
10.
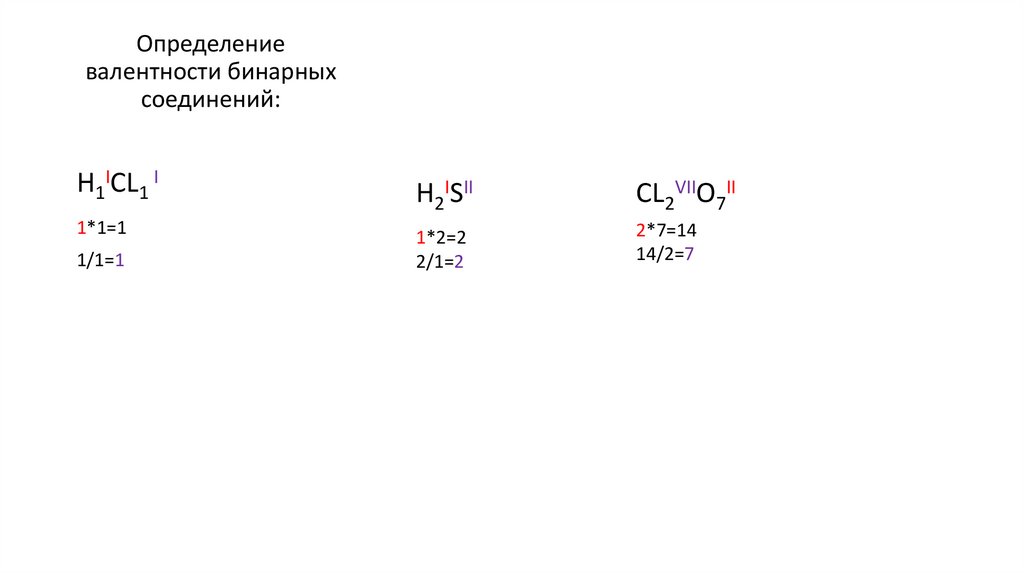
Определениевалентности бинарных
соединений:
H1ICL1 I
1*1=1
1/1=1
H2ISII
CL2VIIO7II
1*2=2
2/1=2
2*7=14
14/2=7
11. Определение валентности многоатомных соединений:
1. НАЙТИ ЭЛЕМЕНТЫ С ПОСТОЯННОЙВАЛЕНТНОСТЬЮ И УКЗАТЬ ИХ СВЕРХУ
РИМСКИМИ ЦИФРАМИ.
KICLVO3II
2. УМНОЖАЕМ ВАЛЕНТНОСТИ ИЗВЕСТНЫХ
ЭЛЕМЕНТОВ НА ИНДЕКСЫ ДАННЫХ
ЭЛЕМЕНТОВ.
2*3=6
1*1=1
6-1=5
3. ЧТОБЫ НАЙТИ ВАЛЕНТНОСТЬ
НЕИЗВЕСТНОГО ЭЛЕМЕНТА, МЫ
ВЫЧИТАЕМ ПОЛУЧИВШИЕСЯ РАНЕЕ
ПРОИЗВЕДЕНИЯ (БОЛЬШЕЕ МИНУС
МЕНЬШЕЕ) И НАХОДИМ НЕИЗВЕСТНУЮ
ВАЛЕНТНОСТЬ.
12.
1. НАЙТИ ЭЛЕМЕНТЫ С ПОСТОЯННОЙВАЛЕНТНОСТЬЮ И УКЗАТЬ ИХ СВЕРХУ РИМСКИМИ
ЦИФРАМИ.
2. УМНОЖАЕМ ВАЛЕНТНОСТИ ИЗВЕСТНЫХ
ЭЛЕМЕНТОВ НА ИНДЕКСЫ ДАННЫХ ЭЛЕМЕНТОВ.
3. ЕСЛИ ИЗВЕСТНЫЙ ЭЛЕМЕН НАХОДИТСЯ ЗА
СКОБКАМИ, ТО ПРЕДВАРИТЕЛЬНО УМНОЖАЕМ
ПОЛУЧИВШЕЕСЯ ПРОИЗВЕДЕНИЕ, КОТОРОЕ МЫ
ПОЛУЧИЛИ ИЗ ПУНКТА 2 НА ЧИСЛО ИНДЕКСА ЗА
СКОБКАМИ.
4. ЧТОБЫ НАЙТИ ВАЛЕНТНОСТЬ НЕИЗВЕСТНОГО
ЭЛЕМЕНТА, МЫ ВЫЧИТАЕМ ПОЛУЧИВШИЕСЯ РАНЕЕ
ПРОИЗВЕДЕНИЯ (БОЛЬШЕЕ МИНУС МЕНЬШЕЕ), ДАЛЕЕ
ДЕЛИМ ПОЛУЧИВШЕЕСЯ ЧИСЛО НА ИНДЕКС ЗА
СКОБКАМИ И В ИТОГЕ НАХОДИМ НЕИЗВЕСТНУЮ
ВАЛЕНТНОСТЬ.
13. Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом
электронейтральна.Металлы в сложных соединениях всегда проявляют положительную степень окисления.
Ca0 – Ca+2O
Na0 – Na+Cl
Неметаллы могут проявлять как положительные, так и отрицательные степени окисления.
В соединениях с металлами и водородом неметаллы всегда имеют отрицательную
степень окисления.
Cl20 – HCl- – HCl+O
H20 – KH- – H+NO3
S0 – CS2-2 - H2S+6O4
14. Для определения степеней окисления атомов необходимо усвоить следующие правила.
1. Металлы во всех сложных соединениях имеют только положительныестепени окисления.
2. Неметаллы могут иметь как положительные, так и отрицательные
степени окисления. В соединениях с водородом и металлами степени
окисления неметаллов всегда отрицательные.
3. Высшая (максимальная) степень окисления элемента, как правило,
равна номеру группы, в которой находится элемент в периодической
таблице Д.И. Менделеева. Низшая (минимальная) степень окисления
металлов равна нулю. Низшая степень окисления неметаллов равна: –
(8 – номер группы, в которой находится элемент).
15. 4.Некоторые элементы во всех сложных соединениях имеют постоянную степень окисления:
16.
17.
1. ЗАРЯД СОЕДИНЕНИЯ ДОЛЖЕН БЫТЬ РАВЕН 0.2. ПИШЕМ СТЕПЕНИ ОКИСЛЕНИЯ ИЗВЕСТНЫХ ЭЛЕМЕНТОВ,
УМНОЖАЕМ СТЕПЕНЬ ОКИСЛЕНИЯ НА ЧИСЛО ИНДЕКСОВ.
3. УРАВНИВАЕМ ЧИСЛО СТЕПЕНЕЙ ОКИСЛЕНИЯ
CuCl2
Al2O3
FeCl3
H2O
Na2CO3
NO
Cr2O3
ZnCl2
I(NO3)3














 chemistry
chemistry








