Similar presentations:
Валентность и степень окисления химического элемента
1. Тема урока Валентность и степень окисления
2.
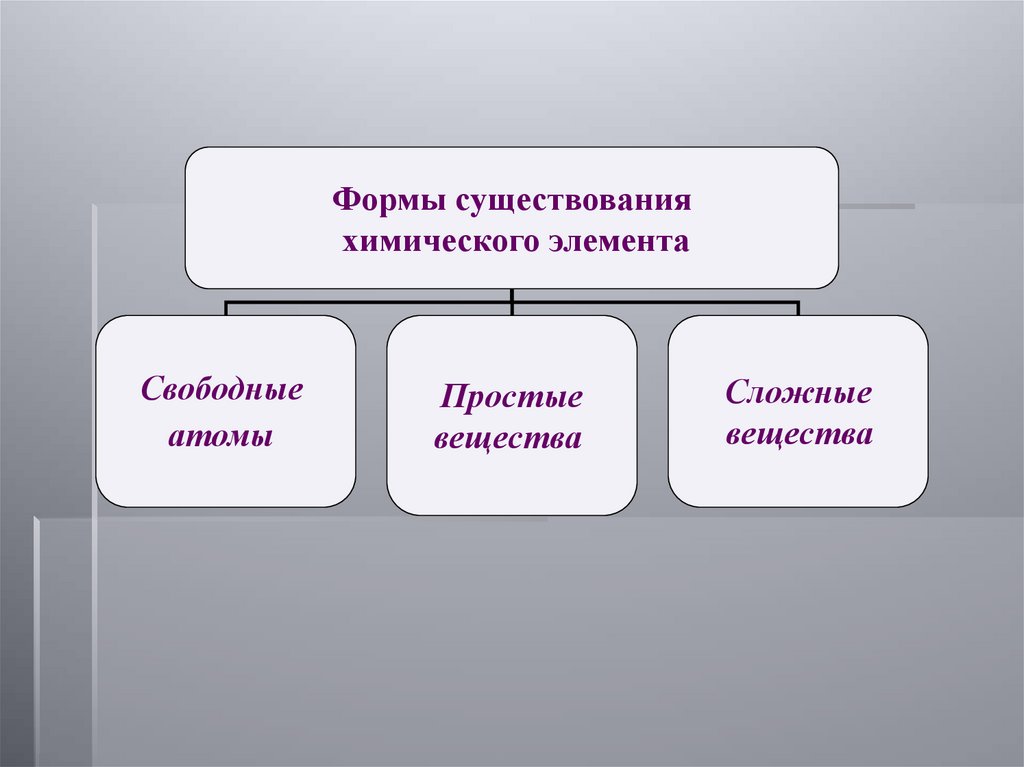
Формы существованияхимического элемента
Свободные
атомы
Простые
вещества
Сложные
вещества
3.
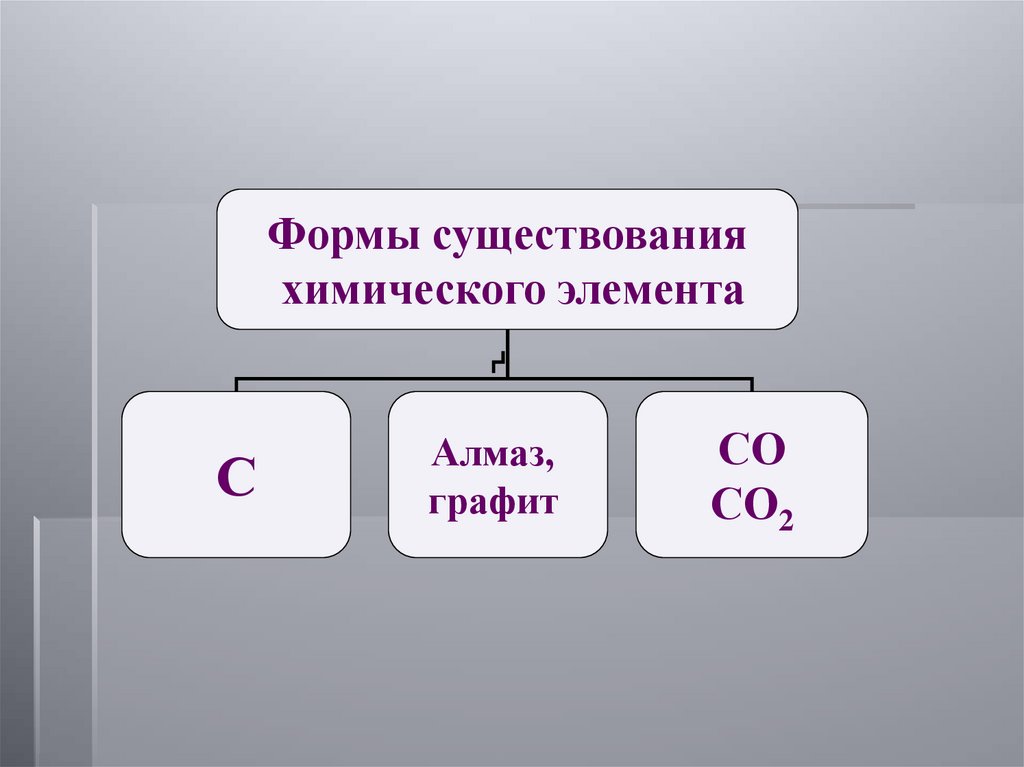
Формы существованияхимического элемента
С
Алмаз,
графит
СО
СО2
4.
Из атомов мир создавалаПрирода.
Два атома лёгких взяла
водорода.
Прибавила атом один
кислорода.
И получилась частица …
5.
Н2 ОПочему такой состав
имеет молекула
воды?
6. Задачи урока:
1. выяснить, от чего зависитсостав сложных веществ;
2.что необходимо знать,
чтобы составить формулы
веществ.
7. Самостоятельная работа
1. Составьте:А) схемы строения атомов водорода и
кислорода;
Б) схему образования химической
связи в молекуле воды;
В) структурную формулу молекулы
воды.
8.
1.Как называется способность атомовобразовывать связи с другими
атомами?
2.Какие электроны называются
валентными?
3. От чего зависит образование связей в
молекулах веществ?
9. Выводы
1. Число связей, в которых атом можетпринимать участие в молекуле
называется валентностью.
2. Валентные электроны расположены
на внешнем энергетическом уровне.
3. В образовании связей участвуют
электроны внешнего слоя и
неспаренные электроны.
10.
Как определить валентность по готовой формуле рассмотрим наданных примерах:
Пример1:
V2 O5
1). Обозначим валентность известного элемента:
II
V2 O5
2). Определяем общее число единиц валентности атомов:
2 * 5 = 10
3). Подставим его под химическими знаками атомов элементов
арабской цифрой:
II
V2 O5
(10)
4). Разделим это число на число атомов элемента, валентность
которого нам известна:
10 / 2 = 5 (в нашем примере)
5). Поставить частное (5) римской цифрой над искомым элементом
как его валентность:
V II
V2 O5
(10)
11.
Пример 2:Определим валентность элементов в солях кислородсодержащих кислот:
Al 2 (SO4)3
1). Определим число атомов кислорода (если символ стоит в скобках, то его
индекс нужно умножить на цифру, стоящую за скобками):
Al 2 (SO4)3
4 *3 = 12
2). Вычислим общее число единиц валентности для атомов кислорода:
Al 2 (SO4)3
12 * 2 = 24
3). Вычислим общее число единиц валентности для атомов металла (здесь
Al ):
III II
Al 2 (SO4)3
2*3=6
4). Отнимем от общего числа единиц валентности кислорода общее число
единиц валентности металла
24 – 6 = 18
5). Определим число атомов неметалла:
1*3=3
6). Разделим число, полученное в п.4 на число, полученное в п.5:
18 / 3 = 6 (это валентность неметалла)
12.
1. Определите валентность элементов поструктурной формуле.
2. Внесите значение валентности
элементов в таблицу.
Валентность
Степень окисления
Н
О
Са
Аl
С
13. Степень окисления
Степень окисления (с.о.)- этоусловный заряд, который мог
бы возникнуть на атоме при
условии, что все общие
электронные пары смещены к
более электроотрицательному
элементу.
14. Правила определения степеней окисления
У свободных атомов и у простых веществСТЕПЕНЬ ОКИСЛЕНИЯ равна 0
Металлы во всех соединениях имеют
ПОЛОЖИТЕЛЬНУЮ С.О.
В соединениях кислород имеет С.О.-2
(кроме Н2О2 , К2О2, ОF2 )
В соединениях с неметаллами у водорода
С.О.+1, а с металлами -1
В соединениях сумма всех С.О. равна 0
15. Определение степени окисления элементов в соединениях
+3 хАlСl 3
(+3)*1 + х *3 = 0;
+3 = - 3х
Х = -1
+3 -1
АlСl 3
16.
Например:Определить степень окисления хрома в дихромате калия
+1 x -2
K2 Cr2 O7
1). Составляем следующее управление, в котором неизвестную степень окисления
хрома обозначаем x (а т.к. в соединении K2 Cr2 O7 – два атома хрома, то x * 2):
(+1) * 2 + x * 2 + (-2) * 7 = 0
2). Решаем это уравнение
(+1) * 2 + x * 2 + (-2) * 7 = 0
2 + 2x – 14 = 0
2x = 14 - 2
2x = 12
x=6
3). Следовательно, степень окисления хрома в этом соединении равна +6:
+1 +6 -2
K2 Cr2 O7
Для самоконтроля правильности нахождения степени окисления нужно подсчитать
общую сумму положительных и отрицательных степеней окисления. Если оно равно 0,
то формула составлена правильно:
+1 +6 -2
В СОДЕРЖАНИЕ
K2 Cr2 O7
(+1) * 2 + (+6) * 2 + (-2) * 7 = 0
17.
Сравним понятия «степень окисления» и «валентность», а точнее, разграничимих.
Даже если абсолютные значения степени окисления и валентности совпадают,
их нельзя отождествлять.
1. Валентность,
характеризующая число
химических связей может
не иметь знака
2.
Валентность не может
равняться нулю (по
определению)
3. Валентность не может
быть дробным числом
4. Валентность имеет
определённый предел
применения.
1. Степень окисления
имеет знак
2. Степень окисления
элемента может
быть равна нулю
3. Степень окисления
может быть дробным
числом
4. Степень окисления
атомов химических
элементов можно
определять в любых
веществах
18. Сравнение понятий валентность и степень окисления
ВалентностьН
О
Са
Аl
С
Степень окисления
I
II
II
III
II, IV
Н +1, -1
О -2
Са +2
Аl +3
С +2, +4, -4
CI I, III, V,VII
CI ? ? ? ? ?
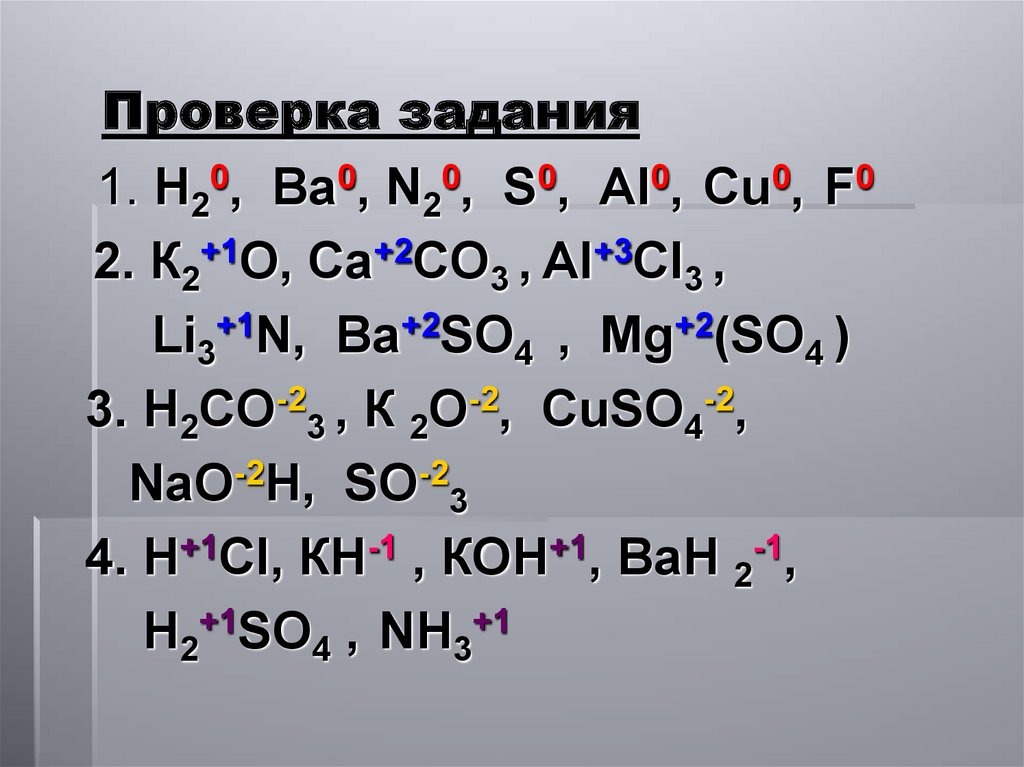
19. Проверка задания
1. Н20, Ва0, N20, S0, AI0, Cu0, F02. К2+1О, Ca+2CO3 , Al+3Cl3 ,
Li3+1N, Ba+2SO4 , Mg+2(SO4 )
3. Н2CO-23 , К 2О-2, CuSO4-2,
NaO-2H, SO-23
4. H+1Cl, КН-1 , КОН+1, BaН 2-1,
Н2+1SO4 , NН3+1
20. Задачи урока:
1. выяснить, от чего зависитсостав сложных веществ;
2.что необходимо знать,
чтобы составить формулы
веществ.
21. Выводы:
1. Состав сложных веществ зависит отстроения атомов, образующих
вещества и возможности
образовывать различные связи.
2.Чтобы составить формулу вещества
надо знать валентность или степень
окисления элементов.
22.
СПИСОК ЛИТЕРАТУРЫ:1. О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская. Настольная книга
учителя. Химия, 8 класс: М.: Дрофа, 2003;
2. А.А. Кудрявцев, Составление химических уравнений,М.: «Высшая
школа», 1991;
3. Г.П. Хомченко, К..И. Севастьянова ,Окислительновосстановительные реакции,М.: «Просвещение», 1989;
4. Л.С. Гузей, В.В. Сорокин, Окислительно-восстановительные
реакции, М.: Изд-во МГУ, 1992;



















 chemistry
chemistry








