Similar presentations:
Analitik kimyo fanidan taqdimot
1.
ANALITIK KIMYO FANIDANTAQDIMOT
2.
Analitikkimyo
yoki
analitika — kimyo va fizika
qonunlari asosida,
moddalarning
atom,
molekular,
fazoviy tuzilishini o'rganuvchi
sifat hamda miqdoriy tahlil
usul
va
uslublarini ishlab
chiquvchi
kimyo
fanining
alohida bo'limidir.
3.
Keltirilgan ta’rif analitik kimyo(analitika) fanining mazmun-mohiyatini
ifodalaydi. Boshqa darslik mualliflari
ham shu kabi ta’riflarni keltirishgan.
Masalan, mashhur tahlilchi akademik
Yu.AZolotov fikriga ko'ra “Analitik
kimyo—moddalarning tarkibi va ma’lum
ma’noda tuzilishini aniqlashga
doir
tamoyillar, usul va vositalar haqidagi
fandir”.
4.
1993-yil analitik kimyoga doirVIII
Yevropa
konferensiyasida
(Edinburg, sentabr 1993-yil) analitik
kimyoga quyidagicha ta’rif berilgan:
“Analitik kimyo moddaning tarkibi
va
tabiatiga doir
ma’lumotlarni
to'plovchi
umumiy
usullar,
vositalarning takomillashtiruvchi va
tatbiq etuvchi ilmiy fandir”.
5.
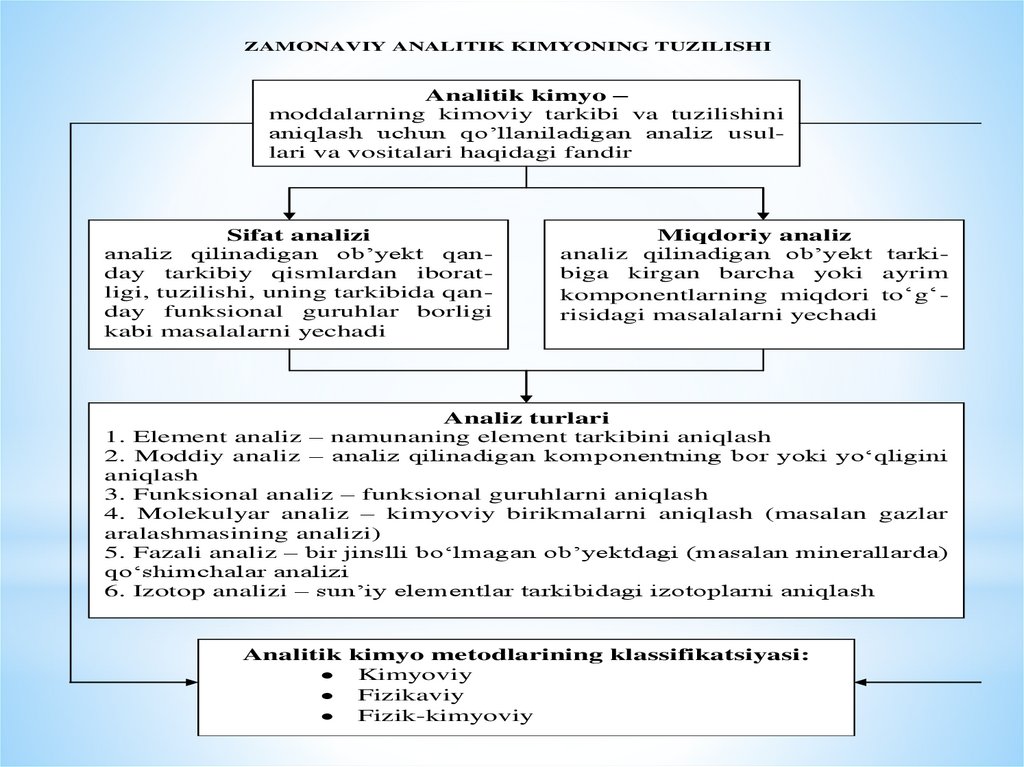
ZAMONAVIY ANALITIK KIMYONING TUZILISHIAnalitik kimyo –
moddalarning kimoviy tarkibi va tuzilishini
aniqlash uchun qo’llaniladigan analiz usullari va vositalari haqidagi fandir
Sifat analizi
analiz qilinadigan ob’yekt qanday tarkibiy qismlardan iboratligi, tuzilishi, uning tarkibida qanday funksional guruhlar borligi
kabi masalalarni yechadi
Miqdoriy analiz
analiz qilinadigan ob’yekt tarkibiga kirgan barcha yoki ayrim
komponentlarning miqdori to‘g‘risidagi masalalarni yechadi
Analiz turlari
1. Element analiz – namunaning element tarkibini aniqlash
2. Moddiy analiz – analiz qilinadigan komponentning bor yoki yo‘qligini
aniqlash
3. Funksional analiz – funksional guruhlarni aniqlash
4. Molekulyar analiz – kimyoviy birikmalarni aniqlash (masalan gazlar
aralashmasining analizi)
5. Fazali analiz – bir jinslli bo‘lmagan ob’yektdagi (masalan minerallarda)
qo‘shimchalar analizi
6. Izotop analizi – sun’iy elementlar tarkibidagi izotoplarni aniqlash
Analitik kimyo metodlarining klassifikatsiyasi:
Kimyoviy
Fizikaviy
Fizik-kimyoviy
6.
ANALIZ QILINADIGAN MODDA MIQDORIGA KO‘RA ANALIZ METODLARININGKLASSIFIKATSIYASI
Analiz qilinadigan modda miqdori
Analiz metodining nomi
Makroanaliz
Gramm-metod
Yarimmikroanaliz Santigramm-metod
Namuna massasi,
g
Namuna hajmi,
ml
1 – 10
10 – 100
0,05 – 0,5
1 – 10
Mikroanaliz
Milligram-metod
0,01 – 10–6
0,1 – 10–4
Ultramikroanaliz
Mikrogram-metod
10–6 – 10–9
10–4 -10–6
Submikroanaliz
Nanogram-metod
10–9 – 10–12
10–7 – 10–10
7.
SIFAT ANALIZINING TURLARIBo‘lib-bo‘lib analiz qilish
Sistemali analiz
Bo‘lib-bo‘lib analiz qilishda
moddaning tarkibi spetsifik
reaksiyalar bilan aniqlanadi,
bunday reaksiyalar yordamida
boshqa
ionlar
ishtirokida
hamanaliz qilinadigan ionlarni
aniqlashmumkin
Sistemali analizda ionlarar alashmasi guruh
reagentlari yordamida bir nechta guruhlarg
abo‘linadi, so‘ngra har qaysi guruhdagi ionlar
muayyan
ketma-ketlikda
xarakterli
reaksiyalar bilan aniqlanadi.
Guruh reagenti – bu ionlarning analitik
guruhlarini
aniqlashda
va
ajratishda
qo‘llaniladigan reagentdir.
Guruh reagentiga qo‘yiladigan talablar:
1. Ionlar guruhlarini amalda to‘liq ajratishi
kerak;
2. Gurug reagenti ta’sirida ajratilgan analitik
guruhga ishlov berish oson bo‘lishi kerak;
3. Guruh reagentining ortiqcha miqdori
keyingi analiz jarayoniga halaqit bermasligi
kerak
8.
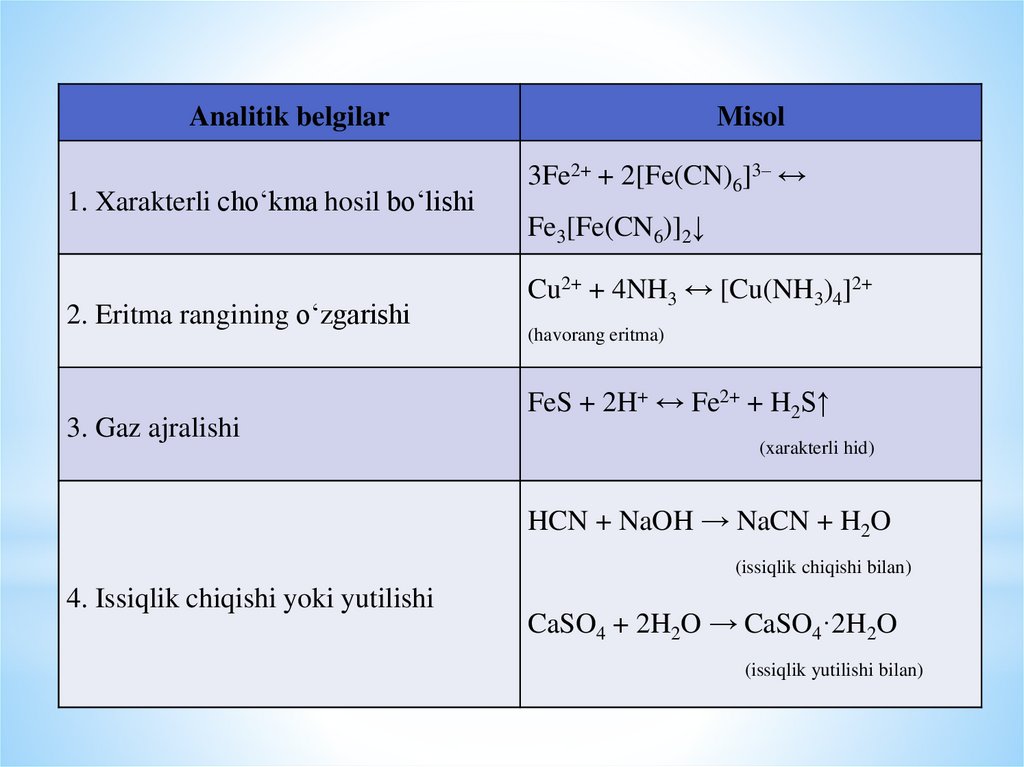
Analitik belgilar1. Xarakterli cho‘kma hosil bo‘lishi
2. Eritma rangining o‘zgarishi
3. Gaz ajralishi
Misol
3Fe2+ + 2[Fe(CN)6]3– ↔
Fe3[Fe(CN6)]2↓
Cu2+ + 4NH3 ↔ [Cu(NH3)4]2+
(havorang eritma)
FeS + 2H+ ↔ Fe2+ + H2S↑
(xarakterli hid)
HCN + NaOH → NaCN + H2O
(issiqlik chiqishi bilan)
4. Issiqlik chiqishi yoki yutilishi
CaSO4 + 2H2O → CaSO4·2H2O
(issiqlik yutilishi bilan)
9.
Kimyoviy sifat analizining asosiy tushunchalariAnalitik reaksiya – elementning borligiga dalolat beruvchi,
tashqi analitik samara bilan boradigan reaksiyalar.
Reagent – aralashmadagi ion (modda)ni ochib beruvchi
reaktiv
Maxsus reaksiyalar – tashqi samarasi (belgisi) murakkab
aralashmadagi faqat bir ion (momolekula)ga xos bo‘lgan analitik
reaksiya.
Selektiv reaksiyalar – tashqi belgisi ayrim ionlargagina
xos bo‘lgan analitik reaksiyalar.
Guruh reaksiyalari – tashqi belgisi bir guruh ionlari uchun
xos bo‘lgan analitik reaksiyalar bo‘lib, tegishli reagent guruh
reagenti deb ataladi.
Analitik reaksiyalarning sezgirligi – aniqlanuvchi ionning
ochilishi mumkin bo‘lgan eng kam miqdori, to‘rtta o‘zaro
bog‘langan o‘lchamlar bilan tavsiflanadi.
10.
Analitik reaksiyalar “ho‘l” va “quruq” usullar bilano‘tkazilishi mumkin.
1) quruq usulda modda va reaktivlar quruq holda olinadi va
reaksiyani qizdirish bilan olib boriladi.
2) Ho‘l usulda esa tekshirilayotgan modda bilan tegishli
reaktivlarning o‘zaro ta’siri eritmalarda kuzatiladi.
“Quruq” usul bilan o‘tkaziladigan reaksiyalar qatoriga
metall tuzlarining alangani bo‘yash bilan boradigan reaksiyalarni
kiritish mumkin. Platina simga natriy tuzlari yuqtirilib gaz
gorelkasi alangasiga tutilsa, alanga sariq rangga, kaliy tuzlaridabinafsha rangga, Sr tuzlarida-och qizil rangga, Ba tuzlarida-yashil
rangga bo‘yaladi. Bura Na2B4O7 10H2O yoki NaNH4HPO4 4H2O
lar ba’zi metallarning tuzlari bilan qorishtirilganda rangli marvarid
(shisha) lar hosil bo‘lishi va hokazolar quruq usulga misol bo‘la
oladi. Bu metodlar piroximiyaviy metodlar deyiladi.
11.
Ko‘pincha sifat analizi “ho‘l” usul bilano‘tkaziladi.
Bularni
o‘tkazish
uchun
tekshirilayotgan modda oldindan eritilgan
bo‘lishi kerak. Odatda erituvchi sifatida suv
ishlatiladi, agar modda suvda erimasa, kislotada
eritiladi. Kislotada eritilgan modda kimyoviy
o‘zgarishga uchrab, suvda oson eriydigan
bironta tuzga aylanadi.
Masalan: CuO↓ H2SO4 CuSO4 H2O
Fe(OH)3↓ 3HCl FeCl3 3H2O
CaCO3↓ 2HNO3 Ca(NO3)2 H2O CO2
12. kationlarni analitik klassifikatsiyalash metodlari
Analiz metodiVodorod sulfidli analiz metodi
Ammiak-fosfatli analiz metodi
Kislota-asosli analiz metodi
Analiz metodi nimaga
asoslangan
Metall sulfidlarining
eruvchanligiga
turlicha
Kationlar fosfatlarining suvda va
ammiak
eritmasida
turlicha
eruvchanligiga
Kationlarning kislotalar (HCl,
H2SO4) va asoslar (NaOH,
NH3·H2O)
ga
turlicha
munosabatiga
13. kationlarning vodorod sulfidli analiz metodi bo‘yicha klassifikatsiyasi
KATIONLARNING VODOROD SULFIDLI ANALIZ METODI BO‘YICHAKLASSIFIKATSIYASI
Guruh
Kationlar
I
K+, Na+, NH4+,
Mg2+
II
III
IV
V
Ba2+, Sr2+, Ca2+
Fe2+, Fe3+, Cr3+,
Al3+, Mn2+, Ni2+,
Zn2+, Co2+
Cu2+, Hg2+, Bi3+,
Sn2+, Sn(IV),
Sb(III), Sb(V),
As(III), As(V)
Ag+, Pb2+, Hg22+
Guruh reagenti
Mavjud emas
(NH4)2CO3,
NH3·H2O + NH4Cl,
pH = 9,25
(NH4)2S,
NH3·H2O + NH4Cl,
pH = 8 – 9
Birikmalarning eruvchanligi
Sulfidlar,
karbonatlar ,
xloridlar
va gidroksidlar
suvda eriydi
Karbonatlar suvda erimaydi
Sulfidlar suvda erimaydi ,
lekin suyultirilgan mineral
kislotalarda eriydi
Sulfidlar suvda va suyultiH2S, HCl, pH = 0,5 rilgan mineral kislotalarda
erimaydi
HCl
Xloridlar
suvda
va
suyultirilgan
mineral
kislotalarda erimaydi
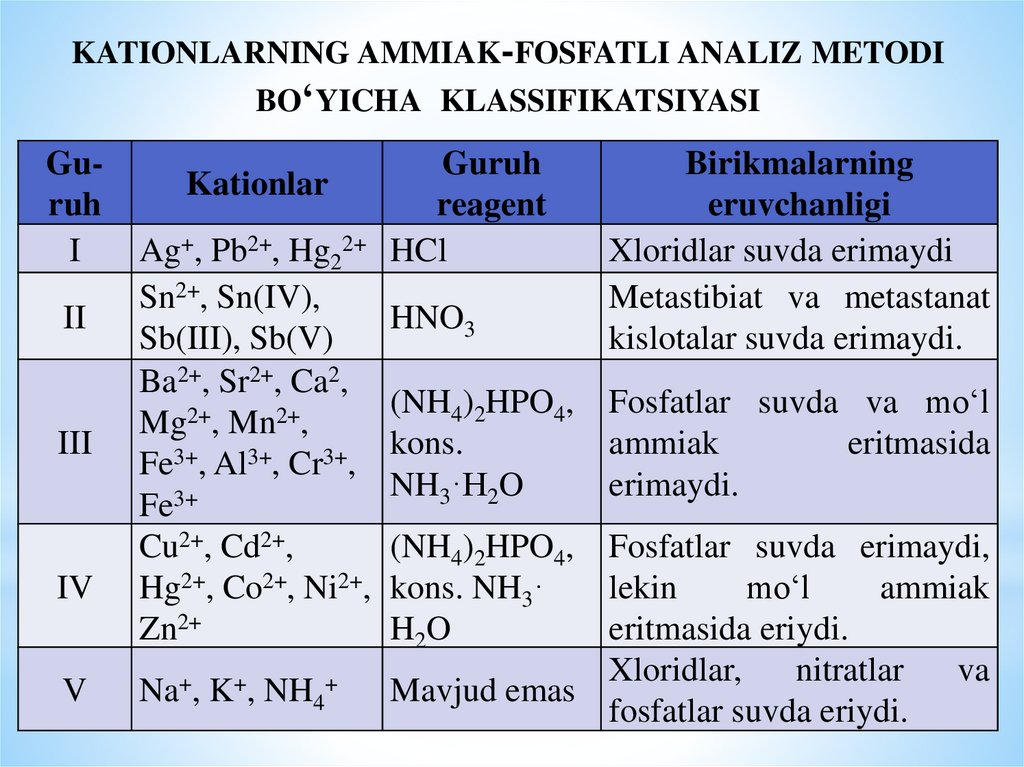
14. kationlarning ammiak-fosfatli analiz metodi bo‘yicha klassifikatsiyasi
KATIONLARNING AMMIAK-FOSFATLI ANALIZ METODIBO‘YICHA KLASSIFIKATSIYASI
Guruh
I
II
III
IV
V
Guruh
Kationlar
reagent
Ag+, Pb2+, Hg22+ HCl
Sn2+, Sn(IV),
HNO3
Sb(III), Sb(V)
Ba2+, Sr2+, Ca2,
(NH4)2HPO4,
2+
2+
Mg , Mn ,
kons.
3+
3+
3+
Fe , Al , Cr ,
NH3·H2O
Fe3+
Cu2+, Cd2+,
(NH4)2HPO4,
Hg2+, Co2+, Ni2+, kons. NH3·
Zn2+
H2O
Na+, K+, NH4+
Birikmalarning
eruvchanligi
Xloridlar suvda erimaydi
Metastibiat va metastanat
kislotalar suvda erimaydi.
Fosfatlar suvda va mo‘l
ammiak
eritmasida
erimaydi.
Fosfatlar suvda erimaydi,
lekin
mo‘l
ammiak
eritmasida eriydi.
Xloridlar,
nitratlar
va
Mavjud emas
fosfatlar suvda eriydi.
15. kationlarning kislota-asosli analiz metodi bo‘yicha klassifikatsiyasi
GuruhKationlar
I
Na+, K+, NH4+,
Mavjud emas
II
Ag+, Pb2+, Hg22+
III
Ba2+, Sr2+, Ca2+
2M HCl eritmasi
1M H2SO4 eritmasi
Sulfatlar suvda erimaydi.
+ C2H5OH
Mo‘l 6M NaOH
Gidroksidlar suvda erimaydi,
erit-masi + 3%
lekin mo‘l ishqorda eriydi.
H2O2
Gidroksidlar
suvda,
mo‘l
Mo‘l
kons.
ishqorda va ammiakda eriNH3·H2O
maydi.
Gidroksidlar
suvda
mo‘l
Mo‘l
kons.
ishqorda erimaydi, lekin mo‘l
NH3·H2O
ammiakda eriydi.
IV
V
VI
Al3+, Zn2+, Cr3+,
Sn(II), Sn(IV),
As(III). As(V)
Fe2+, Fe3+, Mg2+,
Mn2+, Bi3+,
Sb(III), Sb (V)
Co2+, Ni2+, Cd2+,
Cu2+, Hg2+
Guruh reagent
Birikmalarning eruvchanligi
Xloridlar, sulfatlar va gidroksidlar suvda eriydi.
Xloridlar suvda erimaydi
16. Gomogen sistemadagi muvozanat..
*17. Gomogen sistemadagi muvozanat.
* Massalar ta’siri qonuni* Massalar ta’siri qonunining kuchsiz elektrolitlarning ionlanish
jarayoniga qo’llanilishi.
* Ostval’dning suyultirish qonuni tenglamasi.
* Kuchli elektrolitlar nazariyasining asosiy qoidalari.
* Kuchli elektrolitlarning kuchsiz elektrolitlardan farq qiladaga
tomonlari.
* Aktivlik, aktivlik koeffisiyenti.
18.
*Tevarak-atrofda mavjud bo’lgan barcha moddalar,jismlar, va hatto tirik olam analitik kimyoning
tahlil ob’yektlari hisoblanadi. Ularni kimyoviy,
geologik, biologik, tibbiy, tabiiy, sun’iy, sintetik,
sanoat va ishlab chiqarish ob’yektlariga,
moddalarning tabiati bo’yicha anorganik va
organik moddalar, metallar, qotishmalar, radioaktiv
va zaharli moddalarga ajratish mumkin. Masalan,
havo, suv, tuproq, ruda, sement, qotishma, neft,
gaz, o’g’it, oziq-avqot mahsulotlari, kimyoviy
sintetik mahsulotlarning barchasi va boshqalar
tahlil ob’yektlariga kiradi. Ular ham o’z navbatida
bir qancha turlarga bo’linadi. Demak, mavjud
bo’lgan barcha narsalar tahlil ob’yektlaridir.
19.
*Namunaniquyidagi turlari mavjud: 1.General
(birlamchi) namuna, 2.vakolatli (o’rtacha laboratoriya)
namunasi, 3.analitik namuna( analiz uchun namuna)
*Agar tekshiriladigan modda suyuqlik bo’lsa, uning
gomogen yoki geterogen fazali ekanligiga qarab,
namuna olinadi.
*Gomogen materialdan (gazlar yoki suyuq moddalar
aralashmasidan) o’rtacha namuna olish oson. Agar
suyuq holatdagi modda harakatda bo’lsa, masalan
sanoatda chiqayotgan chiqindi suvlar, undan
(trubadan) namuna vaqti-vaqti bilan olinadi.
20.
*Agar tekshiriladigan modda statsionar holatda bo’lgansuyuqlik bo’lsa, uning o’zaro aralashishi yoki
aralashmasligiga qarab turlicha usul qo’llaniladi.
Suyuqlik
o’zaro
aralashuvchan
bo’lsa,
uni
aralashtirgandan so’ng zarur hajmdagi miqdorini turli
pipetkalar yordamida olish mumkin.
*Agar suyuqlik aralashmaydigan bo’lsa, uning turli
chuqurliklaridan maxsus pipetkalar yordamida
namuna olinadi va ularning barchasi qo’shilib, shu
amal takrorlanadi. Takrorlashni zarur miqdorli modda
olinguncha davom ettiriladi.
21.
*Tekshiriladigan gaz moddadan, namunani maxsus gazpipetkasi yordamida bevosita olish mumkin.
Olinadigan gazning eritmada erimasligini ta’minlash
uchun idish (gaz pipetkasi, gazometr) natriy
xloridning to’yingan eritmasi bilan to’ldirilgan
bo’lishi kerak.
*Qattiq agregat holatdagi tekshiriladigan ob’yekt bir
butun holatdagi yoki turli o’lchamlardagi qattiq modda
bo’lishi mumkin. Har xil o’lchamdagi qattiq moddalar
aralashmalarining turli nuqtalaridan (tuproq, o’g’it,
ruda, chiqindilar va boshqalar) namuna olish uchun
maxsus asboblar (shublar)dan foydalaniladi.
22. ANALITIK KIMYODA ISHLATILADIGAN REAKSIYALAR VA JARAYONLAR
**Analitik kimyoda qo’llaniladigan barcha reaksiyalar umumiy va
xususiy reaksiyalarga bo’linadi. Analizda moddalarni topish,
aniqlash, ajratish, va konsentrlash maqsadida, asosan kislotaliasosli, oksidlanish-qaytarilish, kompleks hosil bo’lish, cho’ktirisheritish va boshqa reaksiyalar keng qo’laniladi. Analizda
foydalaniladigan har qanday reaksiya va jarayonga qo’yiladigan
asosiy sabablardan biri uning mumkin qadar oxirigacha borishidan
iborat. Tez sodir bo’ladigan reaksiyalar sifat analizida ham,
miqdoriy analizda ham juda muhim hisoblanadi. Ayniqsa, miqdoriy
aniqlashlarda reaksiyalarning oxirigacha miqdoriy to’la sodir
bo’lishi juda muhim hisoblanadi. Shuning uchun ham analiz
jarayonida kimyoviy muvozanatga katta e’tibor beriladi. Kimyoda
sekin va juda sekin amalga oshadigan reaksiyalar ham borki, ular
analitik kimyoda qo’llanilmaydi, chunki ularni o’tkazish uchun ko’p
vaqt talab etiladi, bundan tashqari bunday reaksiyalar to’g’ri
natijalar bermaydi.
23.
*Analitik kimyoda kimyoviy muvozanatningkislotali-asosli,
oksidlanish-qaytarilish,
kompleks hosil bo’lish, cho’ktirish-eritish
singari
turlari
mavjud.
Kimyoviy
muvozanatning
konstantasi
asosida
reaksiyalarning yo’nalishi to’g’risida xulosalar
qilinadi. Analitik kimyoda qo’llaniladigan
reaksiyalar muayyan pH qiymat va haroratda
sodir bo’ladi. Reaksiyalarni o’tkazish uchun
zarur bo’lgan pH qiymati asosan bufer
eritmalar yordamida o’rnatiladi.
24. Qaytar va qaytmas reaksiyalar.
*Analizda qo’llaniladigan barcha reaksiyalar qaytar vaqaytmas reaksiyalarga bo’linadi. Bir vaqtning o’zida ikkala
tamonga boradigan reaksiyalarga qaytar reaksiyalar
deyiladi Aksariyat hollarda almashinish reaksiyalari bir
tomonga yo’nalgan bo’ladi, bunday reaksiyalar amalda
qaytmas reaksiyalar sanalib, ularni yozganda bitta strelka
bilan tasvirlash mumkin. Masalan:
*Ba2+ + SO42- → BaSO4.
*BaCl2 + Na2SO4 → BaSO4 +2NaCl.
*FeS+2HCl→↑H2S+FeCl
25. Analitik reaksiyalarning yo’nalishi
* Eritmalarda boradigan almashinish reaksiyalari Bertolle qoidasigabo’ysunadi. Bu qoidaga ko’ra “analitik reaksiyalar cho’kma, gaz,
kuchsiz elektrolitlar, kompleks va murakkab ionlar hosil bo’lishi
tomoniga yo’nalgan bo’ladi”.
* Bu holat reaksiyaga kirishuvchi va reaksiya natijasida hosil bo’luvchi
moddalar suvda yaxshi eriganda kuzatiladi. Agar hech bo’lmaganda
bitta modda suvda erimasa yoki gaz holida ajralib chiqsa, bunday
reaksiyalar oxirigacha boradi. Aslida har qanday reaksiya ma’lum
darajada qaytar bo’ladi, hatto bariy sulfatning hosil bo’lish reaksiyasi
ham qaytar bo’lib, eritmada albatta bariy va sulfat ionlari bo’ladi.
Hozirgi vaqtda almashinish reaksiyalarining yo’nalishi haqida quyidagi
qoidalar ma’lum:
26.
*1.Agar bir-biri bilan to’qnashuvchi ionlar noelektrolitmoddalar hosil qilmasa, bunday reaksiyalar natijasida
yangi moddalar hosil bo’lmaydi va eritmada faqat
ionlar bo’ladi.
*2.Agar bir-biri bilan ta’sirlashuvchi moddalar kuchsiz
elektrolitlar yoki oz eruvchan moddalar hosil qilsa
reaksiya shu moddalar hosil bo’ladigan tomoniga
siljib, amalda oxirigacha boradi, masalan:
*KOH+HCl→K++Cl-+ H2O
*NaOH+HCl→Na++Cl-+ H2O.
*CdCl2+H2S → CdS + H+ + Cl-
27.
*Kimyoviyreaksiyalarning tezligi. Kimyoviy
reaksiyalarning tezligi haqidagi ta’limot kimyoviy
kinetika deyiladi. Reaksiya tezligi reaksiyaga
kirishuvchi moddalar konsentratsiyasining vaqt birligi
ichida o’zgarishi bilan o’lchanadi.
*V=(dCD/dt )= -(dCA/dt) (1)
*Kimyoviy reaksiyalarning
tezligi
reaksiyaga
kirishuvchi moddalarning tabiatiga, temperaturaga,
bosimga hamda katalizatorning ishtirok etishiga
bog’liq. Kimyoviy reaksiyalar tezligining reaksiyaga
kirishuvchi moddalar konsentratsiyasiga bog’liqligini
birinchi bo’lib N.N.Beketov kashf etgan.
28. Vant-Goff
**Reaksiya tezligining temperaturaga bog’liqligi. Oddiy
temperaturada H bilan O aralashmasi 6,5·107 yil
davomida birikma hosil qiladi. Agar temperatura 630o
ga ko’tarilsa 1 3 sekund davomida portlash bilan
birikib suv bug’i hosil qiladi. Reaksiya tezligini t-ga
bog’liqligini quyidagicha ta’rifladi.
* (5)
29.
* Reaksiyatezligiga katalizator ta’siri. Katalizator kimyoviy
reaksiyaga ishtirok etadi. Reaksiya tezligini o’zgartiradi. Kimyoviy
jihatidan o’zgarmaydi.
* 2KClO3 2KCl+3O2
* 2KClO3+4MnO2=2KCl+2Mn2O7
* 2Mn2O7→4 MnO2+3O2
* 2KClO3 + MnO2→2KCl+3O2+ MnO2
* N2+3H2 2NH3
* N2+2Fe↔2FeN
* 2FeN+3H2↔2NH3+2Fe
* N2+H2+Fe 2NH3+Fe
30.
* N.N.Beketov tomonidan kiritilgan qonuniyat, norvegiyalik olimlarGuldberg va Vaage (1867-y.) tomonidan “Massalar ta’siri konuni”
nomi bilan quyidagicha ta’riflanadi: Kimyoviy reaksiya tezligi
reaksiyaga
kirishayotgan
moddalarning
konsentratsiyalari
ko’paytmasiga to’g’ri proporsionaldir.
* mA + nB = pC + qD
(2)
* Reaksiya
tezligining
reaksiyaga
kirishuvchi
moddalar
konsentratsiyasiga bog’liqligini ifodolovchi tenglama reaksiyaning
kinetik tenglamasi deyiladi va quyidagi ko’rinishga ega bo’ladi:
* ν = k [A]m[B] n
(3)
* k – reaksiyaning tezlik konstantasi (proporsionallik koyeffisenti)
bo’lib, u temperatura, bosim va reaksiyaga kirishayotgan moddalar
* Reaksiyaga kirishuvchi moddalar konsentrasisyasi A = B =1 ν=k (4)
ning tabiatiga bog’liq.
31. Reaksiyaning muvozanat konstantasi.
* To’g’ri va teskari reaksiyalar tezliklarining o’zarotenglashgan holatida
kimyoviy muvozanat yuzaga kelgan bo’ladi. , ya’ni:
* ν 1 = ν2
* holat yuzaga keladi. Bunday kimyoviy muvozanat dinamik (harakatchan)
muvozanat bo’lib, u doimo o’ngdan chapga va chapdan o’ngga siljib turgan
reaksiyalarni aks ettiradi. ν1 = ν2 o’rniga (7) va (8) tenglamalarda keltirilgan
tegishli qiymatlar qo’yilsa:
* k1[A]m·[B]n = k2[D]p·[E]q (10)
* tenglama hosil bo’ladi. Tenglamadagi o’xshash hadlar tegishli tomonlarga
o’tkazilsa:
*
(11)
* tenglama hosil bo’ladi. Bu tenglamadagi
*
(12)
*
32.
* Muvozanat konstantasi K ning qiymati qancha katta bo’lsa, reaksiyashuncha o’ngga yo’nalgan bo’ladi va aksincha. Misol: A+B=D+E
reaksiya uchun K=10-6 bo’lsa massalar ta’siriga muvofiq:
*
(14)
[ D] [ Е ]
6
10
[ A] [ В]
33.
*Bu tenglamadan reaksiya muhitida reaksiya mahsulotilarikonsentratsiyalari ko’paytmasi [D][E] boshlang’ich mahsulotlar
konsentratsiyalari ko’paytmasi [A][B]dan 1000000 (mln) marta
kichikligini ko’rsatadi. Demak reaksiyaning muvozanati chapga
(dastlabki mahsulotlari hosil bo’lgan tamonga) siljigan bo’ladi.
K=106 bo’lgan holatda mahsulotlar konsentratsiyasi
ko’paytmasi [D][E] boshlang’ich moddalar konsentratsiyalari
ko’paytmasidan 1 000 000 marta ko’p bo’ladi. Bunda reaksiya
muvozanati o’ngga siljigan bo’ladi. Muvozanatning siljishini
Fe3+ kationining NH4SCN reagenti yordamida aniqlash
reaksiyasi misolida ko’rsak:
*FeCl3 + 3NH4SCN↔ Fe(SCN)3 + 3NH4Cl
34.
*Аktivlikbu eritmаning idеаl eritmа emаsligi
o’lchоvidir. Аktivlik bu hisоblаnmаgаn yordаmchi
tеrmоdinаmik funksiyadir, bu kаttаlikni tеrmоdinаmik
tеnglаmаlаrdаgi konsentrаtsiya o’rnigа qo’yilsа idеаl
sistеmаlаr uchun bo’lgаn tеnglаmаlаrni ko’rilаyotgаn
rеаl eritmаlаr uchun qo’llаsh imkоnini bеrаdi. Bundа
аsоsiy sаbаb elеktrоstаtik kuchlаrdir, lеkin bоshqа
effеktlаrning оz bo’lsаdа tа’siri bo’lаdi. Elеktrоstаtik
kuchlаr-bu zаryadlаngаn zаrrаchаlаr, ya’ni iоnlаrdir.
Аktivlik muvоzаnаt konsentrаtsiyasi bilаn quyidаgi
tеnglаmа оrqаli bоg’lаngаn:
*а=f [C]
*f—аktivlik kоeffitsiyеnti, o’lchоvsiz kаttаlikdir.
35.
*Moddalarningaktivligi
koeffitsiyentlari
va
konsentratsiyalariga bog’liq:
ularning
aktivlik
muvozanatdagi
*a=f[A] (16)
*Yuqoridagi muvozanat
konstantasi formulasiga
moddalarning
aktivliklari
qo’yilsa,
tenglama
quyidagicha bo’ladi:
*mA + nB ↔pC + qD (17)
*Bu tenglamadagi to’g’ri va teskari reaksiyalarning
tezligi quyidagicha ifodalanadi
*νAB = k1∙amA ∙ anB (6) νCD = k2∙apC ∙ aqD (18)
36.
* Muvozanat qaror topgach to’g’ri va teskari reaksiyalar tezligi birbiriga teng bo’ladi, ya’ni: νAB νCD* Bu tenglikning qiymatlarini o’rniga
* k1∙amA ∙ anB = k2∙apC ∙ aqD (18)
* bo’ladi.
* Bundan :
*
(19)
* Ushbu (9) tenglamadagi Kt- termodinamik muvozanat konstantasi
deyiladi.
*
k 1 a Cp a Dq
m n
k2 a A aB
k1
K мув. К Т
k2
(20)
q
a Cp a D
n
am
a
A
B
КТ
37.
* Kt moddalar tabiati va temperaturaga bog’liq bo’ladi. Agar (20)tenglamadagi hamma moddalar aktivliklarini (16) tenglamadagi [f]
bilan almashtirilsa, u holda
*
* bunda
*
(21)
*
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
*Eritmani ion kuchi 0 va aktivlik koeffitsiyentlarif 1 bo’lgan holatida KC KT bo’ladi. Ayrim hollarda
KT ni tajriba yo’li bilan, ya’ni eritma ion kuchining
nolga teng bo’lgan qiymati bilan KC ni ekstrapolyatsiya
qilib topish mumkin.
*Cheksiz suyultirilgan eritmalarda aktivlik koeffitsiyenti
birga teng bo’lib, aktivlik konsentratsiyaga tenglashadi.
Debay-Xyukkelning kuchli elektrolitlar nazariyasi
asosida o’rtacha aktivlik koeffitsiyenti topilishi
mumkin. O’rtacha aktivlik koeffitsiyenti eritmaning ion
kuchi bilan bog’liq. Eritmaning ion kuchi
* =(1/2)[C1Z12+C2Z22+...+CnZn2] (23)
48.
–* Eritmaning ion kuchi ( )- bilan aktivlik koeffitsiyenti o’rtasidagi
matematik bog’lanishni 1923 yilda P.Debay va Ye.Gyukkel topgan.
Aktivlik haqidagi ta’limotga asosan, massalar ta’siri qonuni
tenglamasiga ionlarning konsentratsiyasi emas, balki ularning
aktivligi kirishi kerak.
* Aktivlik koeffitsiyenti va eritmaning ion kuchi orasidagi bog’lanish
quyidagi formula bilan ifodalanadi:
* Suyultirilgan eritma (0,01 – 0,05 n) uchun Debay-Gyukel formulasini
* – lg f 0,5z 2
* Konsentrlangan eritma (0,1 – 0,5 n) uchun Debay-Gyukel
formulasini
lg f 0,5 z
2
1
49.
*Massalarta’siri qonunining analitik
kimyoda ahamiyati juda katta bo‘lib,
undan
kuchsiz
elektrolitlarning
dissotsilanish konstantasini, kompleks
birikmalarning barqarorligini, gidroliz
konstantasini,
yomon
eriydigan
cho‘kmalarning hosil bo‘lishini va
ularning erishini hisoblashda, oksidlanishqaytarilish reaksiyalarining yo‘nalishini
aniqlashda
va
boshqa
sohalarda
foydalaniladi.
50. Massalar ta’siri qonuni, uning gomogen va geterogen tizimdagi muvozanatga tatbiqi.
** Massalar ta’siri qonuni analitik kimyoda turli analitik reaksiyalarda
keng qo‘llaniladi:
* 1. Cho‘ktirish reaksiyalarida – cho‘kma hosil bo‘lishini oldindan
bilib berish uchun.
* 2. Kislota – asos muvozanatida eritmalar pH qiymatini va tuzlarning
gidroliz darajasini hisoblash uchun.
* 3. Oksidlanish – qaytarilish reaksiyalarida muvozanat doimiysi va
reaksiya unumini hisoblash uchun.
* 4. Kompleks hosil bo‘lish reaksiyalarida kompleks ion barqarorligi
doimiysini hisoblash va boshqa ko‘p masalalarda ishlatiladi.















































 chemistry
chemistry



