Similar presentations:
Ферменты: общая характеристика, классификация и номенклатура
1. ФЕРМЕНТЫ:
общая характеристика, классификация иноменклатура
2. ФЕРМЕНТЫ (от лат. fermentum - брожение, закваска) - это энзимы, специфические белки, увеличивающие скорость протекания
химических реакций вклетках всех живых организмов.
Наука о ферментах называется энзимологией.
3. Ферменты (энзимы) – многочисленная группа специализированных белков, биологическая функция которых состоит в ускорении
биохимических реакциях ворганизме.
Ферменты-биокатализаторы белковой
природы.
4. Термин «фермент» был предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
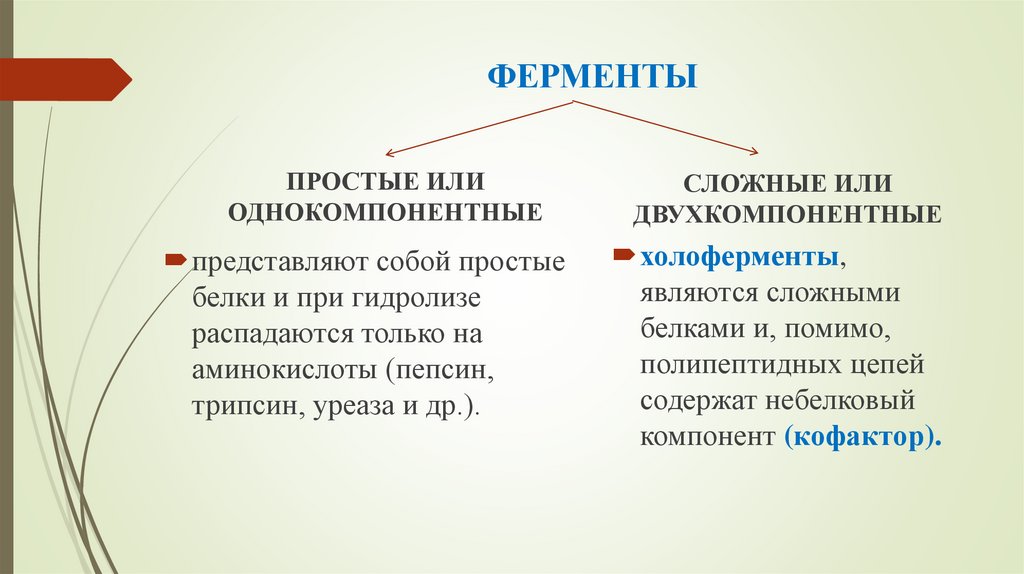
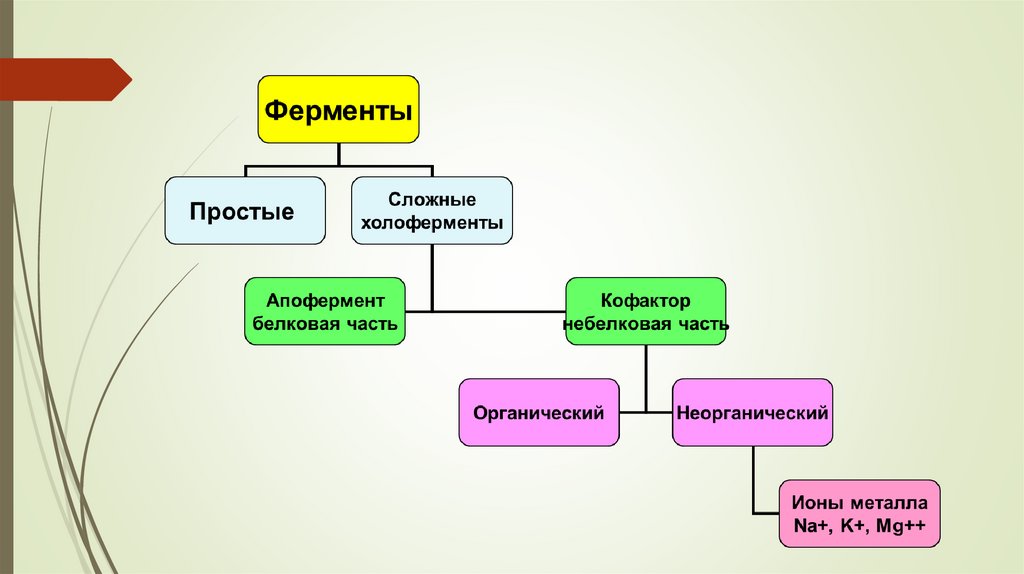
5. ФЕРМЕНТЫ
ПРОСТЫЕ ИЛИОДНОКОМПОНЕНТНЫЕ
представляют собой простые
белки и при гидролизе
распадаются только на
аминокислоты (пепсин,
трипсин, уреаза и др.).
СЛОЖНЫЕ ИЛИ
ДВУХКОМПОНЕНТНЫЕ
холоферменты,
являются сложными
белками и, помимо,
полипептидных цепей
содержат небелковый
компонент (кофактор).
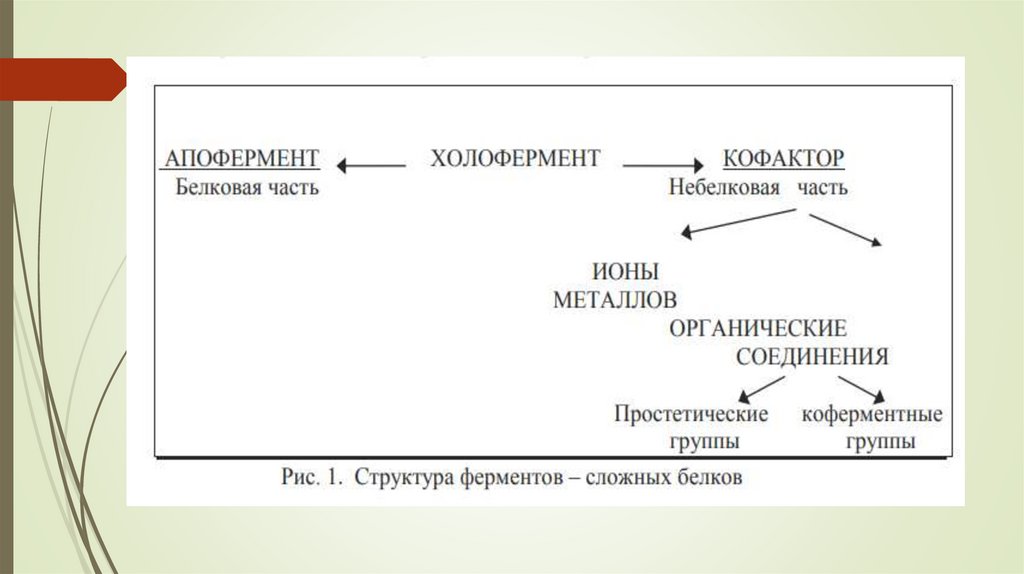
6. Белковая часть двухкомпонентного фермента называется апоферментом. Кофакторы могут иметь различную прочность связи с
апоферментом.Если кофактор прочно связан с полипептидной цепью, он
называется простетической группой.
Между простетической группой и апоферментом –
ковалентная связь.
Если кофактор легко отделяется от апофермента и способен к
самостоятельному существованию, то такой кофактор называется
коферментом.
7.
8. Виды кофакторов: По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими
соединениями.Органические кофакторы можно разделить на две группы:
1) простетические группы – кофакторы, которые прочно соединены с
апоферментом и при выделении из организма не отсоединяются от белковой части.
Например, ФАД в составе фермента сукцинатдегидрогеназы из цикла Кребса.
2) коферменты – кофакторы, которые соединены с апоферментами слабыми
связями и легко от него отщепляются: например, НАД, НАДФ, а иногда и ФАД.
Неорганические кофакторы представлены ионами металлов (чаще всего ионами
железа, меди, марганца, цинка и т.д.).
Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа,
либо образуют мостики, связывающие фермент с субстратом.
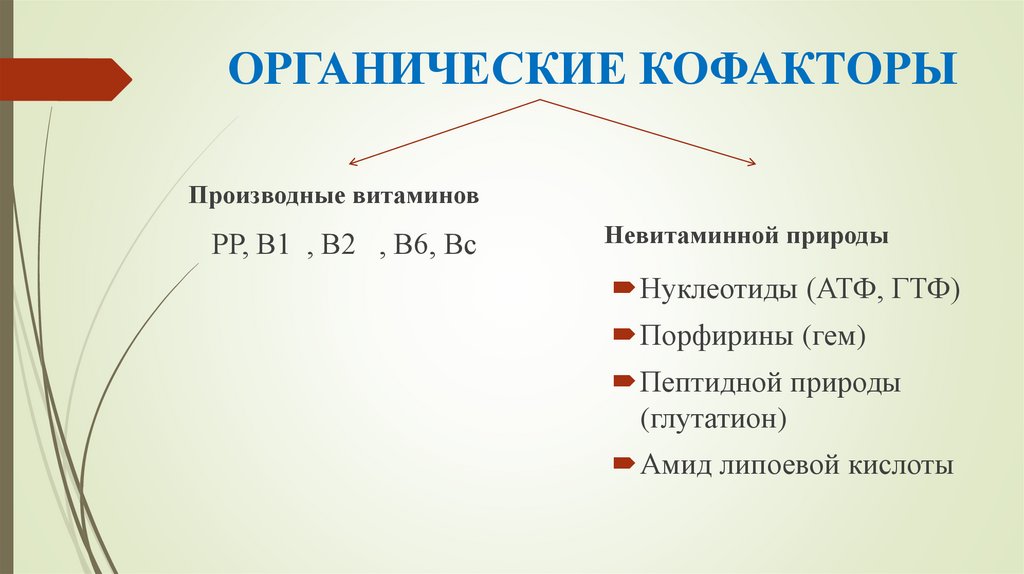
9. ОРГАНИЧЕСКИЕ КОФАКТОРЫ
Производные витаминовРР, В1 , В2 , В6, Вс
Невитаминной природы
Нуклеотиды (АТФ, ГТФ)
Порфирины (гем)
Пептидной природы
(глутатион)
Амид липоевой кислоты
10.
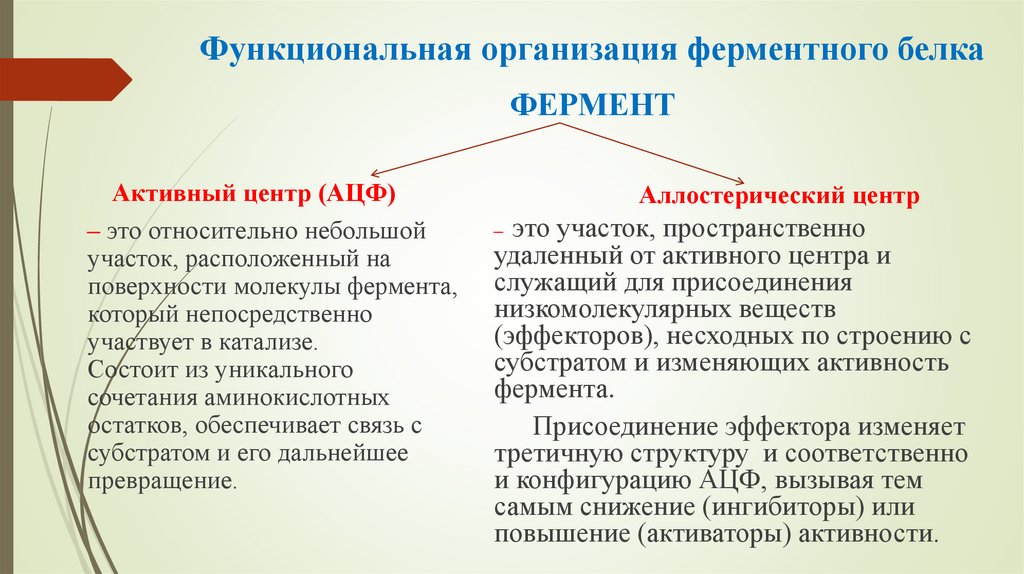
11. Функциональная организация ферментного белка
ФЕРМЕНТАктивный центр (АЦФ)
– это относительно небольшой
участок, расположенный на
поверхности молекулы фермента,
который непосредственно
участвует в катализе.
Состоит из уникального
сочетания аминокислотных
остатков, обеспечивает связь с
субстратом и его дальнейшее
превращение.
Аллостерический центр
– это участок, пространственно
удаленный от активного центра и
служащий для присоединения
низкомолекулярных веществ
(эффекторов), несходных по строению с
субстратом и изменяющих активность
фермента.
Присоединение эффектора изменяет
третичную структуру и соответственно
и конфигурацию АЦФ, вызывая тем
самым снижение (ингибиторы) или
повышение (активаторы) активности.
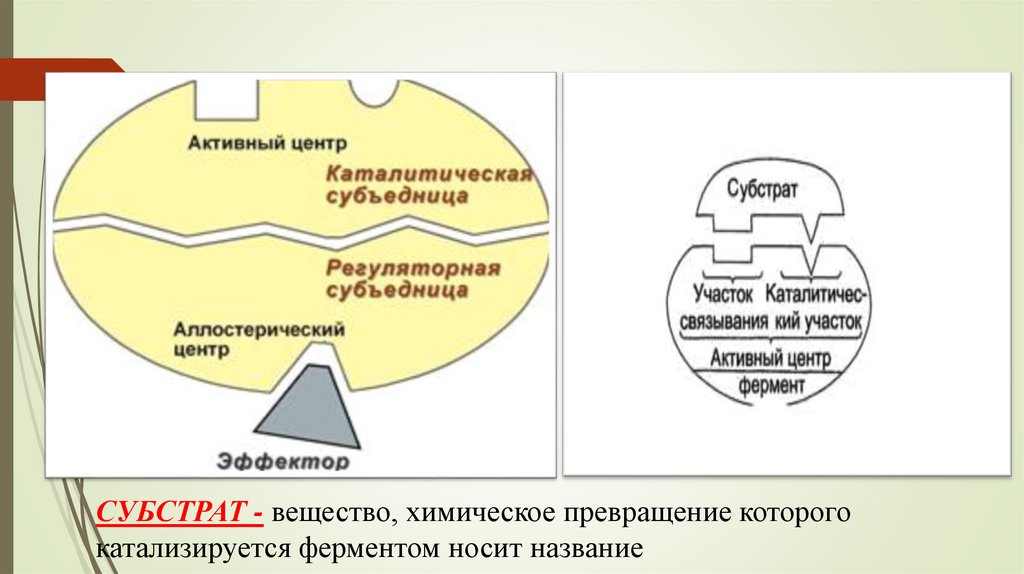
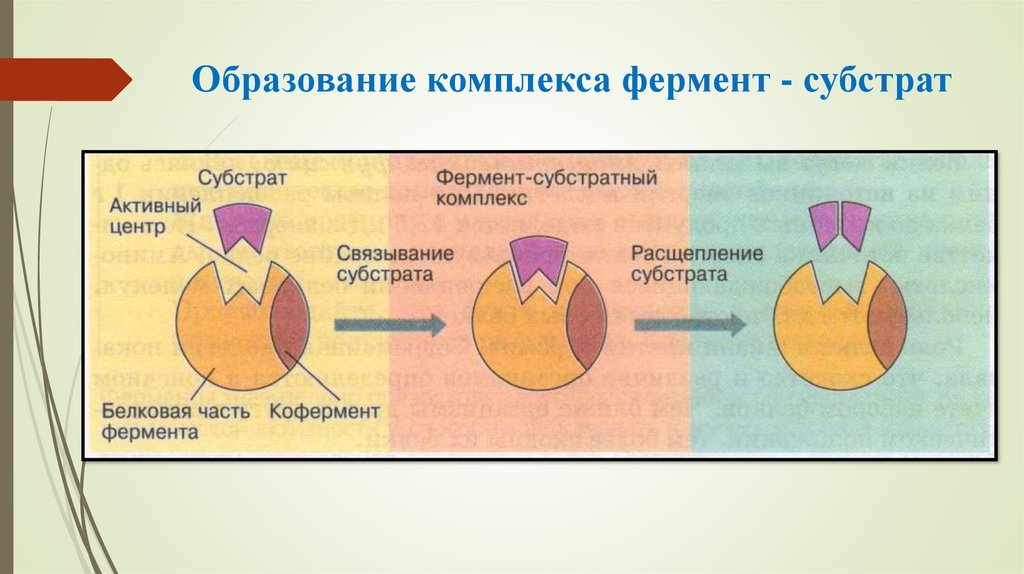
12. Активный центр (АЦФ) может иметь 2 участка: - субстратный (якорный) - участок, который отвечает за комплиментарное связывание
субстрата и образование фермент –субстратного комплекса.;
- каталитический - непосредственно участвуют в
химические реакции с субстратом.
.
Субстратный участок обладает геометрическим сходством
(соответствием) молекулы субстрата и обеспечивает
специфичность действия фермента.
У сложных ферментов в состав активного центра обязательно
входит кофактор.
13.
СУБСТРАТ - вещество, химическое превращение которогокатализируется ферментом носит название
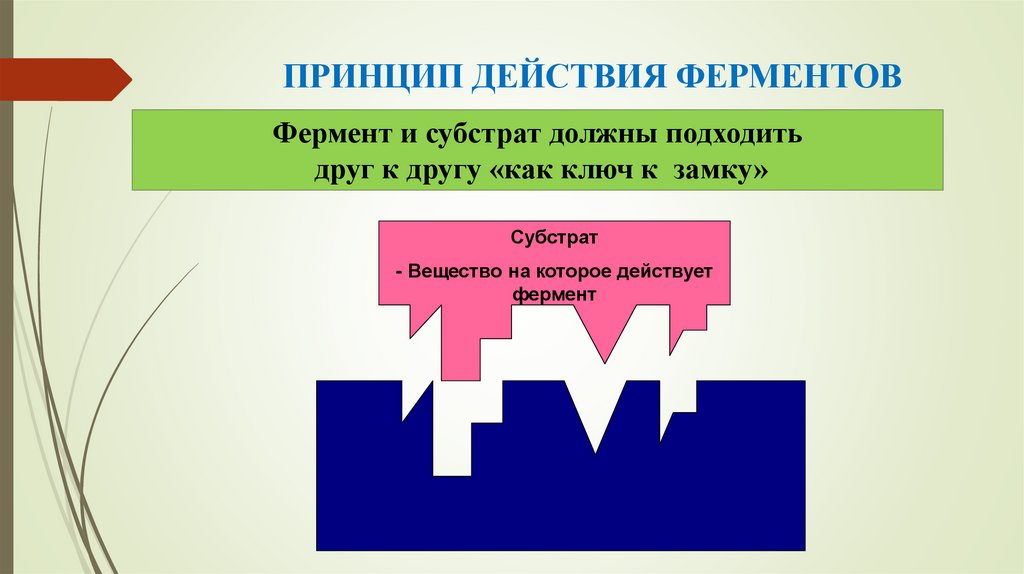
14. ПРИНЦИП ДЕЙСТВИЯ ФЕРМЕНТОВ
Фермент и субстрат должны подходитьдруг к другу «как ключ к замку»
Субстрат
- Вещество на которое действует
фермент
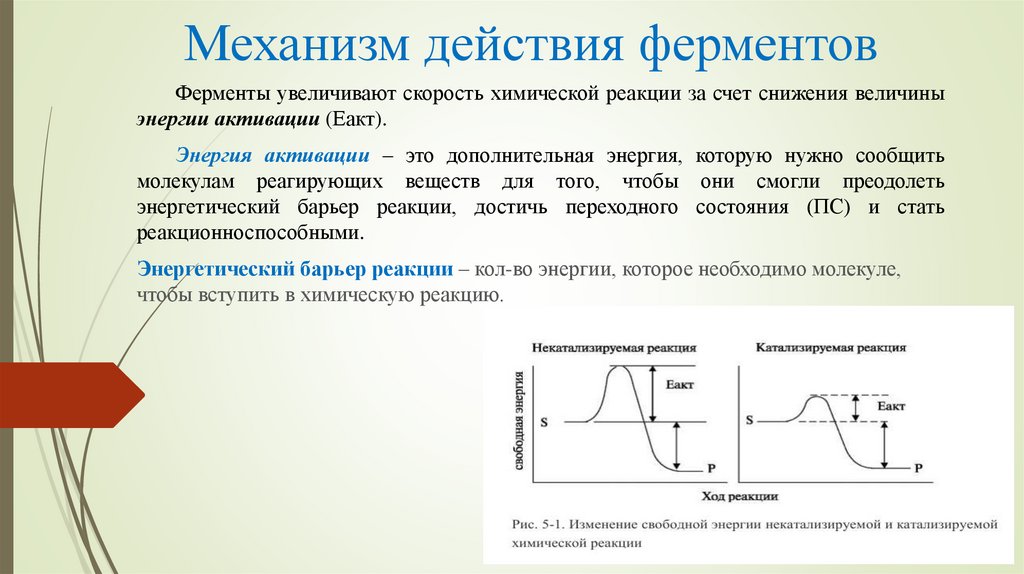
15. Механизм действия ферментов
Ферменты увеличивают скорость химической реакции за счет снижения величиныэнергии активации (Еакт).
Энергия активации – это дополнительная энергия, которую нужно сообщить
молекулам реагирующих веществ для того, чтобы они смогли преодолеть
энергетический барьер реакции, достичь переходного состояния (ПС) и стать
реакционноспособными.
Энергетический барьер реакции – кол-во энергии, которое необходимо молекуле,
чтобы вступить в химическую реакцию.
16. Образование комплекса фермент - субстрат
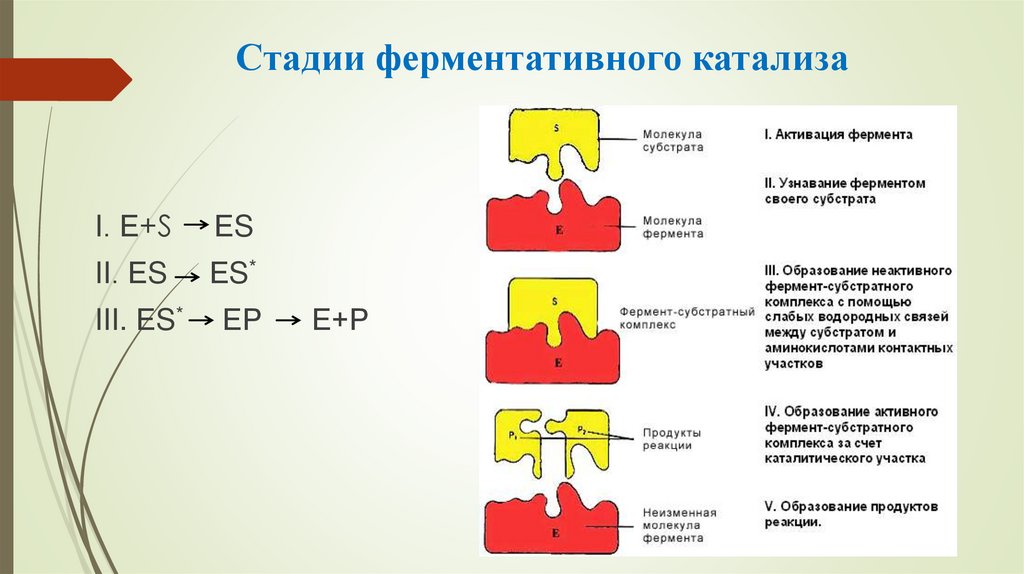
17. Стадии ферментативного катализа
I. Е+SЕS
II. ЕS
ЕS*
III. ЕS*
ЕР
Е+Р
18. Сходство между ферментами и небиологическими катализаторами 1. Любой катализатор (неорганический и органический) уменьшает
энергию активации молекулы. Энергия активации –количество энергии в калориях, необходимая для перевода всех
молекул 1-го моля вещества в активированное состояние, т.е.
состояние, при котором они способны вступить в химическую
реакцию.
2. Любой катализатор может ускорять только химические
реакции, возможные с точки зрения термодинамики.
3. Катализаторы не изменяют направление химической
реакции.
4. Катализаторы не расходуются в процессе реакции.
19. Отличия ферментов от неорганических катализаторов 1. Катализ осуществляется в очень мягких условиях (Т, рН) 2. Высокая
эффективность: ферменты увеличивают скорость реакциив 1010 - 1012 раз.
Пример: в организме есть фермент каталаза (кофактор - Fe).
1 мг железа в каталазе действует как 10 т неорганического железа.
3. Специфичность действия. Каждый фермент ускоряет только 1 реакцию. Виды
специфичности:
- абсолютная (1 фермент действует только на 1 субстрат, например, фермент уреаза
катализирует гидролиз мочевины);
- относительная (1 фермент может действовать на группу сходных по строению
субстратов).
4. Возможность тонкой и точной регуляции скорости реакции изменением
условий среды (связано с белковой природой фермента)
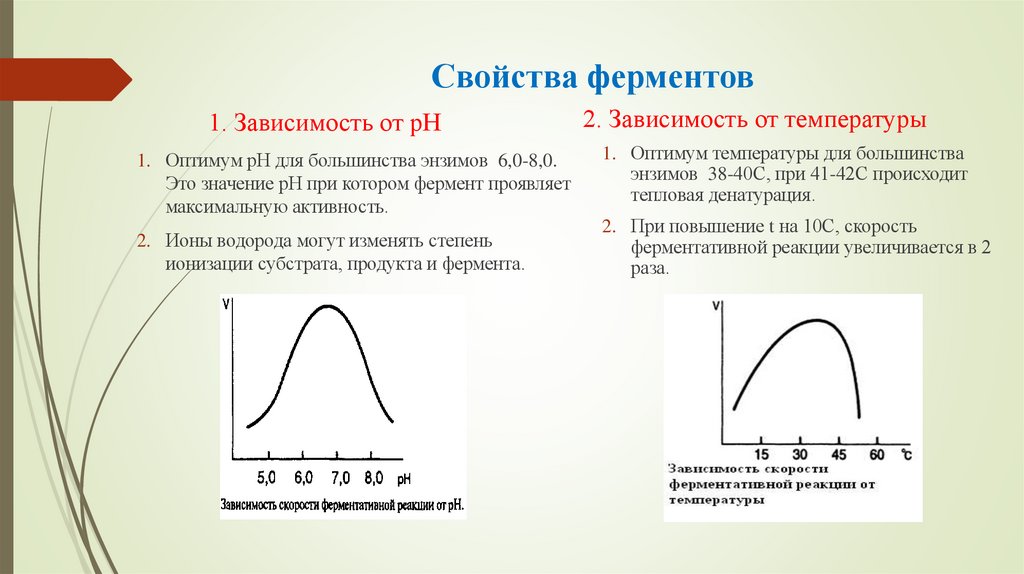
20. Свойства ферментов
1. Зависимость от рН1. Оптимум рН для большинства энзимов 6,0-8,0.
Это значение рН при котором фермент проявляет
максимальную активность.
2. Ионы водорода могут изменять степень
ионизации субстрата, продукта и фермента.
2. Зависимость от температуры
1. Оптимум температуры для большинства
энзимов 38-40С, при 41-42С происходит
тепловая денатурация.
2. При повышение t на 10С, скорость
ферментативной реакции увеличивается в 2
раза.
21.
4. Способностью к регуляцииВлияние на активность ферментов
3. Высокая
активаторов и ингибиторов. К числу
факторов, повышающих активность ферментов,
специфичность действия
относятся катионы металлов и некоторые
Специфичность действия
анионы. Чаще всего активаторами ферментов
определяется структурой
являются катионы Mg2+, Mn2+, Zn2+, K+ и Со2+, а
активного центра фермента
из анионов - Сl-. Катионы действуют на
ферменты по-разному. В одних случаях они
и заключается в том, что
облегчают образование фермент-субстратного
каждый фермент
комплекса, в других - способствуют
катализирует превращение
присоединению кофермента к апоферменту,
одного субстрата или группы
либо присоединяются к аллостерическому
субстратов, сходных по
центру фермента и изменяют его третичную
структуру, в результате чего субстратный и
своей структуре.
каталитический центры приобретают наиболее
выгодную для осуществления катализа
конфигурацию.
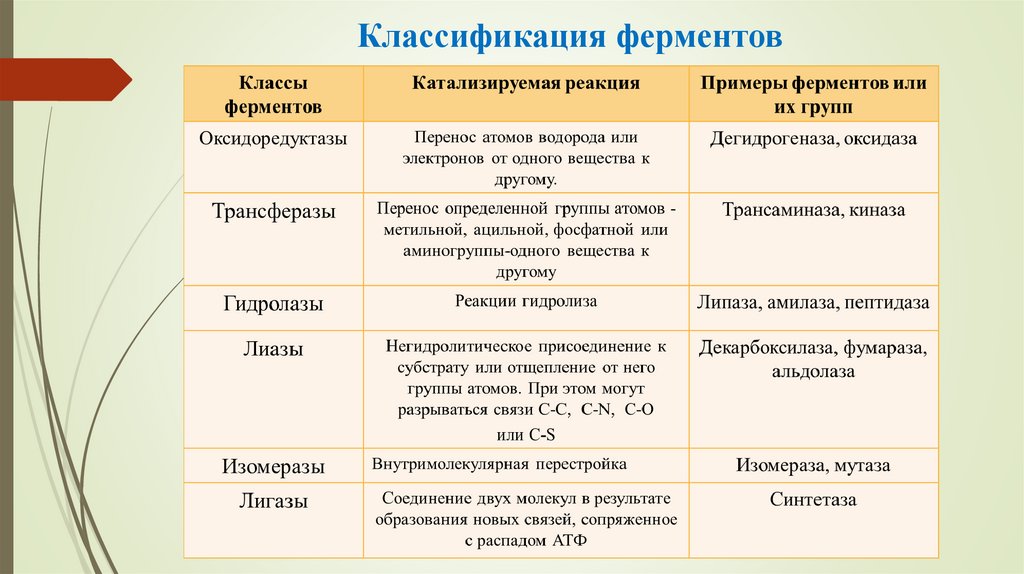
22. Классификация ферментов
В 1961 году предложена комиссией международногобиохимического союза систематическая номенклатура
ферментов. Ферменты подразделили на 6 групп в
соответствии с типом реакции, которую они катализируют.
Рабочее название складывалось из названия субстрата,
типа каталитической реакции и окончания –аза.
Пример: лактан+дегидрогенизация+аза=лактатдегидрогеназа
Известным ферментам оставлены прежние названия пепсин,
трипсин.
23. Классификация ферментов
24. КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Согласно современной классификации все ферменты делятся наклассы, классы - на подклассы, а подклассы – на подподклассы
К л а с с указывает на тип катализируемой реакции. В подклассе
и подподклассе более детально характеризуется действие фермента,
указывается природа химической группы субстрата, изменяющейся
под его действием, конкретизируется тип преобразуемой связи или
уточняется химическая природа доноров и акцепторов, участвующих
в данной реакции. Все ферменты подразделяются на 6 классов
25.
Оксидоредуктазы - катализируют окислительно-восстановительные реакции.Окисляющийся субстрат рассматривается как донор водорода, в связи с чем
большинство ферментов этого класса называют дегидрогеназами. К оксидоредуктазам
относятся такие ферменты, как анаэробные дегидрогеназы, переносящие протоны и
электроны на промежуточный субстрат; аэробные дегидрогеназы (оксидазы),
катализирующие перенос водорода непосредственно на кислород; цитохромы,
осуществляющие транспорт электронов; каталаза и пероксидаза, катализирующие
реакции с участием Н2О2. Этот класс включает 480 ферментов, разделенных на 17
подклассов, в которых указывается тип связи в молекуле донора, подвергающейся
окислению .
Трансферазы - осуществляют перенос атомов или групп атомов между отдельными
субстратами (от донора к акцептору). В зависимости от характера переносимой группы
они делятся на 8 подклассов: аминотрансферазы, трансферазы, переносящие
одноуглеродные группы (метильные, карбоксильные, формильные), фосфотрансферазы,
ацилтрансферазы, гликозилтрансферазы и т.д. В подкласс фосфотрансфераз входят
киназы - ферменты, использующие АТФ в качестве донора фосфатного остатка.
26.
Гидролазы - ферменты, расщепляющие внутримолекулярные связи в субстратес участием молекул воды. В зависимости от характера расщепляемой связи этот
класс, объединяющий свыше 460 ферментов, делится на 11 подклассов: эстеразы,
гликозидазы, пептидазы, амидазы и т.д.
Лиазы - ферменты, катализирующие: - разрыв связей между атомами С - О, С N, С - С и др., а также обратимые реакции отщепления различных групп от
субстрата негидролитическим путём; - учитывая обратимость ферментативных
реакций, присоединение различных групп по месту разрыва образовавшихся при
этом двойных связей. К лиазам относятся такие ферменты, как альдолаза,
декарбоксилазы, гидратазы, дегидратазы и т.д.
Изомеразы - ферменты, осуществляющие различные типы реакции
изомеризации. Класс включает около 80 ферментов, подразделяемых на 4 подкласса
в зависимости от типа реакции изомеризации – рацемазы и эпимеразы, цис-трансизомеразы и т.д. Ферменты, катализирующие внутримолекулярный перенос атомов,
называются мутазами.
Лигазы (синтетазы) - ферменты, участвующие в синтезе различных соединений
с использованием энергии АТФ. Делятся на 4 подкласса в зависимости от характера
новообразуемой связи (например, глутаминсинтетаза катализирует синтез
глутамина из глутаминовой кислоты и аммиака в присутствии АТФ
27. Шифры ферментов
На основании принятой классификации составлен список, включающий свыше 2000известных в настоящее время ферментов. Для каждого из них разработан шифр (КФ) в
виде четырехзначного кода:
I цифра - обозначает номер класса, к которому относится фермент.
II цифра - номер подкласса.
III цифра - номер подподкласса.
IУ цифра - порядковый номер фермента в данном подподклассе (в алфавитном порядке).
Так, указанный выше фермент - лактатдегидрогеназа, участвующий в обратимой реакции
окисления лактата в пируват и содержащий НАД в качестве кофермента, имеет шифр КФ
I. I. I. 27.
Этот шифр обозначает, что лактатдегидрогеназа относится к I классу (оксидоредуктаз), I
подклассу (ферменты, окисляющие связь СН-ОН в субстрате), I подподклассу (ферменты,
акцептором водорода у которых является НАД) и занимает 27 место в этом подподклассе.
28. Номенклатура ферментов
Для обозначения ферментов используются рабочие и систематические названия.В основе р а б о ч и х названий лежат несколько принципов:
1.
Название фермента чаще всего складывается из названия субстрата с добавлением
окончания - аза. Например, фермент, расщепляющий крахмал (amylum), называется
амилазой; фермент, участвующий в распаде РНК - рибонуклеазой.
2.
Многие ферменты обозначаются по названию субстрата и характеру катализируемой
реакции. Например, фермент, окисляющий молочную кислоту, называется
лактатдегидрогеназой; фермент, синтезирующий глутамин, – глутаминсинтетазой.
3.
Некоторые ферменты имеют исторически сложившиеся случайные названия
(например, термин « пепсин » происходит от слова pepsis - пищеварение, « трипсин » от слова tripsis - разжижжаю).
29.
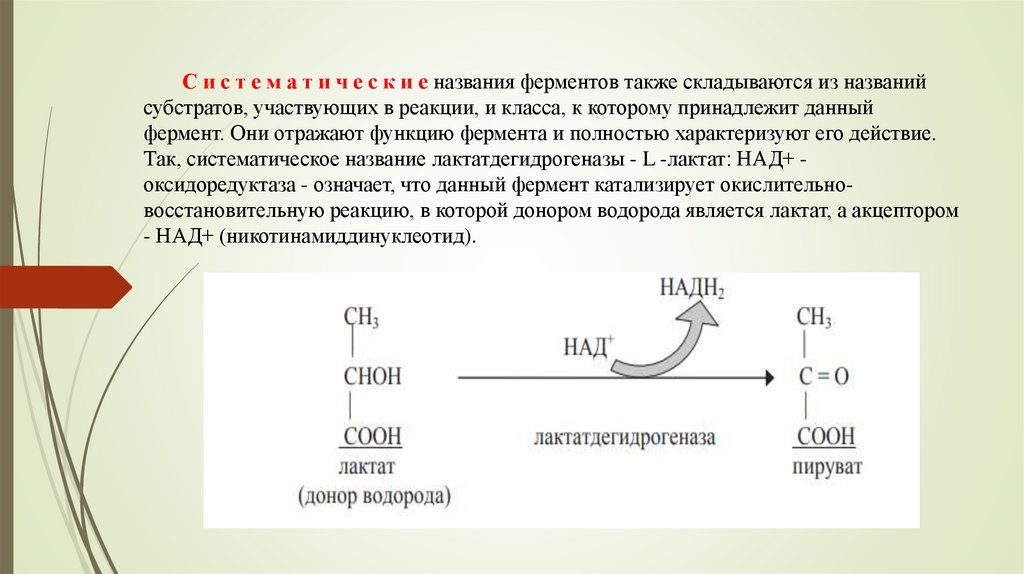
С и с т е м а т и ч е с к и е названия ферментов также складываются из названийсубстратов, участвующих в реакции, и класса, к которому принадлежит данный
фермент. Они отражают функцию фермента и полностью характеризуют его действие.
Так, систематическое название лактатдегидрогеназы - L -лактат: НАД+ оксидоредуктаза - означает, что данный фермент катализирует окислительновосстановительную реакцию, в которой донором водорода является лактат, а акцептором
- НАД+ (никотинамиддинуклеотид).
















 biology
biology








