Similar presentations:
Ферменты: структура, классификация, механизм действия и регуляция
1. Лекция №4
2. Тема 2 Ферменты: структура, классификация, механизм действия и регуляция
3. Классификация ферментов
Оксидоредуктазы (окислительновосстановительные реакции);Трансферазы (перенос функциональных
групп);
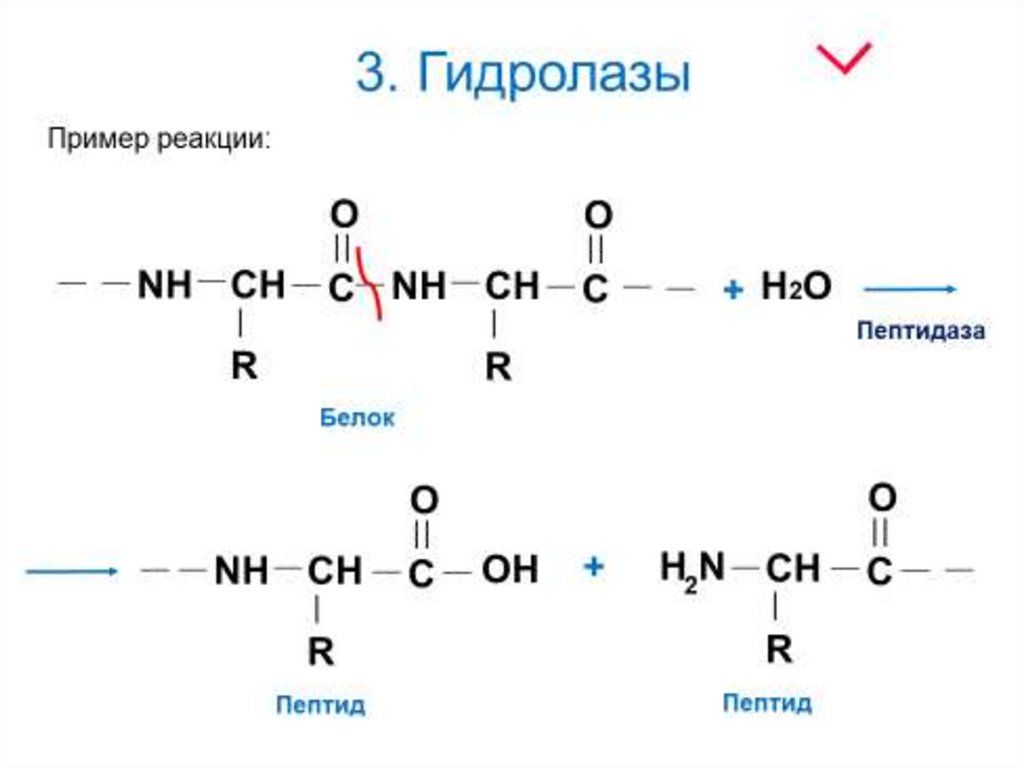
Гидролазы (реакции расщепления с участием
воды);
Лиазы (разрыв связей без участия воды);
Изомеразы (изомерные превращения);
Лигазы (синтез с затратой молекул АТФ).
4.
5.
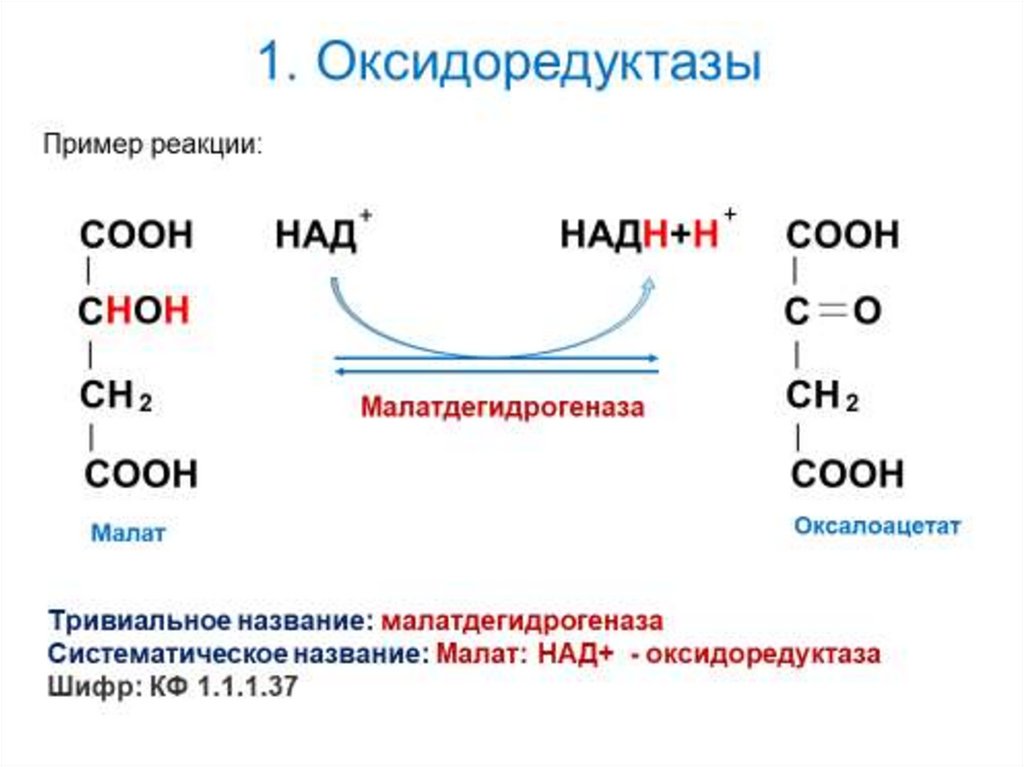
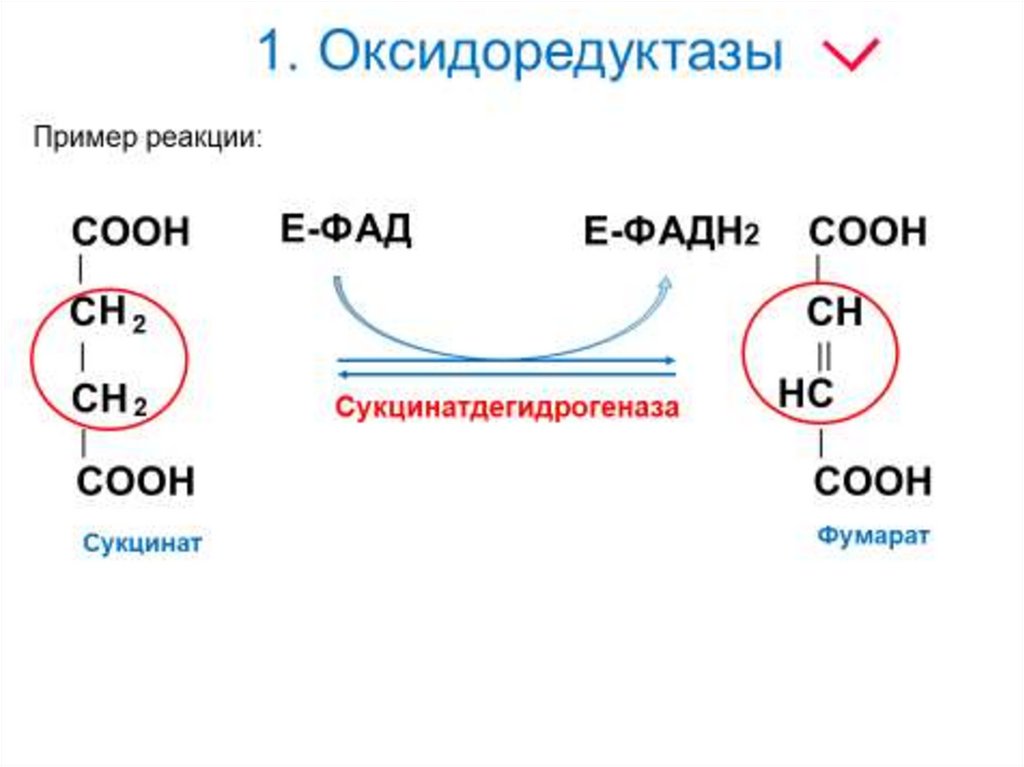
6. 1. Оксидоредуктазы
1) Тривиальное название:название основного субстрата+ тип катализируемой реакции + «аза»
Малат + дегидрирование + аза = малатдегидрогеназа
2) Систематическое название:
названия субстратов + класс химических реакций + «аза»
Малат : НАД – оксидоредуктаза
7. 1. Оксидоредуктазы
1) Тривиальное название:название основного субстрата+ тип катализируемой реакции + «аза»
Малат + дегидрирование + аза = малатдегидрогеназа
2) Систематическое название:
названия субстратов + класс химических реакций + «аза»
Малат : НАД – оксидоредуктаза
Классификационный номер: КФ1.1.1.37.
Класс: 1. Оксидоредуктазы
Подкласс: 1.1. Действующие на СН-ОН группу донора
Подподкласс: 1.1.1. НАД+ или НАДФ+
- в качестве акцептора гидрид-иона.
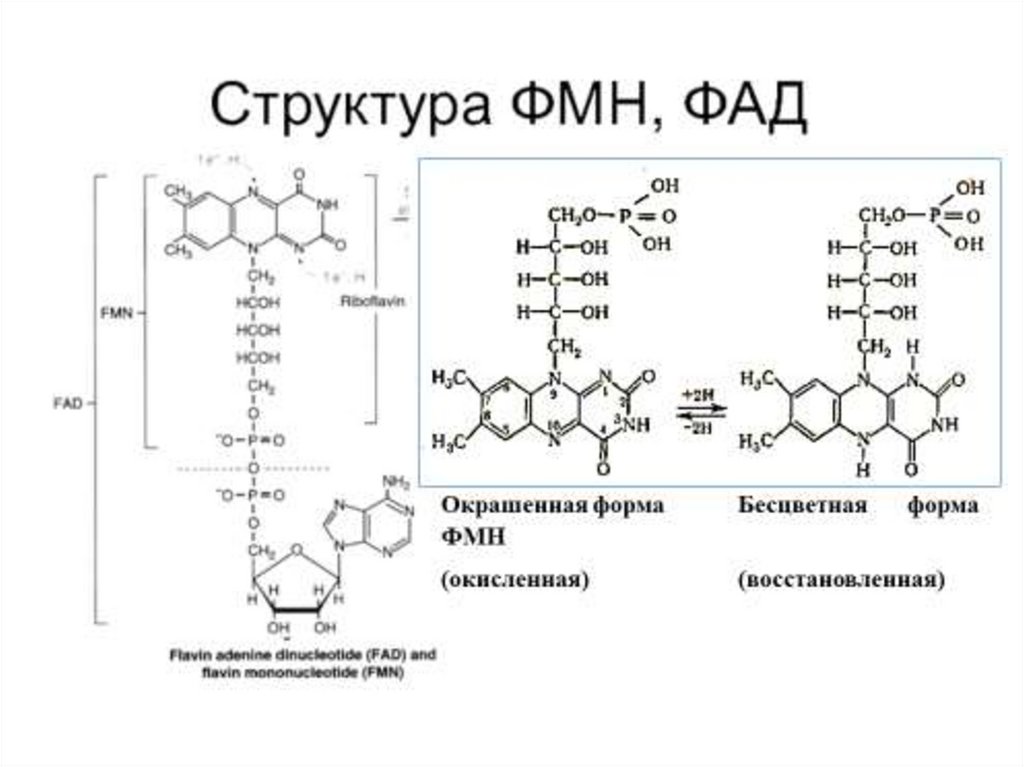
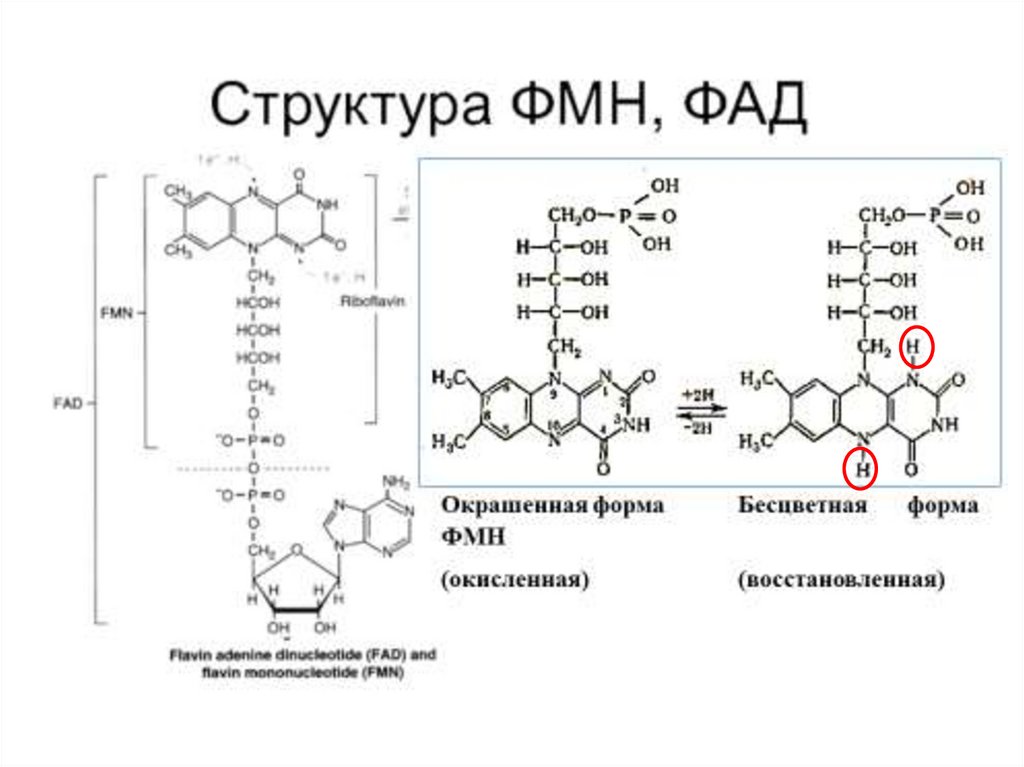
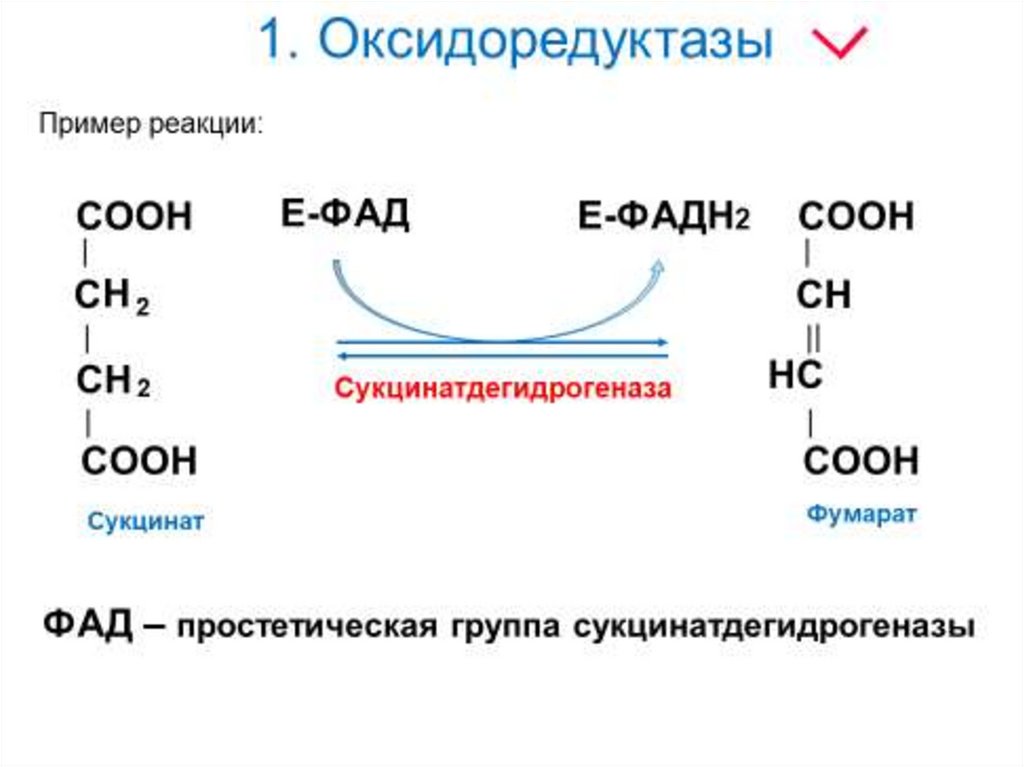
8. 1. Оксидоредуктазы
Коферменты ФАД(флавинадениндинуклеотид) и
ФМН (флавинмононуклеотид)
содержат в своём составе витамин
В2 (рибофлавин) и принимают
участие в окислительновосстановительных реакциях.
Восстановленные формы этого
кофермента - ФАДН2 и ФМНН2
соответственно.
9.
10.
11.
12.
13.
14.
15.
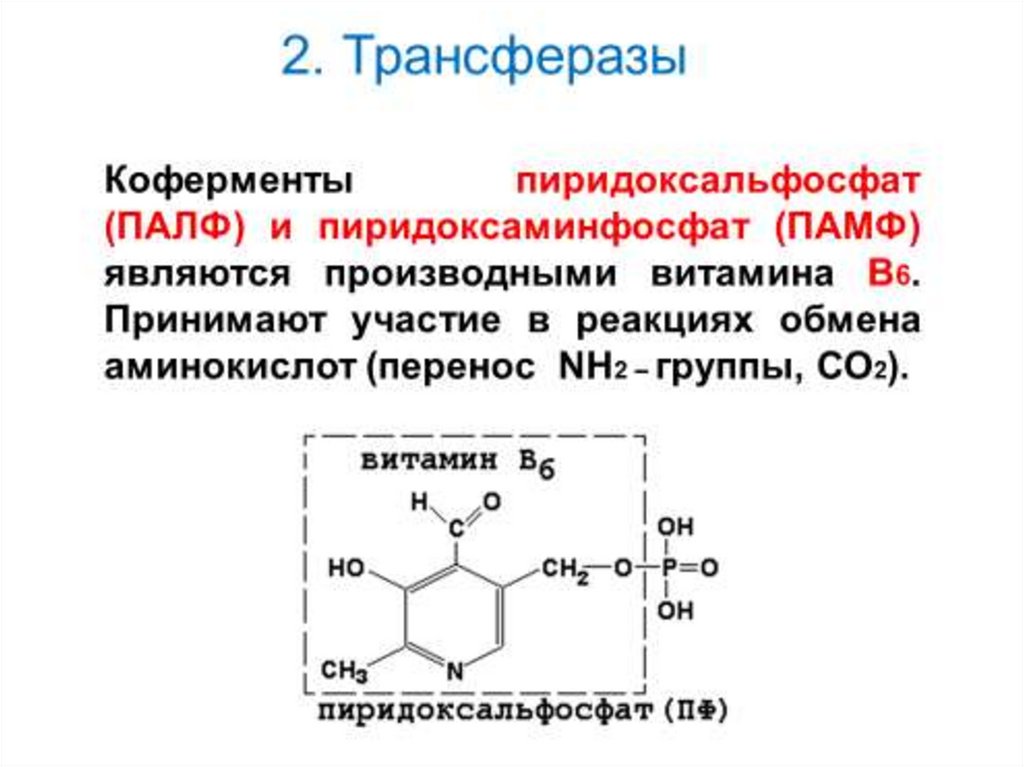
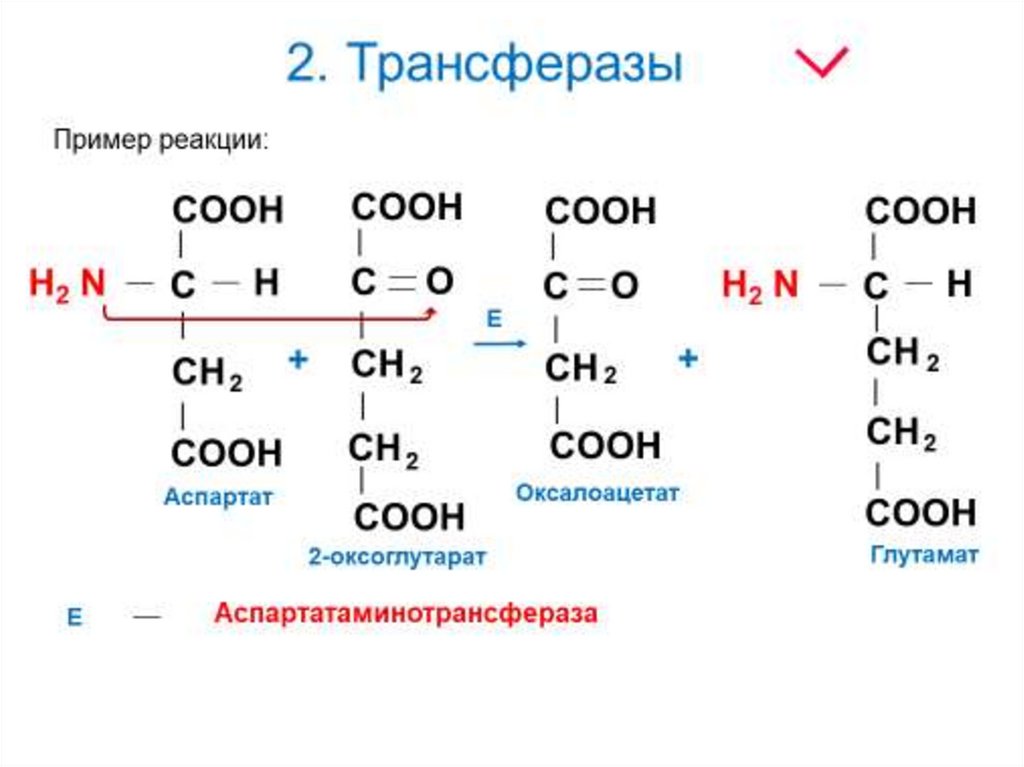
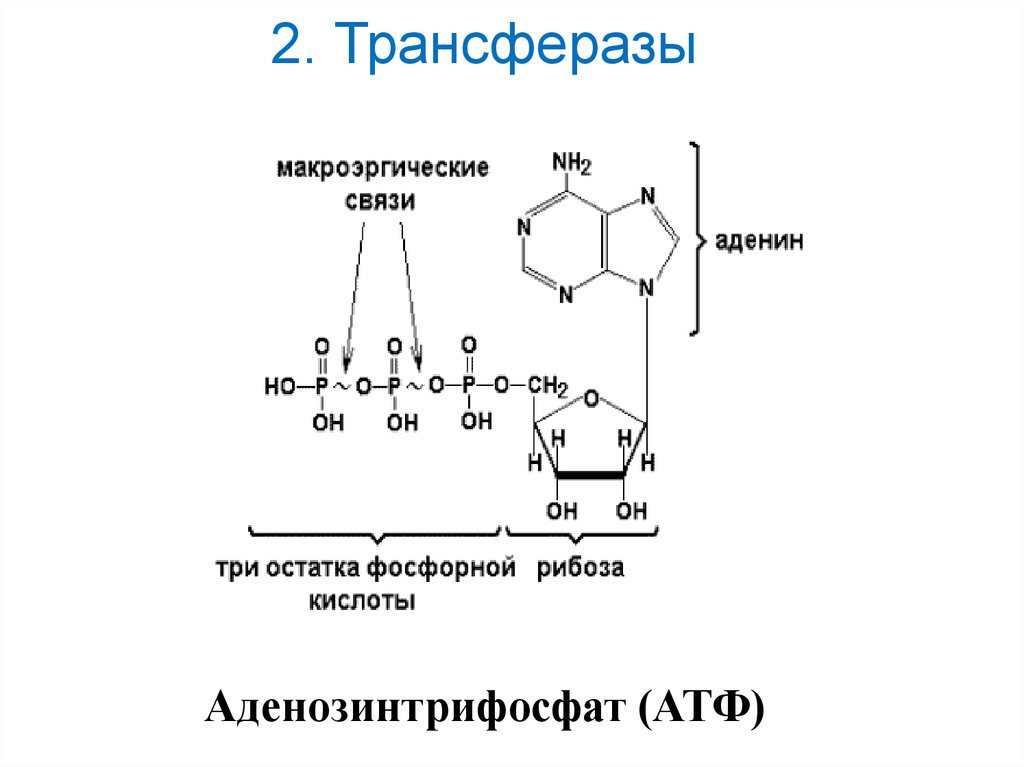
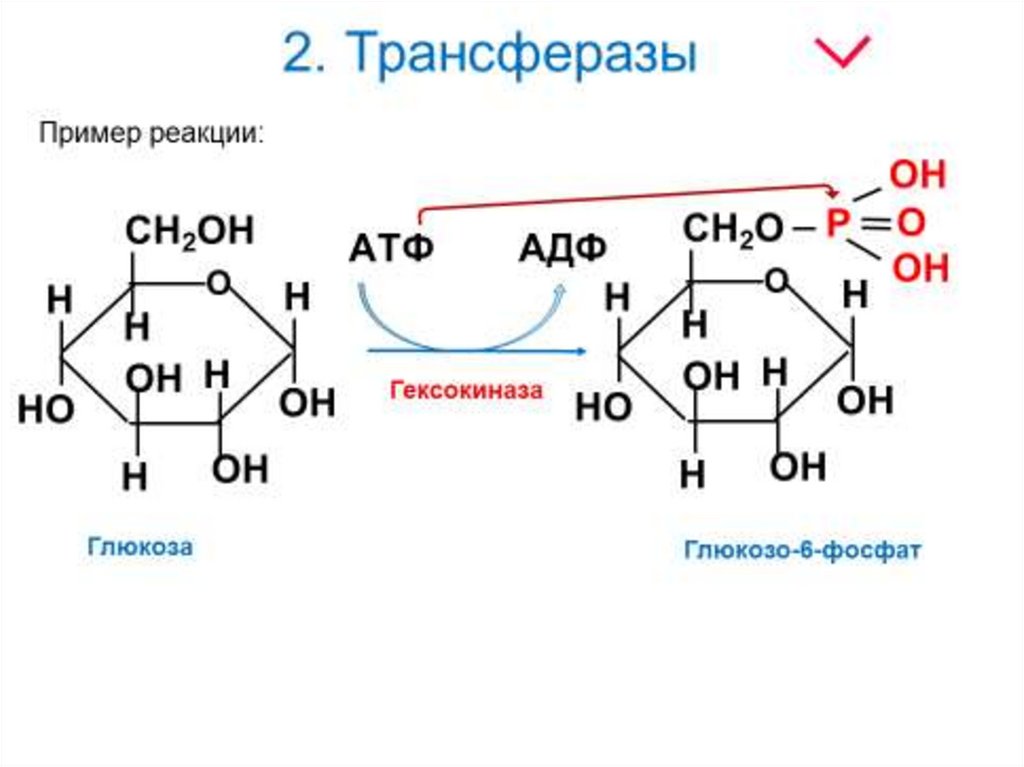
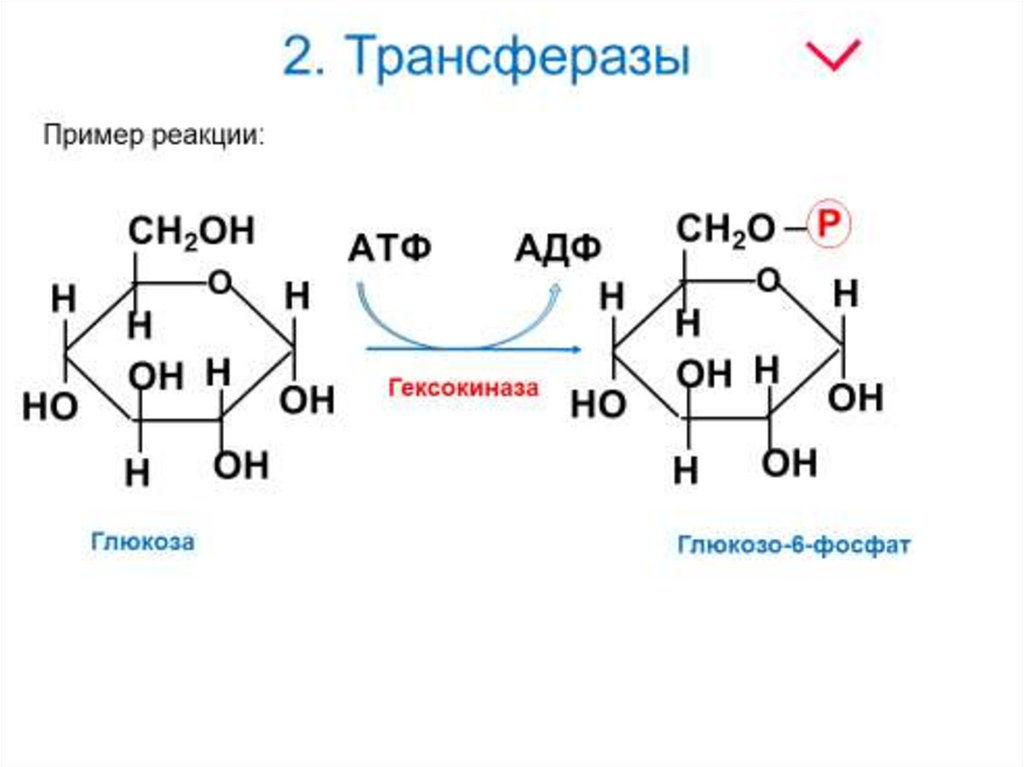
2. Трансферазы16.
17. 2. Трансферазы
Аденозинтрифосфат (АТФ)18.
19.
20.
21.
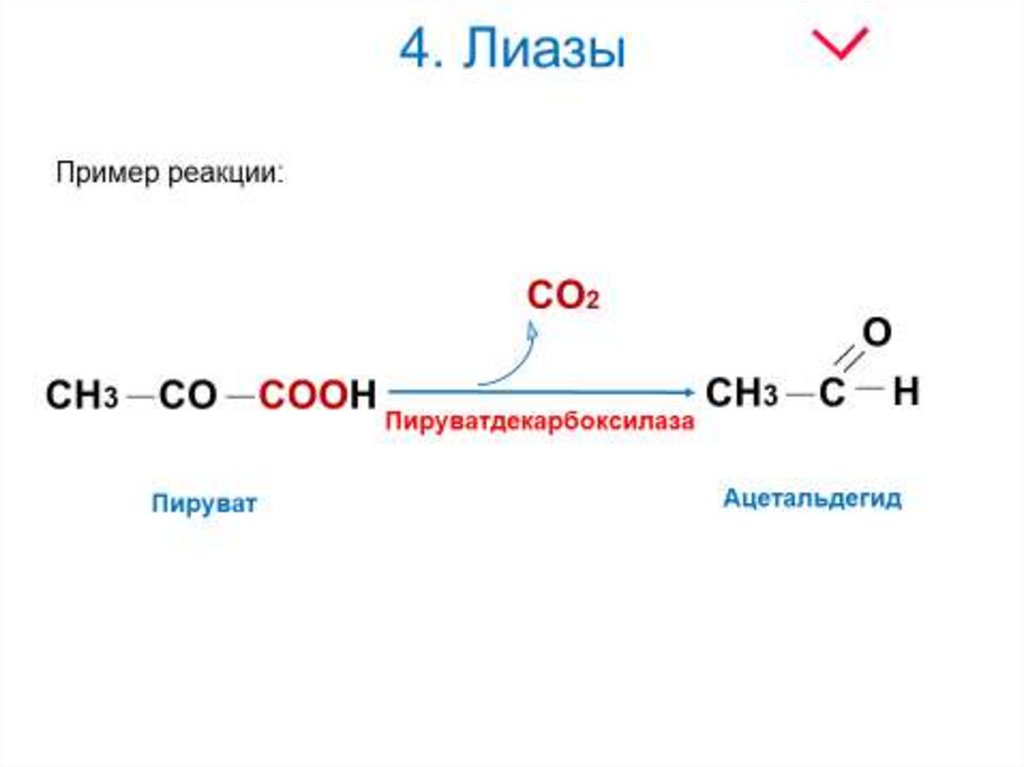
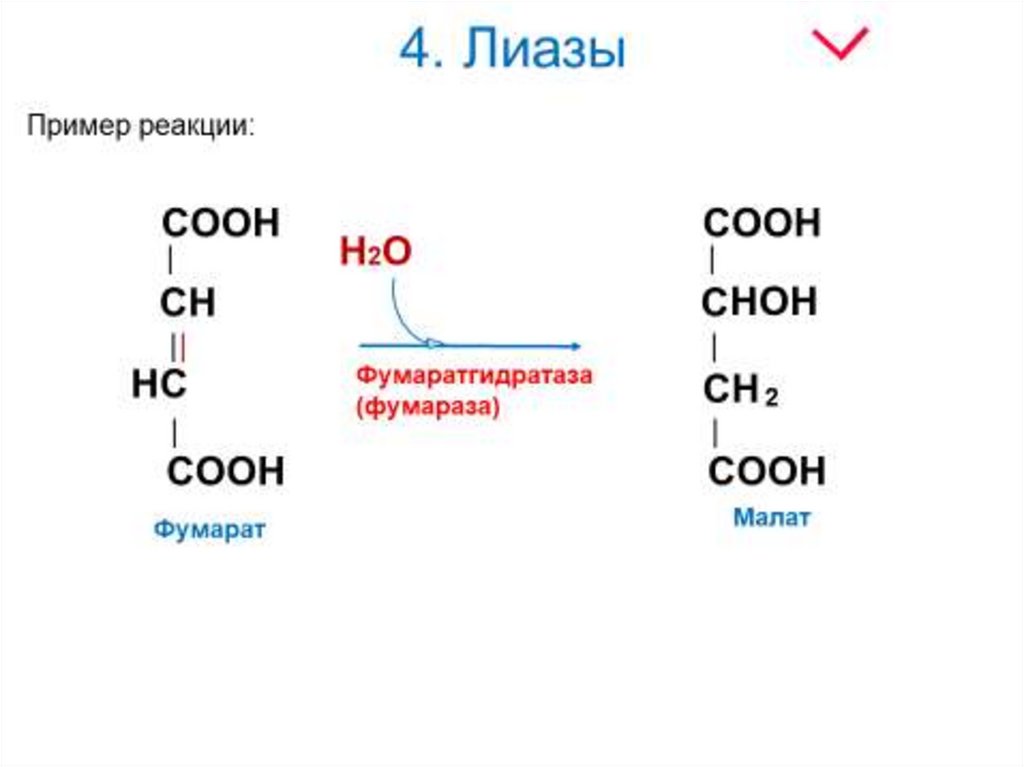
22. 4. Лиазы
Лиазы - ферменты, ускоряющие негидролитическиереакции распада органических соединений по связям С—С;
С—N; С—О и т. д. При этом замыкаются двойные связи и
выделяются такие простейшие продукты, как СО2, Н2О,
NH3 и т. п. Некоторые из этих реакций обратимы, и
соответствующие ферменты в подходящих условиях
катализируют реакции не только распада, но и синтеза.
где А—В - субстрат, А и В - продукты реакции.
23.
24.
25.
26. 5. Изомеразы
Изомеразы - класс ферментов, ускоряющихпроцессы внутримолекулярных
превращений с образованием изомеров.
где А и А' - вещества-изомеры.
Подразделяется на подклассы в зависимости от
типа катализируемой реакции изомеризации.
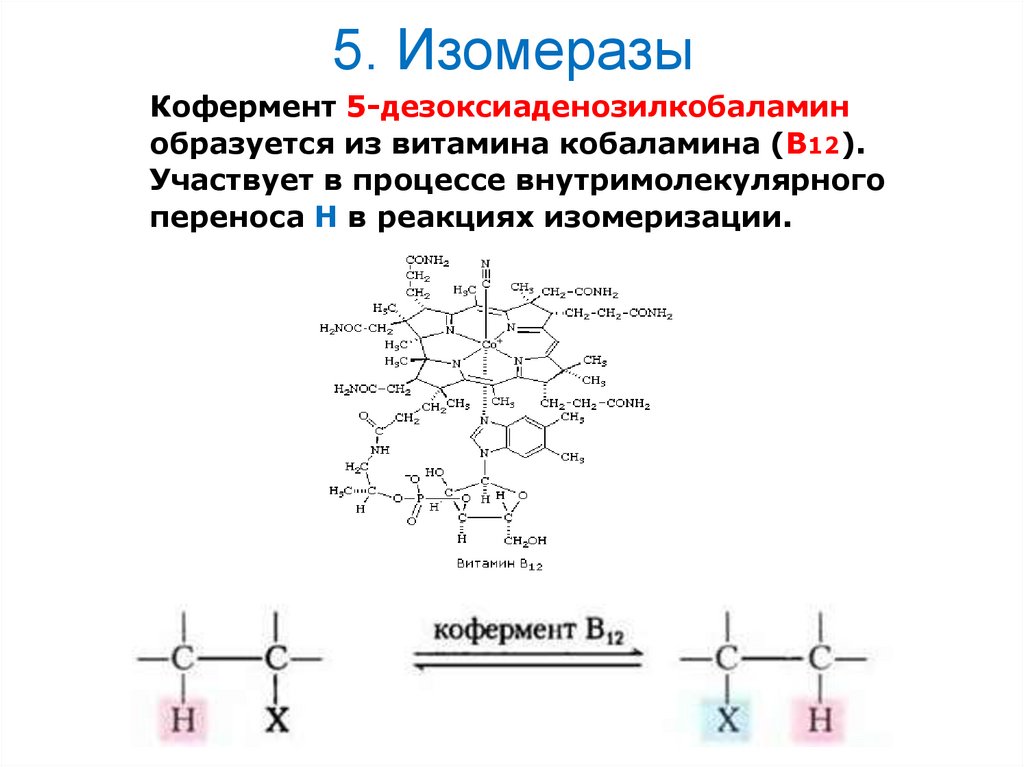
27. 5. Изомеразы
Кофермент 5-дезоксиаденозилкобаламинобразуется из витамина кобаламина (В12).
Участвует в процессе внутримолекулярного
переноса Н в реакциях изомеризации.
28. 5. Изомеразы
Пример реакции:29. 6. Лигазы
Лигазы - класс ферментов, катализирующихсинтез органических соединений из
активированных за счет распада АТФ (или ГТФ)
исходных веществ. Для ферментов этого класса
сохраняется также тривиальное название синтетазы.
(Фн)
где А и В - взаимодействующие вещества; А—В вещество, образующееся в результате взаимодействия.
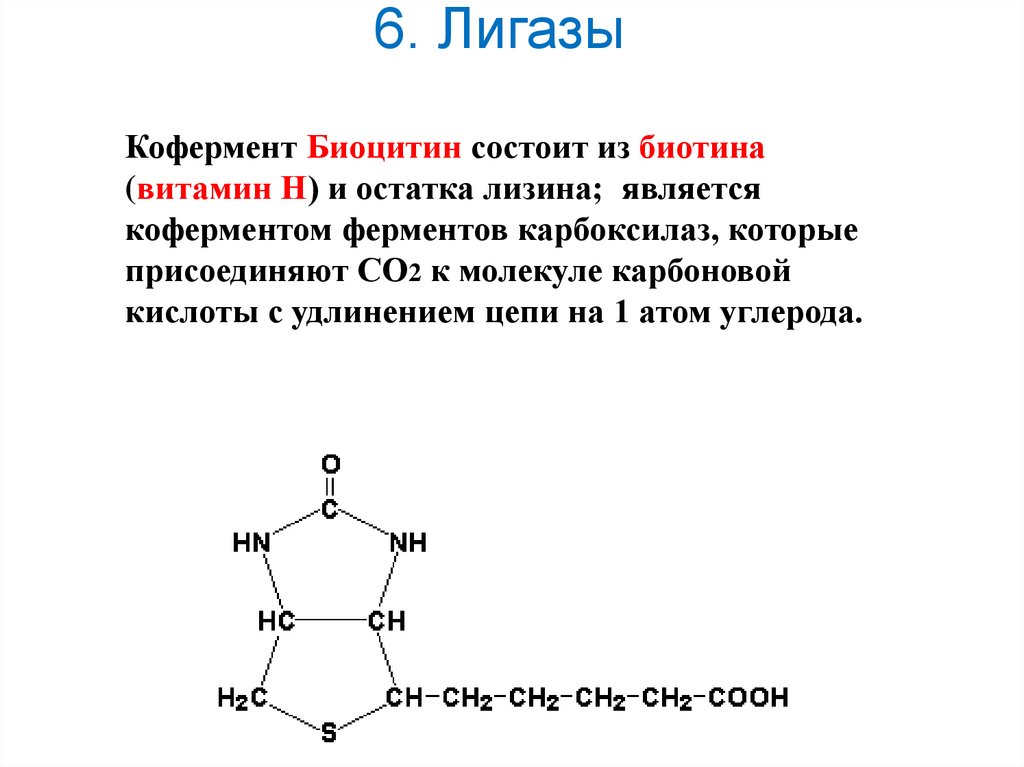
30. 6. Лигазы
Кофермент Биоцитин состоит из биотина(витамин Н) и остатка лизина; является
коферментом ферментов карбоксилаз, которые
присоединяют СО2 к молекуле карбоновой
кислоты с удлинением цепи на 1 атом углерода.
31.
32.
33.
34. Мультиферменты
Примером мультэнзима может служитьпируватдегидрогеназный комплекс, находящийся в
митохондриях и катализирует последовательные реакции
окислительного декарбоксилирования пирувата.
35.
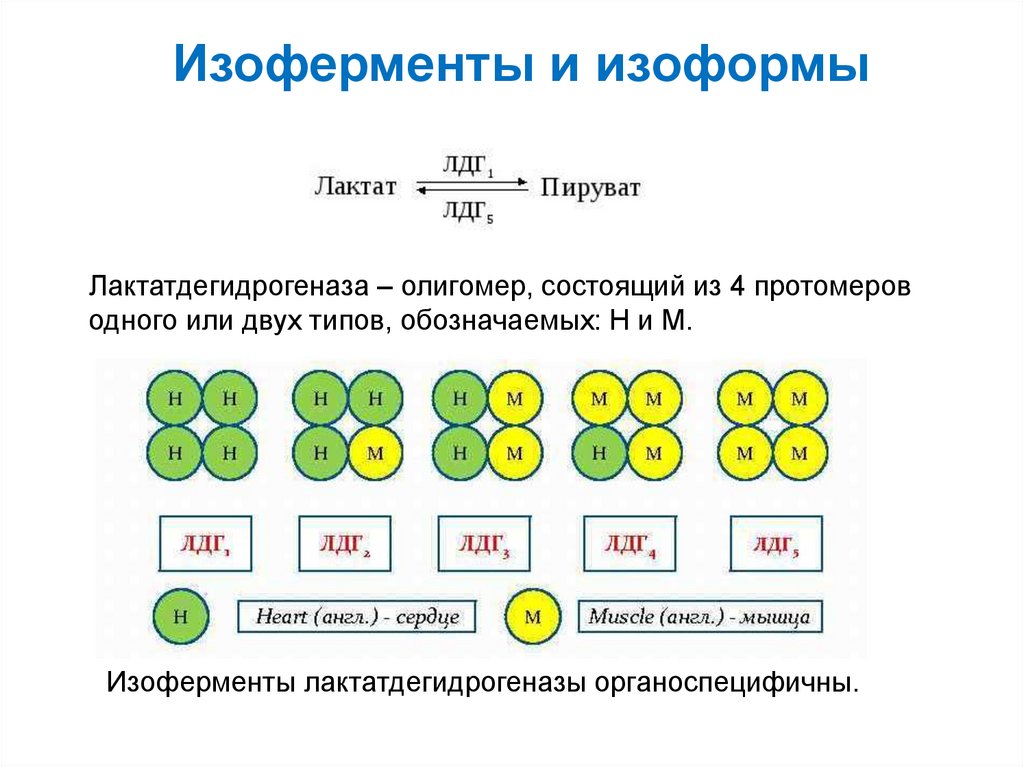
36. Изоферменты и изоформы
Лактатдегидрогеназа – олигомер, состоящий из 4 протомероводного или двух типов, обозначаемых: Н и М.
Изоферменты лактатдегидрогеназы органоспецифичны.
37.
Механизм действия ферментов38.
Изменение свободной энергии системы при протеканиихимической реакции в присутствии и отсутствии катализатора
39. Факторы, влияющие на эффективность ферментативного катализа
1. Эффект сближения и эффект ориентации.2. Индуцированное соответствие обеспечивает
эффективный ферментативный процесс.
При взаимодействии фермента и субстрата оба
подвергаются модификации и подстраиваются
друг под
друга путем ослабления специфических связей.
40. Факторы, влияющие на эффективность ферментативного катализа
3. Кислотно-основный катализ –в активном центре фермента находятся
группы специфичных аминокислотных
остатков, которые являются хорошими
донорами или акцепторами протонов.
4. Ковалентный катализ –
определенные группы активного центра могут
образовывать ковалентные связи с
субстратом, приводя к образованию более
реакционноспособных по сравнению с
субстратом структур.
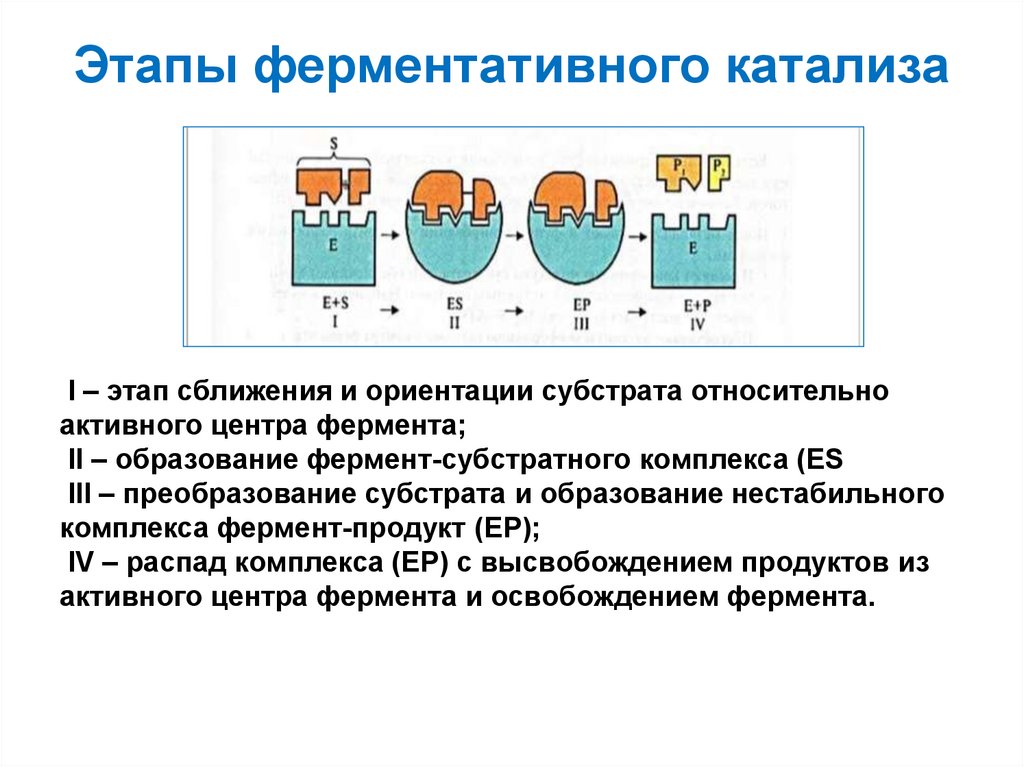
41. Этапы ферментативного катализа
I – этап сближения и ориентации субстрата относительноактивного центра фермента;
II – образование фермент-субстратного комплекса (ES
III – преобразование субстрата и образование нестабильного
комплекса фермент-продукт (ЕР);
IV – распад комплекса (ЕР) с высвобождением продуктов из
активного центра фермента и освобождением фермента.
42. Кинетика и регуляция действия ферментов
43. Кинетика и регуляция действия ферментов
44. Единицы активности фермента:
Согласно международному соглашению, за единицуактивности фермента принимается такое количество
фермента, которое катализирует превращение 1 мкмоля
субстрата (1 мкмоль= 10 6 моля) в 1 мин в оптимальных
условиях действия фермента. Должна быть указана
температура, при которой проводится реакция.
Международная единица (МЕ, Е, U):
1 Е = мкмоль/мин (мкмоль * мин-1).
Активность фермента в системе СИ:
1 катал - это количество фермента, которое превращает 1
моль субстрата за 1 сек.
1 катал (кат.) = моль/с
Отношение международной единицы (Е) к каталу:
1 кат = 6 107 Е.
45. Единицы активности фермента:
Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка.Удельная активность - это мера чистоты ферментного
препарата: она возрастает в процессе очистки фермента и
становится максимальной и постоянной, когда фермент
находится в гомогенном состоянии.
Числом оборотов фермента называется число молекул
субстрата, претерпевающих превращение в единицу времени
в расчете на одну молекулу фермента в условиях, когда
концентрация фермента является единственным фактором,
лимитирующим скорость реакции.
46.
Зависимость скоростиферментативной реакции от
концентрации фермента, субстрата,
температуры, рН среды и
ингибиторов
47.
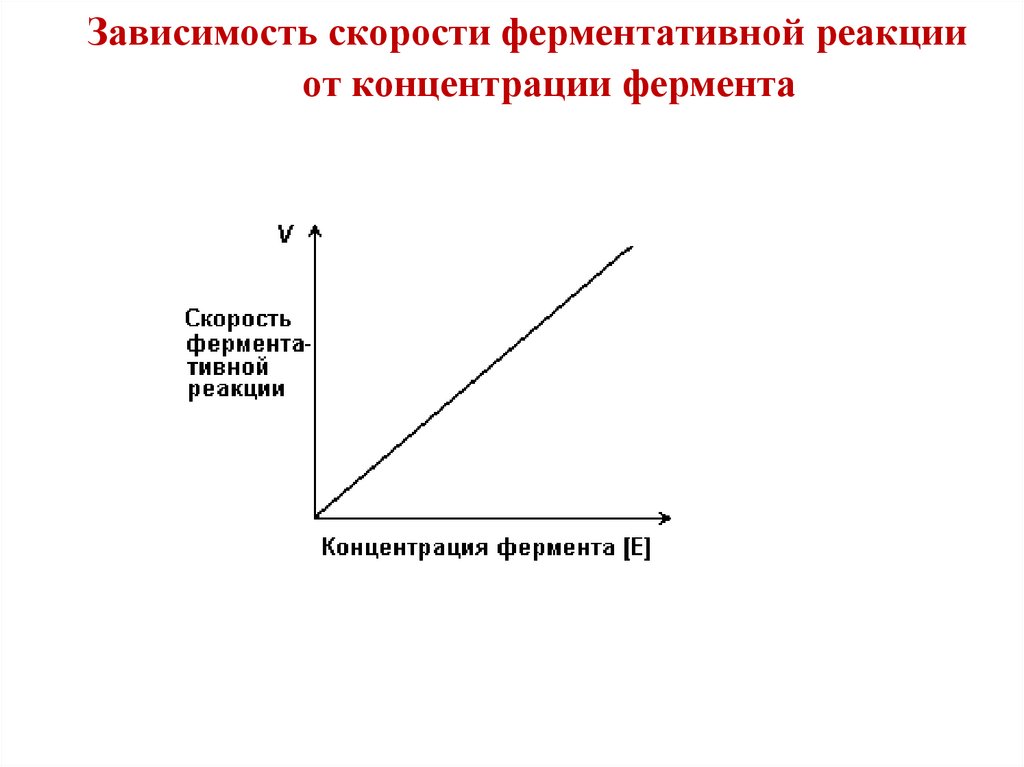
Зависимость скорости ферментативной реакцииот концентрации фермента
48.
49.
50.
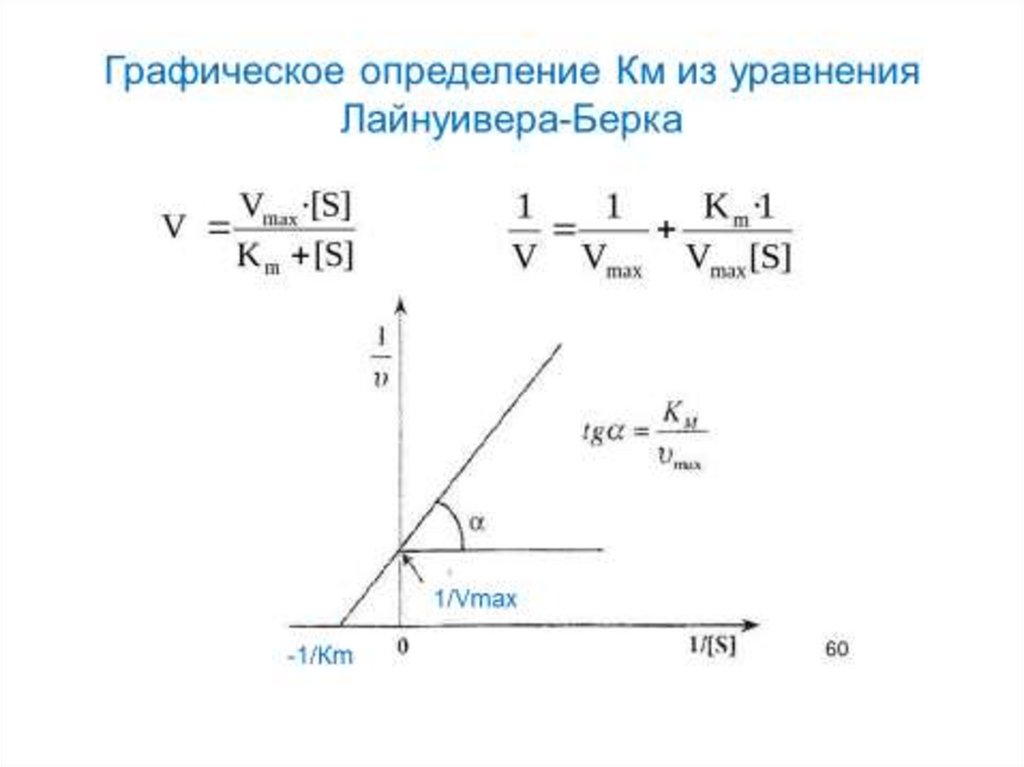
Зависимость скорости ферментативной реакцииот концентрации субстрата
51.
52.
53.
Определение KM и Vmax имеетважное е значение
Значение Км позволяет корректно оценить
активность фермента.
Кm – мера сродства к ферменту, мера прочности
связывания субстрата с активным центром. Чем
выше сродство, тем меньше величина Км.
Vmax – величина постоянная для каждого фермента,
которая позволяет оценить эффективность его
действия.
54.
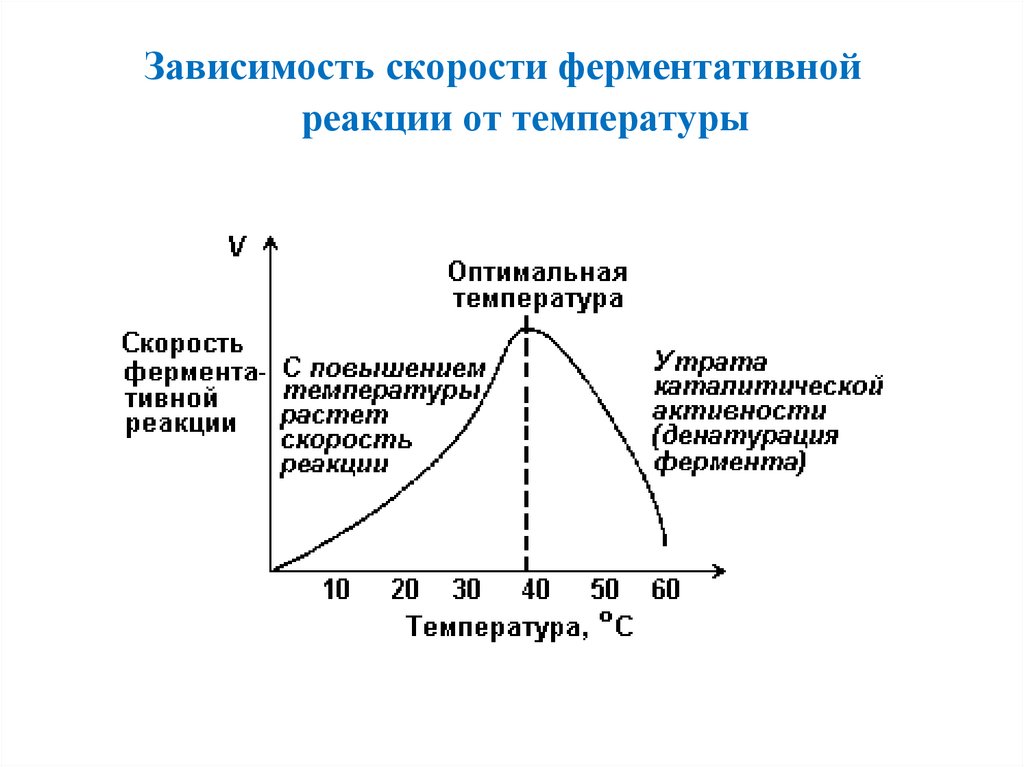
Зависимость скорости ферментативнойреакции от температуры
55.
Зависимость скорости ферментативнойреакции от рН среды
56.
Зависимость скорости ферментативнойреакции от рН среды
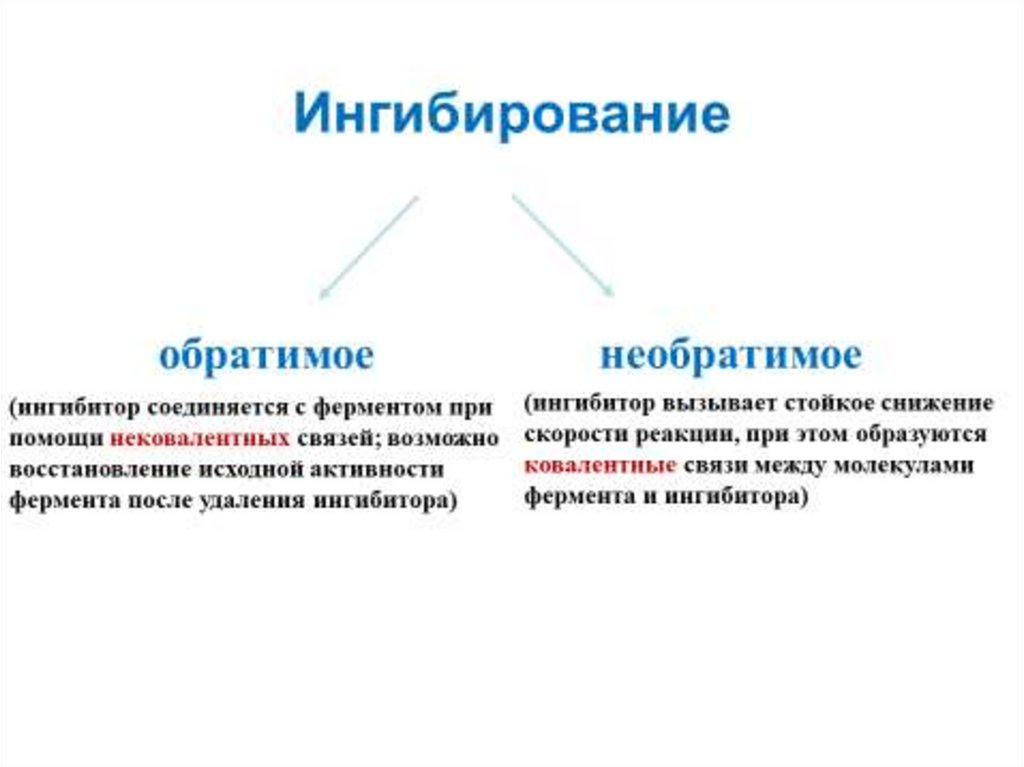
57. Зависимость скорости реакции от присутствия ингибиторов
Ингибирование - частичное или полноеторможение ферментативной реакции
под действием веществ различной
химической природы. Вещества,
вызывающие ингибирование
ферментов, называют ингибиторами.
58.
59.
Обратимое ингибированиеКонкурентное
Неконкурентное
Смешанное
Бесконкурентное






































 biology
biology








