Similar presentations:
Инфекционная безопасность пациента и медицинского персонала
1.
Государственное бюджетное образовательное учреждение высшего профессионального образования"Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого"
Министерства здравоохранения Российской Федерации Фармацевтический колледж
ИНФЕКЦИОННАЯ БЕЗОПАСНОСТЬ ПАЦИЕНТА И
МЕДИЦИНСКОГО ПЕРСОНАЛА
Выполнила:
Студентка отделения
"Сестринское дело"
Группы 308-2
Гуптор Анастасия Эдуардовна
Проверила:
Стародубец Ирина Ивановна
Красноярск 2017г.
2.
СОДЕРЖАНИЕ1. Внутрибольничные инфекции
2. Пути передачи инфекций
2.1. Эндогенная инфекция
2.2. Экзогенная инфекция
3. Асептика
4. Профилактика воздушно-капельной инфекции
5. Особенности работы операционного блока
6. Методы борьбы с инфекцией
7. Профилактика контактной инфекции
8. Методы стерилизации
9. Антисептика
10. Обработка рук медицинского персонала
11. Антисептики
12. Операционное поле
12.1 Подготовка и обработка
12.2. Этапы обработки на операционном столе
13. Профилактика имплантационной инфекции
14. Виды шовного материала
15. Методы контроля стерильности
3.
ВНУТРИБОЛЬНИЧНЫЕ ИНФЕКЦИИ— любые клинически выраженные заболевания микробного происхождения,
поражающие больного в результате его госпитализации или посещения лечебного
учреждения с целью лечения, а также больничный персонал в силу осуществления им
деятельности, независимо от того, проявляются или не проявляются симптомы этого
заболевания во время нахождения данных лиц в стационаре
4.
ПУТИ ИНФИЦИРОВАНИЯЭНДОГЕННЫЙ
ЭКЗОГЕННЫЙ
5.
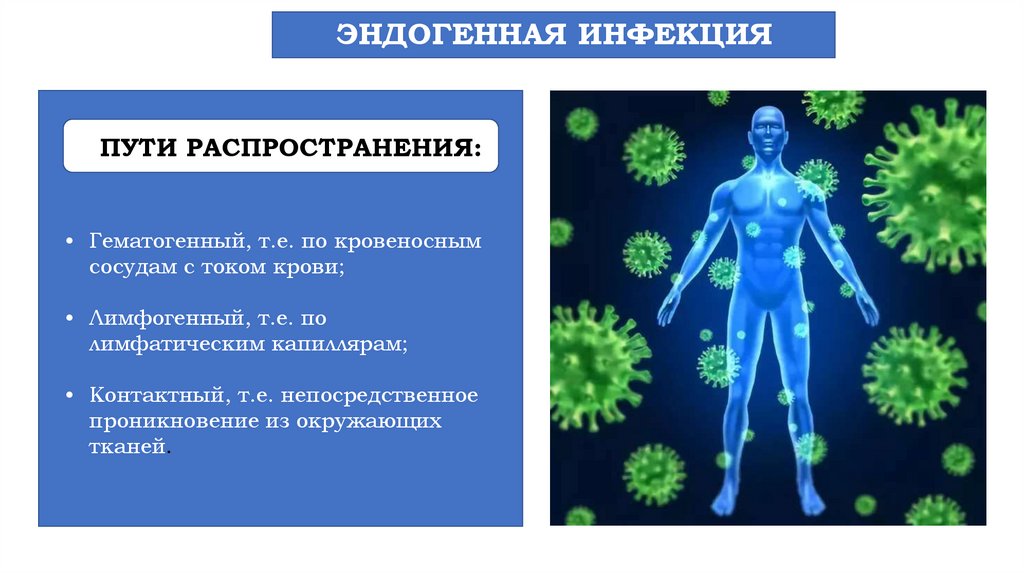
ЭНДОГЕННАЯ ИНФЕКЦИЯПУТИ РАСПРОСТРАНЕНИЯ:
• Гематогенный, т.е. по кровеносным
сосудам с током крови;
• Лимфогенный, т.е. по
лимфатическим капиллярам;
• Контактный, т.е. непосредственное
проникновение из окружающих
тканей.
6.
ЭКЗОГЕННАЯ ИНФЕКЦИЯПУТИ РАСПРОСТРАНЕНИЯ:
• Воздушно-капельный
• Воздушно-пылевой
• Контактный
• Имплантационный
7.
Для борьбы с экзогенной инфекциейиспользуются методы асептики, а эндогенную
инфекцию уничтожают методами
антисептики.
8.
АСЕПТИКА—
комплекс
мероприятий,
направленный
на
предупреждение проникновение микробов в рану,
организм в целом.
ЦЕЛЬ АСЕПТИКИ
– защита организма и особенно послеоперационной раны от
контакта с инфекцией.
9.
ДЛЯ ДОСТИЖЕНИЯ ЭТОЙ ЦЕЛИ ИСПОЛЬЗУЮТСЯ:Организационные
мероприятия
(сортировка
хирургических больных на «чистых» и «гнойных»;
отделка помещений, регулярный контроль качества
стерилизации медицинским персоналом и санитарноэпидемиологической службой; режим кварцевания и
влажной уборки подразделения хирургического
отделения);
Соблюдение
СЭР
во
всех
подразделениях
хирургического стационара;
• Физические факторы (высокая температура,
ионизирующее излучение, ультразвук, УФО и др.);
• Химические препараты
10.
ПРОФИЛАКТИКА ВОЗДУШНО-КАПЕЛЬНОЙ ИНФЕКЦИИ• Ежедневно проводится текущая уборка 2 раза в день с применением
дезинфицирующих средств с последующим кварцеванием.
• Генеральная уборка проводится 1 раз в 7 дней.
• Кварцевание проводится бактерицидными лампами ОБН – 200, ОБН
– 250 из расчета 1 ВТ на 1 м куб. в течение 2 часов.
11.
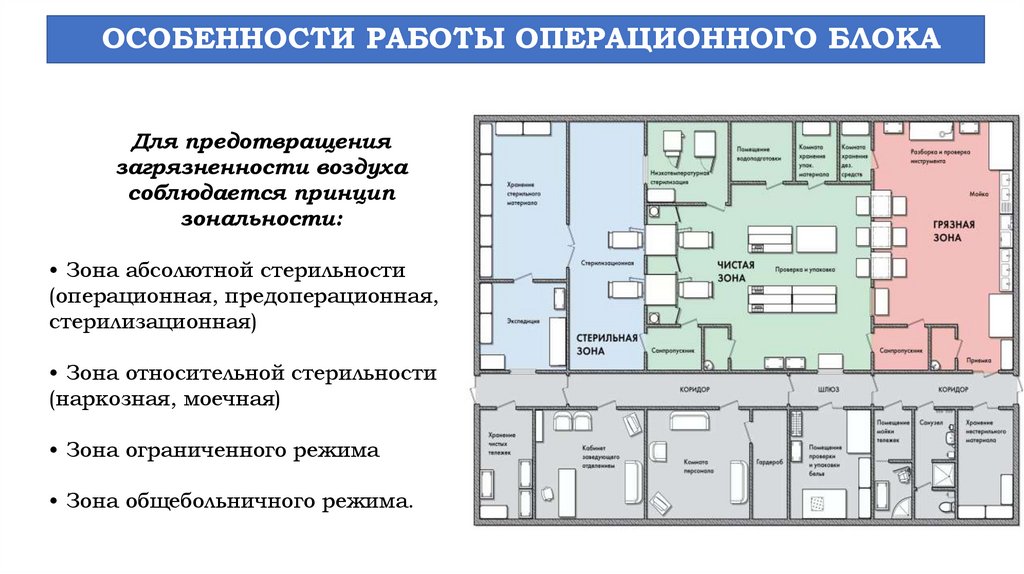
ОСОБЕННОСТИ РАБОТЫ ОПЕРАЦИОННОГО БЛОКАДля предотвращения
загрязненности воздуха
соблюдается принцип
зональности:
• Зона абсолютной стерильности
(операционная, предоперационная,
стерилизационная)
• Зона относительной стерильности
(наркозная, моечная)
• Зона ограниченного режима
• Зона общебольничного режима.
12.
В ОПЕРАЦИОННОЙ СУЩЕСТВУЕТ НЕСКОЛЬКО ВИДОВ УБОРОК:• Предварительная (протирание
поверхностей в начале рабочего
подготовка стерильного стола);
всех
дня
горизонтальных
дез.растворами,
• Текущая (удаление из операционной отработанного
перевязочного материала, инструментов, белья; протирание
столов; подготовка необходимого для следующей операции);
• Окончательная (после всех операций в конце рабочего дня
мытье полов и горизонтальных поверхностей, включение бак.
ламп).
• Генеральная (проводится 1 раз в неделю, обработка всех
поверхностей: пол, стены, потолок, лампы, аппараты).
13.
МЕТОДЫ БОРЬБЫ С ИНФЕКЦИЕЙНошение масок;
Использование бактерицидных ламп;
Вентиляция – приточно-вытяжная;
Личная гигиена мед.персонала.
14.
МЕДИЦИНСКИЙ ПЕРСОНАЛ ХИРУРГИЧЕСКОГО ОТДЕЛЕНИЯ ОБЯЗАНСоблюдать правила личной гигиены;
Ежедневно менять спецодежду;
Проходить полный медицинский осмотр по графику;
Своевременно проводить санацию полости рта и носоглотки;
Отстраняться от работы при наличии гнойничковых и
простудных заболеваниях;
Своевременно один раз в квартал проходить обследование на
носительство патогенного стафилококка в носоглотке.
15.
ПРОФИЛАКТИКА КОНТАКТНОЙ ИНФЕКЦИИГлавный принцип асептики:
«Все, что соприкасается с раной, должно быть стерильно».
Итак, что соприкасается с раной? Это:
• Хирургические инструменты;
• Перевязочный материал;
• Руки хирурга;
• Операционное поле.
16.
СТЕРИЛИЗАЦИЯ - ОСНОВА АСЕПТИКИ!Методы стерилизации
Физические – стерилизация паром под давлением, стерилизация
горячим воздухом (сухожаровой шкаф) и лучевая стерилизация ( y –
лучи, ультрафиолетовые лучи и ультразвук).
Химические – газовая стерилизация и стерилизация растворами
химических препаратов (раствор дезаксона, 8% первомур, 2% раствор
хлоргексидина)
17.
АНТИСЕПТИКА- комплекс мероприятий, направленных на уменьшение количества
микробов в ране, снижение опасности их проникновения в рану и
развития в ней.
• Физическая антисептика – методы, создающие в ране
неблагоприятные условия для развития бактерий (марля, тампоны,
дренажи)
• Механическая антисептика – удаление из раны микробов,
некротизированных тканей, свертков крови, инородных тел (ПХО).
• Химическая – использование химических веществ для уничтожения
бактерий в ране (обработка операционного поля, рук хирурга,
шовного материала и т.д.).
• Биологическая – повышение иммуно-биологических сил организма
(вакцины, сыворотки, плазма, кровь,антибиотики и т.д.).
18.
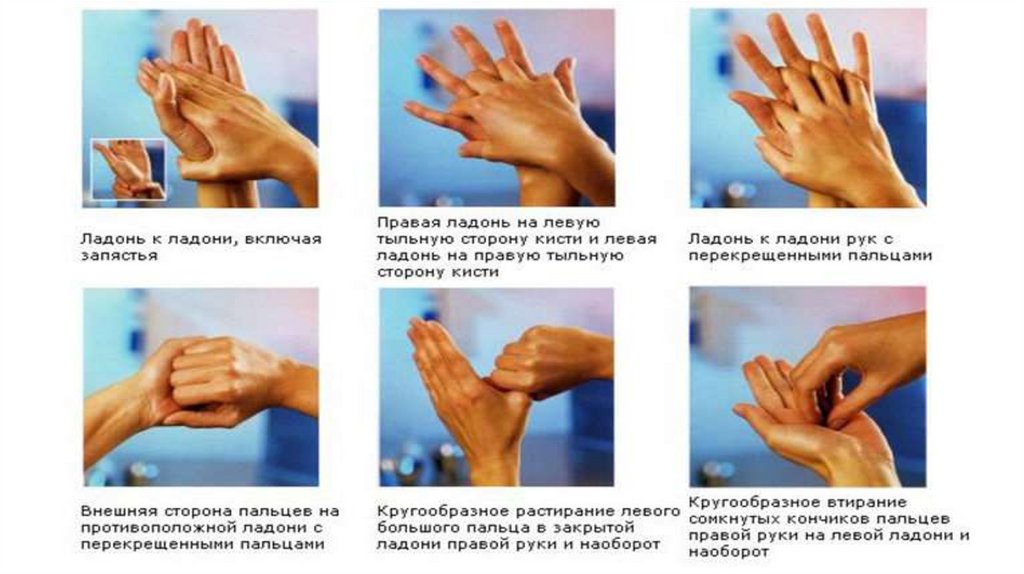
Обработка рук медицинского персоналаХирургическая антисептика рук – проводится перед операцией и
любыми вмешательствами, связанными с нарушением целостности
кожных покровов.
Современные методы хирургической антисептики рук:
0,5% хлоргексидином биглюконатом;
2,4% раствором первомура;
5% новосептом;
церигелем;
дегмицидом и дегмином;
АХД – 2000;
АХД – 2000 – специаль;
«Плевосепт».
19.
20.
ОБЩИЕ ПРАВИЛА АНТИСЕПТИКИ РУК1. Антисептик наносят только на сухие руки после гигиенического мытья.
2. Препарат энергично втирают в кожу кистей рук и предплечий двух- или
трехкратно в течение определенного времени, согласно инструкции.
3. На высохшие руки сразу надевают перчатки.
21.
ПОДГОТОВКА И ОБРАБОТКА ИНФЕКЦИОННОГО ПОЛЯЭтапность
дезинфекции
зоны
операции
на
операционном столе предложена Филончиковым (1904) и
Гроссихом (1908).
Суть метода – четырехкратное смазывание
будущего разреза 5% спиртовым раствором йода.
места
По ОСТу применяются современные антисептики:
органические йодсодержащие препараты (1% йодонат,
1% йодопирон), хлоргексидин, АХД.
22.
ЭТАПЫ ОБРАБОТКИ ОПЕРАЦИОННОГО ПОЛЯНА ОПЕРАЦИОННОМ СТОЛЕ
1. Широкая
двукратная
обработка
«от
центра
к
периферии», загрязненные участки (пупок, паховые
складки, подмышечные впадины) обрабатываются в
последнюю очередь;
2. Изоляция зоны операции стерильным бельем, повторная
обработка;
3. Обработка перед наложением швов на кожу;
4. Обработка после наложения швов на кожу.
23.
ПРОФИЛАКТИКА ИМПЛАНТАЦИОННОЙ ИНФЕКЦИИИсточники имплантационной инфекции:
Шовный материал;
Протезы;
Катетеры и дренажи;
Спирали;
Трансплантационные материалы.
24.
ВИДЫ ШОВНОГО МАТЕРИАЛАЕстественного происхождения (шелк, х –б нить, кетгут)
Искусственного происхождения (капрон, лавсан, фторлон, полиэстер, дакрон).
Рассасывающийся шовный материал
Нерассасывающийся шовный материал. (дексон, викрил, оксицилон. )
Лучший способ стерилизации шовного материала и протезов – лучевая
стерилизация в заводских условиях.
25.
МЕТОДЫ КОНТРОЛЯ СТЕРИЛЬНОСТИМетоды контроля стерильности делятся на прямые и непрямые.
Прямым методом контроля стерильности является бактериологическое
исследование. Его недостаток – длительность проведения исследования,
результаты становятся известными через 3-5 дней, в то время как
использовать инструменты целесообразно сразу после стерилизации. В
связи с этим метод применяется для выборочного контроля стерильности
хирургических материалов в плановом порядке, и по его результатам
судят о методических погрешностях в работе медперсонала или
дефектах используемого оборудования.
Контроль обсемененности разных объектов и воздуха в хирургических
отделениях производится 1 раз в месяц. Выборочный контроль
стерильности инструментов, перевязочного материала, рук хирурга,
кожи, операционного белья и др. проводят 1 раз в 7дней, шовного
материала – 1 раз в 10 дней.
26.
Непрямые методы контроля используются при термических способахстерилизации и позволяют определить температуру, при которой
производилась стерилизация, не давая ответ на вопрос о присутствии
или отсутствии микрофлоры.
Так при автоклавировании в бикс кладут ампулу с веществом, имеющим
температуру плавления в пределах 110-120 0С: бензойную кислоту,
резорцин, антипирин . После стерилизации сестра обращает внимание
на эту ампулу: если вещество расплавилось, то материал стерильный,
если нет – нагревание было недостаточным и пользоваться таким
материалом нельзя – он нестерильный. Вместо ампулы в бикс можно
положить термоиндикаторные полоски или максимальный термометр, по
которому определяют, достигалась ли во время стерилизации
необходимая температура.
Для контроля стерилизации в сухожаровом шкафу используются
вещества с более высокой точкой плавления (180-190 0С): аскорбиновая
кислота, янтарная кислота, тиомочевина.
27.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ1. http://uhonos.ru/infekcii/vnutribolnichnay
a-vbi/
2. http://bolezni.by/bugatca/150xk8.html
3. https://studfiles.net/preview/2706243/






















 medicine
medicine








