Similar presentations:
Реакции ионного обмена (РИО)
1. Реакции ионного обмена (РИО) – в воде
• Вещества, растворы которых обладаютэлектролитической проводимостью, называются
электролитами. Растворитель – вода.
• Электролитическая диссоциация – это
распад растворимых веществ (распад
электролита) на ионы под действием
воды (молекул растворителя).
2.
• Не являются электролитами (выучить):- нерастворимые вещества↓,
- газообразные вещества ↑,
- вода,
- оксиды
H2SiO3↓, H2CO3, H2SO3,
Они не обладают проводимостью – это
неэлектролиты (очень слабые электролиты).
• Электролиты:
- растворимые кислоты,
- растворимые соли,
-растворимые основания (щелочи).
3. Электролиты: I.Растворимые основания (Щелочи) – электролиты, диссоциирующие с образованием катионов металлов Ме+ и гидроксид
ионов ОН1.1 Сильные электролиты (10): КОН, NaOH,Ba(OH)2, Sr(OH)2, Ca(OH)2, LiOH и др. Щелочи –
растворимые в воде основания
1.2 Слабые электролиты: NH4OH (NH3 и Н2O)
1.3 Очень слабые электролиты (неэлектролиты):
нерастворимые в воде основания.
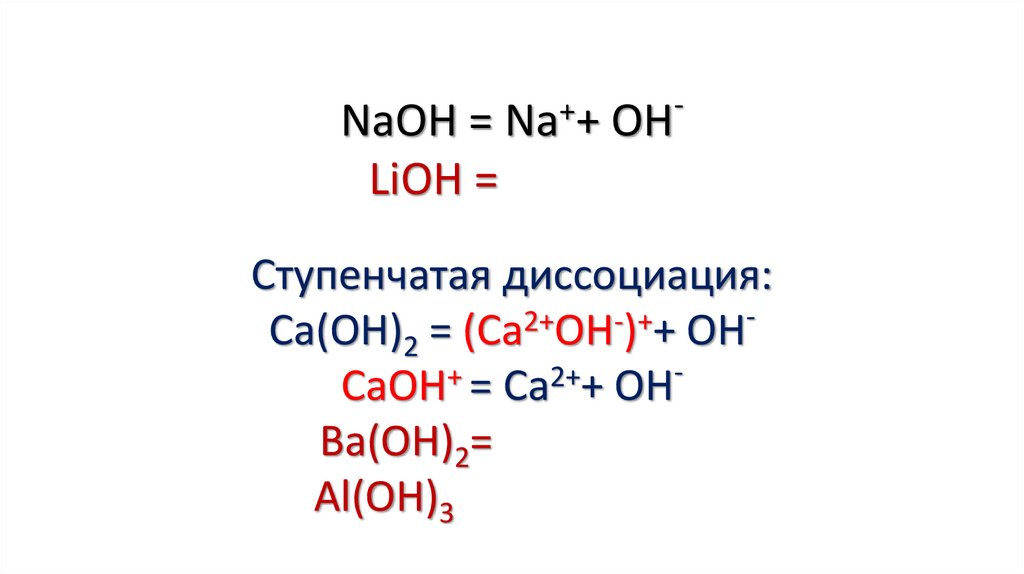
4.
+NaOH = Na + OH
LiOH =
Ступенчатая диссоциация:
2+
+
Са(ОН)2 = (Са ОН ) + ОН
+
2+
СаОН = Са + ОН
Ва(ОН)2=
Al(OH)3
5. II.Кислоты – электролиты, диссоциирующие с образованием катионов водорода Н+ и анионов кислотных остатков-
II.Кислоты – электролиты, диссоциирующие собразованием катионов водорода Н+
и анионов кислотных остатков2.1 Сильные электролиты - сильные кислоты H2SO4.
2.2 Электролиты средней силы: H3РO4, HNO2 и др.
2.3 Очень слабые электролиты (неэлектролиты):
H2SiO3↓, H2CO3, H2SO3,
H2CO3 в воде распадаются на CO2↑ и H2O
H2SO3 в воде распадаются на SO2 и H2O
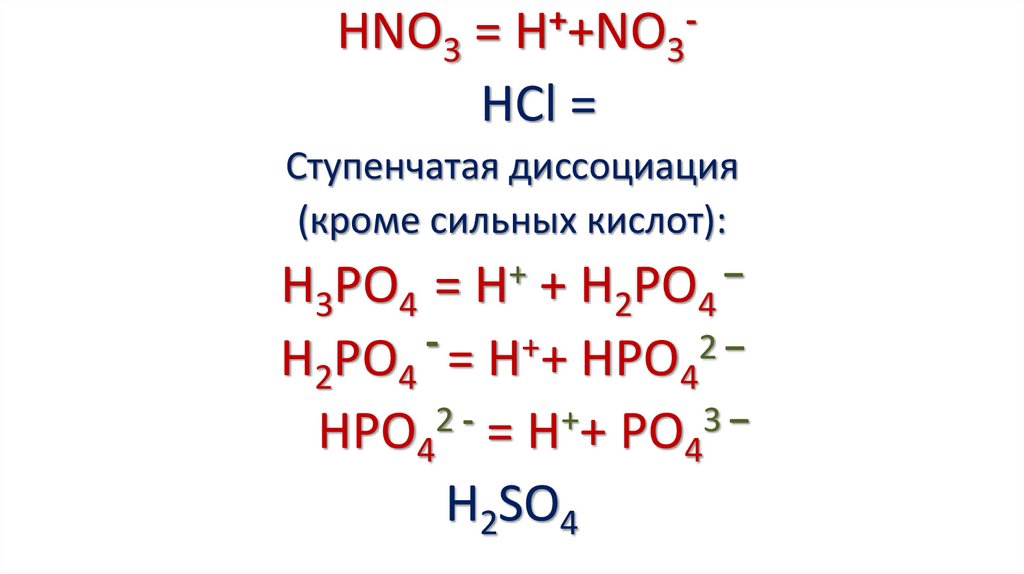
6.
HNO3 = H++NO3HCl =Ступенчатая диссоциация
(кроме сильных кислот):
+
–
H3PO4 = H + H2PO4
H2PO4 = H++ HPO42 –
HPO42 - = H++ PO43 –
H2SO4
7. III. Cоли 3.1 Растворимые средние соли диссоциируют с образованием катионов Ме+ и анионов кислотных остатков- Нет ступенчатой
диссоциацииCu(NO3)2 = Cu2+ + 2NO3Fe2(SO4)3 =
K3PO4 =
Mn3(PO4)2 =
8. 3.2 Кислые соли - электролиты диссоциирующие на катионы металла Ме+ и анионы кислотных остатков (гидро…ионы), содержащие
водород2+
Ca(H2PO4)2 = Ca + 2H2PO4
+
2H2PO4 = H +HPO4
HPO42- = H++PO43-
9. 3.3 Основные соли – электролиты диссоциирующие на гидроксоионы металлов (Ме2+ОН-)+ и анионы кислотного остатка-
AlOHCl2 = AlOH2+ +2ClAlOH2+10. Запишите уравнения реакций следующих превращений:
12
3
4
Cu →CuO →CuSO4 →Cu(OH)2 →CuO
11. Запишите уравнения реакций следующих превращений:
Al→Al2O3 →Al2(SO4)3 →Al(OH)3 →Al(NO3)3Ca → CaO → CaCl2 → Ca(NO3)2 → Ca3(PO4)2
CuSO4 →Cu(NO3)2 →Pb(NO3)2 →K2PbO2 →Pb(OH)2
12. Реакции ионного обмена (РИО) написать полное ионное уравнение (ПИУ) и сокращенное ионное уравнение (СИУ).
1. Взаимодействие оснований с кислотами:Са(OH)2 + Hl =
2. Взаимодействие основного оксида с кислотой:
CaO + HNO3 =
13.
3. Взаимодействие растворимой соли сощелочью:
CuCl2 + KOH =
4. Взаимодействие двух растворимых солей:
Al2(SO4)3 + BaCl2 =
14.
5. Взаимодействие растворимой или нерастворимой соли скислотой:
K2S + 2HCl = 2KCl + H2S↑
CuS↓ + HCl =
6. Взаимодействие растворимой соли с кислотой:
Na2CO3 + HNO3 = NaNO3 + ?
7. Взаимодействие нерастворимого основания с
кислотой:
Fe(OH)3↓ + HNO3 =
15.
8. Взаимодействие нерастворимого основания скислотой:
Fe(OH)3↓+ H3PO4 = FePO4↓ + 3H2O.
ПИУ и СИУ: Fe(OH)3↓ + 3H+ + PO43- = FePO4↓ + 3H2O
В данном случае полное ионное уравнение реакции
совпадает с сокращенным. Эта реакция протекает
до конца, о чем свидетельствуют сразу два факта:
образование вещества, нерастворимого в воде, и
выделение воды.
9. Взаимодействие малорастворимой соли с кислотой:
СaSO3 + H3РO4 =
16.
10. KNO3 + NaCl = KCl + NaNO3ПИУ:
K+ + NO3– + Na+ + Cl – ⇄ K+ + Cl –+ Na+ + NO3–
В данном случае сокращенное ионное уравнение
написать нельзя:
согласно теории электролитической
диссоциации, реакция не протекает.
Если такой раствор выпарить, то получим смесь
четырех солей: KNO3, NaCl, KCl, NaNO3.
17. Подготовка к контрольной работе: 1. Распределите перечисленные вещества на электролиты и неэлектролиты
NaOHMn(OH)2
Na2SO3
AlPO4
H2SO4
H2SO3
Ca(OH)2
CaO
Na2O
Na2HРO3
Вa(H2PO4)2
H2S ↑
CaOHNO3
FeOHCl
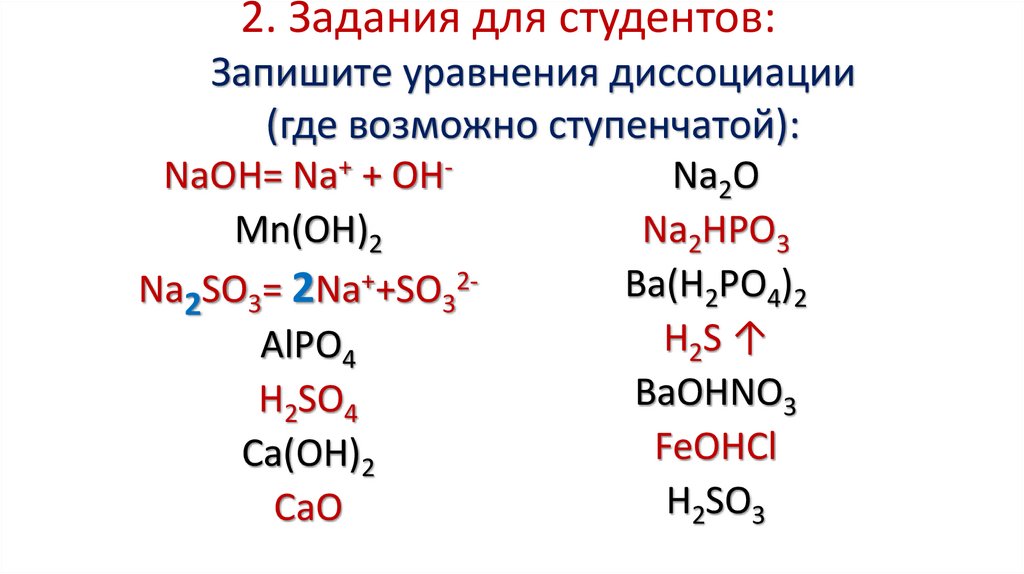
18. 2. Задания для студентов: Запишите уравнения диссоциации (где возможно ступенчатой):
NaOH= Na+ + OHMn(OH)2Na2SO3= 2Na++SO32AlPO4
H2SO4
Ca(OH)2
CaO
Na2O
Na2HРO3
Вa(H2PO4)2
H2S ↑
BaOHNO3
FeOHCl
H2SO3
19. 3. Запишите молекулярные и ионные (ПИУ и СИУ) уравнения взаимодействия:
МУNaOH + FeSO4 =
ПИУ
СИУ
CaCO3 + HNO3=
AgNO3 + Н2CrO4 =
Mg + H2SO4=
СuO + HNO3=
20. 4. Составьте МУ уравнения, и ПИУ, исходя из СИУ:
3+СИУ Fe + 3OH = Fe(OH)3↓
МУ
ПИУ
4.2 Al3+ + PO43- = AlPO4↓
+
4.3 H + OH = H2O
2+
4.4 Mn + 2OH = Mn(OH)2↓
4.5 Pb2+ + SO42- = PbSO4↓

















 chemistry
chemistry








