Similar presentations:
Галлий, индий (Ga, In)
1. Галлий, индий (Ga, In)
2. История открытия галлия
Первооткрывателем галлия является француз П. Лекок деБуабодран. Это произошло 27 августа 1875 года.
О своем открытии он сообщил, делая доклад в Парижской
Академии наук. Он описал свойства нового химического
элемента. 29 августа он был назван галлием, в честь Франции,
которая в древности называлась Галлия.
Ученый проводил интенсивные опыты по изучению свойств.
Результаты исследований он направил в один из научных
журналов. Статья, написанная им, достигла Петербурга, где
жил великий русский ученый Д.И. Менделеев. Он-то и ждал с
нетерпением публикацию. Ведь существование химического
элемента было предсказано теоретически Менделеевым
после открытия им периодического закона. Назывался он
экаалюминий, т.е. похожий на алюминий. Атомная масса
галлия оказалась такой же, как и предсказал Д.И. Менделеев.
Через некоторое время П. Лекок де Буабодран прислал
русскому химику своё фото, на котором он сделал надпись с
подписью «Почтительный знак совершенного уважения и
мое живейшее желание считать Менделеева в числе моих
друзей. Л. де Б.», а Д. И.Менделеев написал: «Лекок де
Буабодран. Париж. В 1875 г. открыл экаалюминий,
названный галлием».
3. История открытия индия
Элементом, послужившим, как бы катализатором к открытию нового химическогоэлемента индия, был таллий. Эти элементы были открыты с использованием
метода спектрального анализа.
Индий был обнаружен немецкими учеными Ф.Рейхом и И.Рихтером. Произошло
это в 1863 году. Ученые проявили интерес к уже открытому химическому
элементу-таллию. Они решали проблему получения металла. Природным
источником были цинковые руды из местечка Химмельсфюрста. Эти руды были
полиметаллическими, помимо основного металла цинка, в них присутствовали
мышьяк, сера, кремний, олово, медь, кадмий. Ф. Рейх предложил включить в их
состав и таллий. Но проведя большое количество операций, ему не удалось
получить его.
Результатом опытов стало получение осадка желтоватого цвета, состав которого был
неизвестен. Для изучения осадка он использовал спектроскопию. Но Ф. Рейх
страдал дальтонизмом (не различал цвета). Для изучения результатов
спектрального анализа он привлек И. Рихтера, который был его ассистентом. И
Рихтер сразу же обнаружил очень яркую синюю линию, которая не принадлежала
ни одному из ранее известных химических элементов. Он поделился этим с Ф.
Рейхом и ученые пришли к выводу, что ими обнаружен новый химический
элемент.
Этот элемент решили назвать индием, но не в честь индии, а по названию
природного красителя индиго (краситель ярко-синего цвета).
4. История открытия индия
Фердинанд Рейх - немецкийфизик и химик
Иероним Теодор Рихтер –
немецкий химик
5. Распостранение галлия в природе
Среднее содержание галлия в земной коре относительно высокое, 0,0015% помассе, что равно содержанию свинца и молибдена, и в десятки раз больше,
чем, например, тантала или вольфрама, в сотни раз больше, чем ртути или
серебра.
Галлий - типичный рассеянный элемент. В природе он встречается в
исключительно малых количествах (0,002% и меньше), обычно это - бокситы,
нефелины, сфалериты, каменные угли, некоторые железные руды.
Основная часть галлия заключена в минералах с алюминием, меньше - с
железом, цинком, медью и другими металлами. Дело в том, что галлий
практически не имеет как собственных месторождений, так и "персональных"
минералов.
Лишь сравнительно недавно в юго-восточной части Африки был обнаружен
первый галлиевый минерал, который и получил название галлит- CuGaS2. В
нем содержится почти 37% галлия. До этого самым богатым галлием
минералом - был германит из Юго-Восточной Африки. В нём содержится 0,6 0,7% галлия.
6. Минералы галлия
Галлит - CuGaS2Германит - Cu3(Fe, Ge)S4
7. Распостранение индия в природе
Индий — типичный рассеянный элемент, его среднее содержание влитосфере составляет 1,4×10-5% по массе.
При магматических процессах происходит слабое накопление индия в
гранитах и других кислых породах. Главные процессы концентрации
индия в земной коре связаны с горячими водными растворами,
образующими гидротермальные месторождения.
Индий связан в них с Zn, Sn, Cd и Pb. Сфалериты, халькопириты и
касситериты обогащены индием в среднем в 100 раз (содержание
около 1,4×10-3%).
Известны 3 минерала индия — самородный индий, рокезит CuInS2 и
индит In2S4, но все они крайне редкие. Практическое значение имеет
накопление индия в сфалеритах (до 0,1%, иногда 1% ).
8. Минералы индия
Сфалерит - ZnSХалькопирит - CuFeS2
9. Методы получения галлия
Основной источник получения галлия в настоящее время — растворы глиноземногопроизводства при переработке боксита и нефелина; кроме того, возможно
извлечение галлия из отходов электролиза алюминия, из угольной пены, из
сульфидных полиметаллических руд и углей при их переработке.
Галлий отделяют от большей части алюминия карбонизацией (процесс
карбонизации заключается в понижении рН алюминатного раствора насыщением
его углекислым газом), концентрируя галлий в виде Ga(OH)3 в последней фракции
осадка. Обогащенный раствор обрабатывают известью, получая галлиевый
концентрат, содержание Ga203 в котором достигает ~1%.
Технический галлий получают электролизом. Электролит — раствор галлиевого
концентрата в едком натре. Температура электролиза 50—70°С.
Получаемый электрохимическими методами галлий содержит значительное
количество примесей, зависящее от состава исходного электролита. Черновой
галлий подвергают очистке несколькими способами:
1) промывка горячей водой и фильтрация через пористые фильтры (галлий чистотой
99,9 %);
2) промывка кислотами (содержание примесей снижается до 0,01 %);
3) вакуумная обработка (основана на различии в давлении паров при высокой
температуре между галлием и рядом примесей);
4) электролитическое рафинирование, т. е. растворение чернового галлия в
щелочном электролите в катодное осаждение чистого металла;
5) физические методы очистки (направленная кристаллизация, зонная плавка).
10. Методы получения индия
Индий получают из отходов и промежуточных продуктов производства цинка,свинца и олова.
Это сырьё содержит от тысячных до десятых долей процента индия.
Извлечение индия складывается из трёх основных этапов:
- получение обогащенного продукта — концентрата индия;
- переработка концентрата до чернового металла;
- рафинирование.
Сначала исходный технический индий растворяют, нагревая в серной кислоте.
Нерастворившийся остаток, содержащий медь, серебро и свинец,
отфильтровывают, а из кислого раствора цементируют (процесс
извлечение металла путем вытеснения из раствора
его соли другим металлом цементатором, имеющим более
отрицательный стандартный потенциал) примеси на листах чернового индия.
При этом удаляются медь, сурьма, висмут, серебро и большая часть олова.
Черновой индий рафинируют электрохимическими или химическими методами.
Сверхчистый индий получают зонной плавкой (метод очистки твёрдых веществ,
основанный на различной растворимости примесей в твердой и жидкой фазах).
11. Галлий и индий – мягкие серебристо-белые металлы
ГаллийИндий
Галлий и индий – мягкие серебристобелые металлы
12. Почему галлий легкоплавок?
Предсказывая свойства галлия, Менделеев считал, что этот металл должен бытьлегкоплавким, поскольку его аналоги по группе – алюминий и индий – тоже
тугоплавкостью не отличаются.
Но температура плавления галлия необычно низкая, в пять раз ниже, чем у
индия. Объясняется это необычным строением кристаллов галлия. Его
кристаллическая решетка образована не отдельными атомами (как у
«нормальных» металлов), а двухатомными молекулами. Молекулы Ga2 очень
устойчивы, они сохраняются даже при переводе галлия в жидкое состояние.
Но между собой эти молекулы связаны лишь слабыми вандерваальсовыми
силами, и для разрушения их связи нужно совсем немного энергии.
Галлий имеет уникальный температурный интервал жидкого состояния (от
29,8 до 2225 ⁰C). Молекулы Ga2 сохраняются в жидком состоянии, тогда как
в парах металлический галлий почти всегда одноатомен. Высокую
температуру кипения галлия объясняют тем, что при плавлении образуется
плотная упаковка атомов с координационным числом 12, для разрушения
которой требуется большая энергия. В частности таким строением
объясняется большая плотность жидкого галлия по сравнению с
кристаллическим. Электропроводность жидкого галлия также больше, чем
твердого.
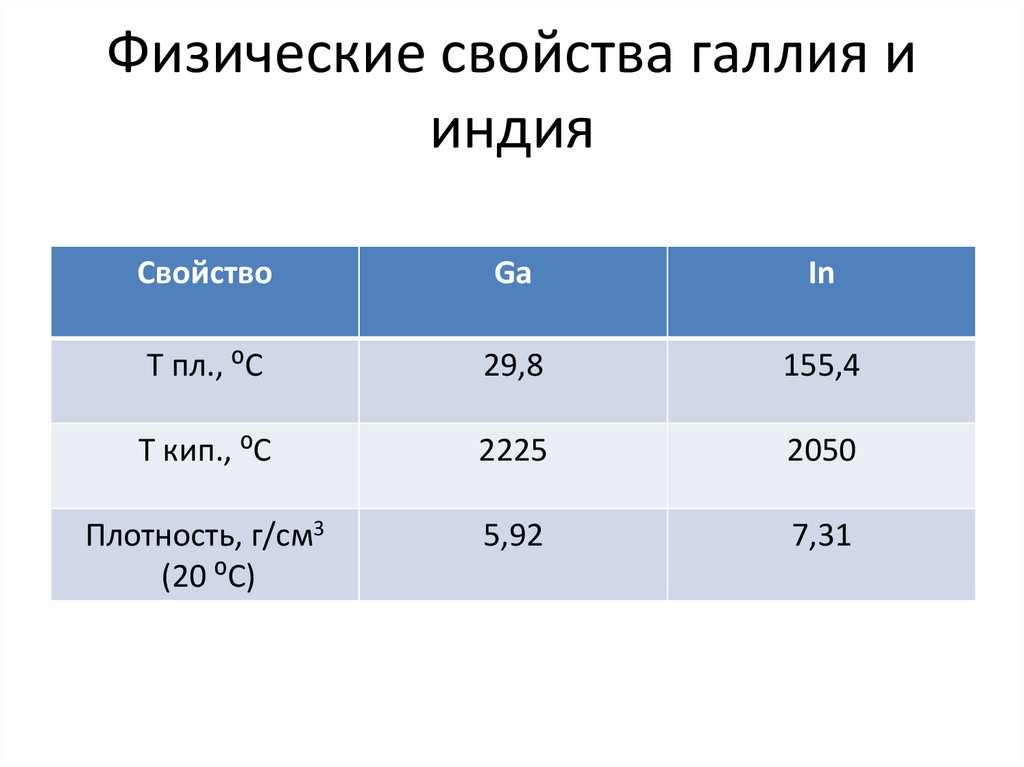
13. Физические свойства галлия и индия
СвойствоGa
In
Т пл., ⁰С
29,8
155,4
Т кип., ⁰С
2225
2050
Плотность, г/см3
(20 ⁰С)
5,92
7,31
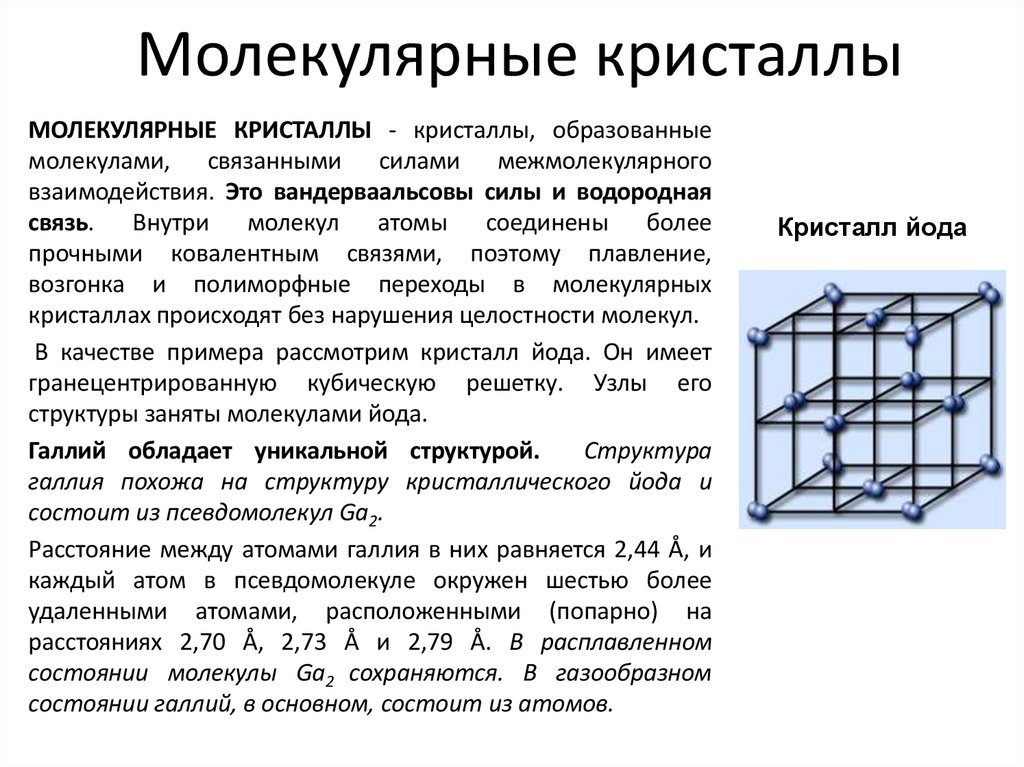
14. Молекулярные кристаллы
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ - кристаллы, образованныемолекулами, связанными силами межмолекулярного
взаимодействия. Это вандерваальсовы силы и водородная
связь. Внутри молекул атомы соединены более
прочными ковалентным связями, поэтому плавление,
возгонка и полиморфные переходы в молекулярных
кристаллах происходят без нарушения целостности молекул.
В качестве примера рассмотрим кристалл йода. Он имеет
гранецентрированную кубическую решетку. Узлы его
структуры заняты молекулами йода.
Галлий обладает уникальной структурой.
Структура
галлия похожа на структуру кристаллического йода и
состоит из псевдомолекул Ga2.
Расстояние между атомами галлия в них равняется 2,44 Å, и
каждый атом в псевдомолекуле окружен шестью более
удаленными атомами, расположенными (попарно) на
расстояниях 2,70 Å, 2,73 Å и 2,79 Å. В расплавленном
состоянии молекулы Ga2 сохраняются. В газообразном
состоянии галлий, в основном, состоит из атомов.
Кристалл йода
15. Химические свойства галлия и индия
На воздухе при комнатной температуре галлий и индий покрываются защитнойоксидной пленкой, однако при нагревании выше 200°С они окисляются до
оксидов Э2О3:
4Э + 3O2 = Э2О3
S:
2Э + 3S = Э2S3
H2:
не реагируют
Г:
2Э + 3Г2 = 2ЭГ3
NH3:
2Ga + 2NH3 = 2GaN + 3H2↑
(1050 – 1200oC)
Галлий медленно реагирует с горячей водой:
2Ga + 6H2O = 2Ga(OH)3↓ + 3H2↑
С большинством металлов галлий и индий образуют интерметаллиды.
16. Химические свойства галлия и индия
HCl:(In )2Ga + 6HCl = 2GaCl3 (2InCl3 )+ 3H2 ↑
H2SO4:
(In )2Ga + 3H2SO4 = Ga2(SO4 )3 (In2SO4)3) + 3H2 ↑
HNO3(конц .) :
Э + 6HNO3 = Э(NO3)3 + 3NO2↑ + 3H2O
HNO3(разб.) :
Э + 4HNO3 = Э(NO3)3 + 3NO↑ + 2H2O
Галлий растворяется в щелочах с образованием гидроксогаллатов:
2Ga + 6H2O + 2NaOH = 2Na[Ga(OH)4] + 3H2↑
Галлий и индий реагируют с галогенами: реакция с хлором и бромом идёт при
комнатной температуре, взаимодействие с йодом начинается при
нагревании.
17. Оксиды галлия и индия
Э2О, Э2О3 . Наиболее устойчивы Э2О3.Ga2O3 – амфотерный, In2O3 – слабо амфотерный
Э2О3 + 6HCl = 2ЭCl3 + 3H2O
(Э = Ga, In)
Э2О3 + 2NaOH = 2NaЭO2 + H2O, (Э = Ga, In)
(выше 150 oC)
Ga2O3 + Na2CO3 = 2NaGaO2 + CO2
Ga2O3 + 2NaOH + 3H2O = 2Na[Gа(OH)4]
18. Гидроксиды галлия и индия
• Получение:ЭCl3 + 3NaOH = Э(ОН)3↓ + 3NaCl
ЭCl3 + 3NH3 = Э(ОН)3↓ + 3NH4Cl + 3H2O
• Э(ОН)3 амфотерны:
Э(ОН)3 + 3H3O+ = [Э(Н2O)6]3+
Э(ОН)3 + 3OH- = [Э(ОН)6]3-
19. Соли галлия и индия
Из водных растворов выделяются кристаллогидраты:ЭГ3·6Н2О,
Э(NO3)3·6H2O,
KЭ(SO4)2·12H2O и др.
ЭГ3 - летучие, легкоплавкие, хорошо растворимые,
проявляют кислотные свойства:
ЭГ3 + 3КГ = К3[ЭГ6]
ЭH3 (гидриды) полимерны. Известны гидридогаллаты,
получаемые в неводных (эфир) средах:
GaCl3 + 4LiH = Li[GaH4] + 3LiCl
Ионы Ga3+,In3+ - бесцветны, все соли Э3+ подвержены
гидролизу.
20. Применение галлия и его соединений
Арсенид
галлия
GaAs
—
перспективный
материал
для
полупроводниковой электроники.
• Изотоп 71Ga является важнейшим материалом для регистрации нейтрино, и в
этой связи перед техникой стоит весьма актуальная задача выделения этого
изотопа из природной смеси в целях повышения чувствительности детекторов
нейтрино. Так как содержание 71Ga составляет в природной смеси изотопов
около 39,9 %, то выделение чистого изотопа и использование его в качестве
детектора нейтрино способно повысить чувствительность регистрации в 2,5
раза.
• Галлий — превосходный смазочный материал. На основе галлия и никеля,
галлия и скандия созданы практически очень важные металлические клеи.
• Металлическим галлием также заполняют кварцевые термометры (вместо
ртути) для измерения высоких температур. Это связано с тем, что галлий имеет
значительно более высокую температуру кипения по сравнению с ртутью.
• Оксид галлия входит в состав ряда стратегически важных лазерных
материалов.
• Нитрид галлия используется в создании полупроводниковых лазеров и
светодиодов синего и ультрафиолетового диапазона.
21.
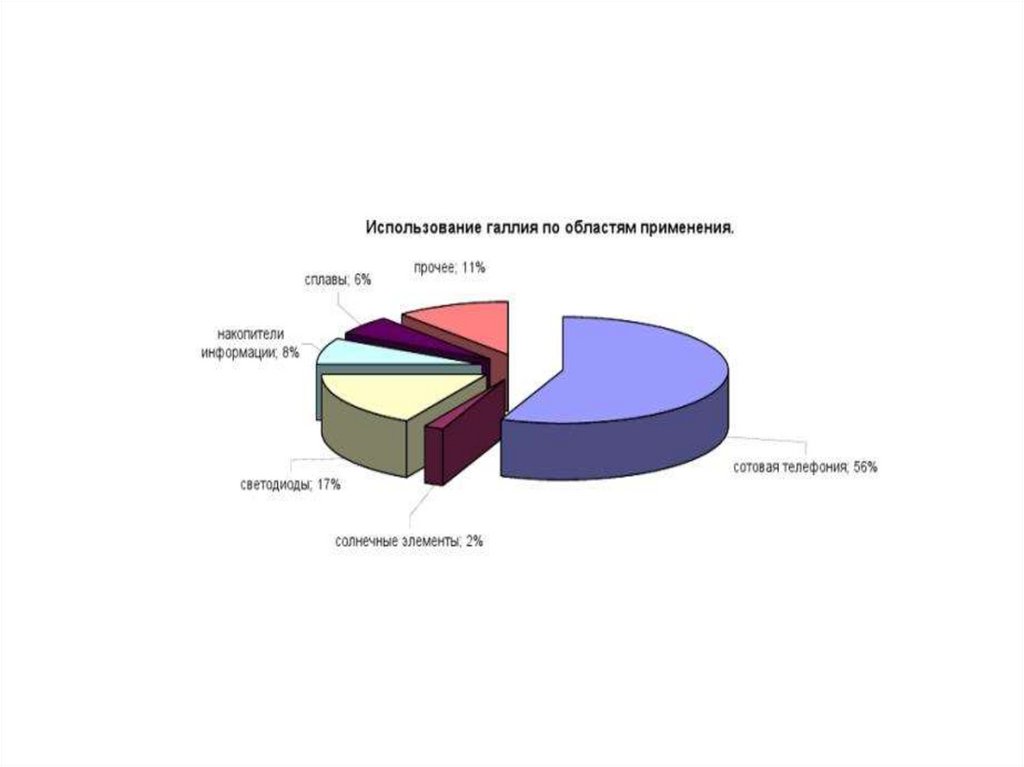
22. Применение галлия и его соединений
Галлий - основа электронной промышленности.Он используется при изготовлении ячеек памяти.
Оптикоэлектронные устройства, такие как LEDs (англ. Light-emitting
diode — светодиоды), лазер диоды, фотодатчики и солнечные
батареи, произведенные из GaAs, продолжают быть основной
областью потребления галлия во всем мире.
В ближайшем будущем, использование GaAs, как ожидают, увеличится,
особенно на коммуникационных рынках. Рост применения средств
сотовых коммуникаций и спутниковых навигационных приборов, как
ожидается, приведет к увеличению спроса на галлий.
Новые GaN устройства используются для создания высокой плотности
хранения данных (CD-проигрыватели и цифровые видеоплееры),
высококачественной лазерной печати, средствах коммуникации и
освещении.
23. Термометр немецкого производства, внутри которого находится галлиевый сплав – галинстан (Galinstan). Этот сплав состоит из
68,5% галлия,21,5% индия и 10% олова.
24.
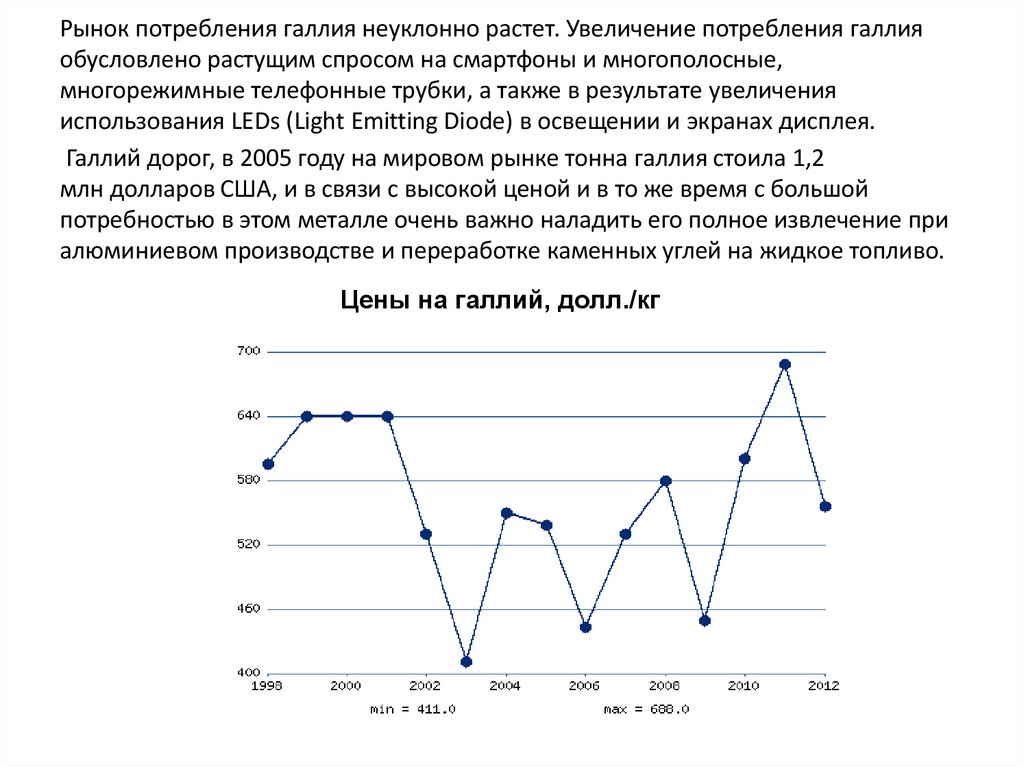
Рынок потребления галлия неуклонно растет. Увеличение потребления галлияобусловлено растущим спросом на смартфоны и многополосные,
многорежимные телефонные трубки, а также в результате увеличения
использования LEDs (Light Emitting Diode) в освещении и экранах дисплея.
Галлий дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2
млн долларов США, и в связи с высокой ценой и в то же время с большой
потребностью в этом металле очень важно наладить его полное извлечение при
алюминиевом производстве и переработке каменных углей на жидкое топливо.
Цены на галлий, долл./кг
25. Применение индия и его соединений
Галлий может быть заменен при изготовлении полупроводников наиндий.
Основная статья потребления (65%) индия в США и Японии –
изготовление тонких электропроводящих пленок и ИК-отражающих
пленок на основе оксида индия.
Оксид индия(III) – наиболее широко применяемое соединение индия,
так как он является основой большинства электропроводящих пленок
(легированных диоксидом олова) на стекле, слюде или лавсане,
используемых при изготовлении жидкокристаллических дисплеев,
мониторов портативных компьютеров, электролюминесцентных ламп,
электродов фотопроводящих элементов, топливных элементов (в том
числе – высокотемпературных) и т.п.
Электропроводящие пленки на основе In2O3, будучи нанесенными на
автомобильные или авиационные стекла, способны нагревать их до
100° С при пропускании тока и, тем самым, предотвращать их
обледенение и запотевание.
26. Применение индия и его соединений
Благодаря пластическим и антикоррозионным свойствам, низкой летучести ималенькой температуре плавления, индий используется для получения
различных сплавов и припоев (15% от общего потребления индия),
находящих самые разнообразные применения от ювелирного дела и
зубоврачебной практики до изготовления космических аппаратов.
Индий способен легко (даже при натирании) диффундировать в другие металлы
и образовывать твердые износостойкие покрытия, поэтому он успешно
применяется в изготовлении высококачественных подшипников для
двигателей, срок службы которых в пять раз превосходит срок службы
обычных.
• Предложено множество покрытий для нанесения на трущиеся поверхности
подшипников – серебряно-индиевые, серебряно-ториево-индиевые, индийцинковые, свинцово-индиевые, чистый индий и другие. Многие из таких
подшипников способны работать без смазки – покрытия на основе индия
придают поверхности хорошие смазывающие свойства.
• Для увеличения сопротивления износу индием покрывают острия контактов
различных выключателей, графитовых щеток и т.д.
27. Применение индия и его соединений
В ювелирном деле индий применяется в сплавах с золотом, серебром иплатиноидами.
Добавление индия к золоту значительно увеличивает твердость и прочность
изделий, улучшает их декоративный вид. Разработан ряд сплавов индия для
замены золота в ювелирных изделиях. Получены сплавы индия с палладием,
имеющие золотой и розово-сиреневый цвета. Например, известны «голубое
золото» (75%, Au, 20% Ag, 5% In), сплав платины с индием (60% In и 40% Pt)
золотисто-желтого цвета, «белое золото» и многие другие сплавы. Добавка
индия к серебру предотвращает потускнение серебряных ювелирных изделий
на воздухе.
Индий применяется в стоматологии. При небольших добавках к материалам
зубных пломб и протезов индий повышает их коррозионную стойкость и
твердость. Добавка индия к материалу зубных протезов позволяет
использовать большие количества меди вместо золота при их изготовлении.
Соединения индия являются компонентами зубных цементов, порошков и паст
для профилактики кариеса зубов.
Индиевые покрытия обладают прекрасной отражающей способностью и
применяются в изготовлении высококачественных зеркал, необходимых для
астрономических приборов (например, телескопов, регистрирующих слабый
свет от далеких звезд), прожекторов, рефлекторов и других устройств с
высокой измерительной точностью.
28.
Современное «голубое золото»получают путем добавления индия.
При этом сплав получается достаточно
мягким, что существенно ограничивает
его использование. В основном, из
голубого золота изготавливаются
различные декоративные элементы и
вставки.
Индий снижает температуру
плавления.
Является легирующей добавкой
«белого золота».
























 chemistry
chemistry








