Similar presentations:
Электрохимия. Экзаменационные вопросы
1.
Экзаменационные вопросы7. Электрохимия
1. Электрохимический процесс. Основные понятия. Электрохимическая система. Количественные
соотношения между величиной тока и количеством реагентов при электролизе и работе
гальванического элемента..
2. Двойной электрический слой на границе «металл – электролит». Электродный потенциал.
Уравнение Нернста.
3. Типы электродов. Водородный электрод. Водородная шкала электродных потенциалов.
4. Химический и концентрационный гальванические элементы. ЭДС, электродные реакции.
5. Скорость
электрохимических
процессов.
электрохимической системы.
6. Химические источники тока.
7. Электролиз водных растворов электролитов.
Поляризация
электродов.
Поляризация
2. 7.1 Электрохимические процессы (взаимные превращения электрич. и хим. форм энергии). УП 1, с.257-310 Основные понятия
Ок.-восст. реакция (переход электронов от восстановителя к окислителю) –основа эл.хим.процесса, если ∆G < 0 - самопроизв. процесс, ∆G > 0 – несамопр.
Zn0 Zn 2+ + 2ē – окисление восстановителя Zn0 Схема эл.хим.системы
Cu2+ + 2ē Cu0 – восстановлен. окислителя Cu2+ Zn|ZnSO4||CuSO4|Cu
Zn|Zn+2||Cu+2|Cu
Zn0 + Cu2+ Zn 2+ + Cu0 ∆G < 0 самопроизв.
В ЭХС полуреакции ОВР разделены в пространстве протекает электрич.ток
Электрохимич.система (ЭХC) – в ней протекают эл.хим.процессы - ОВР
1-электроды (Ме) - ē проводимость; на поверхн.
3
4
Ме: окисление –анод А, восстановлен.–катод К
∆G>0 ē ∆G< 0
[электрод - контакт фаз 1/2: 1-(ē пров.) и 2-(ионн)]
1
1
2–электролиты с ионн.проводим.для Ме (А и К)
А
К
3 -внешняя цепь для перехода электронов ē ↔,
Ме
Ме
проводник электр.тока (электронная проводим-ть)
5
4 –м.быть внешн.источник электрич.энергии -∆G > 0
2
2
ионы
5 -внутренняя цепь для перехода ионов ↔,
проводник электр.тока (ионный тип проводимости)
3. 7.1 Электрохимическая система (ЭХС)
При равновесии G=0, ток во внешн.цепи I=0-нет переноса эл-новG= rG + Wэ = 0 (*); rG –работа при протекании хим.реакции; Wэработа переноса электрич.зарядов (ē) - если между электродами ∆φ
Wэ = n F E, где E=∆φ= К – А(**) -разность потенциалов эл-дов (ЭДС)
F = NA ē 96500 Кл/моль – ч.Фарадея; NA – ч.Авогадро, ē – заряд эл-на;
n – число молей. Из (*) →Wэ = n F E = - rG → Е= - rG / nF (***) →
rG
Самопроизвольн. процесс: rG 0,→Е>0 К > А см.
E
(***) и (**). ЭХС – наз.гальваническим элементом - ГЭ или
n F
I 0
rG 0
хим. источником тока - ХИТ. Получение электрич.энергии –
результат протекания самопроизвольных ОВР. Потенциалы
электродов: Катод - «+» относительно «-» Анода т.к. Е>0
Вынужденный процесс: rG >0,→Е<0 К < А см.(***)
и (**). ЭХС – электролизер. Электролиз за счет электрическ.
энергии внешнего источника тока. Протекают вынужденные
окислит.-восст. реакции. Потенциалы: Катод «-», Анод «+»
4. 7.1 Соотношение количество вещества - величина тока в электрохимических(электродных) процессах
анодный процесс А: Ме1 Mе1+n + nē Ме1 – nē Mе1+nкатодный процесс К: Ме2+n+ nē Mе2
Превращению 1 атома Ме соответствует кол.эл-ва q = n ē (Кл) -[единичный акт]
Для 1 моля атомов: q NA для 1 моль: q =n ē NA=n F (Кл/моль); F= ē NA
За время t (с) при токе в системе I (А) общее кол-во эл-ва q = I t (Кл);
при этом на электродах (например, при электролизе) превратится ν моль веществ:
Электролиз:
m
I t
моль
n F
ХИТ(ГЭ): q = I t n F
M I t
[г
n F
n
[Kл
M
q=I⸱t; ν = m/M; =q/qp - коэфф-т
З-н Фарадея. m – масса, M – мол.масса
(для газа -Vν =22,4 л); η =m/mp 1 коэфф.
выхода по току (эффективность
электролиза); mp – расчетная масса
q m F
использован.материалов массой m
(при получение заданного кол-ва элва q) ; q:[Кл] [А час]–емкость ХИТ
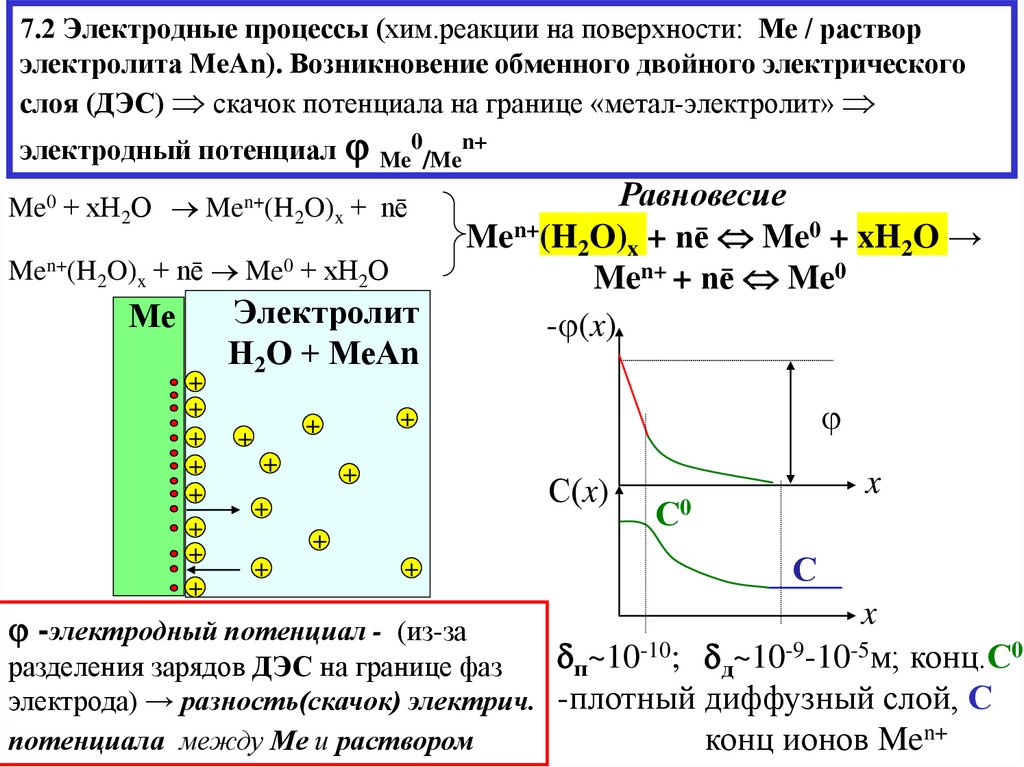
5. 7.2 Электродные процессы (хим.реакции на поверхности: Ме / раствор электролита MeAn). Возникновение обменного двойного
электрическогослоя (ДЭС) скачок потенциала на границе «метал-электролит»
электродный потенциал Me0/Men+
Me0 + хН2О Men+(H2O)x + nē
Men+(H2O)x + nē Me0 + хН2О
Ме
+
+
+
+
+
+
+
+
Электролит
Н2О + МеАn
+
+
С(x)
+
+
+
+
+
+
Равновесие
Men+(H2O)x + nē Me0 + xH2O →
Men+ + nē Me0
- (x)
+
x
С0
С
x
п~10-10; д~10-9-10-5м; конц.С0;
разделения зарядов ДЭС на границе фаз
электрода) → разность(скачок) электрич. -плотный диффузный слой, С
конц ионов Men+
потенциала между Ме и раствором
-электродный потенциал - (из-за
6. 7.2 Уравнение Нернста для определения электродного потенциала [φ = f (C Me(n+), T )] – термодинамич.подход
Men+(H2O)x+nē Me0 + xH2O или Men+ +nē Me0 (*)G = rG + Wэ = 0 при равновесии, Wэ = n F φ → rG = - n F φ
Изотерма реакции (*) rG = RT(ln C Me0 / C Men+ - ln Kp); (C Me0 =1,
тв.фаза), следовательно rG = - n F φ = RT(ln 1 / C Men+ - ln Kp) →
φ = (RT/nF)∙ln Kp + (RT/nF)∙ln C Men+ (**)
Стандартн.условия: Т=298 и C Men+ = 1 моль/л → [lnCMen+ = 0 ] →
(RT/nF)∙ln C Men+ =0. Из (**) → φ = (RT/nF)∙ln Kp = φ0 (***) в
стандартных условиях, т.е. [φ = φ0 - f ( материала электрода)]
φ0 –наз. стандартный электродный потенциал - невозможно
рассчитать [неизвестно К р] и определить
R T
0
lnC Me n
из опыта [разность потенциалов между
n F
проводником 1-го рода (Ме) и 2-го рода (электролит)]
уравнение Нернста
Из (**) и (***) → уравнение Нернста для
φ в нестандартных условий (Т≠298К, СМеn+≠1)
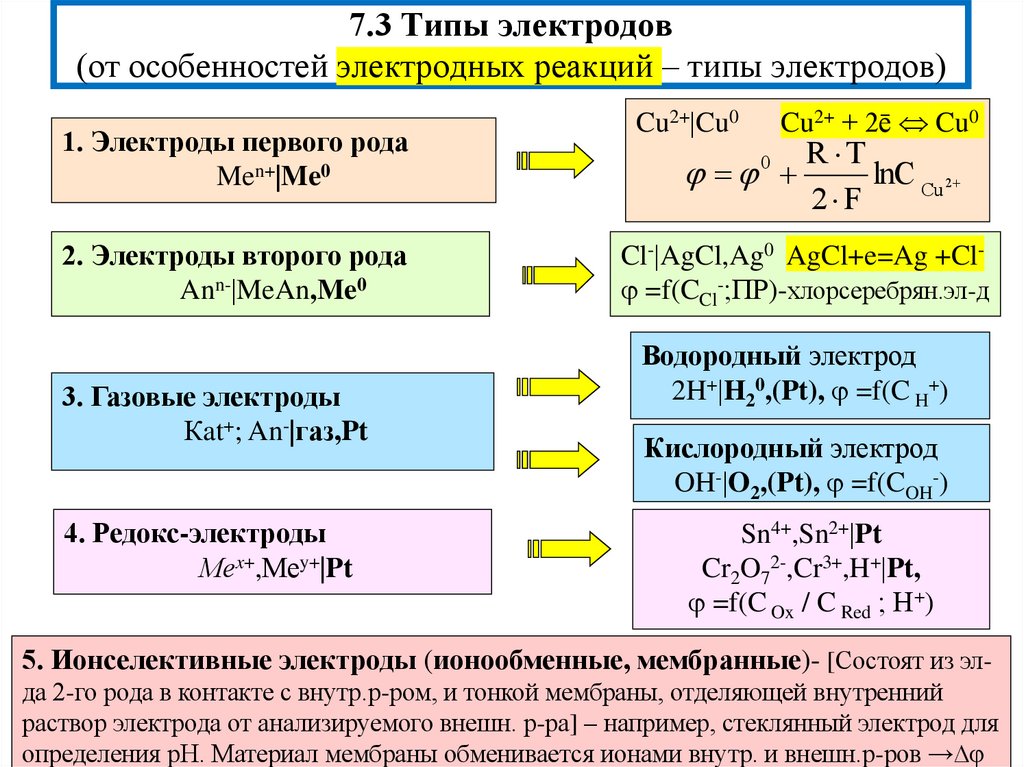
7. 7.3 Типы электродов (от особенностей электродных реакций – типы электродов)
1. Электроды первого родаMen+ Me0
2. Электроды второго рода
Ann- MeAn,Me0
3. Газовые электроды
Кat+; An- газ,Pt
4. Редокс-электроды
Меx+,Меy+ Pt
Cu2+ Cu0
Cu2+ + 2ē Cu0
R T
lnC Cu 2
2 F
0
Cl- AgCl,Ag0 AgCl+e=Ag +Cl =f(CCl-;ПР)-хлорсеребрян.эл-д
Водородный электрод
2H+ H20,(Pt), =f(C H+)
Кислородный электрод
OH- O2,(Pt), =f(COH-)
Sn4+,Sn2+ Pt
Cr2O72-,Cr3+,H+ Pt,
=f(C Ox / C Red ; Н+)
5. Ионселективные электроды (ионообменные, мембранные)- [Состоят из элда 2-го рода в контакте с внутр.р-ром, и тонкой мембраны, отделяющей внутренний
раствор электрода от анализируемого внешн. р-ра] – например, стеклянный электрод для
определения рН. Материал мембраны обменивается ионами внутр. и внешн.р-ров →∆φ
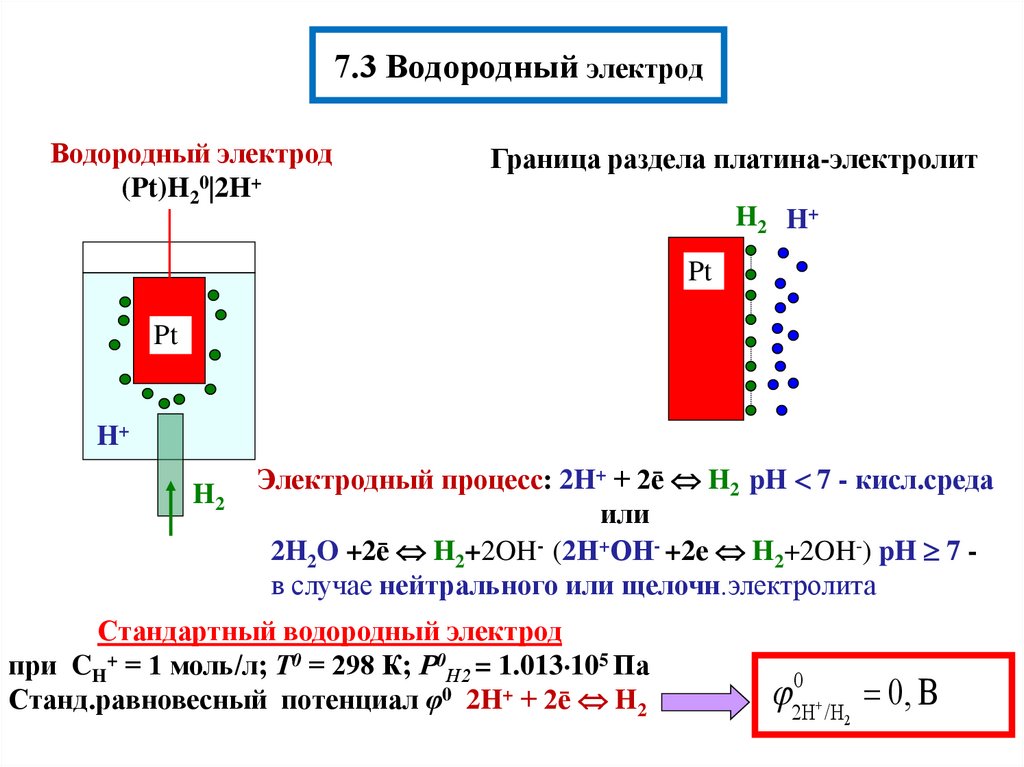
8. 7.3 Водородный электрод
Водородный электрод(Pt)H20 2H+
Граница раздела платина-электролит
H2 H +
Pt
Pt
H+
H2
Электродный процесс: 2H+ + 2ē H2 pH 7 - кисл.среда
или
2H2O +2ē H2+2OH- (2Н+ОН- +2е H2+2OH-) pH 7 в случае нейтрального или щелочн.электролита
Стандартный водородный электрод
при CH+ = 1 моль/л; Т0 = 298 К; Р0Н2 = 1.013 105 Па
Станд.равновесный потенциал φ0 2H+ + 2ē H2
0
2H
0, В
/H
2
9. 7.3 Водородная шкала электродных потенциалов
А( ) Me0|Men+||2H+|H20(Pt) (+)Кили
А( ) (Pt)H20, |2H+||Men+|Me0 (+)К
При CH+ = 1 моль/л; Т0 = 298 К; Р0=1.013 105 Па; CМе+ = 1 моль/л
Е
0
2H / H2
0
0
2H
0
/H
2
φ 0 ≡ 0 Men+/ Me0 = Е
Стандартные электродные потенциалы ( 0, В)
Электрод
Электродная реакция
Na+ Na0
Na+ + ē Na 0
Al3+ Al0
Al3+ + 3ē Al0
Zn2+ Zn0
Zn2+ + 2ē Zn0
Fe2+ Fe0
Fe2+ + 2ē Fe0
Pb2+ Pb0
Pb2+ + 2ē Pb0
2H+ H20,Pt
2H+ + 2ē H2
Cu2+ Cu0
Cu2+ + 2ē Cu0
OH- O2,Pt
О2 + 2H2O + 4ē 4OHpH 7
NO3-,NO2,H+ Pt NO3- + 2H+ + ē NO2 + H2O
Е 0 20H / H
0, В
-2.71
-1.67
-0.76
-0.44
-0.13
0.00
+0.34
+0.40
+0.80
2
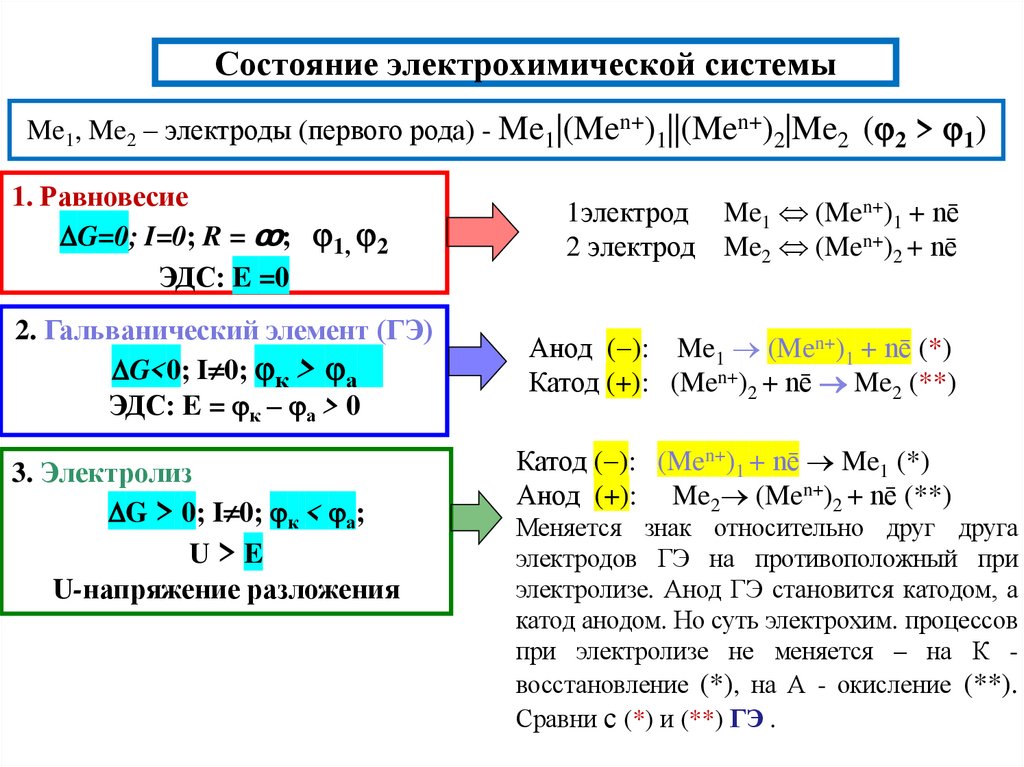
10. Состояние электрохимической системы
Me1, Me2 – электроды (первого рода) - Me1|(Men+)1||(Men+)2|Me2 ( 2 > 1)1. Равновесие
G=0; I=0; R = ꝏ; 1, 2
ЭДС: E =0
2. Гальванический элемент (ГЭ)
G<0; I 0; к > а
ЭДС: E = к – а > 0
3. Электролиз
G > 0; I 0; к < а;
U>E
U-напряжение разложения
1электрод Me1 (Men+)1 + nē
2 электрод Me2 (Men+)2 + nē
Анод ( ): Me1 (Men+)1 + nē (*)
Катод (+): (Men+)2 + nē Me2 (**)
Катод ( ): (Men+)1 + nē Me1 (*)
Анод (+): Me2 (Men+)2 + nē (**)
Меняется знак относительно друг друга
электродов ГЭ на противоположный при
электролизе. Анод ГЭ становится катодом, а
катод анодом. Но суть электрохим. процессов
при электролизе не меняется – на К восстановление (*), на А - окисление (**).
Сравни с (*) и (**) ГЭ .
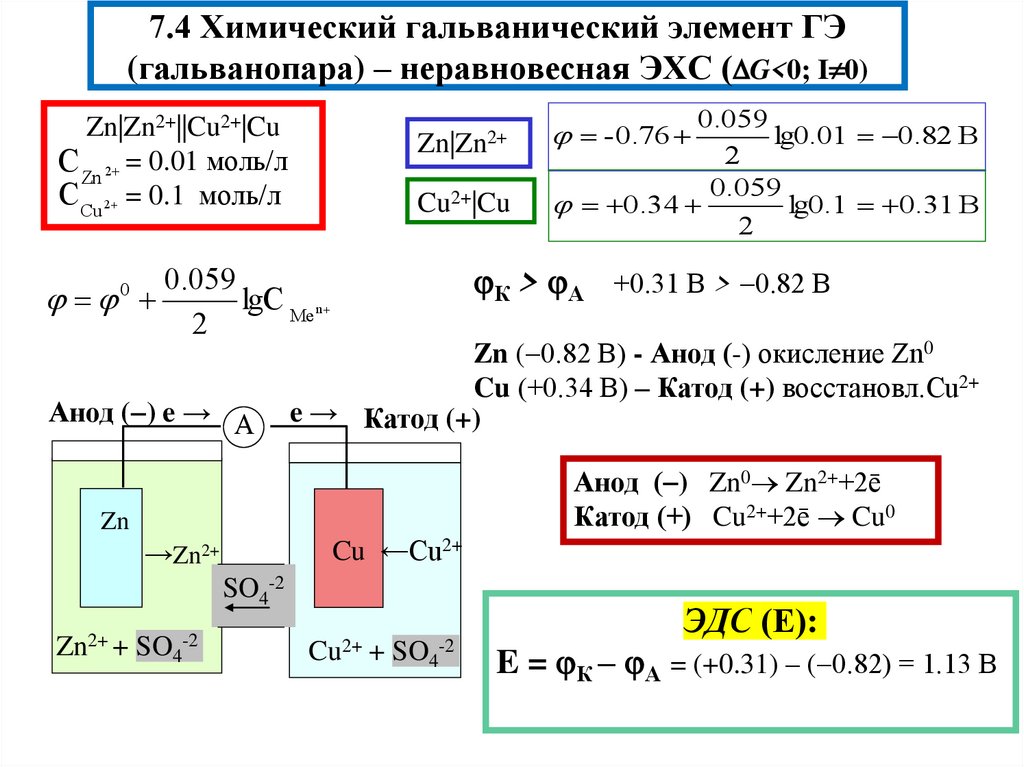
11. 7.4 Химический гальванический элемент ГЭ (гальванопара) – неравновесная ЭХС (G<0; I0)
7.4 Химический гальванический элемент ГЭ(гальванопара) – неравновесная ЭХС ( G<0; I 0)
Zn|Zn2+||Cu2+|Cu
С Zn 2 = 0.01 моль/л
С Cu 2 = 0.1 моль/л
0
-0.76
Cu2+|Cu
0.34
0.059
lg0.1 0.31 В
2
К > А +0.31 В > 0.82 В
0.059
lgC Me n
2
Анод ( ) e → А
0.059
lg0.01 0.82 В
2
Zn|Zn2+
Zn ( 0.82 В) - Анод (-) окисление Zn0
Cu (+0.34 В) – Катод (+) восстановл.Cu2+
e → Катод (+)
Анод ( ) Zn0 Zn2++2ē
Катод (+) Cu2++2ē Cu0
Zn
Cu ←Cu2+
→Zn2+
SO4-2
Zn2+ + SO4-2
Cu2+ + SO4-2
ЭДС (Е):
E = К – А = (+0.31) – ( 0.82) = 1.13 В
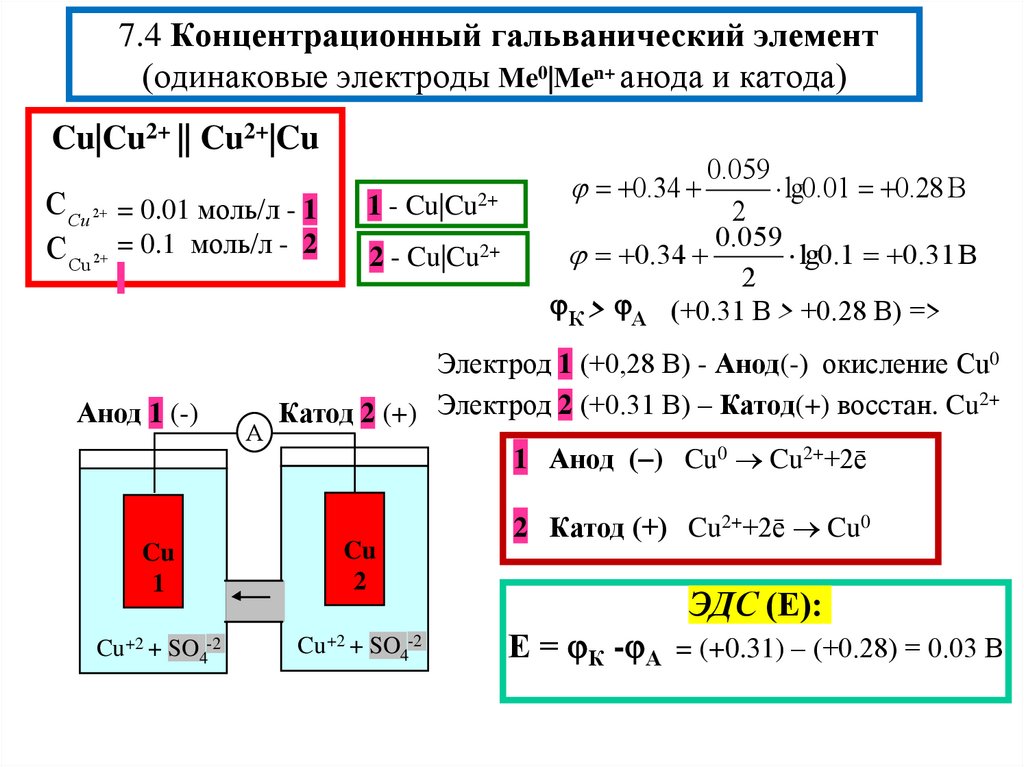
12. 7.4 Концентрационный гальванический элемент (одинаковые электроды Me0|Men+ анода и катода)
Cu|Cu2+ || Cu2+|CuС Cu 2 = 0.01 моль/л - 1
С Cu 2 = 0.1 моль/л - 2
Анод 1 (-)
А
1 - Cu|Cu2+
2 - Cu|Cu2+
0.059
lg0.01 0.28 В
2
0.059
0.34
lg0.1 0.31 В
2
К > А (+0.31 В > +0.28 В) =>
0.34
Электрод 1 (+0,28 В) - Анод(-) окисление Cu0
2+
Катод 2 (+) Электрод 2 (+0.31 В) – Катод(+) восстан. Cu
1 Анод ( ) Cu0 Cu2++2ē
Cu
1
Cu
2
Cu +2 + SO4-2
Cu +2 + SO4-2
2 Катод (+) Cu2++2ē Cu0
ЭДС (Е):
Е = К - А = (+0.31) – (+0.28) = 0.03 В
13. 7.5 Скорость электрохимических процессов
Скорость электродного процесса (эл.хим.реакции) – r - это число молейвещества - образовавшегося (израсходовавшегося) на единице поверхности
электрода - S в единицу времени - t
r
S t
I t
i
r
S t n F n F
I t
[моль]
n F
i
i
r
n F
I
[А/м 2 ] - плотность тока
S
i - характерис тика скорости
14. Поляризация электродов – [] (приводит к сближению потенциалов катода и анода и уменьшению ЭДС (∆φ) при работе ГЭ)
Поляризация электродов – [ ](приводит к сближению потенциалов катода и
анода и уменьшению ЭДС (∆φ) при работе ГЭ)
= I явл.[f(i)]
Поляризация - разность
потенциалов электрода I
при прохождении тока I и
его равновесным значением
(I=0)
Диффузионная(концентра
Электрохимическая
ционная) поляризация
Фазовые
(катодная) поляриза(стадии 1,3). Называют
превращения
ция; перенапряжение
перенапряжением - (для
(стадия 2)
лимитирующей стадии)
Стадии электрохимического процесса (сложной гетерогенной хим.реакции),
определяющего потенциал электродов:
1) подвод реагирующих частиц (диффузия) из объема электролита к поверхности
электрода (ур. Нернста);
2) собственно электрохимическая реакция на электродах (приводит к сближению
потенциалов электродов) (*);
3) отвод продуктов реакции(диффузия) от электрода (ур. Нернста).
(*)[Скорость переноса электронов во внешней цепи выше скорости
отдельных стадий →
Анод ( A ↑) > 0 – положительн. I = + (i)
изменение
потенциалов электродов Катод ( K ↓) < 0 – отриц.поляриз. I = - (i)
→ эл.хим. поляризация]
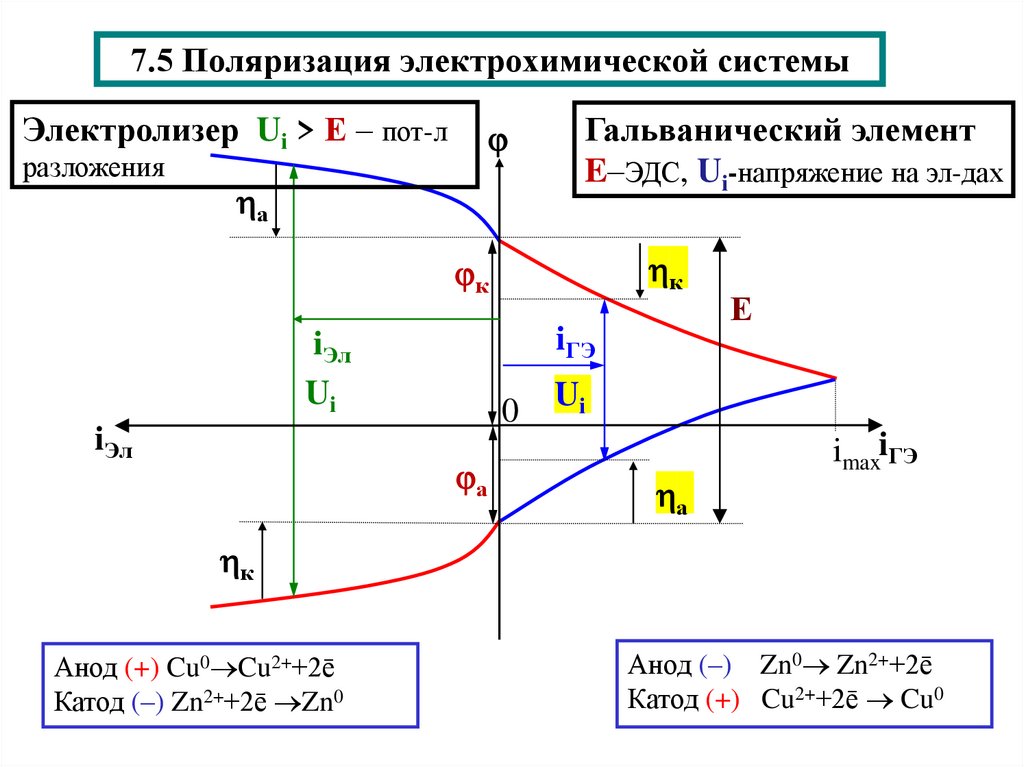
15. 7.5 Поляризация электрохимической системы
Электролизер Ui > Е – пот-лразложения
а
Гальванический элемент
E–ЭДС, Ui-напряжение на эл-дах
к
к
iГЭ
iЭл
Ui
iЭл
0
а
Е
Ui
а
imaxiГЭ
к
Анод (+) Cu0 Cu2++2ē
Катод (–) Zn2++2ē Zn0
Анод (–) Zn0 Zn2++2ē
Катод (+) Cu2++2ē Cu0
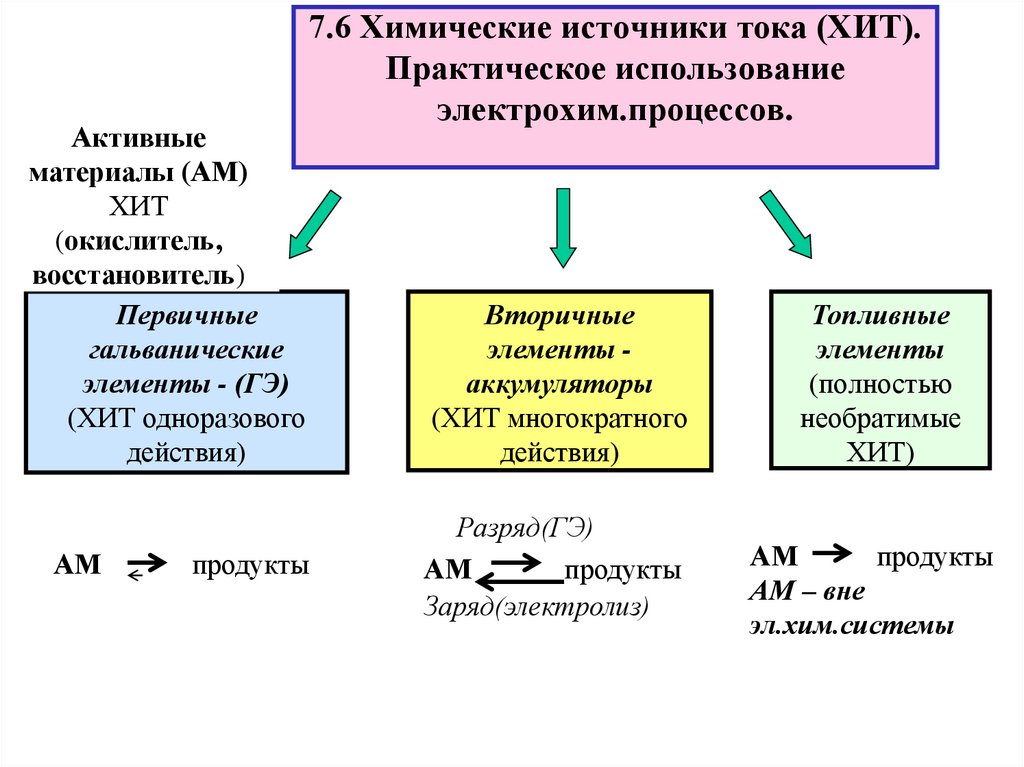
16. 7.6 Химические источники тока (ХИТ). Практическое использование электрохим.процессов.
Активныематериалы (АМ)
ХИТ
(окислитель,
восстановитель)
Первичные
гальванические
элементы - (ГЭ)
(ХИТ одноразового
действия)
АМ
7.6 Химические источники тока (ХИТ).
Практическое использование
электрохим.процессов.
продукты
Вторичные
элементы аккумуляторы
(ХИТ многократного
действия)
Разряд(ГЭ)
АМ
продукты
Заряд(электролиз)
Топливные
элементы
(полностью
необратимые
ХИТ)
АМ
продукты
АМ – вне
эл.хим.системы
17. Основные характеристики ХИТ
• ЭДС гальванического элемента (Е, В) -напряжение без нагрузки• Номинальное напряжение (U, В) -напряжение в средней части разрядной
характеристики (учитывает поляризацию ГЭ)
• Номинальная ёмкость(C)-ампер-час А ч - кол-во эл-ва, отдаваемое ХИТ
во внешнюю цепь; также используется для характеристики ёмкости ХИТ
удельная энергия (Вт ч/кг)
• Удельная мощность(N, Вт/кг) – макс.допустимая разрядная мощность
(показывает макс.возможный ток при номинальном напряжении)
•Срок хранения (Тхр) –время, когда ёмкость ХИТ существенно не
уменьшается из-за саморазряда(хим.процессы на элетродах с потреблением
АМ без генерирования эл.тока)
•Число циклов разряд-заряд(для аккумуляторов); ресурс работы - ТЭ
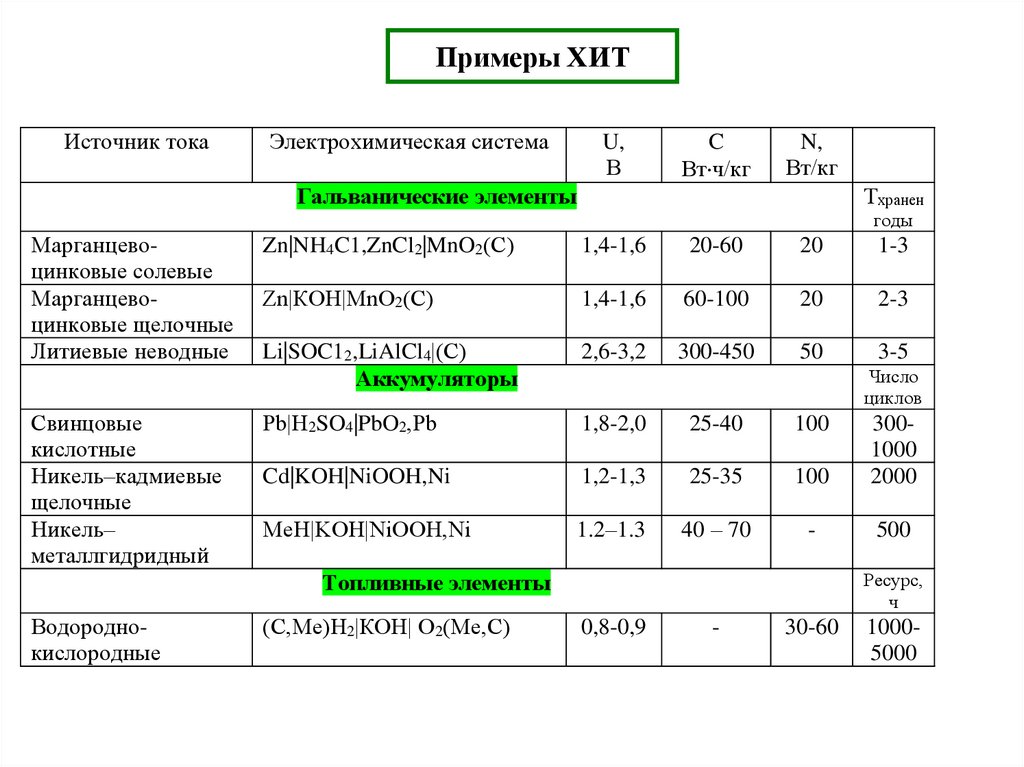
18. Примеры ХИТ
Источник токаЭлектрохимическая система
U,
В
C
Вт ч/кг
N,
Вт/кг
Тхранен
Гальванические элементы
годы
Марганцевоцинковые солевые
Марганцевоцинковые щелочные
Литиевые неводные
Свинцовые
кислотные
Никель–кадмиевые
щелочные
Никель–
металлгидридный
Zn|NH4C1,ZnCl2|MnO2(С)
1,4-1,6
20-60
20
1-3
Zn|КОН|MnO2(С)
1,4-1,6
60-100
20
2-3
Li|SOC12,LiAlCl4|(С)
Аккумуляторы
2,6-3,2
300-450
50
3-5
Рb|H2SO4|PbO2,Рb
1,8-2,0
25-40
100
Cd|KOH|NiOOH,Ni
1,2-1,3
25-35
100
3001000
2000
МеН|KOH|NiOOH,Ni
1.2–1.3
40 – 70
-
500
Число
циклов
Ресурс,
ч
Топливные элементы
Водороднокислородные
(C,Ме)H2|КОН| O2(Ме,C)
0,8-0,9
-
30-60
10005000
19. 7.7 Электролиз водных растворов электролитов. Катодные процессы (К:) – f(i)
7.7 Электролиз водных растворов электролитов.Катодные процессы (К:) – f( i)
Последовательность восстановления окислителей (катодных процессов 1,2 и 3)
К: 1 > 2 > 3... > n [окислители - катионы Меn+ и Н + в растворах]
1 1
Ме В электродн.пот-л
+
1 для Ме1 с Ме > 0 В
1
0
i
i, А/м2
2 2
р
-3
-1
3
К: Ме1n+ + nē Ме10
2 для Ме2 с ~ -1 < Ме < 0 В
2
К: Ме2n+ + nē Ме20 или
К: 2H2O + 2ē H2+2OH-
3
3 для Ме с Ме < ~ -1 В
К: 2H2O + 2ē H2+2OH-
Расплавы солей см.1 - К: Ме1n+ + nē Ме10
20. 7.7 Электролиз Анодные процессы - (А:) 1 – окисл.восст.потенциал для элементарных анионов, 2 – сложных [1<2]
7.7 Электролиз Анодные процессы - (А:)1 – окисл.восст.потенциал для элементарных анионов, 2 – сложных [ 1< 2]
Последовательность окисления (анодных процессов) А: 1 < 2 <... < n
а) пассивный (инертный) анод - Ме0А ( материал анода - Pt,Au; C) или
если потенциал материала анода Ме0A φ Меn+/Ме > φ ОН-/О2
, В
+
2)SO42-,NO3-,PO43--сложные анионы, их 2> 1
А: 2H2O - 4ē О2+ 4H+ рН≤7
А: 4OH- - 4ē О2 + 2H2O рН>7
1)Cl-, Br-, I--элементарные анионы, их 1< 2
А: 2Cl- Cl2 +2ē
б) активный (растворимый) анод Ме0А (металл анода Ме0A соотв-т
катиону МеАn+ соли электролита при электролизе) или
если потенциал металла анода Ме0A - φ Меn+/Ме < φ ОН-/О2
0
(Ме0А)А: Ме0А МеАn+ + nē
Пример: (Cu0А)A: Cu0А → CuА2+ +2e (*)
[медный анод (Cu0А) растворяется при
2
i, А/м
электролизе раствора CuSO4 - см.(*)]




![7.2 Уравнение Нернста для определения электродного потенциала [φ = f (C Me(n+), T )] – термодинамич.подход 7.2 Уравнение Нернста для определения электродного потенциала [φ = f (C Me(n+), T )] – термодинамич.подход](https://cf5.ppt-online.org/files5/slide/s/sPa0OckUSZRnbA2H1oIqz4g3yhrNFjG5XCdVvt/slide-5.jpg)


![Поляризация электродов – [] (приводит к сближению потенциалов катода и анода и уменьшению ЭДС (∆φ) при работе ГЭ) Поляризация электродов – [] (приводит к сближению потенциалов катода и анода и уменьшению ЭДС (∆φ) при работе ГЭ)](https://cf5.ppt-online.org/files5/slide/s/sPa0OckUSZRnbA2H1oIqz4g3yhrNFjG5XCdVvt/slide-13.jpg)


![7.7 Электролиз Анодные процессы - (А:) 1 – окисл.восст.потенциал для элементарных анионов, 2 – сложных [1<2] 7.7 Электролиз Анодные процессы - (А:) 1 – окисл.восст.потенциал для элементарных анионов, 2 – сложных [1<2]](https://cf5.ppt-online.org/files5/slide/s/sPa0OckUSZRnbA2H1oIqz4g3yhrNFjG5XCdVvt/slide-19.jpg)
 chemistry
chemistry