Similar presentations:
Соединения железа
1.
2.
Оксид железа (II)Гидроксид железа (II)
Соли железа (II)
Оксид железа (III)
Гидроксид железа (III)
Соли железа (III)
Качественные реакции на Fe2+ и Fe3+
3.
Оксид железа (II) FeO не растворяется в воде и щелочах.По химическим свойствам он близок к основным
оксидам. Легко взаимодействует с кислотами.
Со щелочами реакция возможна лишь при сплавлении.
4.
При взаимодействии оксида железа (II) с сильнымиокислителями образуются соединения железа (III).
5.
Оксид железа (II) восстанавливается до железаводородом, углеродом (коксом).
6.
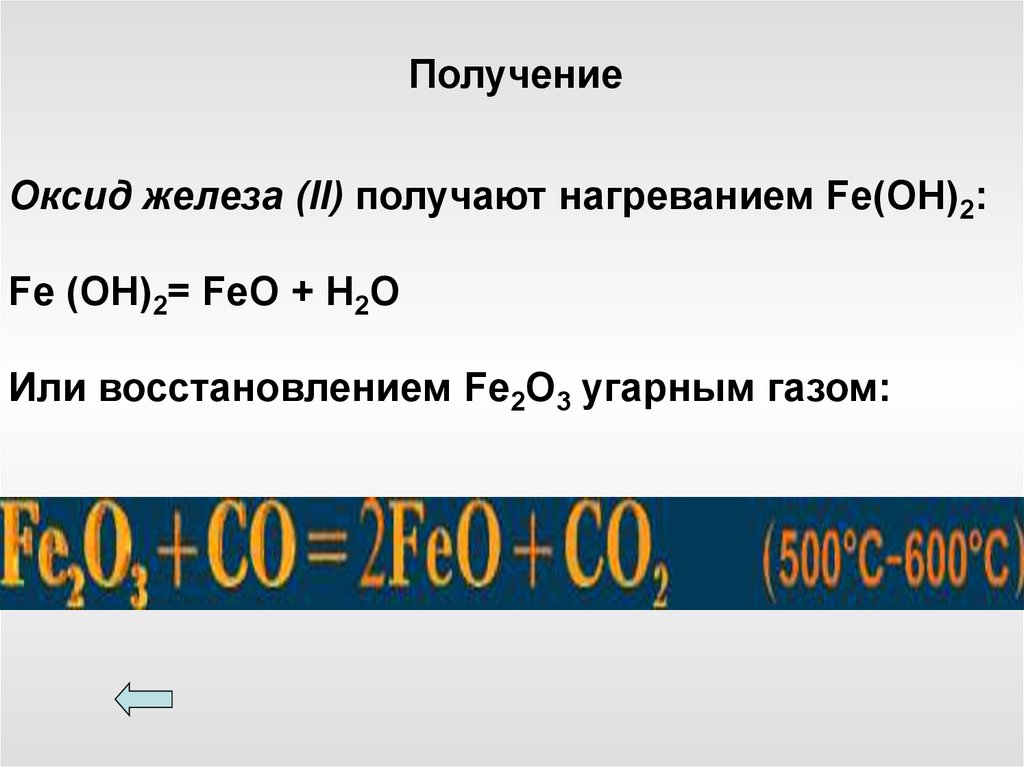
ПолучениеОксид железа (II) получают нагреванием Fe(OH)2:
Fe (OH)2= FeO + H2O
Или восстановлением Fe2O3 угарным газом:
7.
Образуется в виде мелких бледно-зелёных хлопьевпри реакции солей железа (II) со щелочами. Быстро
окисляется на воздухе.
8.
Гидроксид железа (II) проявляет основные свойства,поэтому легко реагирует с кислотами:
Легко разлагается при нагревании на оксид и воду:
9.
Гидроксид железа (II) очень легко окисляетсякислородом воздуха и другими окислителями:
Гидроксид железа (II) очень может реагировать
с концентрированными щелочами в жёстких
условиях:
10.
Соли Fe2+Соли железа (II) образуются и при растворении
железа в кислотах:
Fe + H2SO4 = FeSO4 + H2
Соли двухвалентного железа неустойчивы и на
воздухе или под действием окислителей окисляются
до трехвалентного железа.
11.
С щелочами соли двухвалентного железа образуютбелый осадок гидроксида железа (II):
Fe2+ + 2OH- = Fe(ОН)2
Fe(OH)2 со щелочам не реагирует, но легко
взаимодействует с кислотами, образуя соли железа (II):
Fe (ОН)2 + 2HCl = FeCl2 + 2H2O
Растворы солей двухвалентного железа в реакциях
гидролиза проявляют слабокислую реакцию:
Fe2+ + HOH FeOH+ + H+
12.
13.
Оксид железа (III) получают:• нагреванием Fe(OH)3:
2Fe(OH)3 = Fe2O3 + 3H2O
• разложением солей Fe3+:
14.
15.
Представляет собой бурый аморфный осадок. Егополучают действием щелочей на растворы солей
трехвалентного железа:
Fe2(SO4)3 + 6NаОН = 2Fe (ОН)3 + 3Na2SO4
16.
Гидроксид железа (III),как и соответствующие
гидроксиды алюминия
и хрома, амфотерен и
взаимодействует с
концентрированными
растворами щелочей,
образуя ферриты:
Fe (ОН) 3 + NaOH = NaFeO2 + 2H2O
17.
Растворимые соли железа (III)подвергаются гидролизу.
18.
Качественными реакциями на ион Fe3+ являются:образование кроваво-красной окраски роданида железа
(III) и тёмно-синего осадка (берлинская лазурь) в реакции
с гексацианоферратом (II) калия.
19.
Реактивом на ион Fe2+ является: образование синегоосадка (турнбулева синь) с гексацианоферратом (III)
калия (красная кровяная соль).


















 chemistry
chemistry