Similar presentations:
Координационная теория Вернера и ее практическое применение
1. Координационная теория Вернера и ее практическое применение.
Государственное бюджетное образовательное учреждение города МосквыШкола имени дважды Героя Советского Союза И.С. Полбина
Координационная теория Вернера и
ее практическое применение.
Автор проекта:
Тюрина Мария, ученица 10 “В” класса
ГБОУ Школа им. Полбина
г. Москва
Руководитель проекта:
Минаева И.И., учитель химии
ГБОУ Школа им. Полбина
г. Москва
Москва, 2025 год
2.
Составить учебное пособие для подготовки к ЕГЭ-2025 иолимпиадам
Подготовить теорию по теме
Подобрать задания разной степени сложности для ЕГЭ и олимпиад
Данная тема актуальна:
В экзаменационных работах часто встречаются
комплексообразователи и комплексные соли
В учебниках химии на данную тему недостаточно информации для
подготовки
Многих отпугивают задания по данной теме
Комплексообразователи встречаются в биологии и медицине
3.
1. Введение2. Основная часть
1) Координационная теория Вернера
2) Номенклатура комплексных соединений
3) Строение комплексных соединений
4) Образование координационной связи
5) Комплексообразующие агенты
6) Строение органических лигандов
7) Образование комплексных соединений
8) Геометрия комплекса
9) Биологически важные комплексы железа
10) Геометрическая изомерия
11) Равновесие в растворах
12) Хелатный эффект
13) Гиперкоординированные соединения
14) Соединения с асимметрическим центром
15) Псевдовращение
16) Равновесие твердое тело- раствор
17) Задания ЕГЭ
3. Заключение
4. Литература
4.
Координационная теория Вернераа) NaCl, б) CH3COOH, в) H2SO4, г) [PtCl2(NH3)2], д) Ba(СlO2)2, е) C6H12O6,
ж) NaOCl, з) K3[Fe(CN)6]
1798
[Co(NH3)6]Cl3
Аммиакаты: MAm!nNH3 ([M(NH3)n]Am)
1704
Fe(CN)2!4KCN
K4[Fe(CN)6]
Кристаллогидраты: MAm!nH2O
([M(H2O)n]Am)
Цианиды: M(CN)m!M’ (CN); M’[M(CN)m + n]
Соль Цейзе (1827): KCl!PtCl2(C2H4) K[Pt(C2H4)Cl3]
Альфред Вернер
1866 — 1919
Чугаев Лев
Комплексные (координационные) соединения — это
частицы (нейтральные молекулы или ионы), которые
образуются в результате присоединения к данному иону
(или атому), называемому комплексообразователем,
нейтральных молекул или других ионов, называемых
лигандами. Один из атомов имеет валентность,
превышающую его степень окисления
Cu(OH)2 + 4 NH3!H2O [Cu(NH3)4](OH)2 + 4 H2O
AgCl + 2 NH3!H2O [Ag(NH3)2]Cl + 2 H2O
5.
Номенклатура комплексных соединений[Co(NH3)6]Cl3 – лутеохлорид
[CoCl2(NH3)4]Cl3 – празеохлорид
K4[Fe(CN)6] – желтая кровяная
соль
K3[Fe(CN)6] – красная кровяная
соль
International Union of Pure and Applied Chemistry
(1957, 1970, 1990 г.) http://www.iupac.org/
Формулу записать в квадратных скобках, первым указать символ
центрального атома. В названии – анионные, катионные и
нейтральные лиганды в алфавитном порядке
Центральный атом в катионных и молекулярных комплексах не имеет
отличительного суффикса. В анионных комплексах: латинский корень
+ суффикс –ат: Fe – феррат, Сu – купрат, Ag – аргентат, Au – аурат
[Pt(NH3)2Cl2]
[CuCl4]2–
[Ni(CO)4]
[Ca(H2O)6]2+
- дихлордиаминплатина(II)
- тетрахлорокупрат(II) – ион
- тетракарбонилникель
- гексааквакальций – катион
6.
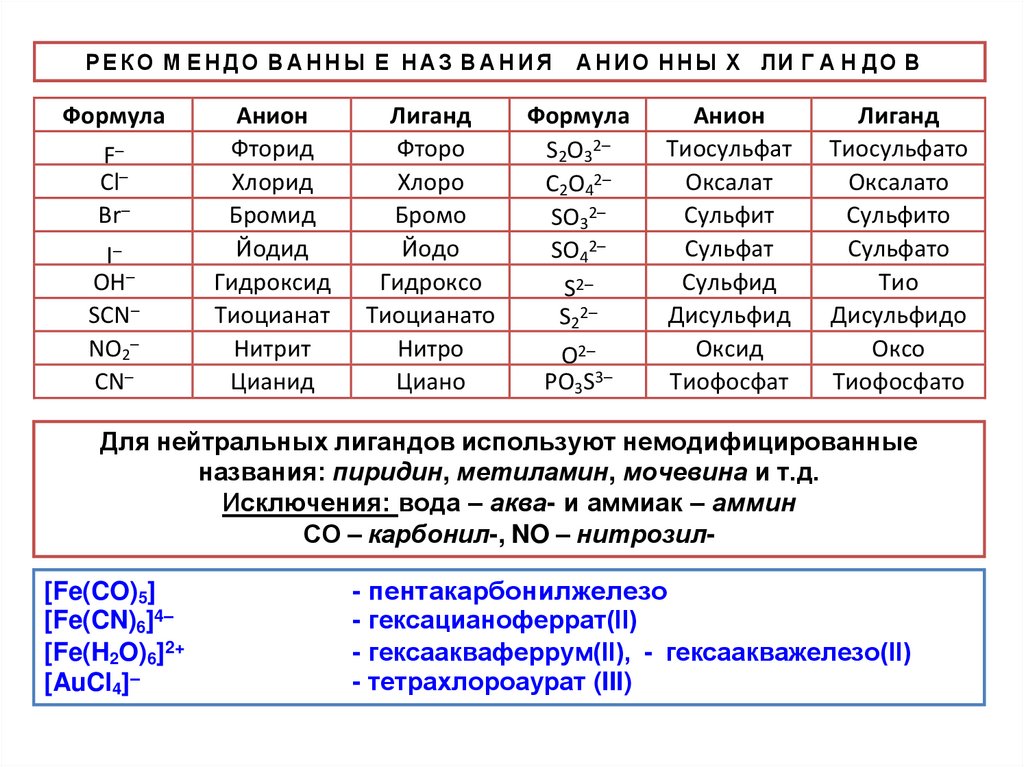
РЕКО М ЕНДО ВАННЫ Е НАЗ ВАНИЯФормула
F–
Cl–
Br–
I–
OH–
SCN–
NO2–
CN–
Анион
Фторид
Хлорид
Бромид
Йодид
Гидроксид
Тиоцианат
Нитрит
Цианид
Лиганд
Фторо
Хлоро
Бромо
Йодо
Гидроксо
Тиоцианато
Нитро
Циано
А Н И О Н Н Ы Х Л И Г А Н ДО В
Формула
S2O32–
C2O42–
SO32–
SO42–
S2–
S22–
O2–
PO3S3–
Анион
Тиосульфат
Оксалат
Сульфит
Сульфат
Сульфид
Дисульфид
Оксид
Тиофосфат
Лиганд
Тиосульфато
Оксалато
Сульфито
Сульфато
Тио
Дисульфидо
Оксо
Тиофосфато
Для нейтральных лигандов используют немодифицированные
названия: пиридин, метиламин, мочевина и т.д.
Исключения: вода – аква- и аммиак – аммин
СО – карбонил-, NO – нитрозил[Fe(CO)5]
[Fe(CN)6]4–
[Fe(H2O)6]2+
[AuCl4]–
- пентакарбонилжелезо
- гексацианоферрат(II)
- гексаакваферрум(II), - гексаакважелезо(II)
- тетрахлороаурат (III)
7.
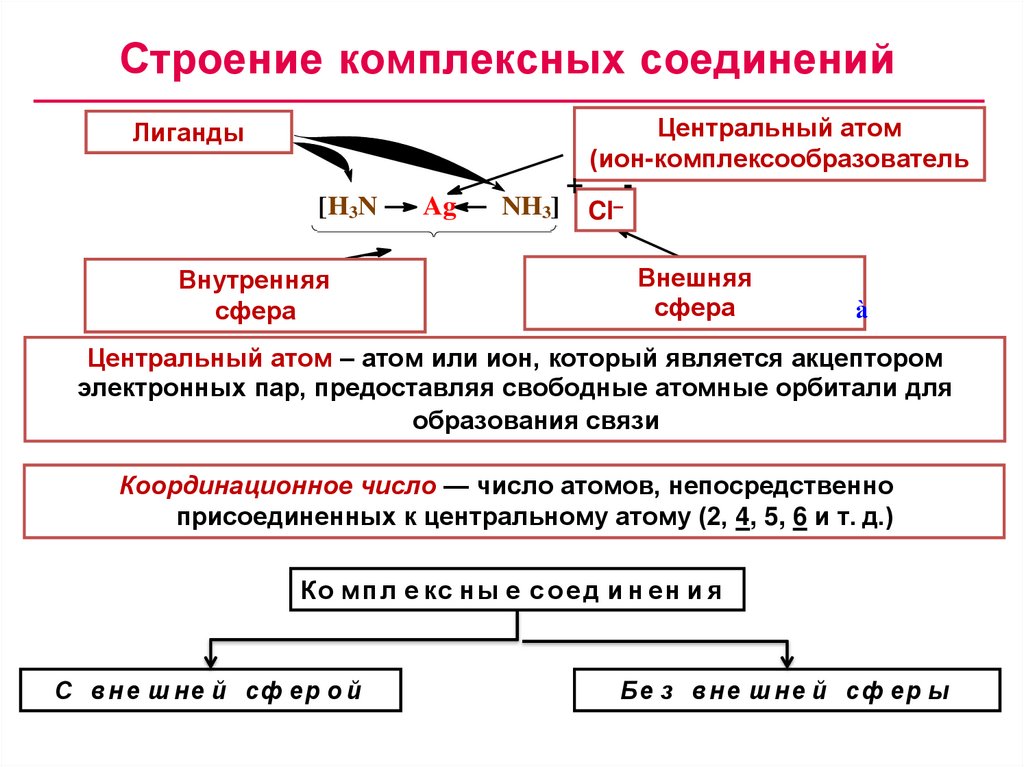
Строение комплексных соединенийöåí Центральный
òðàëüí û é àòî ì атом
(ê(ион-комплексообразователь
î ì ï ëåê ñî î áðàçî âàòåëü)
Лиганды
ëè ãàí äû
[H3N
Ag
âí óòðåí í ÿÿ
Внутренняя
ê î î ðäè сфера
í àöè î í í àÿ ñô åðà
NH3]
+
Ñl–
Cl
-
Внешняя
âí åø í ÿÿ
ê î î ðäèсфера
í àöè î í í àÿ ñô åð à
Центральный атом – атом или ион, который является акцептором
электронных пар, предоставляя свободные атомные орбитали для
образования связи
Координационное число — число атомов, непосредственно
присоединенных к центральному атому (2, 4, 5, 6 и т. д.)
Ко м п л е кс ны е с о е д и н ен и я
С в н е ш не й сф ер о й
Бе з в н е ш не й сф ер ы
8.
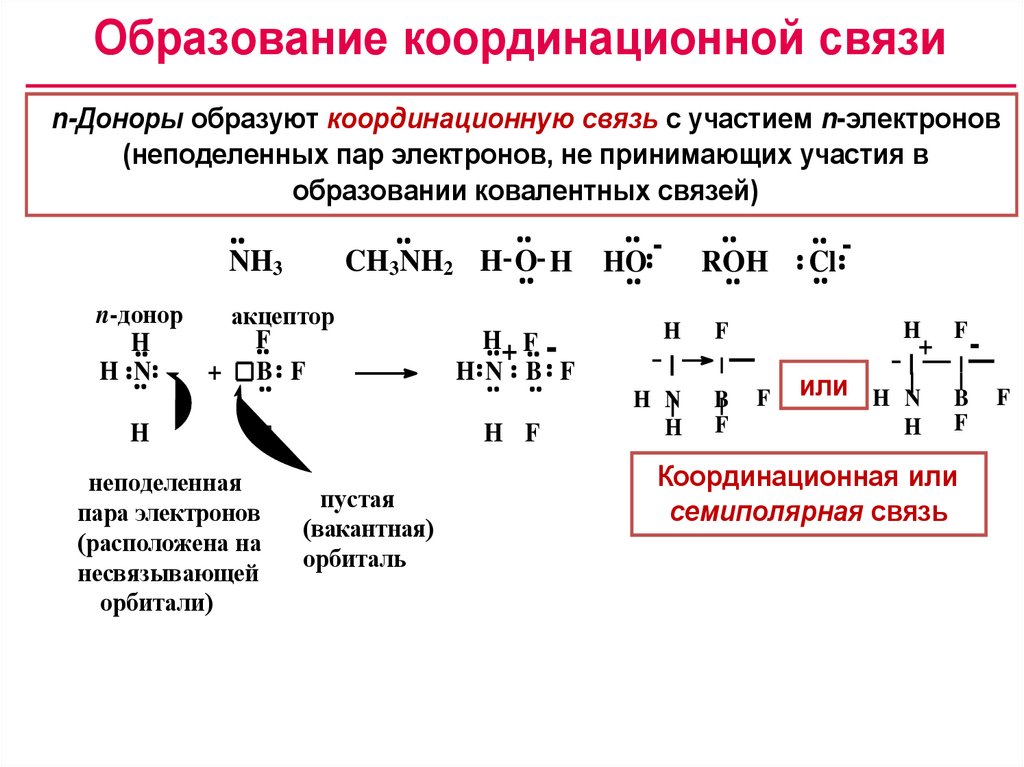
Образование координационной связиn-Доноры образуют координационную связь с участием n-электронов
(неподеленных пар электронов, не принимающих участия в
образовании ковалентных связей)
NH3
CH3NH2 H O H HO
n-донор
акцептор
F
H
H N
+ B F
H
H F
F
неподеленная
пара электронов
(расположена на
несвязывающей
орбитали)
H+ F HN B F
пустая
(вакантная)
орбиталь
-
ROH
H
F
H N
H
B
F
Cl
H
+
F
è ëè
или
H N
H
F
B
F
ñåì è ï î ëÿðí àÿ ñâÿçü
Координационная
или
семиполярная связь
F
9.
Комплексообразующие агентыЛиганды — ионы или нейтральные молекулы, присоединенные к
центральному атому (путем образования координационной
связи за счет электронной пары координирующего атома)
Координирующие атомы
Дентатность лиганда
Хелатные лиганды
Координирующие атомы — атомы в лиганде, непосредственно
связанные с центральным атомом
Дентатность лиганда — определяется числом координирующих атомов
в лиганде (монодентатный, бидентатный и т. д.)
(Cl–, NH3, H2O)
(H2NCH2CH2NH2)
10.
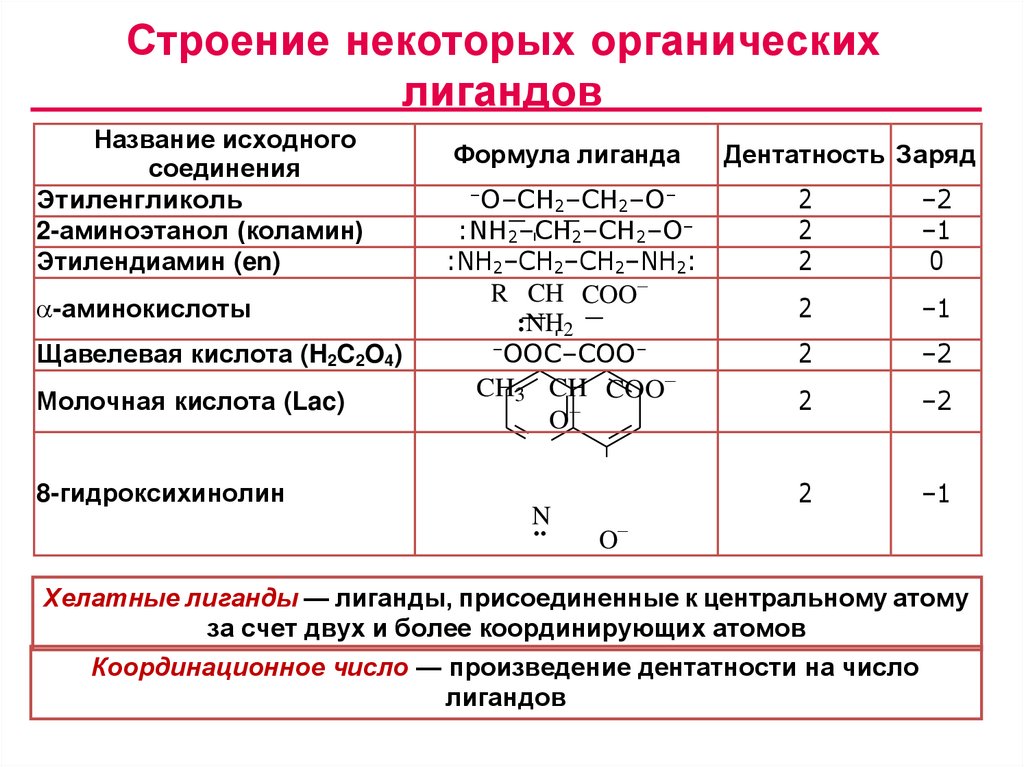
Строение некоторых органическихлигандов
Название исходного
соединения
Этиленгликоль
2-аминоэтанол (коламин)
Этилендиамин (en)
-аминокислоты
Щавелевая кислота (H2C2O4)
Молочная кислота (Lac)
8-гидроксихинолин
Формула лиганда
–O–CH –CH –O–
2
2
:NH2–CH2–CH2–O–
:NH2–CH2–CH2–NH2:
R CH COO
:NH2
–OOC–COO–
CH3 CH COO
O
N
..
Дентатность Заряд
2
2
2
–2
–1
0
2
–1
2
–2
2
–2
2
–1
O
Хелатные лиганды — лиганды, присоединенные к центральному атому
за счет двух и более координирующих атомов
Координационное число — произведение дентатности на число
лигандов
11.
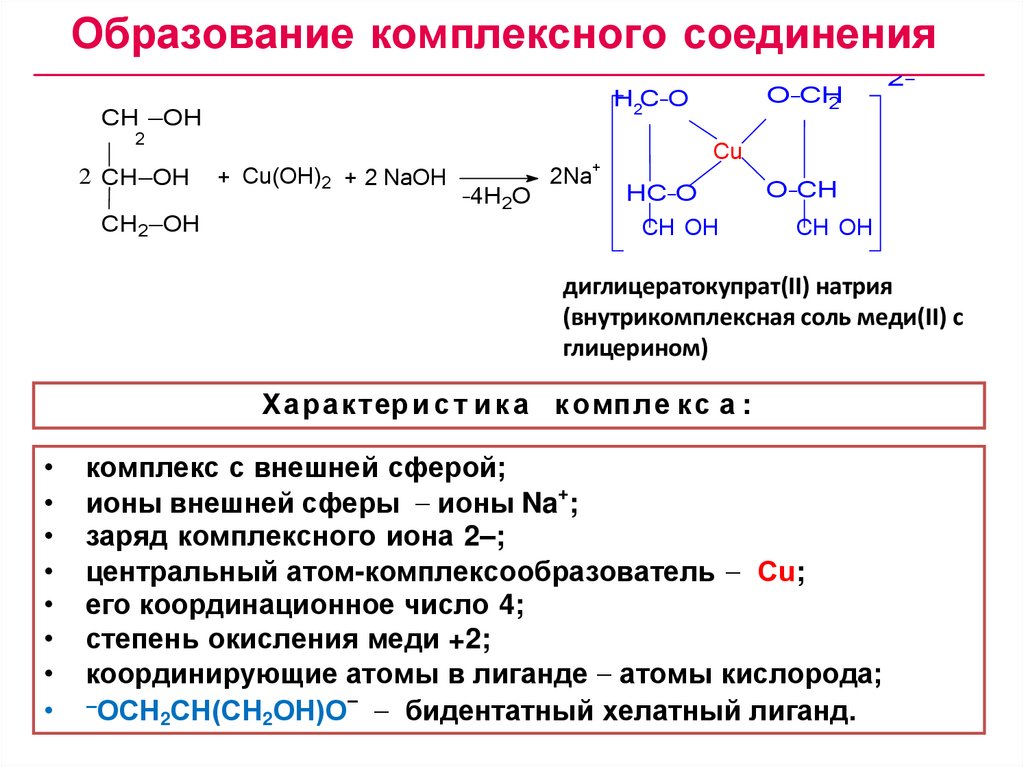
Образование комплексного соединенияCH —OH
2
2 CH—OH
CH2—OH
O–CH
2
H2C–O
+ Cu(OH)2 + 2 NaOH
Cu
+
–4H2O
2Na
2–
HC–O
CH OH
O–CH
CH OH
диглицератокупрат(II) натрия
(внутрикомплексная соль меди(II) с
глицерином)
меди(II) с глицерином)
Ха рак тер и с т и к а к омпл е кс а :
комплекс с внешней сферой;
ионы внешней сферы ионы Na+;
заряд комплексного иона 2–;
центральный атом-комплексообразователь Сu;
его координационное число 4;
степень окисления меди +2;
координирующие атомы в лиганде атомы кислорода;
–ОСН СН(СН ОН)О– бидентатный хелатный лиганд.
2
2
12.
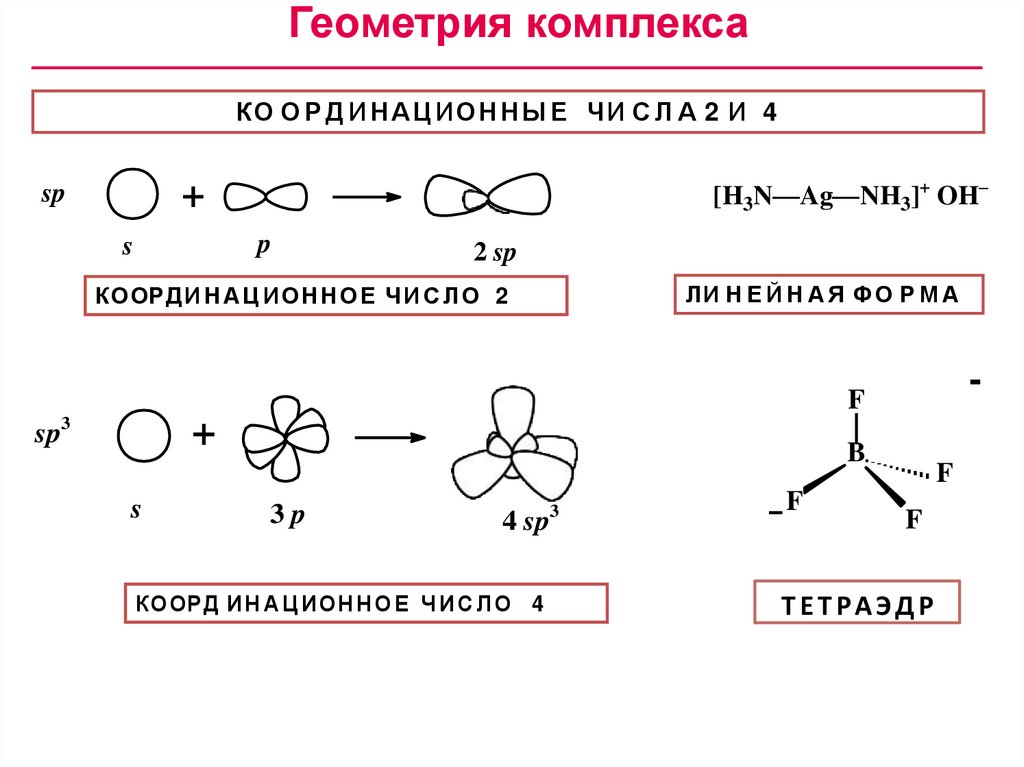
Геометрия комплексаКО О Р Д И Н А Ц ИОН Н Ы Е ЧИ С Л А 2 И 4
[H3N—Ag—NH3]+ OH–
+
sp
p
s
2 sp
ЛИ ëè
Н Еí Й
Ф О Р òóðà
МА
åéНí АàÿЯ ñòðóê
КООРДИ
Ц ИОН
Е Ч
И С2Л О 2
ê î î ðäèНíАàöè
î í í Нî åО÷è
ñëî
-
F
+
sp3
s
B
3p
3
4 sp
ê î î ðäè í àöè î í í î å ÷è ñëî 4
КООР Д И Н А Ц ИОН Н О Е Ч И С Л О 4
F
F
òåòðàýäð
Т Е Т РА Э Д Р
F
13.
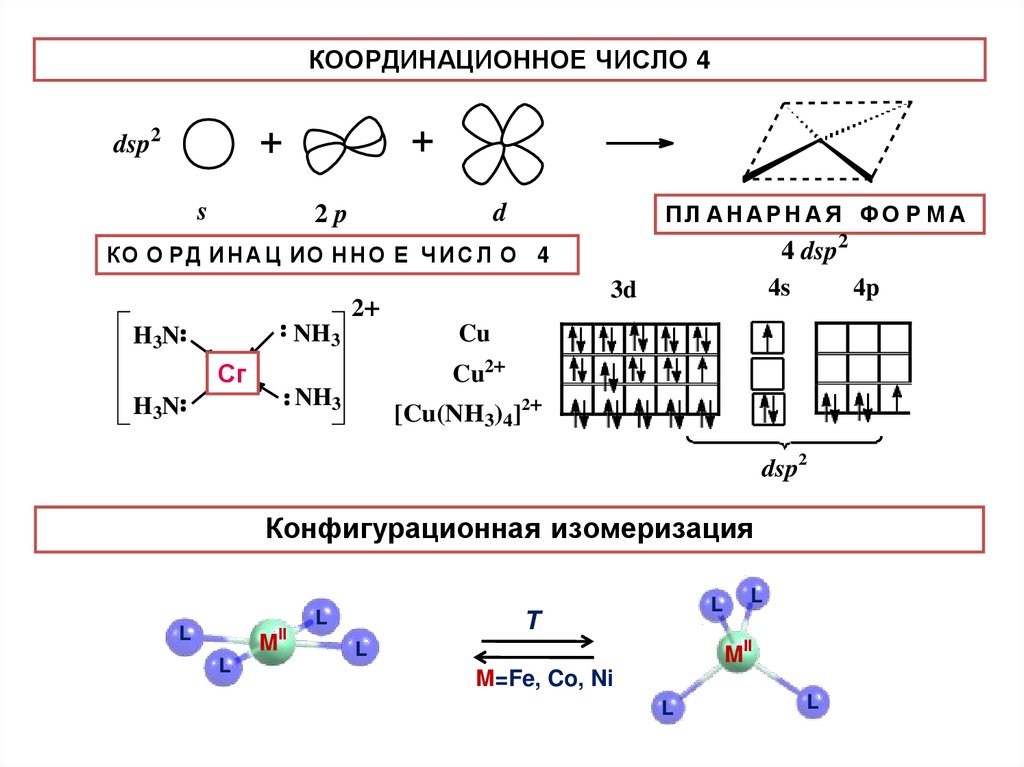
КООРДИНАЦИОННОЕ ЧИСЛО 4+
+
dsp2
ПЛ А Н А РêНâàäðàò
А Я ФО Р М А
s
d
2p
í îНåН÷è
КОêОî îРðäè
Д ИíНàöè
А Цî Иí О
О ñëî
Е Ч4И С Л О 4
4s
3d
2+
4p
Cu
NH3
H3N
4 dsp2
Ñu
Сг
Cu2+
NH3
H3N
[Cu(NH3)4]2+
dsp2
Конфигурационная изомеризация
L
M
L
II
L
L
T
L
MII
L
M=Fe, Co, Ni
L
L
14.
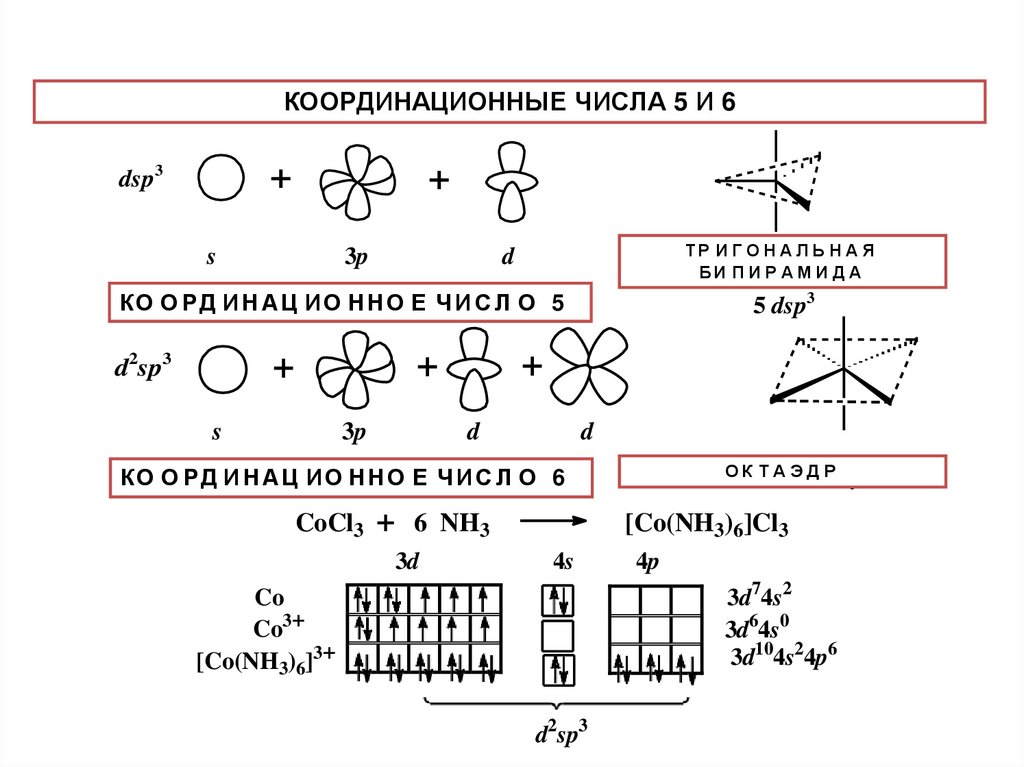
КООРДИНАЦИОННЫЕ ЧИСЛА 5 И 6+
dsp3
+
s
3p
ИГО
А Я è äà
òðè ãî íТ Рàëüí
àÿН АáèЛïЬèНðàì
d
БИ П И Р А М И Д А
КО О РД
Н Аí Цàöè
ИО
Ч И5С Л О 5
ê î îИðäè
î í Нí Н
î åО÷èЕñëî
+
+
+
d2sp3
s
3p
5 dsp3
d
d
О К Т А Эî Д
ê Рòàýäð
КОê О
АЦ
Нñëî
О Е 6Ч И С Л О 6
î î РД
ðäèИí Н
àöè
î í ИО
í î åН÷è
CoCl3 + 6 NH3
3d
[Co(NH3)6]Cl3
4s
3d74s2
3d64s0
3d104s24p6
Co
Co3+
[Co(NH3)6]3+
d2sp3
4p
d2sp3
15.
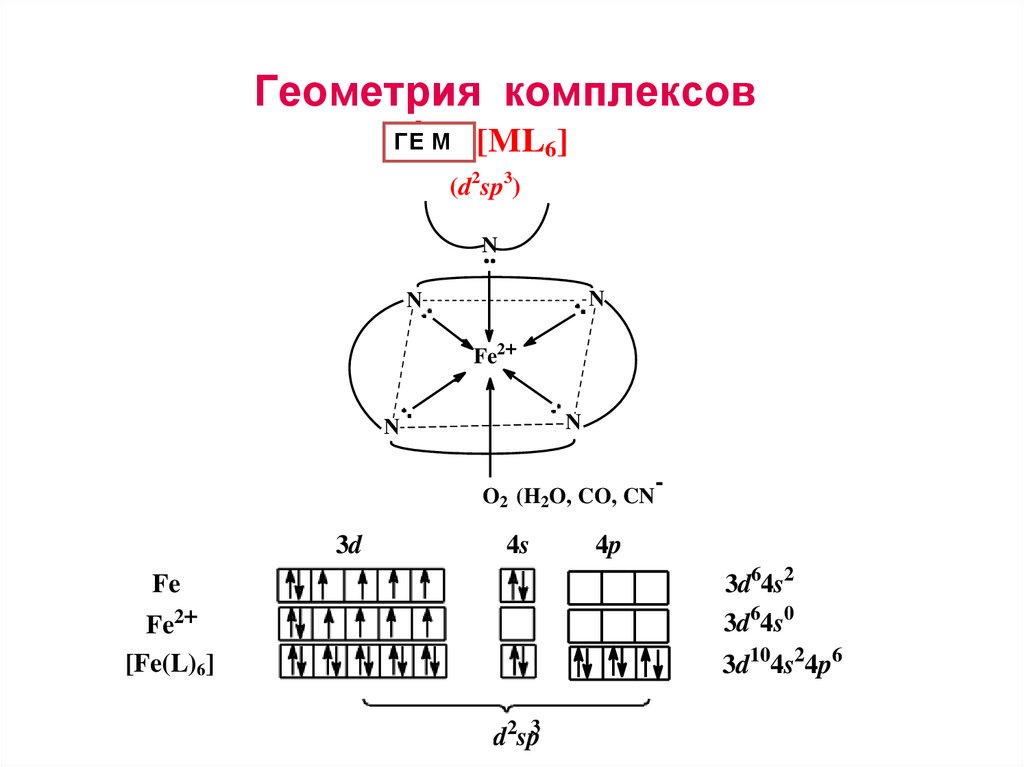
Геометрия комплексовГЕ
ÒèМï
[ML6]
(d2sp3)
N
N
N
Fe2+
N
N
Геометрия комплексов
O (H O, CO, CN
2
3d
3d
4s
2
4s
Fe
Fe
2+
Fe 2+
Fe
[Fe(L)6]
d2sp3
4p
4p
3d64s62 2
3d 4s
6 0
3d 4s6 0
3d 4s
3d104s24p6
16.
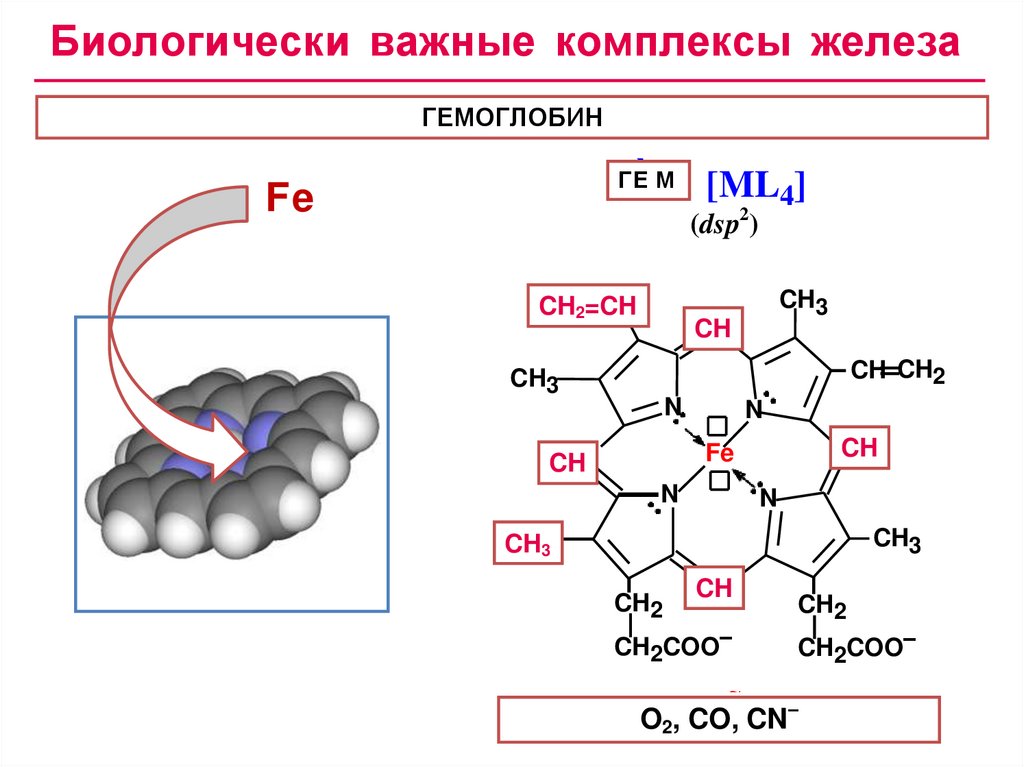
Биологически важные комплексы железаГЕМОГЛОБИН
Òè ï [ML4]
ГЕ М
Fe
(dsp2)
ÑÍ
ÑÍ 22=CH
CH
CH3
ÑÍ
CH
CH CH2
CH3
N
ÑÍ
CH
N
CH
ÑÍ
Fe
N
N
CÍ 33
CH
CH3
CH2
ÑÍ
CH
CH2COO–
CH2
CH2COO–
Ãåì
O2, CO,
CN–
17.
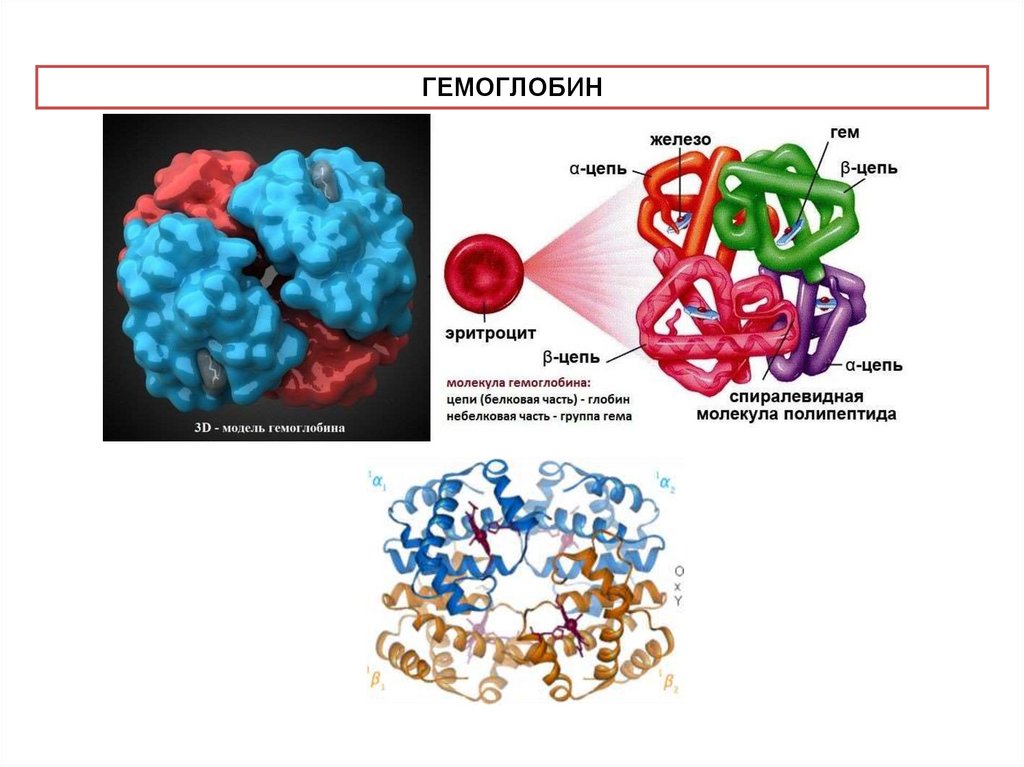
ГЕМОГЛОБИН18.
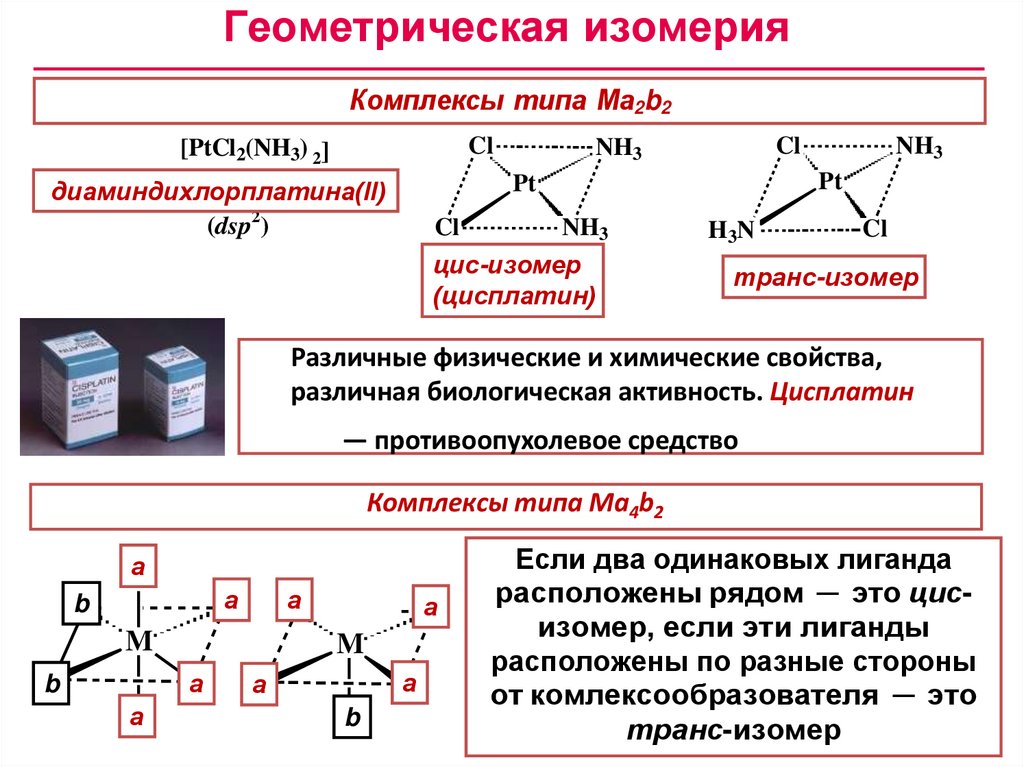
Геометрическая изомерияКомплексы типа Ма2b2
Cl
[PtCl2(NH3) 2]
диаминдихлорплатина(II)
äè àì ì è í äè õëî ðï ëàòè í à(II)
(dsp2)
Cl
NH3
NH3
Pt
Pt
Cl
NH3
öèñ-è çî ì åð
цис-изомер
(öè ñï ëàòè í )
(цисплатин)
Cl
H3N
ò ðàí ñ-è çî ì åð
транс-изомер
Различные физические и химические свойства,
различная биологическая активность. Цисплатин
— противоопухолевое средство
Комплексы типа Ма4b2
а
а
b
а
M
M
а
b
а
а
а
а
b
Если два одинаковых лиганда
расположены рядом ─ это цисизомер, если эти лиганды
расположены по разные стороны
от комлексообразователя ─ это
транс-изомер
19.
Равновесие в растворах• Первичная диссоциация
— для комплекса с внешней сферой как сильного электролита
(по данным электропроводности)
[Cu(NH3)4]2+ SO42– [Cu(NH3)4]2+
+
SO42–
• Вторичная диссоциация
— комплексного иона как слабого электролита
(по данным электропроводности)
— характеризуется константой нестойкости (Кнест)
Ступенчатая диссоциация
[Cu(NH3)4]2+ D [Cu(NH3)3]2+ + NH3
[Cu(NH3)3]2+ D [Cu(NH3)2]2+ + NH3
[Cu(NH3)2]2+ D [CuNH3]2+ + NH3
[CuNH3]2+ D Cu2+ + NH3
K1
K2
K3
K4
20.
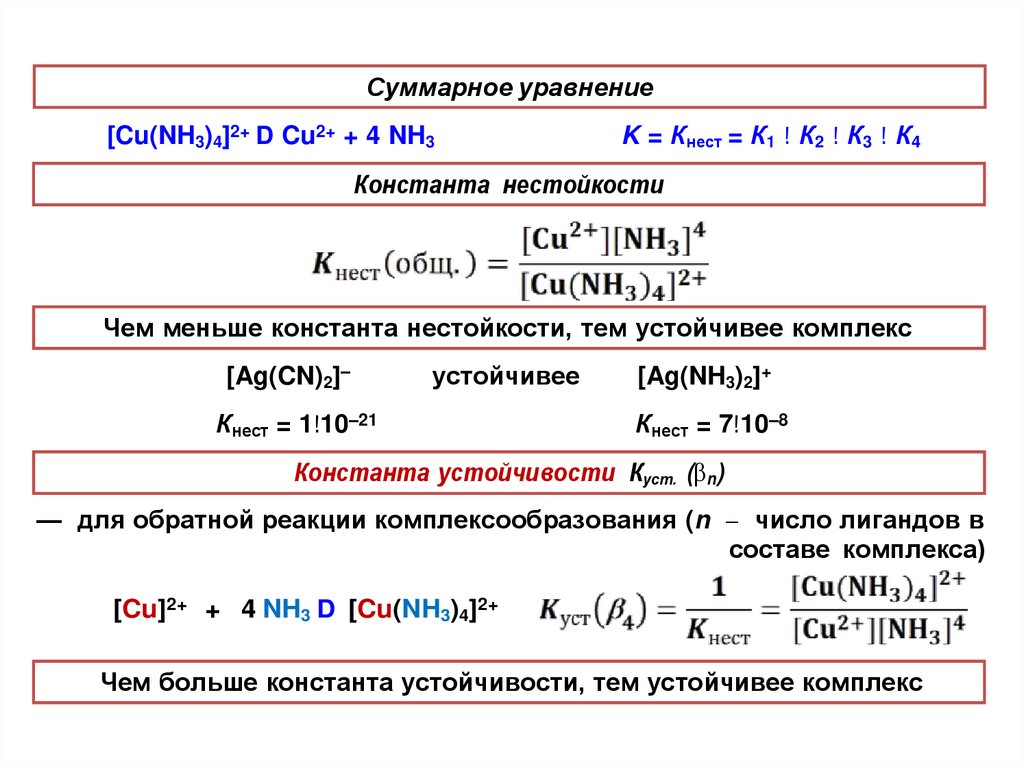
Суммарное уравнение[Cu(NH3)4]2+ D Cu2+ + 4 NH3
K = Кнест = К1 ! К2 ! К3 ! К4
Константа нестойкости
Чем меньше константа нестойкости, тем устойчивее комплекс
[Ag(CN)2]–
устойчивее
Кнест = 1!10–21
[Ag(NH3)2]+
Кнест = 7!10–8
Константа устойчивости Куст. ( n)
— для обратной реакции комплексообразования (n число лигандов в
составе комплекса)
[Cu]2+ + 4 NH3 D [Cu(NH3)4]2+
Чем больше константа устойчивости, тем устойчивее комплекс
21.
Хелатный эффектКомплекс или
комплексный ион
Cu(NH3)4 2+
Название
=
Êуст.
K
óñò.
Тетраамминмедь(II)
[MLn]
[M]•[L]n
1•10 12
Диэтилендиаминомедь(II)
1.6•10 20
Гемоцианины
1•10 29
Cu(Гли) 2
Диглицинатомедь(II)
2•10 15
CuЭДТА 2–
Этилендиаминтетраацетатомедь(II)
6•10 18
Cu(en)22+
CuHc
en — этилендиамин H2NCH2CH2NH2,
CuHc — гемоцианины (медьсодержащие белки),
Гли — глицин,
ЭДТА — (HOOCCH2)2NCH2CH2N(CH2COOH)2
Хелатные, особенно полидентатные лиганды, повышают устойчивость
комплексов
22.
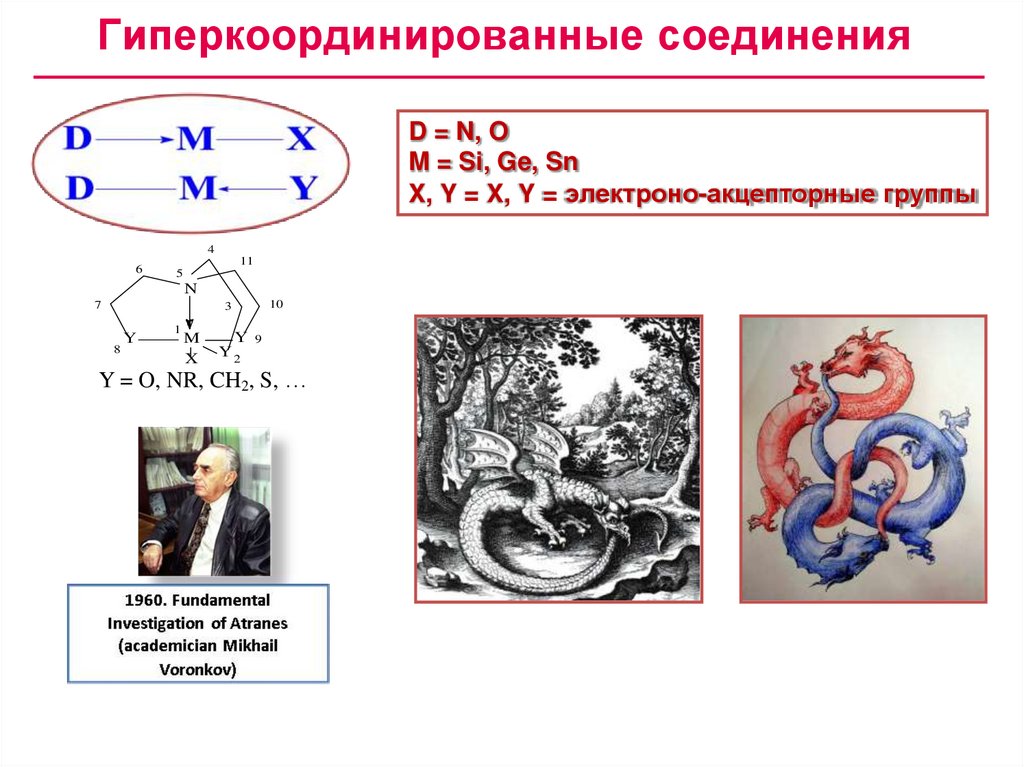
Гиперкоординированные соединенияD = N, O
M = Si, Ge, Sn
X, Y = X, Y = электроно-акцепторные группы
4
6
11
5
N
7
3
8
Y
1
M
X
10
Y 9
Y2
Y = O, NR, CH2, S, …
23.
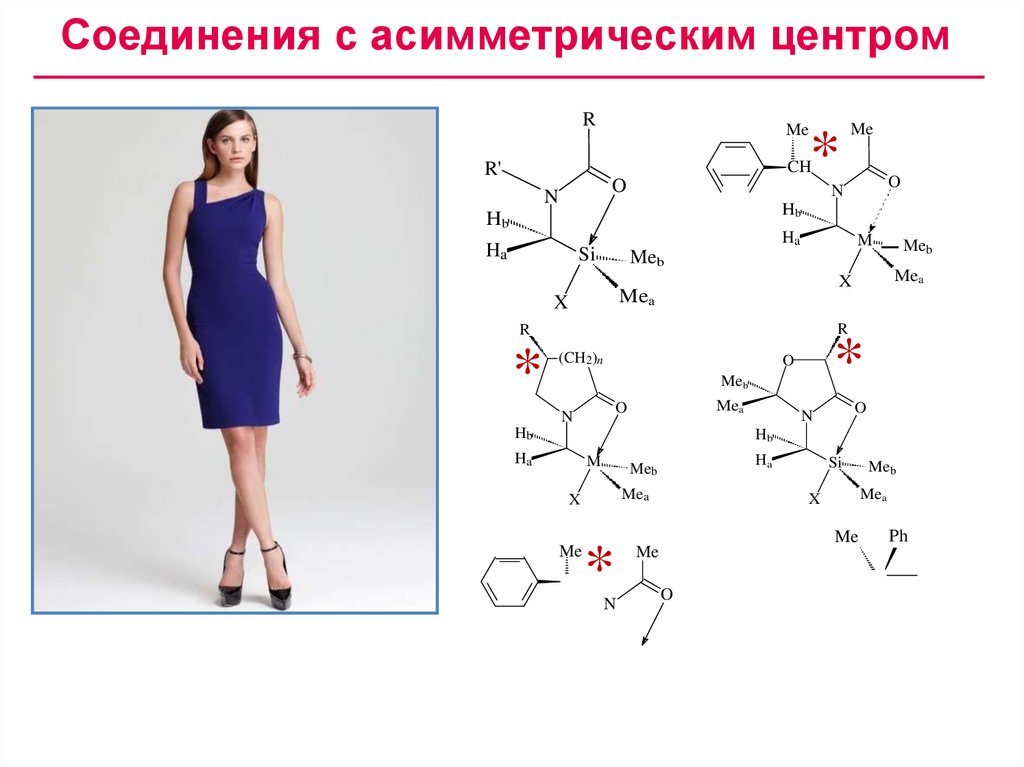
Соединения с асимметрическим центромR
Me
*
Me
CH
R'
O
N
Hb
Hb
Ha
Ha
Si
M
Meb
Meb
Mea
X
Mea
X
R
R
*
O
N
(CH2)n
*
O
Meb
Mea
O
N
Hb
O
N
Hb
Ha
M
Mea
X
Me
Ha
Meb
*
N
Si
Mea
X
Me
Me
O
Meb
Ph
24.
25.
Равновесия твердое тело- растворРастворимость (S) — количество вещества (моль), которое
можно растворить в 1 кг растворителя (в 1 л водного раствора)
BaSO4 (т) D Ba2+(aq) + SO42–(aq)
V =V
Составьте уравнение действующих масс для
представленного гетерогенного равновесия
AgCl (т) D Ag+(aq) + Cl–(aq)
26.
При постоянной Т и в отсутствие посторонних веществ:AmBn (т) D mAn+ + nBm– КПР = [An+]m [Bm–]n = const
Для бинарного
S [Ba2+] = [SO42–]; КПР = S2; [Ba2+] = [SO42–] =
электролита:
ÊКÏПР
Ð
Распространенность химических элементов в живых
организмах зависит от растворимости их соединений в
воде и способности образовывать комплексы с
биолигандами
С М Е ЩЕ Н И Е ИО Н Н О Г О ГЕ Т Е Р О ГЕ Н Н О ГО РА В Н ОВ ЕС И Я
•Условие образования осадка:
КПР(экс) > КПР(табл) (перенасыщенный раствор)
•Условие растворения осадка:
КПР(экс) = КПР(табл) (насыщенный раствор)
КПР(экс) < КПР(табл) (ненасыщенный раствор)
27.
Замена Ca2+ в кости на Be2+ или Sr2+ вызывает бериллиевыйрахит (бериллиоз, размягчение костей) и стронциевый рахит
(ломкость костей)
28.
Пример 4.3Выпадет ли осадок BaCO3 при сливании равных объемов
0.001 М растворов BaCl2 и K2CO3 (KПР(BaCO3) = 5!10 9) ?
Решение
Ba2+(р-р) + CO32 (р-р)
BaCO3(т)
c(Ba2+) c(CO3 2 ) = (0.001/2) (0.001/2) = 2.5!10 7 > K ПР
(равные объемы !!!)
Осадок выпадает
29.
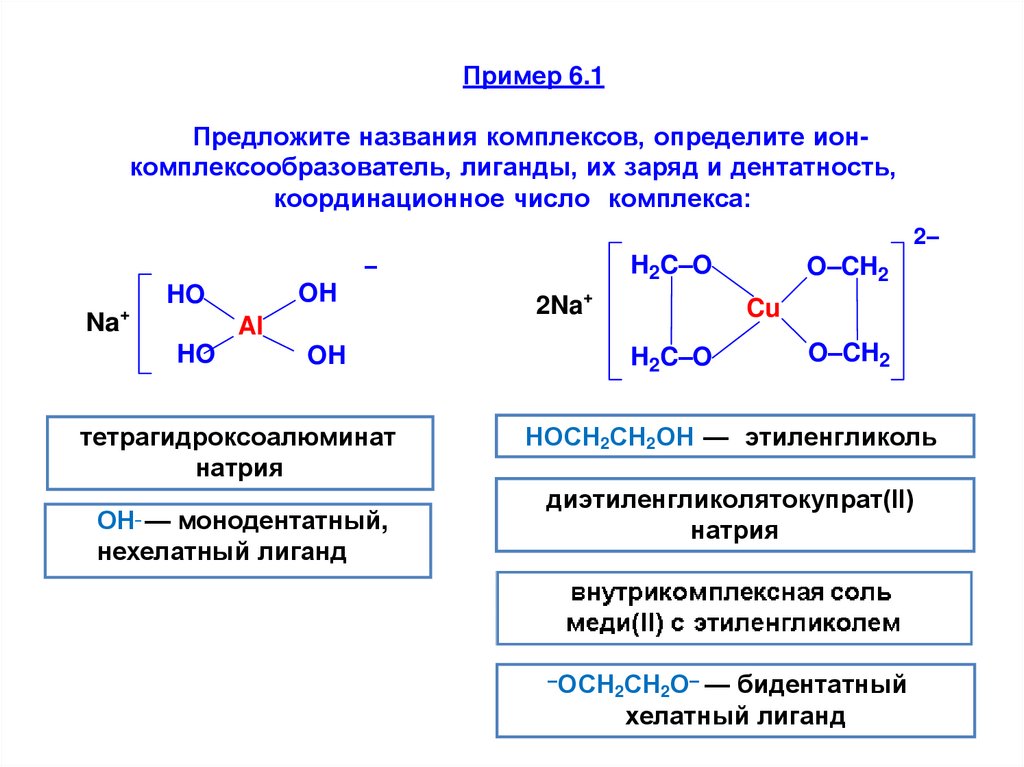
Пример 6.1Предложите названия комплексов, определите ионкомплексообразователь, лиганды, их заряд и дентатность,
координационное число комплекса:
2–
–
Na
OH
HO
+
Al
HO
OH
тетрагидроксоалюминат
натрия
ОН — монодентатный,
нехелатный лиганд
–
H2C–O
2Na+
O–CH2
Cu
H2C–O
O–CH2
НОСН2СН2ОН — этиленгликоль
диэтиленгликолятокупрат(II)
натрия
–ОСН СН О– — бидентатный
2
2
хелатный лиганд
30.
31.
32.
33.
В результате проведенной работы я составила пособие дляподробного изучения комплексных соединений и подобрала задания
ЕГЭ по данной теме.
34.
1. КОМПЛЕКСНЫЕ (КООРДИНАЦИОННЫЕ) СОЕДИНЕНИЯ: учебно-методическое пособие/Гаджиев О.Б. – Нижний Новгород: Нижегородский государственный университет, 2016. –
33 с.
2. Физико-химические основы применения координационных соединений : [учеб.
пособие] / л. к. Неудачина, н. в. Лакиза ; М-во образования и науки рос. Федерации,
урал. федер. ун-т. — Екатеринбург : изд-во Урал. ун-та, 2014. — 124 с.
3. Неорганическая химия в уравнениях реакций: учебное пособие/ Ж.А. Кочкаров.- Ростов
н/Д: Феникс, 2017.- 412,[3] с.- (Высшее образование)
4. Глинка Н.Л. Общая химия: Учебное пособие для вузов.- 21-е изд., стереотипное/Под ред.
Рабиновича В.А. / Н.Л. Глинка. — Ленинград: Химия, 1980. — 720 с.
5. Начала химии: для поступающих в вузы/ Н.Е. Кузьменко, В.В. Еремин, В.А. Попков.- 17
изд.- Москва: Лаборатория знаний, 2017.- 704 с.
6. Общая химия. Лабораторный практикум: учебное пособие/ Н.В. Коровин, В.К.
Камышова, Е.Я. Удрис; под общ. Ред. Н.В. Коровина.- Москва: КНОРУС, 2015.- 336 с
7. 100 баллов по химии. Полный курс для поступающих в вузы: учебное пособие/ И.Ю.
Белавин [и др.]; под ред. В.В. Негребецкого.- 2-е изд.- Москва: Лаборатория знаний,
2019.- 480 с.
8. Справочник школьника по химии: 8-11 кл./ Е.А. Еремина, В.В. Еремен, Н.Е. Кузьменко. —
Москва: изд-во Дрофа, 1996. — 208 с.















 chemistry
chemistry








