Similar presentations:
Иммунотерапия и таргетные препараты при колоректальном раке
1. Иммунотерапия и таргетные препараты при колоректальном раке.
Министерство науки и высшего образованияНовосибирский государственный университет
Институт медицины и медицинских технологий
Центр постдипломного медицинского образования
ИММУНОТЕРАПИЯ И ТАРГЕТНЫЕ
ПРЕПАРАТЫ ПРИ
КОЛОРЕКТАЛЬНОМ РАКЕ.
• PD-1/PD-L1, MSI-H опухоли.
• Моноклональные антитела
(бевацизумаб, цетуксимаб).
Бостриков Кирилл Игоревич
• Перспективы исследований.
Научный руководитель:
М. Ю. Денисов
д.м.н., профессор
Новосибирск
2025
2. PD-1/PD-L1 опухоли
PD-1/PD-L1 ОПУХОЛИPD-1(белок
запрограммированной
клеточной гибели-1):
• трансмембранный белок
• рецептор
• три домена
• экспрессируется на
активированных CD4+ и
CD8+ Т-лимфоцитах, Влимфоцитах, дендритных
клетках и NK
Рис. 1. Структура рецептора PD-1.
ITIM — иммунорецепторный тирозиновый ингибирующий мотив;
ITSM — мотив переключения иммунорецептора
на основе тирозина.
По материалам : Падерина А.С., Валиев Т.Т. Применение
ингибиторов PD-1 и PD-L1 в детской гематологии: обзор
литературы. Педиатрическая фармакология. 2024;21(3):240–248.
doi: https://doi.org/10.15690/pf.v21i3.2751
3. PD-1/PD-L1 опухоли
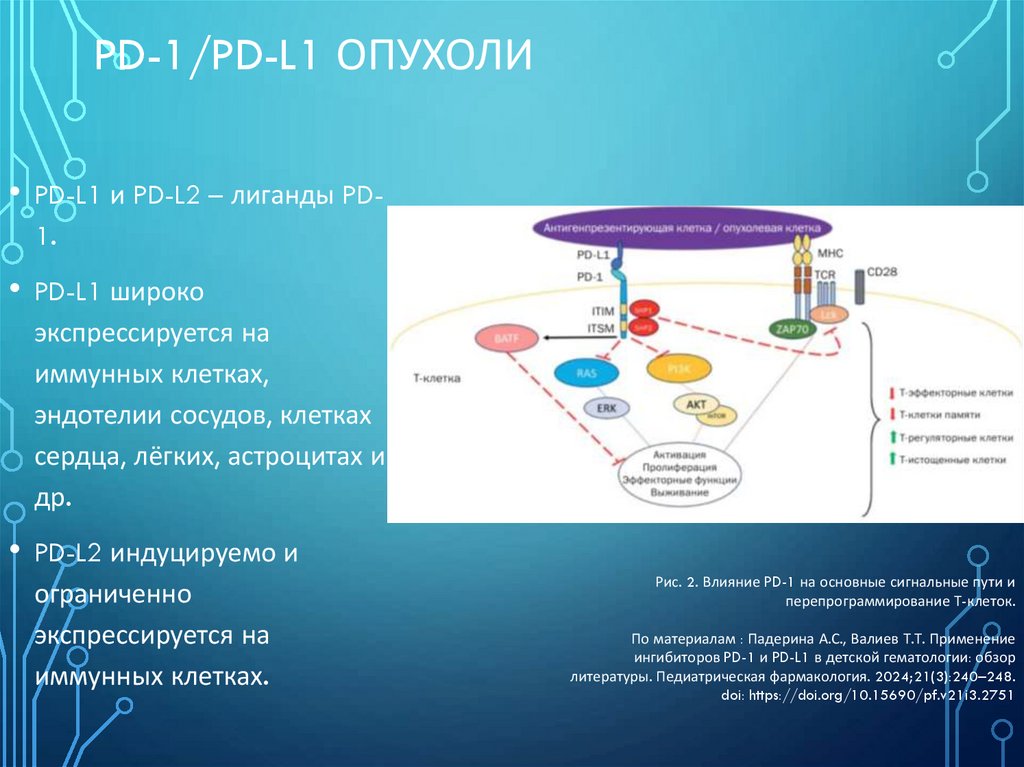
PD-1/PD-L1 ОПУХОЛИ• PD-L1 и PD-L2 – лиганды PD1.
• PD-L1 широко
экспрессируется на
иммунных клетках,
эндотелии сосудов, клетках
сердца, лёгких, астроцитах и
др.
• PD-L2 индуцируемо и
ограниченно
экспрессируется на
иммунных клетках.
Рис. 2. Влияние PD-1 на основные сигнальные пути и
перепрограммирование Т-клеток.
По материалам : Падерина А.С., Валиев Т.Т. Применение
ингибиторов PD-1 и PD-L1 в детской гематологии: обзор
литературы. Педиатрическая фармакология. 2024;21(3):240–248.
doi: https://doi.org/10.15690/pf.v21i3.2751
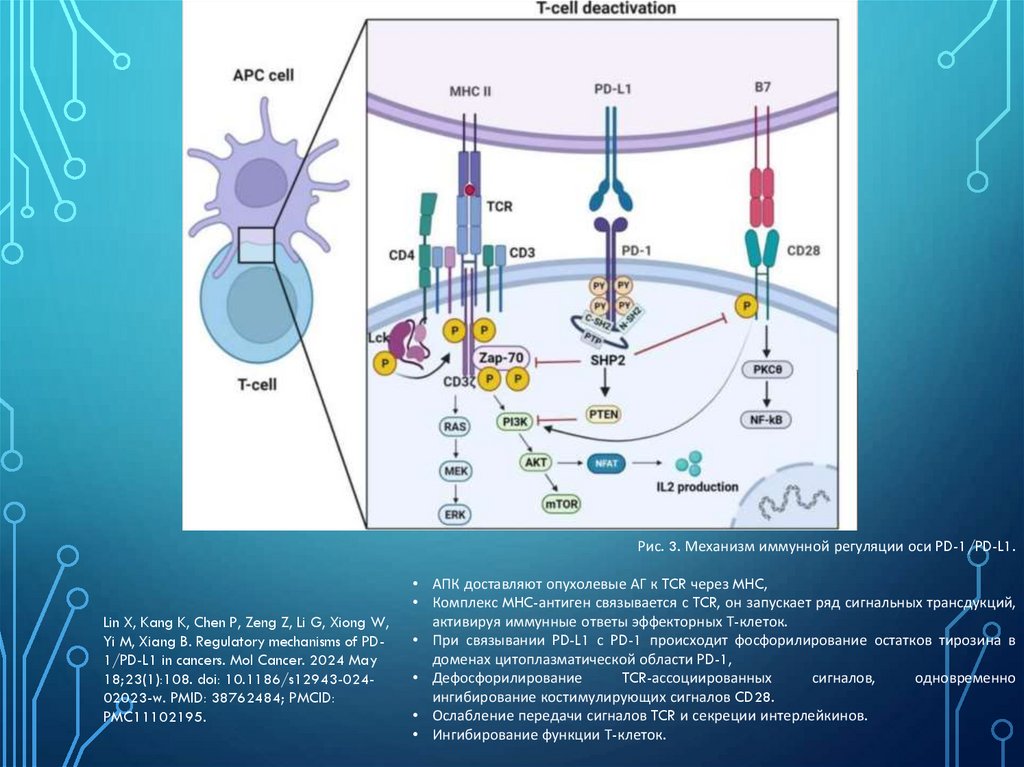
4.
Рис. 3. Механизм иммунной регуляции оси PD-1/PD-L1.Lin X, Kang K, Chen P, Zeng Z, Li G, Xiong W,
Yi M, Xiang B. Regulatory mechanisms of PD1/PD-L1 in cancers. Mol Cancer. 2024 May
18;23(1):108. doi: 10.1186/s12943-02402023-w. PMID: 38762484; PMCID:
PMC11102195.
• АПК доставляют опухолевые АГ к TCR через MHC,
• Комплекс MHC-антиген связывается с TCR, он запускает ряд сигнальных трансдукций,
активируя иммунные ответы эффекторных Т-клеток.
• При связывании PD-L1 с PD-1 происходит фосфорилирование остатков тирозина в
доменах цитоплазматической области PD-1,
• Дефосфорилирование
TCR-ассоциированных
сигналов,
одновременно
ингибирование костимулирующих сигналов CD28.
• Ослабление передачи сигналов TCR и секреции интерлейкинов.
• Ингибирование функции Т-клеток.
5.
PD-1+PD-L1Опухолевые клетки способны крайне интенсивно
экспрессировать PD-L1.
«Истощает» Т-клетки, индуцирует образование Т-reg.
В биоптате опухоли выявляется экспрессия PD-1 в
инфильтрирующих опухоль лимфоцитах (tumourinfiltrating lymphocytes;
TIL).
Снижение активации Т-лимфцитов и их апоптоз.
Истощённые Т-клетки экспрессируют иные виды
ингибирующих рецепторов.
Ткани опухоли инфильтрируются
иммуносупрессивными Treg-клетками.
Основа поддержания иммунного гомеостаза.
Предотвращение аутоиммунных реакций, за счет
ингибирования активации Т-клеток.
Ускользание опухоли от иммунного надзора.
Рост и отдалённое mts.
6.
• PD-1+PD-L1- иммунные контрольные точки (ИКТ).• Путём воздействия на ИКТ можно модулировать и
возвращать противоопухолевый иммунный ответ.
• Воздействие – моноклональные антитела.
• Экспрессия PD-L1 – предиктор эффективности иИКТ.
• Блокадная терапия PD-1/PD-L1 является основой
современной иммунотерапии опухолей
Lin X, Kang K, Chen P, Zeng Z, Li G, Xiong W, Yi M, Xiang B. Regulatory mechanisms of PD-1/PD-L1 in cancers.
Mol Cancer. 2024 May 18;23(1):108. doi: 10.1186/s12943-024-02023-w. PMID: 38762484; PMCID:
PMC11102195.
7. MSI-H опухоли
MSI-H ОПУХОЛИMSI-H (microsatellite instability high) - микросателлитная
нестабильность высокой степени.
Вызвана дефектом системы восстановления несоответствия ДНК
(MMRd).
MSI-H приводит к высокой мутационной нагрузке опухоли (ТМВ) экспрессии опухолевого антигена – усилению активации
противоопухолевых Т-клеток.
Lin X, Kang K, Chen P, Zeng Z, Li G, Xiong W, Yi M, Xiang B. Regulatory mechanisms of PD-1/PD-L1 in cancers. Mol Cancer. 2024 May
18;23(1):108. doi: 10.1186/s12943-024-02023-w. PMID: 38762484; PMCID: PMC11102195.
8.
• Пациенты с опухолями с высокой микросателлитнойнестабильностью получают недостаточный эффект
от неоадъювантной химиолучевой терапии или
неоадъювантной химиотерапии.
• Решение – неоадъювантная иммунотерапия.
Zhang X, Wu T, Cai X, Dong J, Xia C, Zhou Y, Ding R, Yang R, Tan J, Zhang L, Zhang Y, Wang Y, Dong C, Li Y.
Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled
Opportunities. Front Immunol. 2022 Mar 17;13:795972. doi: 10.3389/fimmu.2022.795972.
9.
• Неоадъювантная ИТ (НИТ) индуцирует экспансию Тклеток и приводит к восстановлению функции Т-клеток.• Повышенный уровень опухолевых антигенов в
первичной опухоли активирует Т клетки.
• НИТ позволяет уничтожать опухолевые клетки, устранять
микрометастазы, способствовать предоперационному
уменьшению опухоли, улучшать показатели резекции и
ремиссии, а также снижать частоту послеоперационных
рецидивов
Zhang X, Wu T, Cai X, Dong J, Xia C, Zhou Y, Ding R, Yang R, Tan J, Zhang L, Zhang Y, Wang Y, Dong C, Li Y.
Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled
Opportunities. Front Immunol. 2022 Mar 17;13:795972. doi: 10.3389/fimmu.2022.795972.
10.
• НИТ позволяет применять органосохраняющуюстратегию в лечении колоректального рака.
• НИТ снижает риск дисфункции анального сфинктера,
сексуальной дисфункции и дисфункции мочевого
пузыря.
Zhang X, Wu T, Cai X, Dong J, Xia C, Zhou Y, Ding R, Yang R, Tan J, Zhang L, Zhang Y, Wang Y, Dong C, Li Y.
Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled
Opportunities. Front Immunol. 2022 Mar 17;13:795972. doi: 10.3389/fimmu.2022.795972.
11. Бевацизумаб
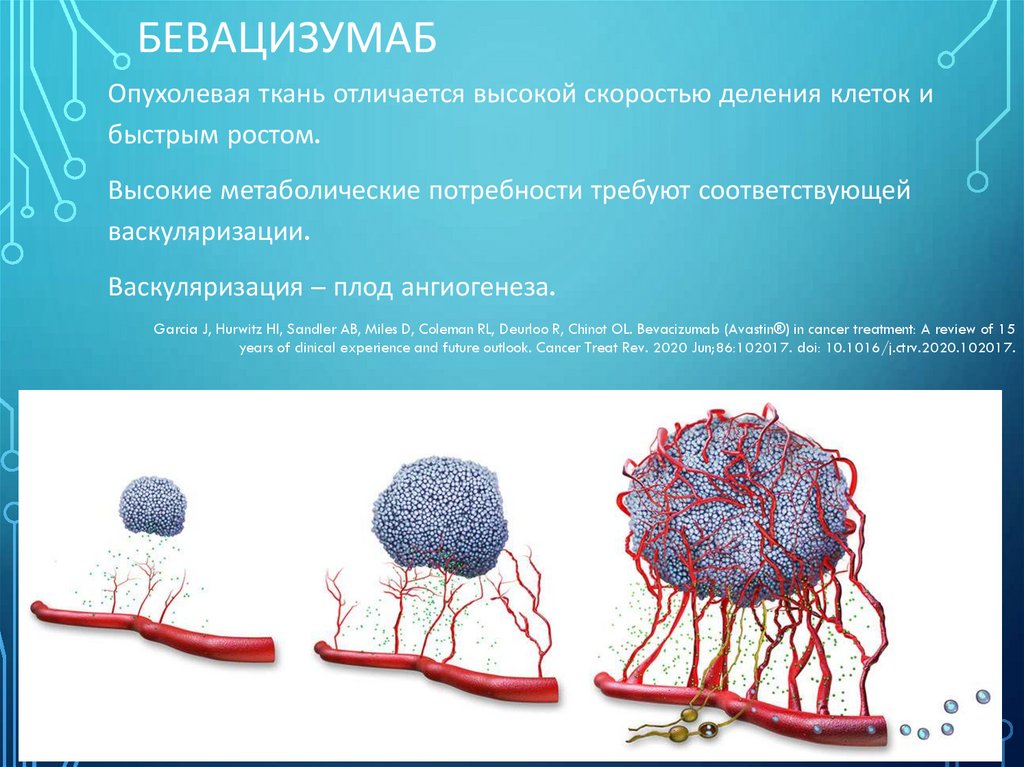
БЕВАЦИЗУМАБОпухолевая ткань отличается высокой скоростью деления клеток и
быстрым ростом.
Высокие метаболические потребности требуют соответствующей
васкуляризации.
Васкуляризация – плод ангиогенеза.
Garcia J, Hurwitz HI, Sandler AB, Miles D, Coleman RL, Deurloo R, Chinot OL. Bevacizumab (Avastin®) in cancer treatment: A review of 15
years of clinical experience and future outlook. Cancer Treat Rev. 2020 Jun;86:102017. doi: 10.1016/j.ctrv.2020.102017.
12. Бевацизумаб
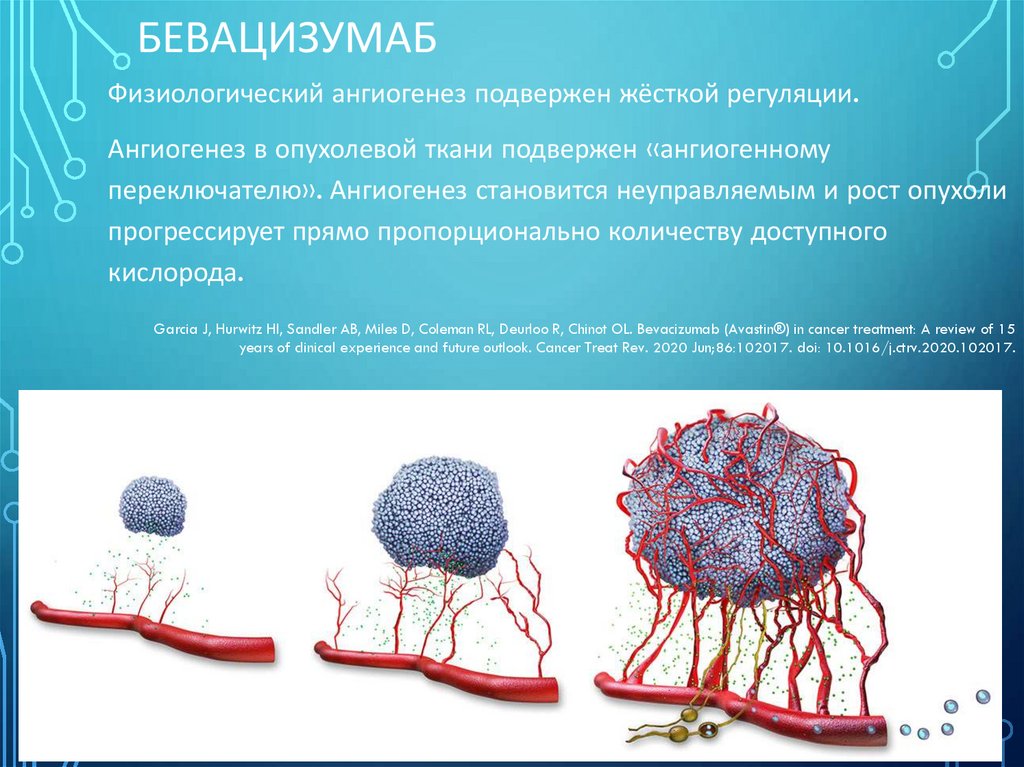
БЕВАЦИЗУМАБФизиологический ангиогенез подвержен жёсткой регуляции.
Ангиогенез в опухолевой ткани подвержен «ангиогенному
переключателю». Ангиогенез становится неуправляемым и рост опухоли
прогрессирует прямо пропорционально количеству доступного
кислорода.
Garcia J, Hurwitz HI, Sandler AB, Miles D, Coleman RL, Deurloo R, Chinot OL. Bevacizumab (Avastin®) in cancer treatment: A review of 15
years of clinical experience and future outlook. Cancer Treat Rev. 2020 Jun;86:102017. doi: 10.1016/j.ctrv.2020.102017.
13. Бевацизумаб
БЕВАЦИЗУМАБКлючевые факторы индуцирования ангиогенеза опухоли - факторы роста
эндотелия сосудов (VEGF), в частности, VEGF-A.
VEGF:
• стимулируют пролиферацию и выживание эндотелиальных клеток
• увеличивают проницаемость сосудов
• поддерживают метаболические потребности растущей опухоли.
VEGF-A является терапевтической мишенью для ингибирования
ангиогенеза и нормализации сосудистой сети опухоли
Garcia J, Hurwitz HI, Sandler AB, Miles D, Coleman RL, Deurloo R, Chinot OL. Bevacizumab (Avastin®) in cancer treatment: A review of 15
years of clinical experience and future outlook. Cancer Treat Rev. 2020 Jun;86:102017. doi: 10.1016/j.ctrv.2020.102017.
14. Бевацизумаб
БЕВАЦИЗУМАББевацизумаб - моноклональное антитело, которое связывается с
изоформами VEGF-A, ингибируя активацию сигнальных путей VEGF,
способствующих неоваскуляризации.
Бевацизумаб подавляет рост сосудов, индуцирует регрессию новых
сосудов и ремоделирует сосудистую сеть, облегчая доставку
цитотоксической химиотерапии.
Garcia J, Hurwitz HI, Sandler AB, Miles D, Coleman RL, Deurloo R, Chinot OL. Bevacizumab (Avastin®) in cancer treatment: A review of 15
years of clinical experience and future outlook. Cancer Treat Rev. 2020 Jun;86:102017. doi: 10.1016/j.ctrv.2020.102017.
15. Бевацизумаб
БЕВАЦИЗУМАББевацизумаб является стандартной терапией при метастазирующем
колоректальном раке в сочетании с химиотерапией для индукции и в
качестве поддерживающей терапии
Garcia J, Hurwitz HI, Sandler AB, Miles D, Coleman RL, Deurloo R, Chinot OL. Bevacizumab (Avastin®) in cancer treatment: A review of 15
years of clinical experience and future outlook. Cancer Treat Rev. 2020 Jun;86:102017. doi: 10.1016/j.ctrv.2020.102017.
16. Цетуксимаб
ЦЕТУКСИМАБГен рецептора эпидермального фактора роста (EGFR) обычно
сверхэкспрессируется при колоректальном раке.
Цетуксимаб – моноклональное антитело к рецептору EGFR ингибирующее
пролиферацию раковых клеток, метастазирование и ангиогенез.
EGFR-сигнальный каскад тесно связан с фактором роста сосудистого
эндотелия (VEGF). Цетуксимаб широко блокирует продукцию VEGF и, как
следствие, неоангиогенез в опухоли.
Доброва Н.В. (к.м.н.)
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, Гематология и Радиология" №2












 medicine
medicine








