Similar presentations:
Железо и его соединения
1. Перевертыши
ЗОАТИМНЙЕКР
ЕЖОЗЕЛ
ЛЕРУОГД
РОАГН
2. Железо и его соединения 9 класс
3.
«Железо не только основа всего мира, самыйглавный металл окружающей нас природы,
оно основа культуры и промышленности,
оно орудие войны и мирного
труда. И
трудно во всей таблице Менделеева найти и
другой такой элемент,
который был бы
так связан с прошлыми, настоящими и
будущими судьбами человечества».
Ферсман А.Е.
4. План урока:
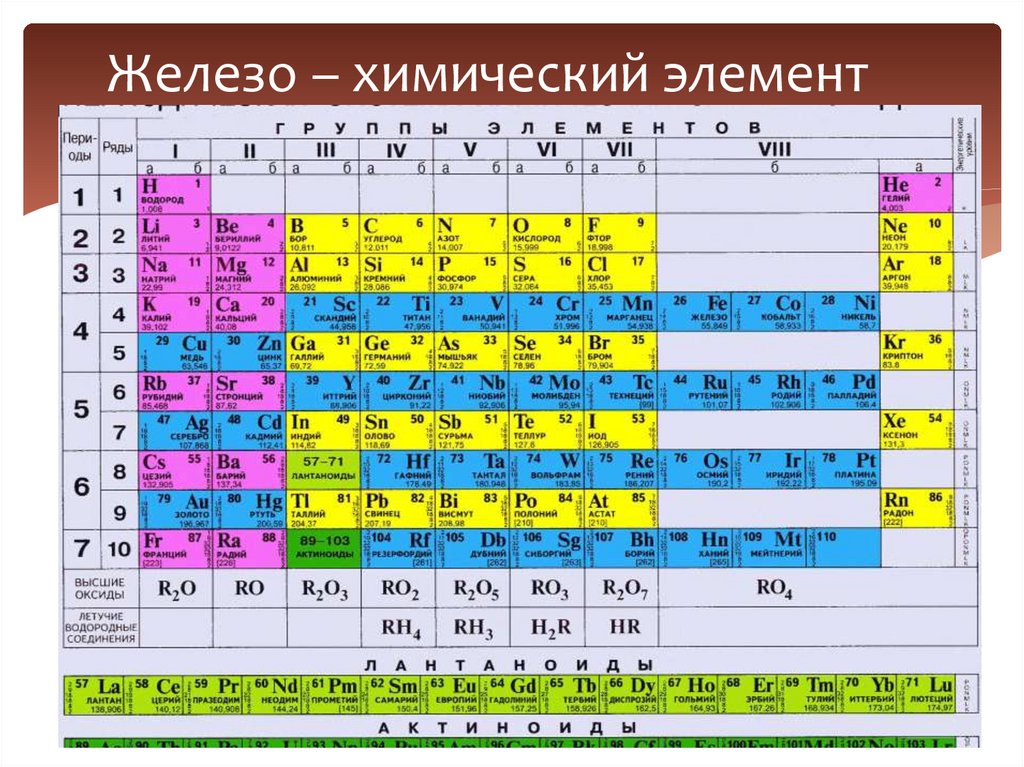
1. Железо – химический элемент (положениев ПСХЭ Д.И. Менделеева и строение
атома)
2. Железо – простое вещество (физические и
химические свойства)
3. Соединения железа
5. Железо – химический элемент
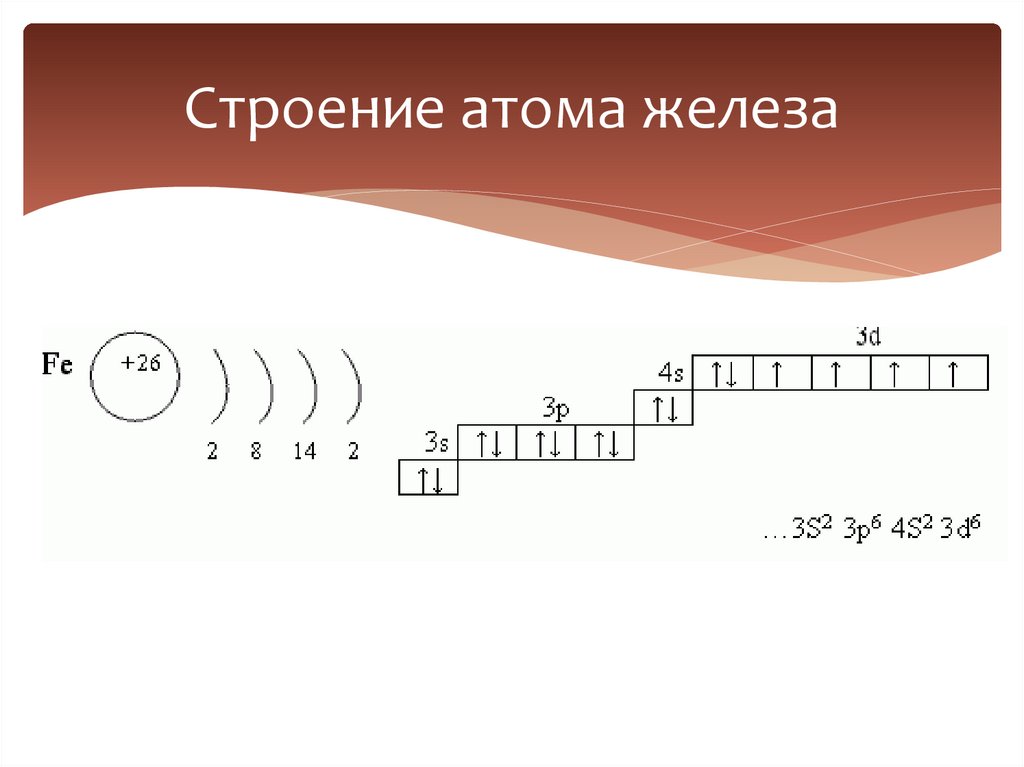
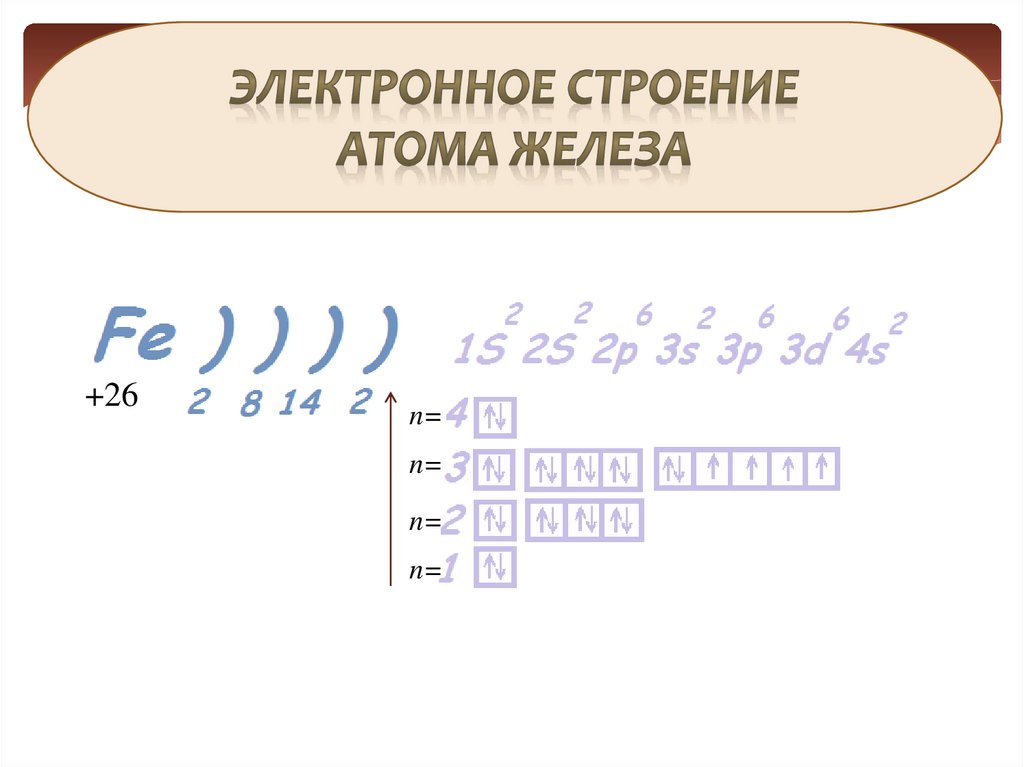
6. Строение атома железа
7.
+26n=
n=
n=
n=
8.
Нахождение в природеВ земной коре на долю железа приходится
около 4,1% массы земной коры (4-е место среди
всех элементов, 2-е среди металлов).
Известно большое число руд и минералов,
содержащих железо.
Оно бывает в виде различных соединений: оксидов,
гидроксидов и солей.
В свободном виде железо находят в метеоритах,
изредка встречается самородное железо (феррит) в
земной коре как продукт застывания магмы.
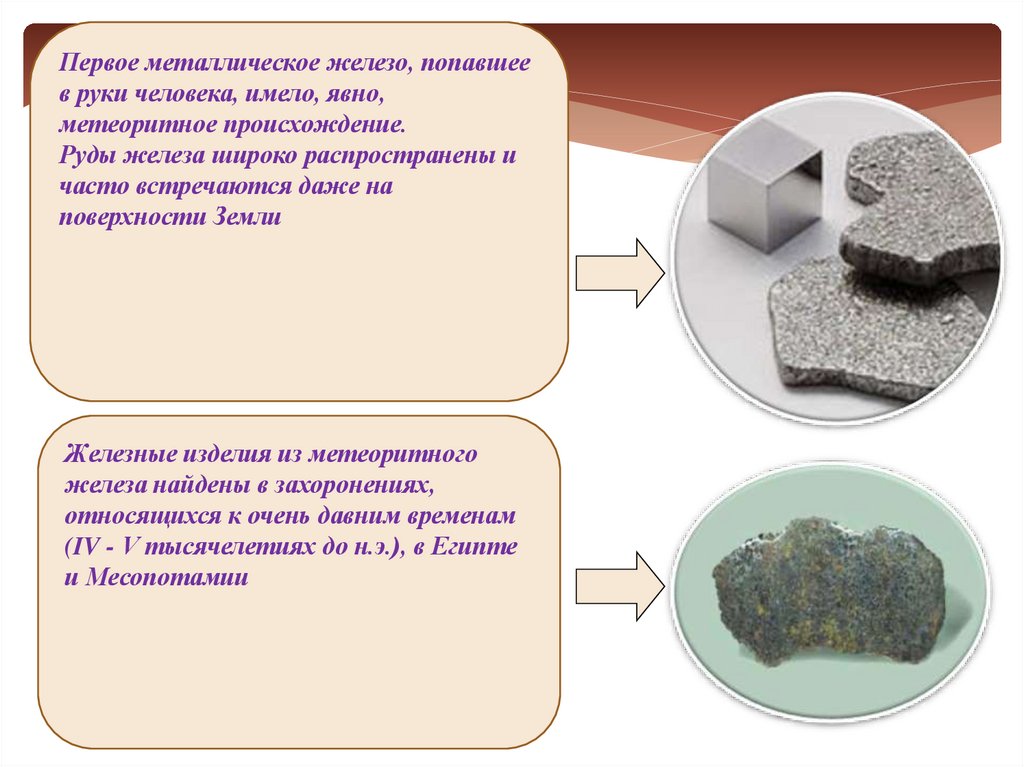
9.
Первое металлическое железо, попавшеев руки человека, имело, явно,
метеоритное происхождение.
Руды железа широко распространены и
часто встречаются даже на
поверхности Земли
Железные изделия из метеоритного
железа найдены в захоронениях,
относящихся к очень давним временам
(IV - V тысячелетиях до н.э.), в Египте
и Месопотамии
10.
Историяполучения железа
Люди впервые овладели железом в 4-3 тысячелетиях
до н. э., подбирая упавшие с неба камни — железные метеориты, и превращая
их в украшения, орудия труда и охоты. Их и сейчас находят у жителей
Северной и Южной Америки, Гренландии и Ближнего Востока, а также при
археологических раскопках на всех континентах.
Самый древний способ получения железа основывается на его восстановлении
из оксидных руд. В 19 веке были разработаны современные способы:
мартеновские печи, электросталеплавильные процессы и другие методы…
11. Физические свойства железа
Серебристо-серый МеКовкий
Очень пластичный
Плотность 7.87 г/см3
Температура плавления = 1539 ⁰С
Проводит тепло и электричество
Обладает магнитными свойствами
12. Сплавы железа
Сталь и чугун представляют собой сплавыжелеза с углеродом
сталь (до 2% «С») чугун (свыше 2% «С»)
13. Различают:
Химически чистое железо<0,01% примесей
Технически чистое железо
<0,02-0,04 % примесей
14. Химические свойства железа:
Железо может проявлять степени окисления +2 и +3.Степень окисления железа зависит от окислительной
способности реагирующего с ним вещества.
При взаимодействии с сильными окислителями
(галогены и т.д.) железо принимает степень окисления
+3, с более слабыми - +2.
15. Взаимодействие с простыми веществами (неметаллами)
С галогенами железо образует галогениды, вкоторых оно имеет степень окисления +3.
2Fe+3CI2 = 2FeCI3
С серой образует сульфид железа (II).
Fe + S = FeS
16.
Раскаленное железо сгораетобразованием железной окалины.
в
3Fe+2O2 = Fe3O4(FeO•Fe2O3)
О2
с
17. Взаимодействие со сложными веществами
С кислотамиВ разбавленных соляной и серной кислотах железо растворяется,
окисляясь ионами водорода, при этом образуются соли железа
(II) и водород:
Fe + 2HCl = FeCl2+ H2↑
Fe + H2SO4разб. = FeSO4 + H2↑
Растворяется железо и в разбавленной азотной кислоте, при
этом образуется нитрат железа(III), вода и продукт
восстановления азотной кислоты – N2, NO или NH3 (NH4NO3) в
зависимости от концентрации кислоты.
Fe + 4HNO3разб. = Fe(NO3)3 + NO↑ + 2H2O
Концентрированные H2SO4 и HNO3 пассивируют железо,
образуя на поверхности металла плотную прочную оксидную
пленку.
18.
С солямиВ соответствии с положением железа в
электрохимическом ряду напряжений оно
может вытеснять металлы, стоящие правее
него из водных растворов их солей.
Fe + CuSO4 = Cu + FeSO4
19.
С водойЖелезо реагирует с водой только при высокой
температуре (700-900 ⁰С) железо :
3Fe+4H2O = 4H2↑+Fe3O4
Если условия обычные и присутствует кислород,
то железо корродирует:
4Fe+ 4H2O+ 3O2 = 4Fe(OH)3рж.
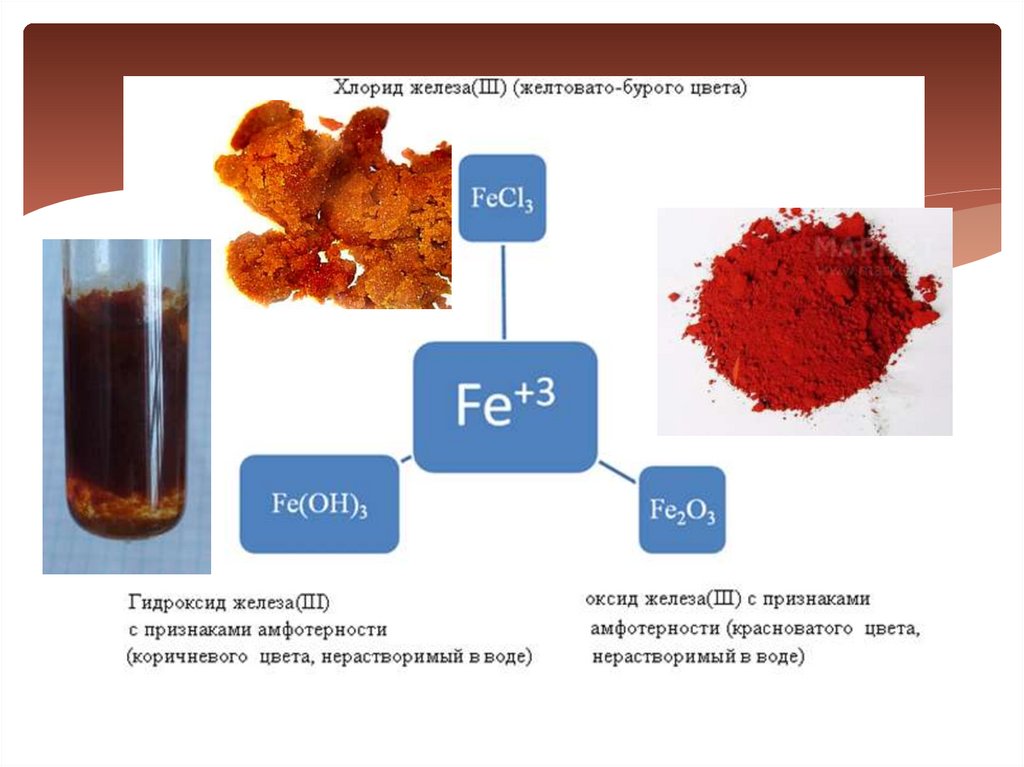
20. Соединения железа
Оксид и гидроксиджелеза (II) имеют ярко
выраженные основные
свойства.
21.
Соединения железа(II) неустойчивы, они могутлегко окисляться (например, кислородом
воздуха пероксидом водорода или другими
окислителями) и переходить в соединения
железа(III).
Fe+2Cl2 + Cl2 = Fe+3Cl3
Fe+2(OH) + H2O + O2 = Fe+3(OH)3
22.
23.
Железо в виде ионов присутствует в организмах всех растений и животных и,конечно же, человека, но в растениях и животных в малых количествах (в
среднем 0,02%).
Основная биологическая функция железа – участие в транспорте кислорода ко
всем органам и окислительных процессах.
В организме человека с массой тела прниблизительно70 кг содержится 4,2 г
железа, а в 1 л крови – 450 мг.
При недостатке железа в организме развивается железистая анемия.
Перенос железа в организме осуществляет важнейший белок –гемоглобин, в
котором находится больше половины всего железа организма.
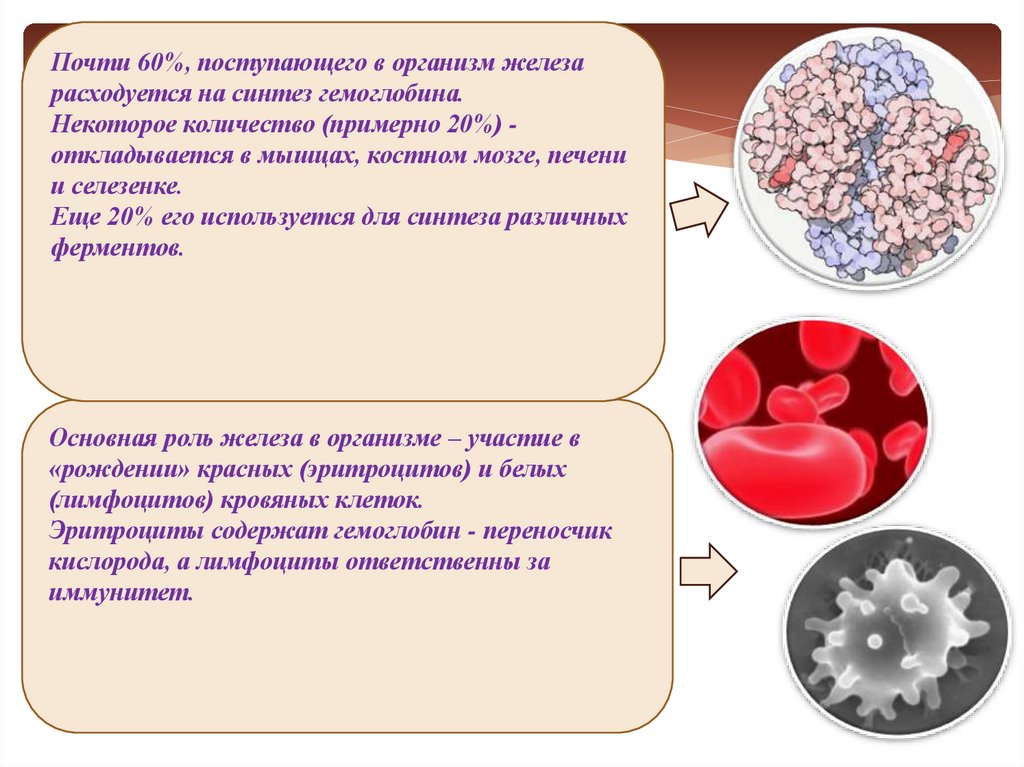
24.
Почти 60%, поступающего в организм железарасходуется на синтез гемоглобина.
Некоторое количество (примерно 20%) откладывается в мышцах, костном мозге, печени
и селезенке.
Еще 20% его используется для синтеза различных
ферментов.
Основная роль железа в организме – участие в
«рождении» красных (эритроцитов) и белых
(лимфоцитов) кровяных клеток.
Эритроциты содержат гемоглобин - переносчик
кислорода, а лимфоциты ответственны за
иммунитет.
25.
Fe → FeCl2 → Fe(OH)2 → FeOFe → FeCl3 → Fe(OH)3 → Fe2O3
26. Качественные реакции на ионы Fe+2
K3[Fe(CN)6] - красная кровяная соль3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SO4
Образуется темно-синий осадок (турнбулева синь).
27. Качественные реакции на ионы Fe+3
K4[Fe(CN)6] - желтая кровяная соль4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
Образуется темно-синий осадок (берлинская лазурь)
28. Качественные реакции на ионы Fe+3
Роданид калия - KCNS или роданид аммония NH4CNSFeCl3+ 3KCNS = Fe(CNS)3 + 3KCl
Образуется роданид железа(III) темно-красного цвета
29. Руды, содержащие железо.
Гематит (красныйжелезняк)
Лимонит (бурый
железняк)
Пирит (железный
колчедан)
Сидерит (шпатовый
железняк)
Магнетит (магнитный
железняк)
30.
«Близ города Дели в Индии стоитжелезная
колонна
без
малейшего
пятнышка ржавчины, хотя ей почти 2800
лет. Это знаменитая Кутубская колонна
высотой 7 м. и массой 6,5 т. Надпись на
колонне говорит о том, что она была
поставлена в 9 веке до н. э.»
Чем объяснить её долговечность и
коррозийную стойкость?
31.
32.
Чистое железо имеет довольно ограниченноеприменение.
Его используют при изготовлении сердечников
электромагнитов, как катализатор химических
процессов, для некоторых других целей.
Находят широкое применение и многие соединения
железа. Так, сульфат железа (III) используют при
водоподготовке, оксиды и цианид железа служат
пигментами при изготовлении красителей и так
далее.
Но сплавы железа — чугун и сталь
— составляют основу современной
техники
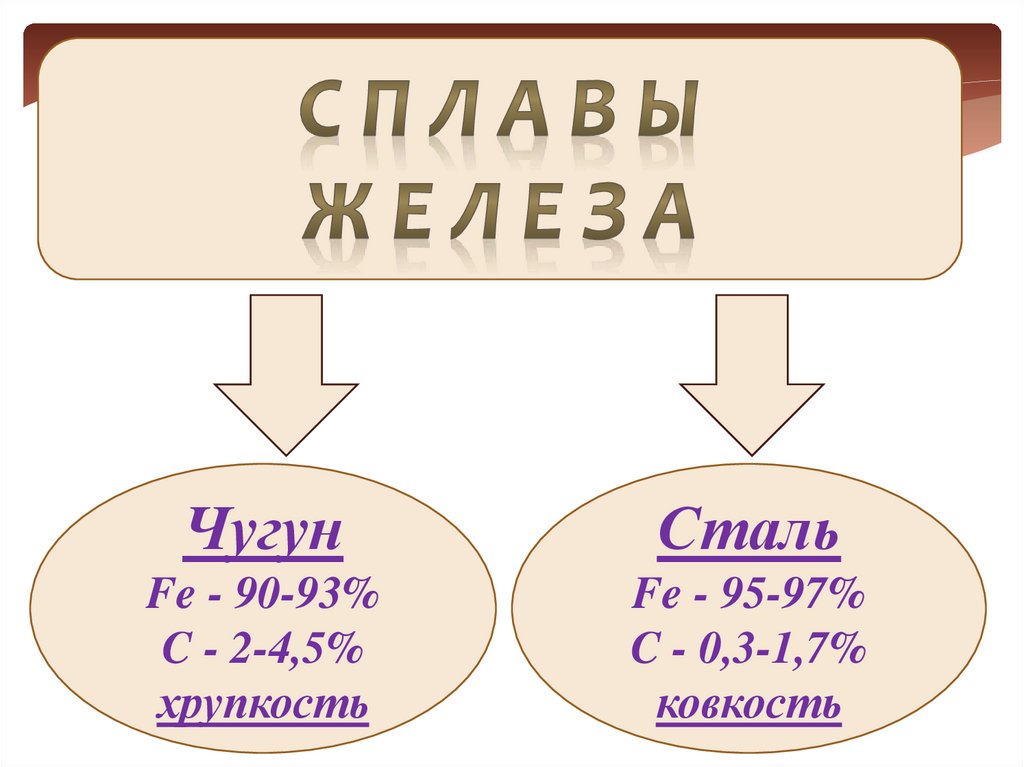
33.
ЧугунСталь
Fe - 90-93%
C - 2-4,5%
хрупкость
Fe - 95-97%
C - 0,3-1,7%
ковкость
34.
Гидроэлектростанции и опорылиний
электропередач
Железо
сегодня
Автомобили ,
Тракторы,
Подводные лодки,
Бытовые приборы,
Другие предметы
Трубопроводы
для воды,
нефти и газа



























 chemistry
chemistry








