Similar presentations:
Металлы. Положение металлов в периодической системе химических элементов Д.И. Менделеева
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
«Металлы»
Преподаватель химии: Агафонова Н.В.
2.
План:1. Положение металлов в периодической системе
2.
3.
4.
5.
6.
2
химических элементов Д.И. Менделеева.
Особенности строения атомов.
Физические свойства металлов.
Химические свойства металлов.
Коррозия металлов.
Характер оксидов гидроксидов металлов.
Нахождение металлов в природе и общие
способы их получения.
3.
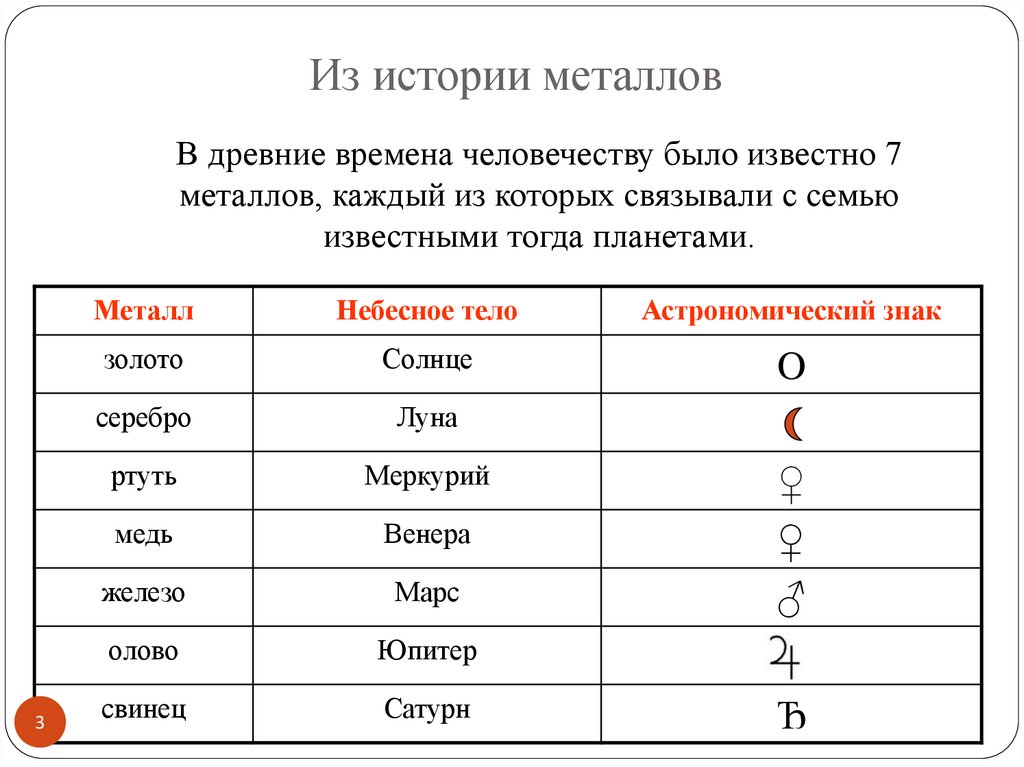
Из истории металловВ древние времена человечеству было известно 7
металлов, каждый из которых связывали с семью
известными тогда планетами.
3
Металл
Небесное тело
Астрономический знак
золото
Солнце
O
серебро
Луна
ртуть
Меркурий
медь
Венера
железо
Марс
олово
Юпитер
свинец
Сатурн
♀
♀
♂
Ђ
4.
Из истории металловС древнейших времен
человек использовал
металлы для изготовления
не только оружия, но и
декоративных изделий.
4
5.
Из истории металловВ настоящее время многие предметы,
которыми мы пользуемся в жизни,
сделаны из металлов.
5
6.
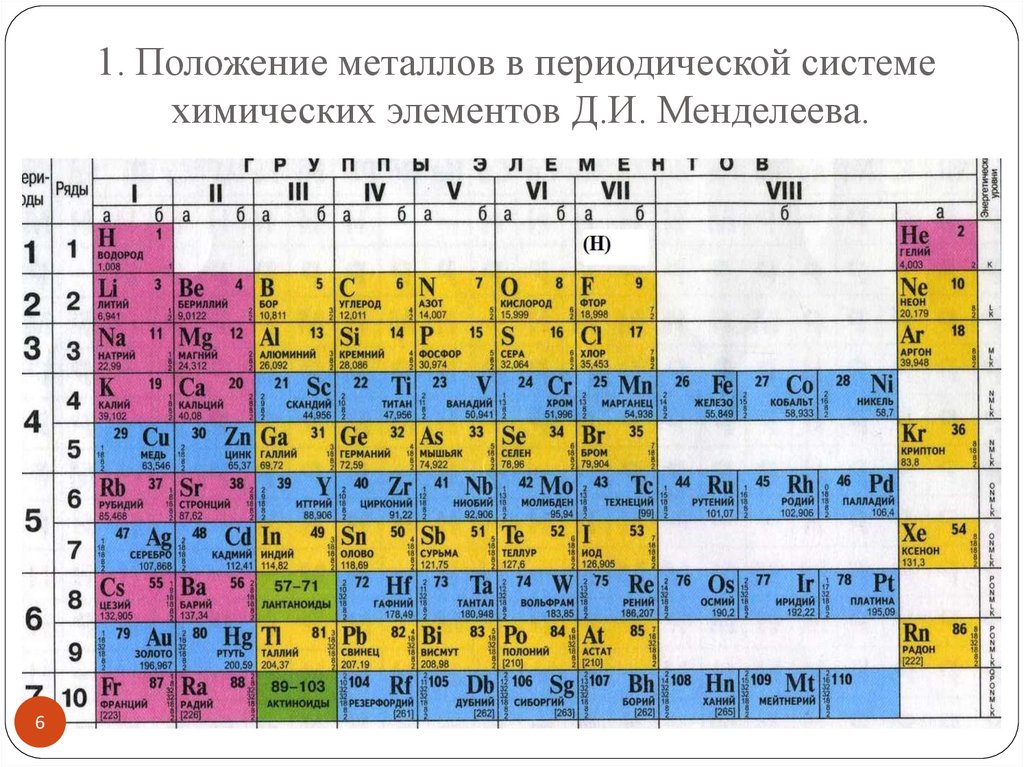
1. Положение металлов в периодической системехимических элементов Д.И. Менделеева.
6
7.
Особенности строения атомов металла1. Небольшое число электронов на внешнем
энергетическом уровне (1-3 электрона).
2. Относительно не большой атомный радиус.
7
8.
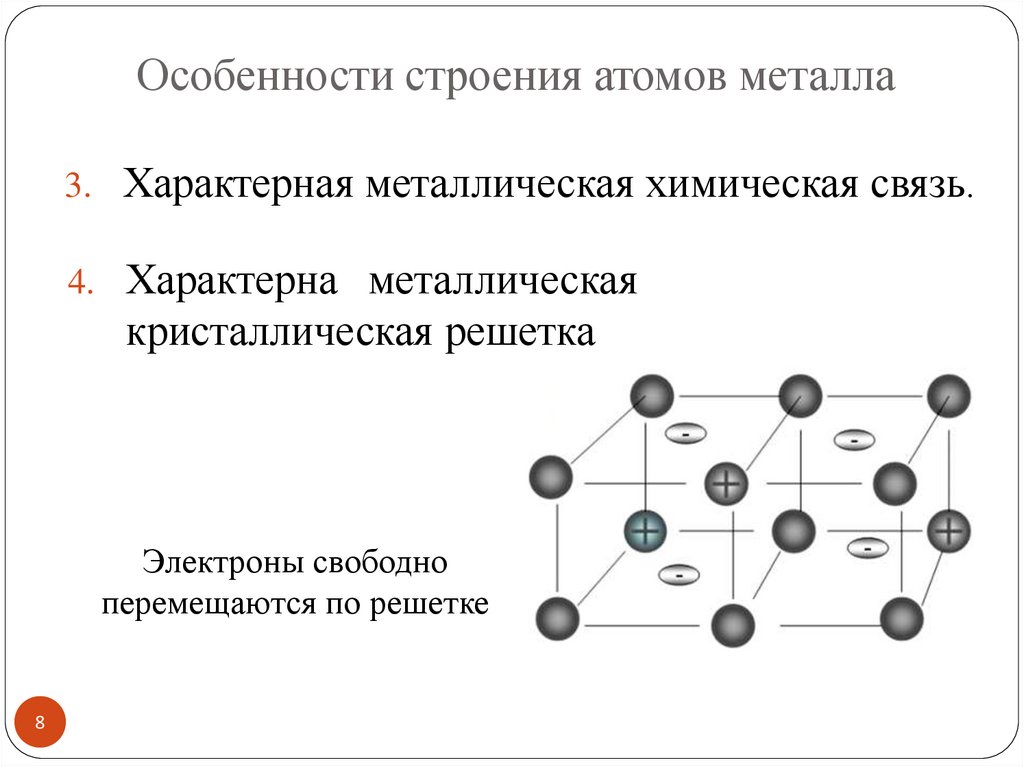
Особенности строения атомов металла3. Характерная металлическая химическая связь.
4. Характерна металлическая
кристаллическая решетка
Электроны свободно
перемещаются по решетке
8
9.
2. Физические свойства металлов1. Все металлы твердые вещества.
Исключение ртуть.
Золото
9
Ртуть
Медь
10.
2. Физические свойства металлов2. Характерен металлический блеск и не
прозрачность.
Железо
10
Кремний
11.
2. Физические свойства металлов3. Металлы проводят тепло и электрический ток.
Самые электропроводные металлы:
Серебро
11
Медь
Алюминий
12.
2. Физические свойства металлов4. Пластичность, упругость, прочность.
4. Пластичность - это способность к сложной
деформации без нарушения механической
прочности.
Мягкие металлы:
Калий
12
Натрий
Твердый метал:
Хром
13.
2. Физические свойства металлов5. Плавление.
Самый легкоплавкий металл
(tплав.= -38,90С)
Ртуть
13
Самый тугоплавкий металл
(tплав.= 33800С)
Вольфрам
14.
2. Физические свойства металлов3. Плавление.
Металлы галий и цезий плавятся в руках
14
15.
2. Физические свойства металлов6. По отношению к магнитным полям:
7. - диамагнитные (не притягиваются к магниту);
8. - парамагнитные (слабая способность к
намагничиванию);
9. - ферромагнитные (способны намагничиваться
под действием слабых магнитных полей).
15
16.
3. По отношению к магнитным полям:Ферромагнитные
Парамагнитные
Диамагнитные
Никель
Олово
Титан
16
Медь
17.
3. Химические свойства металлов1. Общим химическим свойством металлов
является способность их атомов при
химических реакциях отдавать валентные
электроны и превращаться в положительно
заряженные ионы, т.е. металлы в реакциях
являются восстановителями.
17
18.
3. Химические свойства металлов1. В периодах слева направо восстановительная
активность металлов уменьшается;
2. В главных подгруппах сверху вниз – увеличивается.
3. Восстановительная активность металлов в
химических реакциях, которые протекают в водных
растворах различных веществ, определяется
положением металлов в электрохимическом ряду
напряжений металлов.
18
19.
3. Химические свойства металлов1. Взаимодействие с простыми веществами −
неметаллами.
2. Сa0 + 2C → Ca+2C2
3. Na0 + H2 → Na+H2 (только активные металлы)
4. 2Cu0 + O2 → 2Cu+2O
5. Fe0 +S → Fe+2S
6. Mg0 + Cl2 → Mg+2Cl2
19
20.
3. Химические свойства металлов2. Взаимодействие со сложными веществами.
3. а) металлы находящиеся в начале ряда
напряжений (от Li до Na), при обычных
условиях вытесняют водород из воды и
образуют щелочи:
4. 2Na0 + 2H2O → 2Na+OH + H2
20
21.
3. Химические свойства металлов2. Взаимодействие со сложными веществами.
3. б) металлы, расположены в ряду
напряжений до водорода, взаимодействуют
с разбавленными кислотами (искл. HNO3) с
образованием соли и выделением водорода:
4. 2Al0 + 6HCl → 2Al+3Cl3 + 3H2↑
21
22.
3. Химические свойства металлов2. Взаимодействие со сложными веществами.
3. в) металлы взаимодействуют с растворами
менее активных металлов, в результате чего
образуется соль более активного металла, а
менее активный металл выделяется в
свободном виде:
4. Fe + CuSO4 → FeSO4 + Cu
22
23.
3. Химические свойства металлов2. Взаимодействие со сложными веществами.
3. г) металлы взаимодействуют с некоторыми
органическими веществами:
1. 2C2H5OH + 2Na → 2C2H5ONa + H2↑
2. 2CH3Cl + 2Na → C2H6 + 2NaCl
23
24.
4. Коррозия металловРазрушение металлов под действием
окружающей среды называется коррозией.
O2, H2O, CO2
Коррозия, вызванная непосредственным
воздействием окружающей среды, называется
химической, или газовой, коррозией.
2Cu + O2 = CuO
24
25.
4. Коррозия металловЕжегодно из–за коррозии теряется
около 25% всего произведенного в мире
железа.
Коррозия вызывает серьезные
экологические последствия, так как изза разрушения трубопроводов
происходит утечка газа, нефти и других
опасных химических продуктов.
25
26.
5. Характер оксидов и гидроксидов металловНаиболее активные металлы образуют оксиды, которые
являются типичными основными оксидами (Na2O, CaO, BaO
и др). Гидраты этих оксидов (гидроксиды) являются
сильными основаниями (щелочами) (NaOH, Ca(OH)2,
Ba(OH)2 и др.)
Оксиды и гидроксиды некоторых металлов (Zn, Al)
являются амфотерными.
Металлы, имеющие переменную степень окисления, могут
образовывать оксиды и гидроксиды, характер которых
зависит от степени окисления металлов. (СrO – Cr(OH)2 –
основные свойства, Cr2O3 − Cr(OH)3 – амфотерные свойства,
CrO3 – H2CrO4, H2Cr2O7 – кислотные свойства).
26
Гл. подгруппа ↓ усиление основных свойств
Период ←
27.
6. Нахождение металлов в природе и общиеспособы их получение
Получение металлов из их соединений –
задача металлургии:
пирометаллургию;
гидрометаллургию;
электрометаллургию.
27
28.
6. Нахождение металлов в природе и общиеспособы их получение
Пирометаллургия – это получение
металлов из их соединений при высоких
температурах с помощью различных
восстановителей: углерода C, оксида
углерода (II) CO, водорода H2, некоторых
металлов (Al, Mg).
FeO + C → Fe +CO
Cr2O3 + 2Al → 2Cr + Al2O3
28
29.
6. Нахождение металлов в природе и общиеспособы их получение
1. Гидрометаллургия – это получение металлов,
который состоит из двух процессов:
2. 1) природное соединение металла (обычно оксид)
растворяется в кислоте, в результате чего
получается раствор соли металла;
3. 2) из полученного раствора данный металл
вытесняется более активным металлом.
CuO +H2SO4 → CuSO4 + H2O
CuSO4 + Fe → Cu + FeSO4
29
30.
6. Нахождение металлов в природе и общиеспособы их получение
Электрометаллургия – это получение
металлов при электролизе растворов или
расплавов их соединений. Роль
восстановителя в процессе электролиза
играет электрический ток.
30
31.
6. Нахождение металлов в природе и общиеспособы их получение
Электролизом называется окислительновосстановительный процесс, протекающий на
электродах при прохождении электрического тока через
расплав или раствор электролита.
Если в расплав или раствор электролита опустить электроды и
пропустить постоянный электрический ток, то ионы электролита
будут двигаться к электродам:
катионы → к катоду (отрицательно заряженному электроду),
анионы → к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются.
На аноде анионы отдают электроны и окисляются.
31
32.
6. Нахождение металлов в природе и общиеспособы их получение
Нахождение металлов в природе.
Содержание некоторых металлов в земной
коре:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия — 2,1 %
титана — 0,56%
32
33.
6. Нахождение металлов в природе и общиеспособы их получение
33
34.
ЛитератураОсновная литература:
1. Габриелян, О. С. Химия. 10 класс. Базовый уровень : учебник / О. С.
Габриелян. - 4-е изд., стер. - М. : Дрофа, 2016. - 192 с.
Дополнительная литература:
1. Грандберг, И. И. Органическая химия : учеб. для бакалавров / И. И.
Грандберг, Н. Л. Нам. - 8-е изд. - М. : Юрайт , 2013. - 608 с
Электронные ресурсы:
1. ЭБС КрасГМУ «Colibris»
2. ЭБС Консультант студента ВУЗ
3. ЭБС Консультант студента Колледж
4. ЭМБ Консультант врача
5. ЭБС Айбукс
6. ЭБС Букап
7. ЭБС Лань
8. ЭБС Юрайт
9. СПС КонсультантПлюс
10. НЭБ eLibrary
34
35.
Спасибо за внимание35
































 chemistry
chemistry








