Similar presentations:
Источники получения лекарственных средств
1.
2.
План:Источники получения
лекарственных средств.
Источники и причины
недоброкачественности
лекарственных веществ.
Сроки годности и стабилизации
лекарственных средств.
3.
I. Неорганические лекарственные веществаполучают из природных источников- это
минералы, воздух, вода.
-
4.
II. Органические лекарственные вещества :1. а) продукты сухой перегонки каменного угля.
б) дерева.
в) горючих сланцев.
г) различные фракции нефти.
2. Продукты растительного происхождения.
Применяют около 10000 видов лекарственных растений: листья,
цветки, корни, семена, плоды, эфирные и жирные масла, смолы,
белки, углеводы.
3. Продукты животного происхождения.
4. Продукты жизнедеятельности микроорганизмов.
5. Продукты морских организмов - гидробионты.
5.
III. Синтетические методы:1.Полный синтез. Получают более простые
алифатические, гетеро-циклические, ароматические
соединения, природные алкалоиды, витамины.
2. Частичный синтез( полусинтез) – на основе
природных веществ. Получают вещества алкалоидов,
витаминов,
антибиотики.
3. Микробиологический синтез витаминов и
коферментов.
6.
IV. Биотехнология сиспользованием генной
инженерии
Это технология получения
различных продуктов из
живых клеток различного
происхождения .
Объектами биотехнологии
является культивируемые
ткани, клетки животных и
растений, микроорганизмы,
созданные методами генной
инженерии.
7.
1. Замысел создания нового лекарственного вещества.2. Синтез предварительно отобранных структур.
3. Отсеивание неперспективных образцов.
4. Клинические проверки.
5. Разработка технологии производства нового
лекарственного вещества и наиболее рациональной
лекарственной формы.
6. Подготовка НТД , включая контроль качества
лекарственного вещества и его лекарственной
формы.
7. Внедрение в промышленное производства .
8.
Основные источники технологических и специфическихпримесей (приобретенные):
1. Плохая очистка исходного сырья.
2. Примеси материала, из которого приготовлена
аппаратура (металл, стекло).
3. Остатки растворителя .
4. Механические загрязнения (вата, фильтровальная
бумага)
5. Загрязнения побочными продуктами синтеза.
6. Примеси, возникающие при хранении(влажность, свет,
кислород воздуха, температура, качество тары).
9.
Примеси допустимые инедопустимые
Иногда одна и таже примесь допускается в
одном препарате и не допускается в
другом.
10.
Допустимые примеси - допускаются влекарственных веществах в максимально
допустимом пределе, который не влияет на
качество препарата и лечебный
эффект(допускается в пределе эталонного
раствора или в пределе ГФ).
11.
Берут две одинаковые пробирки. В одну пробиркуналивают 10 мл исследуемого вещества, в другую
10 мл эталонного раствора. Добавляют в обе
пробирки одинаковое количество сопутствующего
реактива, затем основной реактив. Проводят
сравнение: опалесценция (муть) в исследуемом
растворе не должна превышать в эталоном
растворе. Смотрят опалесценцию на темном фоне
в проходящем света, окрашивание на белом фоне
в отраженном свете.
12.
Недопустимые примесиНе допускаются в лекарственных веществах, влияют
на качество и лечебный эффект.
Методика определения недопустимых примесей.
Берут две одинаковые пробирки. В одну пробирку
наливают 10 мл исследуемого вещества и добавляют
сопутствующий
реактив.
Затем
разливают
этот
раствор на две пробирки поровну , в одну из них
добавляют основной реактив. Реактивы в обеих
пробирках должны быть одинаковыми.
13.
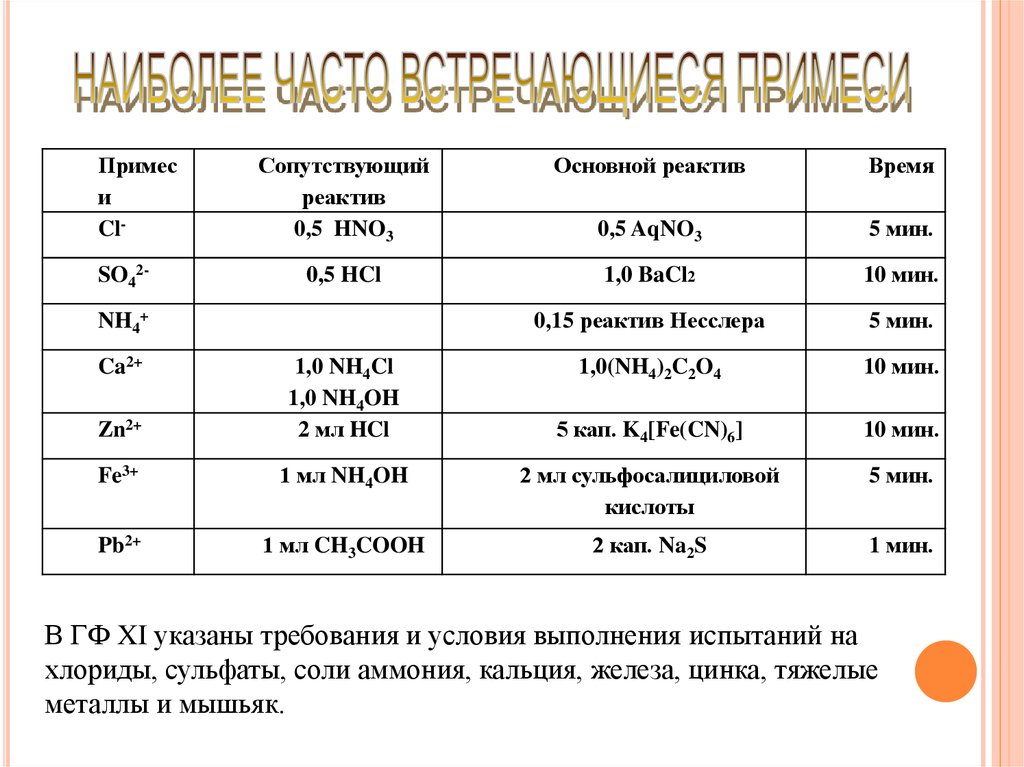
Примеси
Cl-
SO42-
Сопутствующий
реактив
0,5 HNO3
Основной реактив
Время
0,5 AqNO3
5 мин.
0,5 HCl
1,0 BaCl2
10 мин.
0,15 реактив Несслера
5 мин.
1,0(NH4)2C2O4
10 мин.
5 кап. K4[Fe(CN)6]
10 мин.
NH4+
Ca2+
Zn2+
1,0 NH4Cl
1,0 NH4OH
2 мл HCl
Fe3+
1 мл NH4OH
2 мл сульфосалициловой
кислоты
5 мин.
Pb2+
1 мл CH3COOH
2 кап. Na2S
1 мин.
В ГФ XI указаны требования и условия выполнения испытаний на
хлориды, сульфаты, соли аммония, кальция, железа, цинка, тяжелые
металлы и мышьяк.
14.
Методоснован
на
восстановление
мышьяка
металлическим цинком до арсина. Затем арсин
проходит через бумагу, пропитанную
HqCl2 и в
зависимости от концентрация окрашивает его в
оранжевый или в желтый цвет, а после обработки
KJ в буровато коричневый.
15.
As2O3+6Zn+12HCl →6ZnCl2+2AsH3↑ + 3H2OAsH3 + HqCl2 → AsH2 (HqCl) + HCl
AsH3 +2HqCl2→ AsH (HqCl) 2 + 2HCl
AsH3 + 3HqCl2→ As (HqCl) 3 + 3HCl
AsH3 + As (HqCl) 3→ As2Hq3↓+3HCl
16.
Основан на восстановлении мышьяка в свободном виде. Вкачестве восстановителя применяется гипофосфат натрия в
кислой среде.
NaH2PO2 + HCl → NaCl + H3PO2 фосфорноватистая
2H3PO2 →PH3 + H3PO4
As2O3 + PH3→2As↓+ H3PO3 фосфористая
Бурое пятно или осадок.
17.
1. Метод высушивания.2. Метод дистилляции.
3. Метод акваметрии.
18.
1. Индикатором.2. Потенциометрически , pH метром.
19.
Прозрачность, степень мутности.Определяется эталонным раствором из белой глины.
Окраска.
Сравнивают с эталонным раствором CoCl2, K2Cr2O7,
CuSO4, FeCl3
Примеси органических веществ
С помощью H2SO4 (конц.)- озоление.
Определение золы
Прокаливают в фарфоровом или платиновом тигле.
20.
-Физическиеопределение
температуры
плавления,
затвердевания,
плотности,
удельный
вес,
показатель
преломления, вращения, поглощения, излучения, определения
вязкости.
-Физико-химические.
-Химические (качественные реакции на подлинность, примеси,
методы количественного анализа).
-Биологические: определение токсичности и стерильности,
микробиологические испытания. Стерильность путем посева в
пробирках с питательной средой. Отсутствие жизнеспособных
микроорганизмов любого вида. Микробиологические испытания
в лекарственных формах , которые не стерилизуются в течение
производства: таблетки, капсулы, экстракты, спирты, мази.
Испытания проводят в аптечных условиях в чашках Петри.
21.
Это период, в течения которого лекарственные средствадолжны отвечать требованиям государственного стандарта
качества.
Он
зависит
от
физических,
химических,
биологических процессов, на которые влияют температура,
влажность, свет, pH среды. По истечении срока годности
препарат не может быть использован. Для сохранения или
продления срока годности проводят стабилизацию.
22.
1. способ физический - сушка, нанесение защитныхпокрытий, микрокапсулирование.
2. способ химический - вводят специальные
вещества: стабилизаторы, антиоксиданты,
комплексообразователи.
23.
1. ГФ2. ФС
3. ВФС
4. Приказы № 214, №305.
Основной документ, нормирующий качества выпускаемых
в нашей стране лекарственных средств представляет собой
сборник обязательных стандартов и положений.






















 medicine
medicine








