Similar presentations:
Лабораторные биохимические исследования при заболеваниях сердца. Теоретическое занятие № 20
1.
Департамент здравоохранения города МосквыГосударственное бюджетное профессиональное образовательное
учреждение Департамента здравоохранения города Москвы
«Медицинский колледж № 1»
(ГБПОУ ДЗМ «МК № 1»)
Теоретическое занятие № 20
Лабораторные биохимические исследования
при заболеваниях сердца
Специальность: 31.02.03 Лабораторная диагностика
Форма обучения: очная
Курс IV (8 семестр)
Тема 3.10. Энзимодиагностика
Преподаватель: Диденко Изабелла Владимировна
Москва
2024
2.
Цель общая: Уметь использовать знания о сердечных маркерах –измеряемые для оценки функции сердца.
Цель лекции:
Разобрать и дать понятие лабораторным биомаркерам при
исследовании и диагностики повреждения миокарда:
1. Тропонины I и Е
2. Миоглобин
3. Креатинкиназа общая
4. Креатинкиназа МВ
5. АЛТ, АСТ, ЛДГ
medcollege.ru
2
3.
Сердечные маркеры – это биомаркеры, измеряемые для оценкифункции сердца. Они могут быть полезны при раннем прогнозировании
или диагностике заболевания. Они часто обсуждаются в контексте
инфаркта миокарда, другие состояния могут привести к повышению уровня
сердечных маркеров.
При подозрении на заболевания сердца комплекс анализов
выглядит следующим образом: биохимический анализ крови (АСТ, АЛТ,
сахар крови, креатинин, мочевина, биллирубин, К+, Na+, липидный профиль),
общий анализ крови, общий анализ мочи, коагулограмма.
medcollege.ru
3
4.
Лабораторные биомаркеры при исследовании и диагностикиповреждения миокарда
Тропонины – семейство белков, которые содержатся в скелетной мускулатуре и
сердечной мышце – миокарде. Существует три типа тропонина: тропонин С, тропонин I и
тропонин Т. Все вместе они участвуют в сокращении мыщц. Тропонин I и тропонин T
обнаруживаются только в сердечной мышце. Эти кардиоспецифичные тропонины
(обозначаются еще как сТнI и сТнТ) в норме практически не содержатся в крови. Когда
происходит повреждение миокарда, сердечные тропонины I и T в больших количествах
проникают в кровоток. Количество попадающих в кровь тропонинов напрямую зависит от
объема повреждения миокарда. После повреждения кардиомиоцитов сердечные тропонины
высвобождаются в кровь в течение 2–6 часов. Пик концентраций отмечается через 12–24 часа,
варьируя у разных людей.
medcollege.ru
4
5.
Уровень тропонинов коррелирует с площадью поражения сердечной мышцы, идает возможность спрогнозировать тяжесть состояния.
Повреждение миокарда является необходимым условием для постановки диагноза
острого инфаркта миокарда. В этом случае у пациента с помощью высокочувствительных
методов определения тропонинов I (ай) и T (тэ) измеряется хотя бы одно значение,
превышающее верхний референтный предел до 99%. уровня. Нередко сообщается о
повышенных уровнях тропонина T у пациентов с врожденными или хроническими нервномышечными заболеваниями, в то время как значения тропонина I часто находятся в
пределах нормы. Кроме того, некоторые расхождения между результатами лабораторных
тестов на два тропонина иногда обнаруживаются у лиц, не имеющих сердечных
заболеваний, а также у пациентов с сердечными заболеваниями.
medcollege.ru
5
6.
Для чего используется исследование?Анализ на тропонин I чаще всего необходим, чтобы подтвердить или, напротив, исключить
инфаркт миокарда у пациентов с острой болью в сердце либо иными симптомами. Он обычно
назначается вместе с другими маркерами повреждения сердечной мышцы, такими как креатинкиназа
МВ и миоглобин. Тем не менее тропонин I является "золотым стандартом" в определении инфаркта, так
как он более специфичен, чем остальные показатели (которые могут повышаться еще и при
повреждении скелетной мускулатуры), и остается повышенным длительное время.
К тому же данный тест применяют, чтобы оценить степень повреждения сердечной мышцы, а
также отличить боль в грудной клетке, вызванную несердечными причинами. Если человек испытывал
боль или дискомфорт в грудной клетке, а также другие симптомы, связанные с обострением
ишемической болезни сердца, и при этом он не обращался к врачу в течение нескольких дней, а
тропонин I все еще повышен – значит, произошло повреждение сердечной мышцы.
medcollege.ru
6
7.
Когда назначается исследование?Это исследование проводят при подозрении на острый инфаркт миокарда. Кровь
берется сразу при поступлении пациента в стационар и еще через 6 и 12 часов после первого
взятия.
Анализ на тропонин I обычно применяют вместе с другими маркерами повреждения
сердечной мышцы, такими как креатинкиназа МВ и миоглобин, что позволяет более точно
судить о наличии или отсутствии острого повреждения сердечной мышцы.
Данный тест назначают пациентам со стабильной стенокардией при ухудшении состояния,
когда симптомы возникают в покое и/или не уменьшаются при лечении. Следовательно,
стенокардия становится нестабильной, что повышает риск инфаркта миокарда.
medcollege.ru
7
8.
Тест на тропонин I назначается также:при подозрении на воспаление ткани сердечной мышцы – миокардит – и другие заболевания,
вызывающие повреждение миокарда, до и после рентгенохирургических (ангиопластика и
стентирование) и кардиохирургических (коронарное шунтирование) операций на сердце, чтобы
выявить возможное повреждение миокарда.
Референсные значения: 0 – 0,1 нг/мл.
Обычно уровень тропонина I в крови настолько низкий, что не может быть измерен.
Поэтому даже небольшое повышение может свидетельствовать
о повреждении сердца.
Значительно повышенный уровень тропонина I с очень высокой вероятностью свидетельствует
об инфаркте миокарда или другом повреждении сердца. Если у человека, страдающего
стенокардией или предъявляющего жалобы на боль в сердце, уровень тропонина I не повышен,
то это исключает вероятность повреждения у него сердца.
medcollege.ru
8
9.
Причины повышения уровня тропонина I в кровиОсновная причина повышения концентрации тропонина I – гибель клеток сердечной мышцы, что
чаще всего бывает при инфаркте миокарда. После инфаркта уровень тропонина I остается повышенным
еще в течение 10-14 дней. Гораздо реже тропонин I может повышаться вследствие следующих причин.
Миокардит – инфекционное воспаление сердечной мышцы
Перикардит – воспаление оболочек сердца.
Тромбоэмболия легочной артерии – закупорка легочной артерии сгустком крови, приводящая к
ограничению кровотока в зоне легкого. Травма сердца, в том числе хирургическая.
Тропонин I иногда повышается после интенсивной физической нагрузки даже у здоровых людей.
Диагноз "инфаркт миокарда" не ставится лишь на основании повышенного уровня тропонина I.
Для этого необходима комплексная оценка состояния пациента, которую может провести только врач. При
этом учитывается характер болевого синдрома, история развития заболевания, ЭКГ, результаты других
лабораторных и инструментальных обследований.
medcollege.ru
9
10.
Миоглобин– белок, который связывает кислород и поставляет его сердечной и скелетным
мышцам. Его концентрация в крови возрастает при повреждении скелетных мышц или
миокарда. Использование запасенного О2 в мышечной ткани начинается при выраженном
снижении парциального давления кислорода в мышцах. Миоглобин способен связывать
кислород в мышечных клетках, что дает им энергию для сокращения.
Метод исследования: иммунотурбидиметрия.
Единицы измерения: мкг/л (микрограмм на литр).
Миоглобин не является специфичным маркером повреждения миокарда, в отличие
от креатинкиназы МВ и тропонина, однако реагирует на гибель мышечных клеток сердца
одним из первых – через 1–2 часа его концентрация в крови увеличивается.
medcollege.ru
10
11.
МИОГЛОБИН (ПРОДОЛЖЕНИЕ)Миоглобин и гемоглобин относят к гемопротеинам, они содержат порфириновое
производное
–
гем,
который
обеспечивает
их
красный
цвет
и
способность
взаимодействовать с О2. Гемоглобин ответственен за транспорт кислорода, а миоглобин –
за его депонирование. Механизм действия обоих белков обуславливается строением гема,
состоящего из двухвалентного железа и порфирина. Именно молекула гема отвечает за
тропность белков к кислороду. Миоглобин связывает переносимый гемоглобином
кислород, создавая депо О2. Когда в организме начинается кислородное голодание (после
тяжелой физической нагрузки), он освобождает связанный кислород и "передает" его
окислительным
системам
клеток,
где
запускается
процесс
окислительного
фосфорилирования, в результате которого образуется необходимая для работы мышц
энергия.
medcollege.ru
11
12.
Миоглобин фильтруется почками ивыводится из организма с мочой. Если
происходит массивное повреждение мышц,
например, в результате серьезной травмы,
он
начинает
в
больших
количествах
поступать в кровь и может повреждать почки,
вызывая острую почечную недостаточность.
При
отсутствии
повреждений
воспалений
мышечной
ткани
или
он
практически не фиксируется в крови. Это его
свойство
используется
для
уточнения
диагноза "инфаркт миокарда".
medcollege.ru
12
13.
ДЛЯ ЧЕГО ИСПОЛЬЗУЕТСЯ ИССЛЕДОВАНИЕ?Анализ на миоглобин назначается вместе с другими маркерами повреждения сердечной
мышцы, такими как креатинкиназа МВ, и используется для того, чтобы подтвердить или исключить
инфаркт миокарда у пациентов с острой болью в сердце или другими симптомами.
Миоглобин начинает повышаться через 1–2 часа после повреждения миокарда, достигает
своего пика через 8-12 часов и к концу дня обычно приходит в норму.
Тропонин – "золотой стандарт" в определении инфаркта, так как он является более
специфичным, однако преимущество миоглобина состоит в том, что он реагирует максимально рано, тем
самым позволяя быстрее поставить диагноз. Необходимо понимать, что миоглобин может повышаться и
без повреждения сердечной мышцы. Таким образом, отрицательный результат анализа на миоглобин
исключает инфаркт, положительный – требует подтверждения тропонином. Тест на миоглобин
необходим людям с серьезными травмами для того, чтобы определить вероятность поражения почек.
medcollege.ru
13
14.
КОГДА НАЗНАЧАЕТСЯ ИССЛЕДОВАНИЕ?Анализ на миоглобин назначается при подозрении на острый инфаркт миокарда.
Кровь берут сразу при поступлении пациента в стационар и потом еще несколько раз через
каждые 2-3 часа.
Такой тест обычно назначается вместе с другими маркерами повреждения
сердечной мышцы, такими как креатинкиназа МВ и тропонин, что позволяет более уверенно
судить о наличии или, напротив, отсутствии острого повреждения сердечной мышцы.
Кроме того, это исследование может понадобиться после массивных повреждений
скелетной мускулатуры, чтобы оценить риск повреждения почек и острой почечной
недостаточности.
medcollege.ru
14
15.
РЕФЕРЕНСНЫЕ ЗНАЧЕНИЯМужской пол: 23,00 – 72,00 мкг/л.
Женский пол: 19,00 – 51,00 мкг/л.
Содержание миоглобина в крови настолько несущественно, что даже не может быть измерено.
Повышение уровня миоглобина в крови говорит о недавнем повреждении скелетных или сердечной
мышц. Назначение тропонина или креатинкиназы МВ позволяет уточнить причину повышения
миоглобина. Если в течение 12 часов боли в грудной клетке повышения миоглобина не произошло,
вероятность инфаркта миокарда крайне маловероятна.
Миоглобин, помимо сердца, содержится еще в скелетной мускулатуре, он может повышаться и
в других ситуациях: синдром длительного сдавливания (краш-синдром) возникает в результате
раздавливания или размозжения мышечной ткани, а также длительного прекращения кровотока по
конечности; любые травмы; после хирургических операций; судороги любого происхождения; любые
заболевания, приводящие к повреждению мышц: дерматомиозит, полимиозит, мышечная дистрофия и
др.
medcollege.ru
15
16.
ЧТО МОЖЕТ ВЛИЯТЬ НА РЕЗУЛЬТАТ?Злоупотребление амфетаминами и алкоголем повышает уровень миоглобина. Так
как миоглобин выводится через почки, его уровень может быть повышен при почечной
недостаточности.
Важные замечания
Внутримышечные инъекции и физическая нагрузка не влияют на уровень
миоглобина в крови. Повышенный уровень миоглобина – недостаточное основание для
постановки диагноза "инфаркт миокарда". Необходима комплексная оценка состояния
пациента. При этом учитывается характер болевого синдрома, история развития заболевания,
ЭКГ, результаты других лабораторных и инструментальных обследований. В норме миоглобин
не определяется в моче, настолько его в ней мало. Если уровень миоглобина повышается так,
что его становится возможным измерить, то это указывает на вероятность почечной
недостаточности.
medcollege.ru
16
17.
КРЕАТИНКИНАЗА ОБЩАЯКреатинкиназа – это фермент, который катализирует реакцию переноса фосфорильного остатка
с АТФ на креатин с образованием креатинфосфата и АДФ. АТФ (аденозинтрифосфат) – молекула,
являющаяся источником энергии в биохимических реакциях человеческого организма.
Реакция, катализируемая креатинкиназой, обеспечивает энергией мышечные сокращения.
Различают креатинкиназу, содержащуюся в митохондриях и цитоплазме клеток.
Молекула состоит из двух частей, которые могут быть представлены одной из двух субъединиц:
М, от английского muscle – "мышца", и B, brain – "мозг". В организме человека креатинкиназа есть в виде трех
изомеров: ММ, МВ, ВВ. ММ-изомер содержится в скелетной мускулатуре и миокарде, МВ – в основном в
миокарде, ВВ – в тканях головного мозга, в небольшом количестве в любых клетках организма.
В крови здорового человека креатинкиназа присутствует в небольших количествах, в основном
в виде ММ-изомера. Активность креатинкиназы зависит от возраста, пола, расы, мышечной массы и
физической активности.
medcollege.ru
17
18.
ДЛЯ ЧЕГО ИСПОЛЬЗУЕТСЯ ИССЛЕДОВАНИЕ?Для подтверждения диагноза "инфаркт миокарда", "миокардит",
"миокардиодистрофия".
Для подтверждения диагноза "полимиозит", "дерматомиозит", "миодистрофия".
Чтобы проверить наличие заболеваний щитовидной железы.
Чтобы убедиться в наличии опухолевого процесса и оценить его тяжесть.
Чтобы оценить тяжесть течения полимиозита, дерматомиозита, миодистрофии,
миопатии.
Чтобы выявить носительство гена миопатии Дюшенна.
Для диагностики и оценки тяжести поражения сердца и мышечной системы при
интоксикации из-за инфекции, а также при отравлениях (угарным газом, ядом змеи,
лекарственными средствами).
medcollege.ru
18
19.
КОГДА НАЗНАЧАЕТСЯ ИССЛЕДОВАНИЕ?При симптомах ишемической болезни сердца.
При симптомах инфаркта миокарда, в частности при стертой клинической картине,
особенно при повторном инфаркте, атипичной локализации, болевом синдроме или
ЭКГ-признаках, затруднении дифференциальной диагностики с другими формами
ишемической болезни сердца.
При гипотиреозе.
При симптомах миозита, миодистрофии, миопатии.
При планировании беременности женщиной, в семье которой были больные
миопатией Дюшенна.
При заболеваниях, которые могут привести к поражению сердца или мышечной
системы.
medcollege.ru
19
20.
РЕФЕРЕНСНЫЕ ЗНАЧЕНИЯВозраст, пол
Референсные значения
2 – 5 дней
< 652 Ед/л
5 дней – 6 мес.
< 295 Ед/л
6 – 12 мес.
< 203 Ед/л
1 – 3 года
< 228 Ед/л
3 – 6 лет
< 149 Ед/л
6 – 12 лет
12 – 17 лет
> 17 лет
женский
< 154 Ед/л
мужской
< 247 Ед/л
женский
< 123 Ед/л
мужской
< 270 Ед/л
женский
< 167 Ед/л
мужской
< 190 Ед/л
medcollege.ru
20
21.
ПРИЧИНЫ ПОВЫШЕНИЯ АКТИВНОСТИКРЕАТИНКИНАЗЫ ОБЩЕЙ
инфаркт миокарда,
миокардиты,
миокардиодистрофии,
полимиозит,
дерматомиозит,
мышечные дистрофии,
травмы, ожоги,
гипотиреоз,
опухолевый процесс в организме,
распад опухоли,
прием дексаметазона, статинов, фибратов, амфотерицина В, обезболивающих,
алкоголя, кокаина,
интенсивная физическая нагрузка,
судороги, эпилептический статус,
оперативные вмешательства.
medcollege.ru
21
22.
ПРИЧИНЫ ПОНИЖЕНИЯ АКТИВНОСТИКРЕАТИНКИНАЗЫ ОБЩЕЙ
снижение мышечной массы,
алкогольное поражение печени,
коллагенозы (например, ревматоидный артрит), гипертиреоз,
прием аскорбиновой кислоты, амикацина, аспирина, беременность.
Что может влиять на результат?
Необходимо сообщать врачу информацию о принимаемых лекарствах, а также об
имеющихся хронических заболеваниях.
Оперативные вмешательства и в некоторых случаях внутривенные инъекции
повышают активность креатинкиназы.
medcollege.ru
22
23.
ИЗОФЕРМЕНТЫ ЛАКТАТДЕГИДРОГЕНАЗЫ (LDH)Изоферменты LDH являются ферментами, которые играют важную роль в обмене
глюкозы и энергетическом обмене в организме. Они катализируют реакцию превращения
лактата в пируват, что необходимо для процесса гликолиза и образования энергии.
Измерение уровня изоферментов LDH в крови может быть полезным индикатором
повреждения тканей организма. Повышенные уровни LDH могут указывать на наличие
различных заболеваний, таких как инфаркт миокарда, рак или гемолитическая анемия. Это
помогает врачам диагностировать и контролировать состояние тканей пациента.
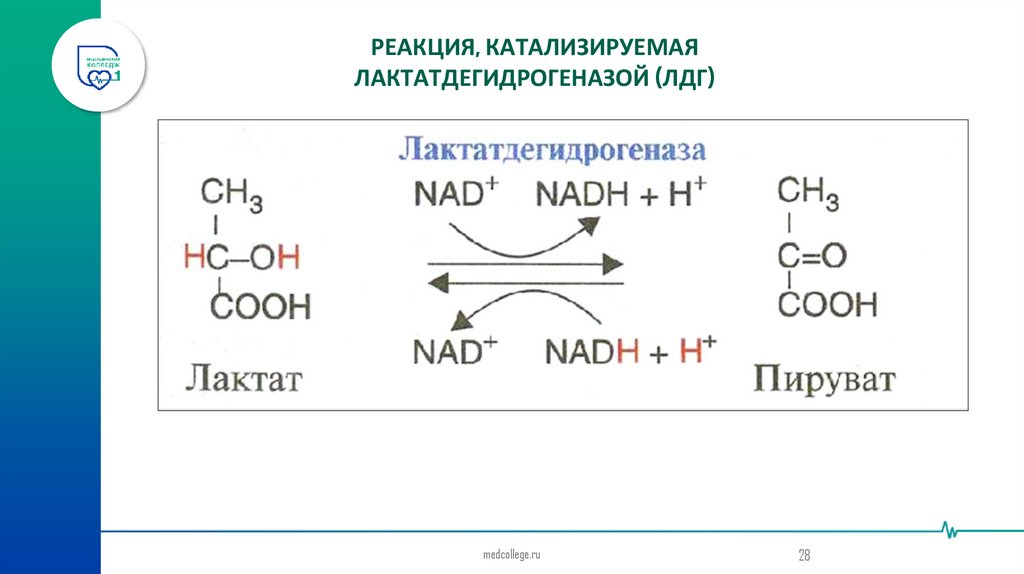
ЛДГ фермент, который катализирует обратимую реакцию: НАДН2
НАД+
пируват ←ЛДГ→ лактат
medcollege.ru
23
24.
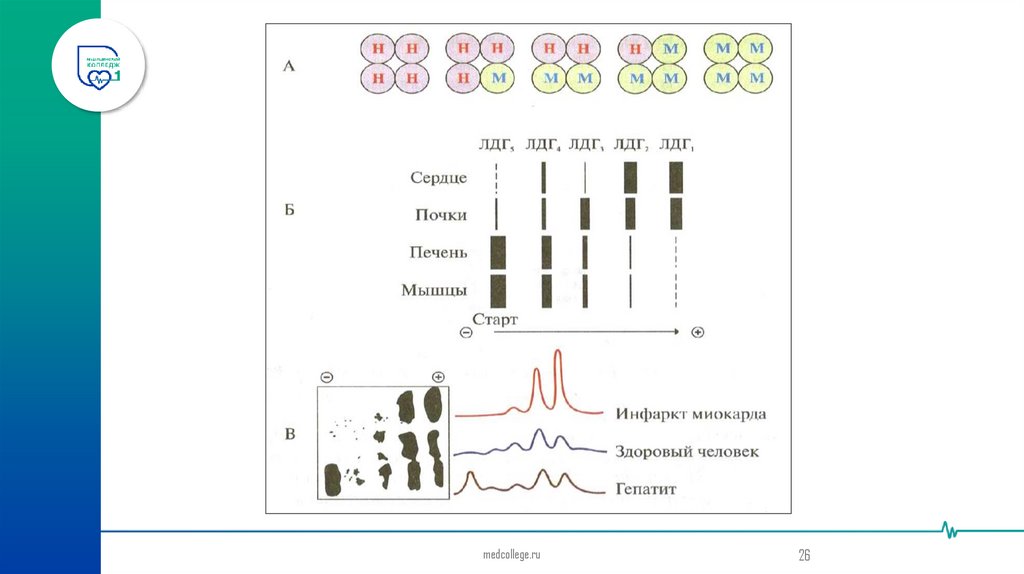
ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров(субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется
двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне
четвертичной структуры:
ЛДГ1(НННН),
ЛДГ2(НННМ),
ЛДГ3(ННММ),
ЛДГ4(НМММ),
ЛДГ5(ММММ).
Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в
составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты,
поэтому они несут разный заряд и могут быть разделены методом электрофореза.
medcollege.ru
24
25.
ЛОКАЛИЗАЦИЯ ЛАКТАТДЕГИДРОГЕНАЗЫ(ЛДГ)
Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует
аэробный обмен, там преобладают ЛДГ1, ЛДГ2 (миокард, надпочечники), где анаэробный
обмен - ЛДГ4, ЛДГ5 (скелетная мускулатура, печень). В процессе индивидуального развития
организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ.
У
зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит
увеличение содержания ЛДГ1, ЛДГ2.
Существование изоформ повышает адаптационную возможность тканей, органов,
организма в целом к меняющимся условиям. По изменению изоферментного состава
оценивают метаболическое состояние органов и тканей.
medcollege.ru
25
26.
medcollege.ru26
27.
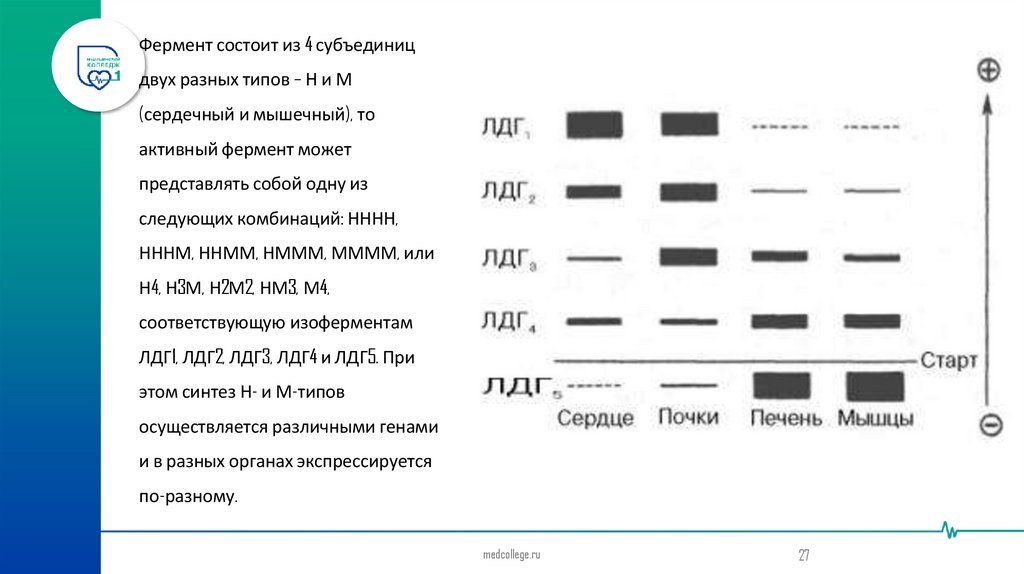
Фермент состоит из 4 субъединицдвух разных типов – Н и М
(сердечный и мышечный), то
активный фермент может
представлять собой одну из
следующих комбинаций: НННН,
НННМ, ННММ, НМММ, ММММ, или
Н4, Н3М, Н2М2, НМ3, М4,
соответствующую изоферментам
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При
этом синтез Н- и М-типов
осуществляется различными генами
и в разных органах экспрессируется
по-разному.
medcollege.ru
27
28.
РЕАКЦИЯ, КАТАЛИЗИРУЕМАЯЛАКТАТДЕГИДРОГЕНАЗОЙ (ЛДГ)
medcollege.ru
28
29.
Заключение по темеИзоферменты играют важную роль в генетике, позволяя исследовать
различия
в
генетическом
материале
и
определять
генетическую
вариабельность. Они являются уникальными формами ферментов, которые
могут быть использованы для идентификации и классификации организмов.
Методы
исследования
изоферментов
позволяют
проводить
генетические анализы и определять генетическую структуру популяций.
Применение изоферментов в генетических исследованиях помогает понять
эволюционные процессы и раскрыть генетические особенности организмов.
medcollege.ru
29
30.
Департамент здравоохранения города МосквыГосударственное бюджетное профессиональное образовательное
учреждение Департамента здравоохранения города Москвы
«Медицинский колледж № 1»
(ГБПОУ ДЗМ «МК № 1»)
Теоретическое занятие № 20
Лабораторные биохимические исследования
при заболеваниях сердца
Специальность: 31.02.03 Лабораторная диагностика
Форма обучения: очная
Курс IV (8 семестр)
Тема 3.10. Энзимодиагностика
Преподаватель: Диденко Изабелла Владимировна
Москва
2024


























 medicine
medicine