Similar presentations:
Физическое состояние вещества
1. ФИЗИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
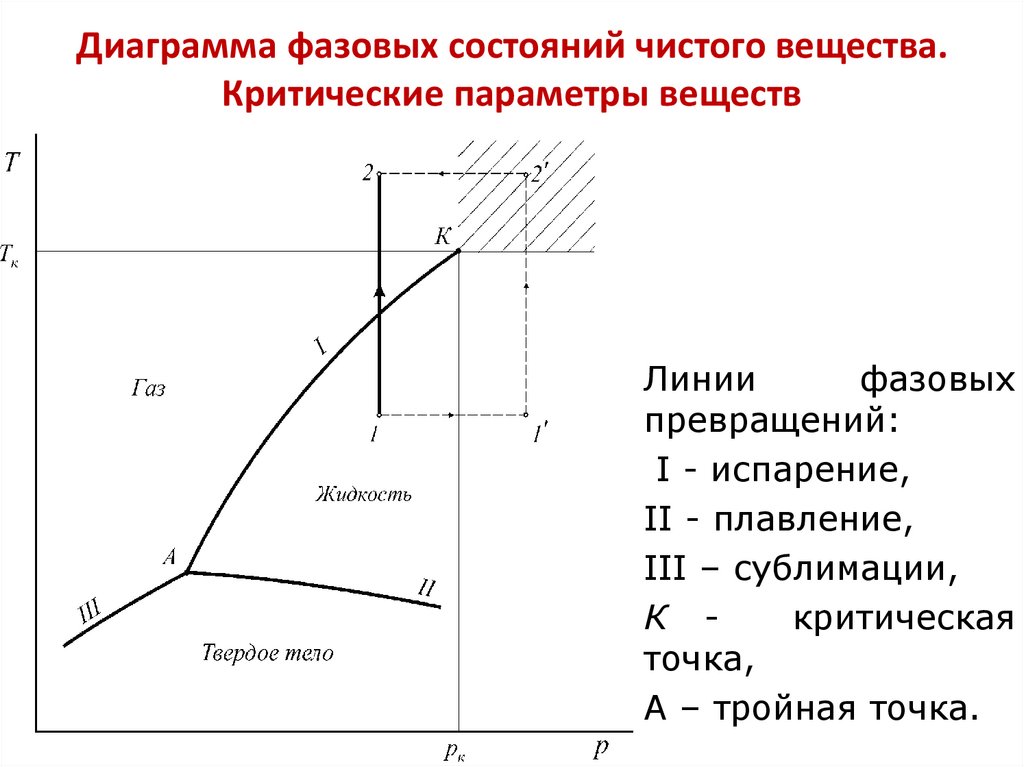
2. Диаграмма фазовых состояний чистого вещества. Критические параметры веществ
Линиифазовых
превращений:
I - испарение,
II - плавление,
III – сублимации,
К критическая
точка,
А – тройная точка.
3.
• Энергетической границей между фазами является теплотафазового перехода (r, кДж/кг): между жидкостью и паром теплота испарения, между твердым телом и жидкостью –
теплота плавления, а между твердым телом и газом – теплота
сублимации.
Tк – это температура, при
• Критическая температура
которой и выше которой газ в результате сжатия не может быть
переведен в жидкое состояние.
Критическое давление p к – это такое давление, при котором
и выше которого жидкость невозможно перевести в
газообразное состояние, а критический объем представляет
собой максимальный объем данного количества вещества в
жидком состоянии.
p pк ; T Tк
• В закритической области (
может находиться только в однофазном состоянии.
) вещество
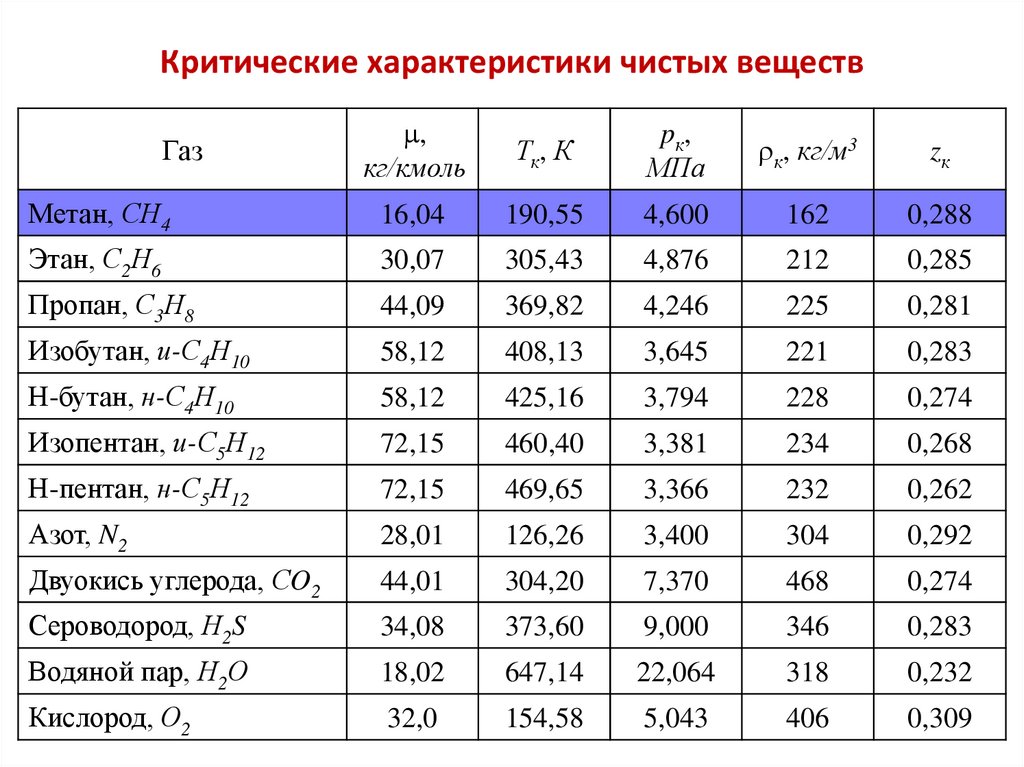
4. Критические характеристики чистых веществ
,кг/кмоль
Тк, К
p к,
МПа
к, кг/м3
zк
Метан, СН4
16,04
190,55
4,600
162
0,288
Этан, С2Н6
30,07
305,43
4,876
212
0,285
Пропан, С3Н8
44,09
369,82
4,246
225
0,281
Изобутан, и-С4Н10
58,12
408,13
3,645
221
0,283
Н-бутан, н-С4Н10
58,12
425,16
3,794
228
0,274
Изопентан, и-С5Н12
72,15
460,40
3,381
234
0,268
Н-пентан, н-С5Н12
72,15
469,65
3,366
232
0,262
Азот, N2
28,01
126,26
3,400
304
0,292
Двуокись углерода, СO2
44,01
304,20
7,370
468
0,274
Сероводород, Н2S
34,08
373,60
9,000
346
0,283
Водяной пар, Н2О
18,02
647,14
22,064
318
0,232
Кислород, О2
32,0
154,58
5,043
406
0,309
Газ
5. Уравнения состояния идеального и реального газа
•В настоящее время известны десятки уравненийсостояния реальных газов и газовых смесей и
практически все эти уравнения структурно построены
на основе уравнения состояния идеального газа –
уравнения Клапейрона с поправками, учитывающими
различия между реальным и идеальным газом и
глубину этих различий.
• Идеальным газом называется такой газ, в котором
молекулы являются материальными точками, не
имеющие между собой никакого взаимодействия,
кроме соударений.
6.
•Атмосферный воздух, продукты сгорания ГТУ, перегретыепары чистых веществ с высокой степенью перегрева, то есть
газы и газовые смеси, основные компоненты которых находятся
в значительном удалении от линии насыщения, практически
полностью соответствуют модели идеального газа и
подчиняются уравнению Клайперона.
•Формы представления уравнения Клайперона:
pv RT
•для 1 кг
кг
pV GRT
•для 1 кмоля
pv R T
•для G
•для G
кмолей
pV GRT
где R – универсальная газовая постоянная, R 8314 Дж /( кмоль К )
R – характеристическая газовая постоянная, R R / , Дж/(кг·К)
G – количество киломолей газа, G G / ; – молярная
масса газа, кг/кмоль.
7. Некоторые законы идеальных газов
Закон Бойля – Мариотта:Закон Гей Люссака:
p1 v2
.
p2 v1
t idem;
p idem;
Закон Шарля:
T2 v2
.
T1 v1
p2 T2
.
p1 T1
v idem;
Закон Авогадро:
v f ( p,t ).
Закон Джоуля:
u u(T );
Закон Дальтона:
p i ri pm ;
n
h h(T ).
n
n
p r p p r p .
i 1
i
i 1
i
m
m
i 1
i
m
8. Некоторые уравнения состояния реального газа
Для природных газов при условиях магистрального транспортарекомендуется использовать ряд уравнений состояния:
Джоуля-Томсона (1862 г.)
c p
pv RT 2
T
Бенедикта-Вебба-Рубина (1942 г.)
b
a a
RT
B
A
4
0
0
v
v v
RT 1
p
2
v v
1
c
v2
2 C0 1 2 e
v v
T
RT
a T 0,5
Редлиха-Квонга (1949 г.)
p
v b v (v b)
RT
a
Соаве (1972 г.)
p
v b v ( v b)
9.
В инженерных расчетах часто пользуются болеепростым, чем ранее приведенные, уравнением
состояния, рекомендуемом для реальных газов и
газовых смесей
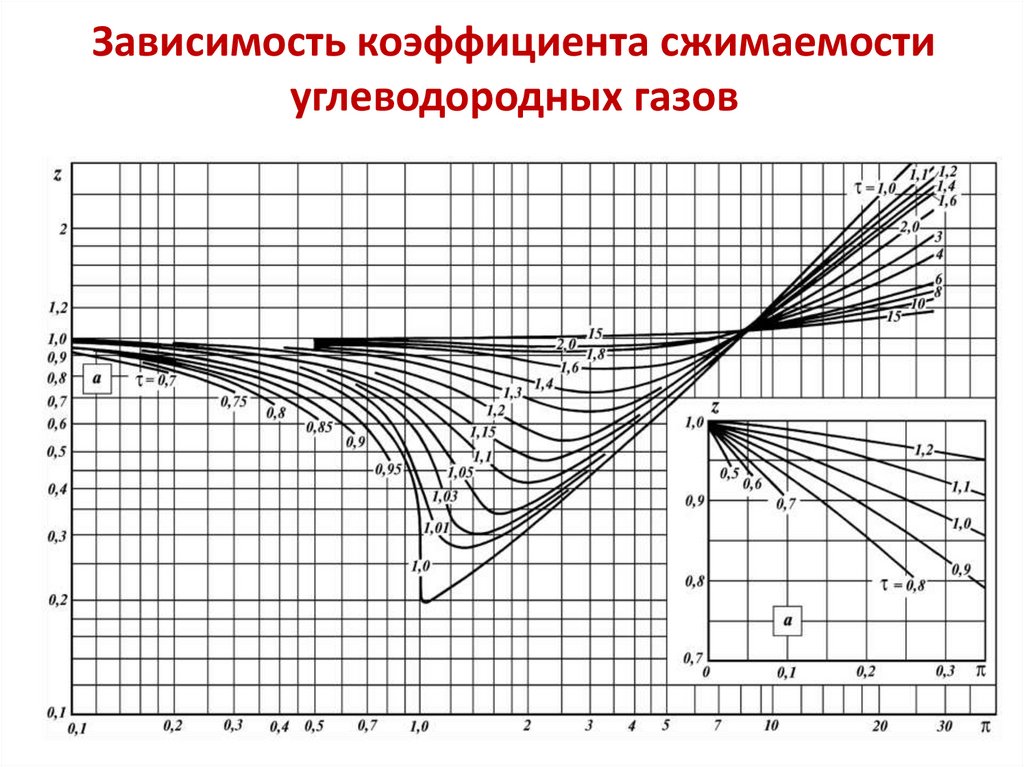
pv zRT
z f , ,
где z – коэффициентом сжимаемости,
– приведенное давление, p / pк ;
– приведенная температура, T / Tк ;
p - критическое давление; Tк - критическая температура.
к
Коэффициент сжимаемости z учитывает различие между
идеальным и реальными газами (для идеального газа
z = 1), зависит от давления, температуры и характеристик,
определяемых природой газа.
z 1 0,4273
3,668
(СТО Газпром).
10.
• Дляобобщения
данных
по
коэффициентам
сжимаемости различных газов был использован
принцип
«соответственных»
состояний,
сформулированный
Ван-дер-Ваальсом
и
утверждающий,
что
вещества
находятся
в
соответственных состояниях при одинаковой степени
удаления от критической области.
• Степень удаления состояния вещества от критической
области определяется с помощью приведенных
параметров: , , w . Состояния веществ, в которых они
имеют одинаковые
называются
, , w
соответственными.
• Таким образом, в соответствии с принципом
«соответственных» состояний можно обобщить
данные по коэффициенту сжимаемости для групп
подобных веществ.









 physics
physics