Similar presentations:
Аминокислоты. Практическое занятие
1.
Аминокислоты.• Практическое занятие
2.
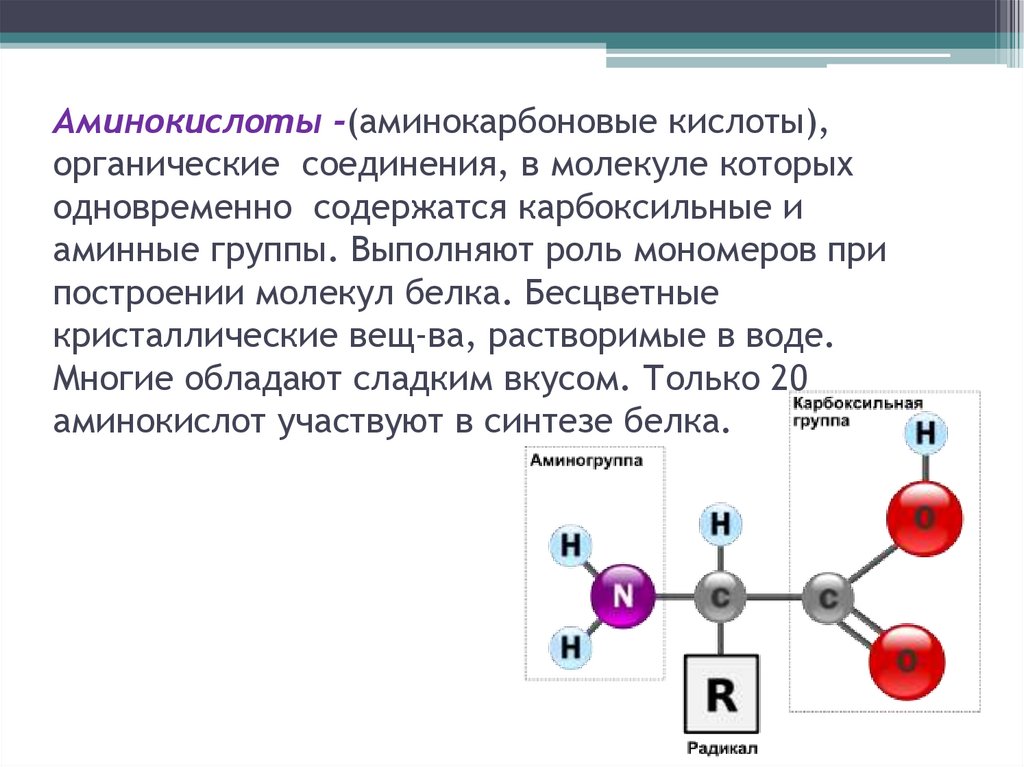
Аминокислоты -(аминокарбоновые кислоты),органические соединения, в молекуле которых
одновременно содержатся карбоксильные и
аминные группы. Выполняют роль мономеров при
построении молекул белка. Бесцветные
кристаллические вещ-ва, растворимые в воде.
Многие обладают сладким вкусом. Только 20
аминокислот участвуют в синтезе белка.
3.
Варианты классификации аминокислот:• В зависимости от положения аминогруппы
(альфа-аминокислоты,бета-аминокислоты)
• По конфигурации молекулы- L и D-изомеры.
• По оптической активности в отношении
плоскости поляризации.
• По участию в синтезе белков
(протеиногенные и непротеиногенные).
• По строению бокового радикала.
• По кислотно-основным свойствам.
• По необходимости для организма
(заменимые, незаменимые)
4.
Все протеиногенные аминокислотыявляются альфа-аминокислотами.
5.
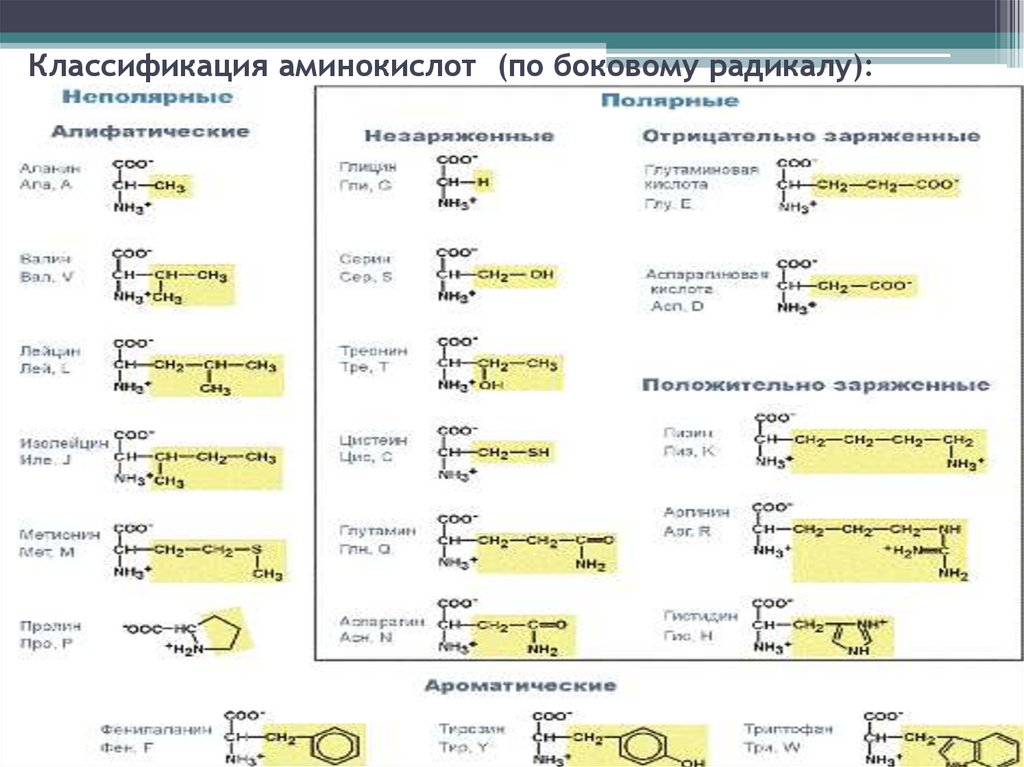
Классификация аминокислот (по боковому радикалу):6.
Общие свойства аминокислот.• Кислотноосновные свойства аминокислот
определяют многие свойства белков.Все
аминокислоты-амфотерные соединения ,
они могут проявлять кислотные свойства,
обусловленные карбоксильной группой, и
основные, обусловленные аминогруппой.
• Растворы аминокислот обладают свойствами
буферных растворов.
• Вступают в реакцию этерификации (на
примере глицина).
7.
Классификация по R-группам1. Неполярные (гидрофобные):
аланин, валин, изолейцин, лейцин, метионин,
H
пролин, триптофан, фенилаланин
CH3
CH C COOCH3
NH3+
2. Полярные незаряженные:
аспарагин, глицин, глутамин, серин, тирозин,
треонин, цистеин
COO-
NH3+
C H
H
8.
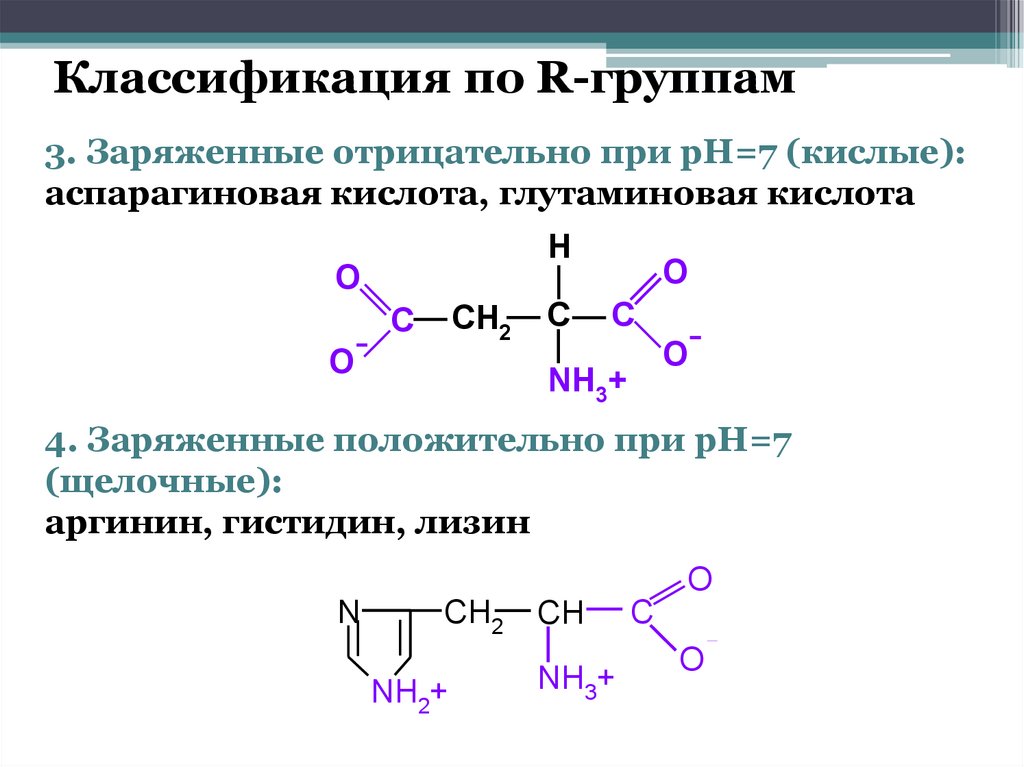
Классификация по R-группам3. Заряженные отрицательно при pH=7 (кислые):
аспарагиновая кислота, глутаминовая кислота
H
O
O
CH2
C
O
C
C
O
NH3+
4. Заряженные положительно при pH=7
(щелочные):
аргинин, гистидин, лизин
O
N
CH2
NH2+
CH
NH3+
C
O
9.
Получают аминокислотыгидролизом белков или с
помощью химических реакций
в присутствии катализатора.
10.
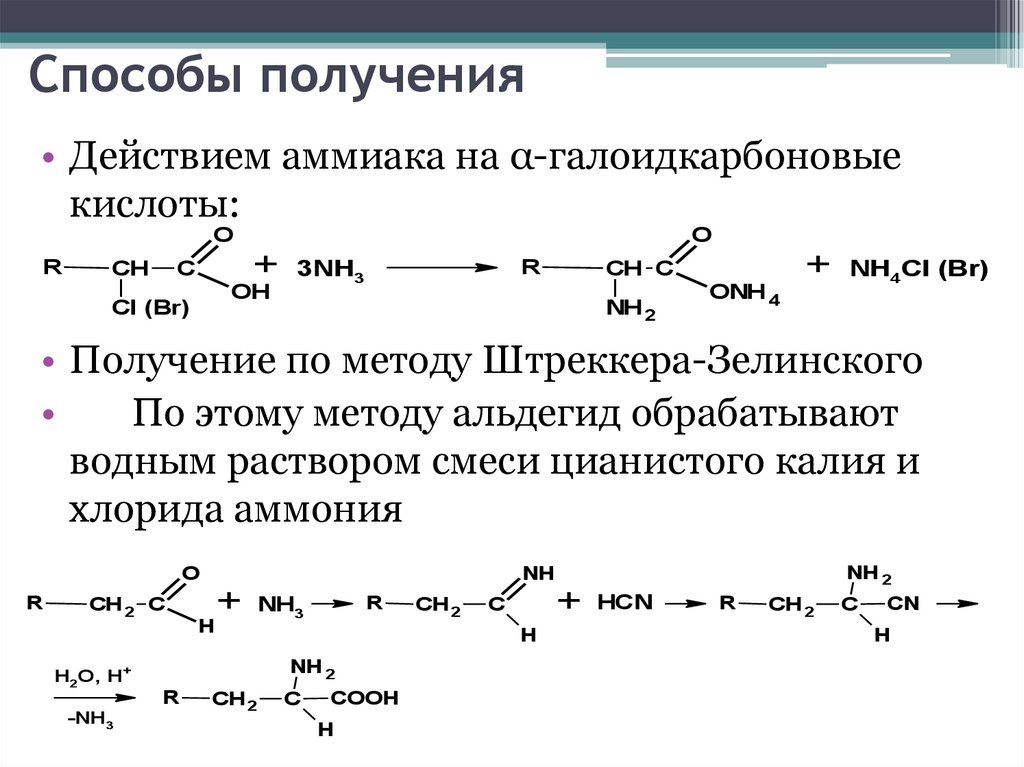
Способы получения• Действием аммиака на α-галоидкарбоновые
кислоты:
O
R
СН
O
+ 3NH
С
OH
Cl (Br)
R
3
+ NH Cl (Br)
СН С
NH 2
4
ONH 4
• Получение по методу Штреккера-Зелинского
По этому методу альдегид обрабатывают
водным раствором смеси цианистого калия и
хлорида аммония
O
R
СН 2 С
R
-NH3
+ NH
H
R
3
СН 2
СН 2
+ HCN
С
H
NH 2
H2O, H+
NH 2
NH
С
COOH
H
R
СН 2
С
CN
H
11.
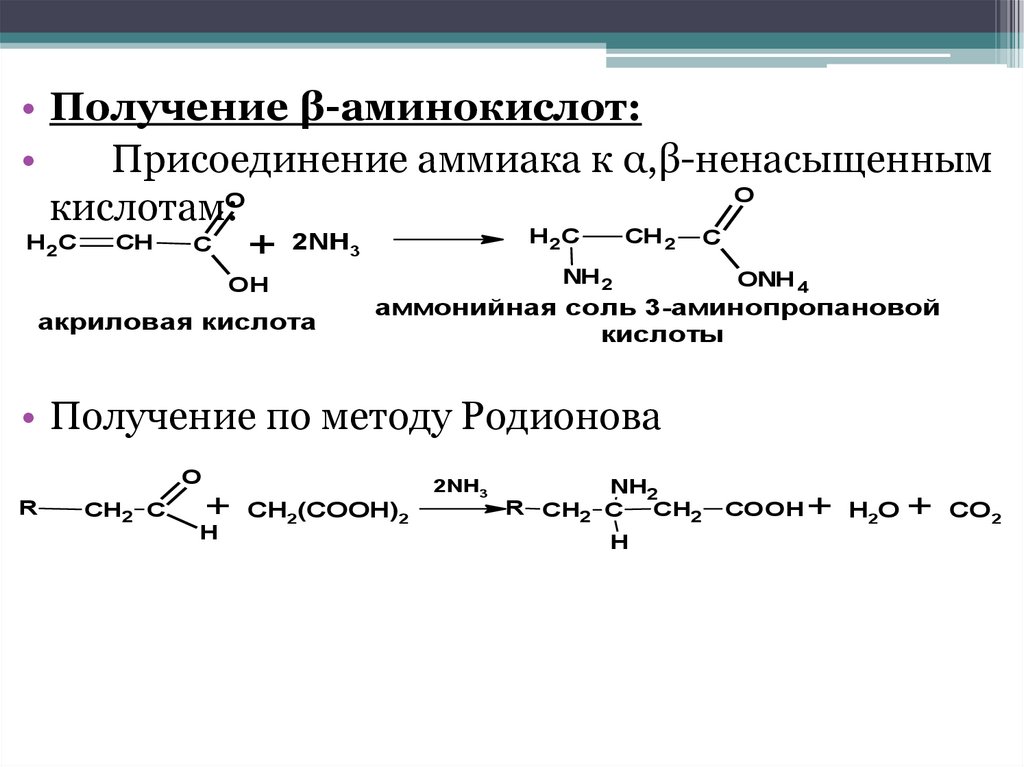
• Получение β-аминокислот:Присоединение аммиака к α,β-ненасыщенным
O
кислотам:O
H2C
СН
С
H2C
+ 2NН3
OH
акриловая кислота
CH 2
NH 2
С
ONH 4
аммонийная соль 3-аминопропановой
кислоты
• Получение по методу Родионова
O
R
СН2 С
+ СH2(COOH)2
H
2NH3
NH2
R СН2 С
CH2
H
COOH
+ H2O + CO2
12.
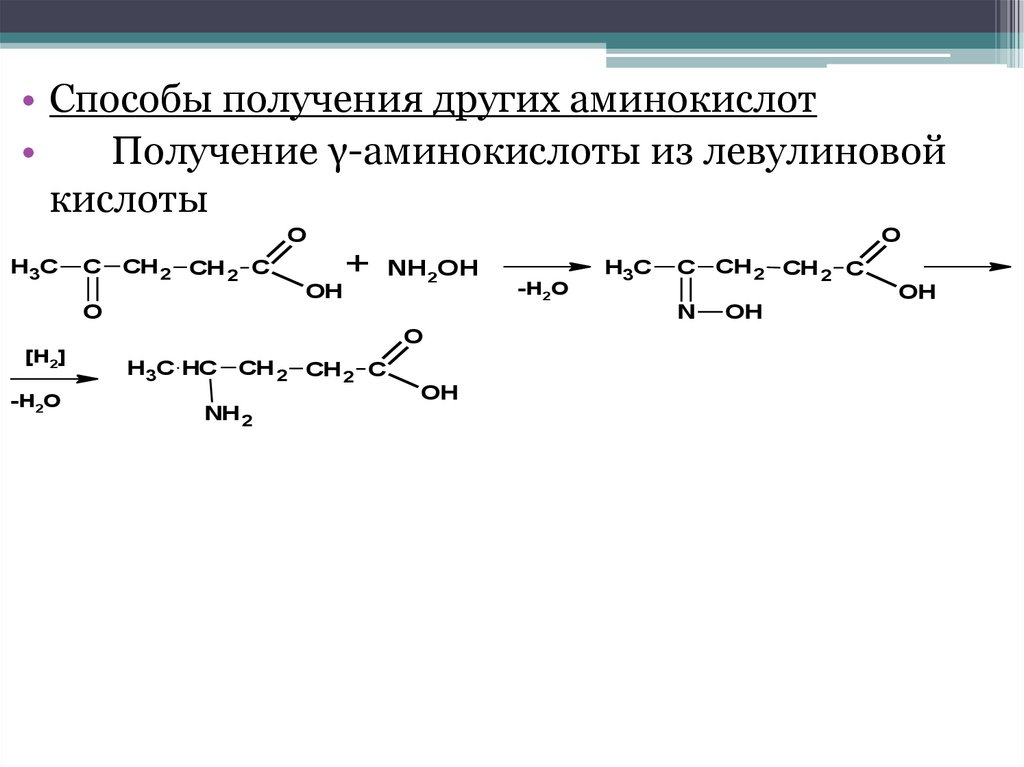
• Способы получения других аминокислотПолучение γ-аминокислоты из левулиновой
кислоты
O
H3C
C
CH 2 СН 2 С
O
+ NH OH
2
OH
O
-H2O
H3C
C CH 2 СН 2 С
N
O
[H2]
-H2O
H3C HC
CH 2 СН 2 С
NH 2
OH
OH
OH
13.
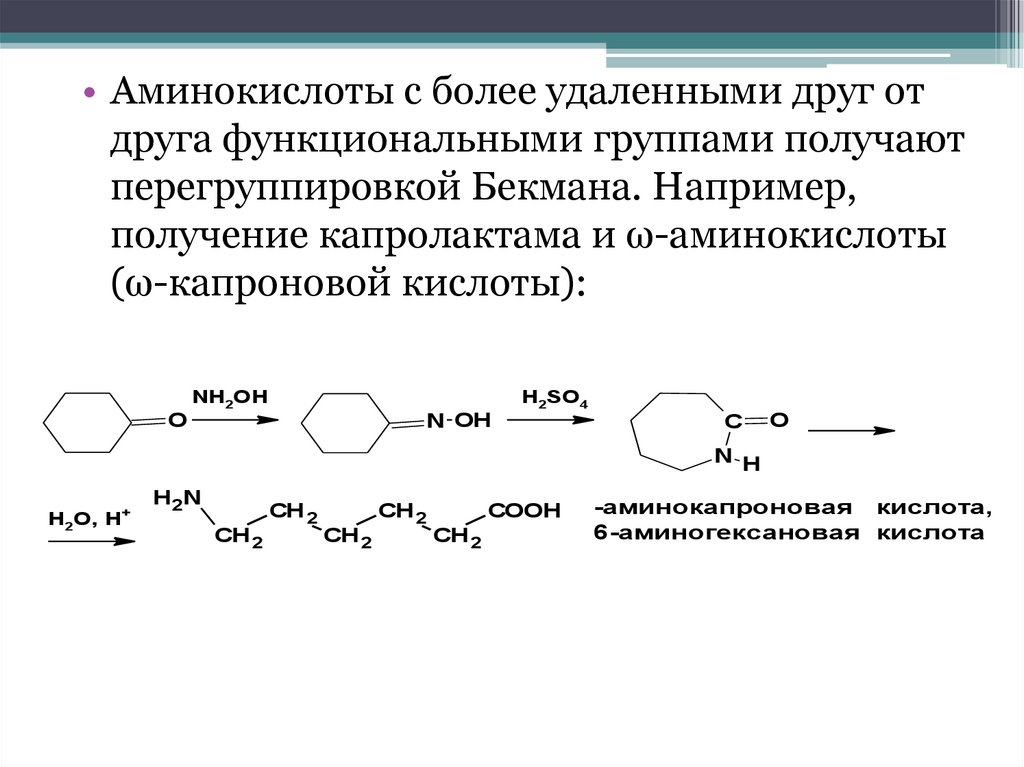
• Аминокислоты с более удаленными друг отдруга функциональными группами получают
перегруппировкой Бекмана. Например,
получение капролактама и ω-аминокислоты
(ω-капроновой кислоты):
NH2OH
H2SO4
O
N OH
C
O
N H
+
H2O, H
H2N
CH 2
CH 2
CH 2
CH 2
COOH
CH 2
-аминокапроновая кислота,
6-аминогексановая кислота
14.
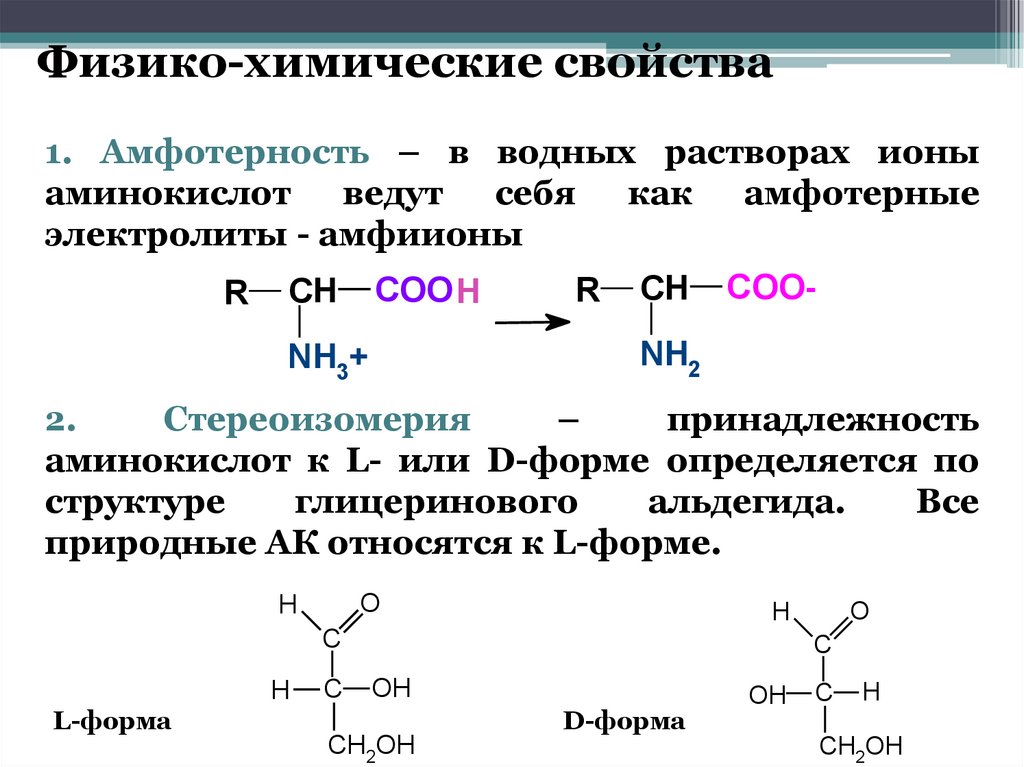
Физико-химические свойства1. Амфотерность – в водных растворах ионы
аминокислот
ведут
себя
как
амфотерные
электролиты - амфиионы
R
COO H
CH
R
CH
COO-
NH2
NH3+
2.
Стереоизомерия
–
принадлежность
аминокислот к L- или D-форме определяется по
структуре
глицеринового
альдегида.
Все
природные АК относятся к L-форме.
O
H
C
H
L-форма
C
O
H
C
OH
CH2OH
D-форма
OH
C
H
CH2OH
15.
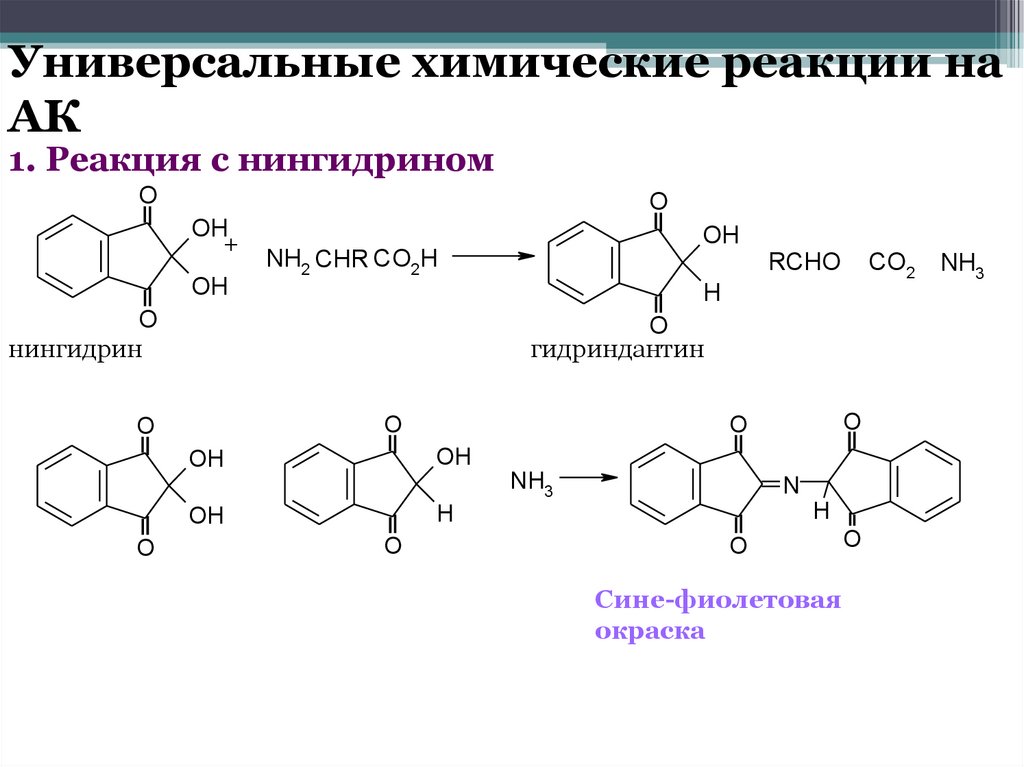
Универсальные химические реакции наАК
1. Реакция с нингидрином
O
O
OH
+
OH
OH
NH2 CHR CO2H
CO2
H
O
нингидрин
O
гидриндантин
O
O
O
O
OH
OH
NH3
N
H
H
OH
O
RCHO
O
O
Сине-фиолетовая
окраска
O
NH3
16.
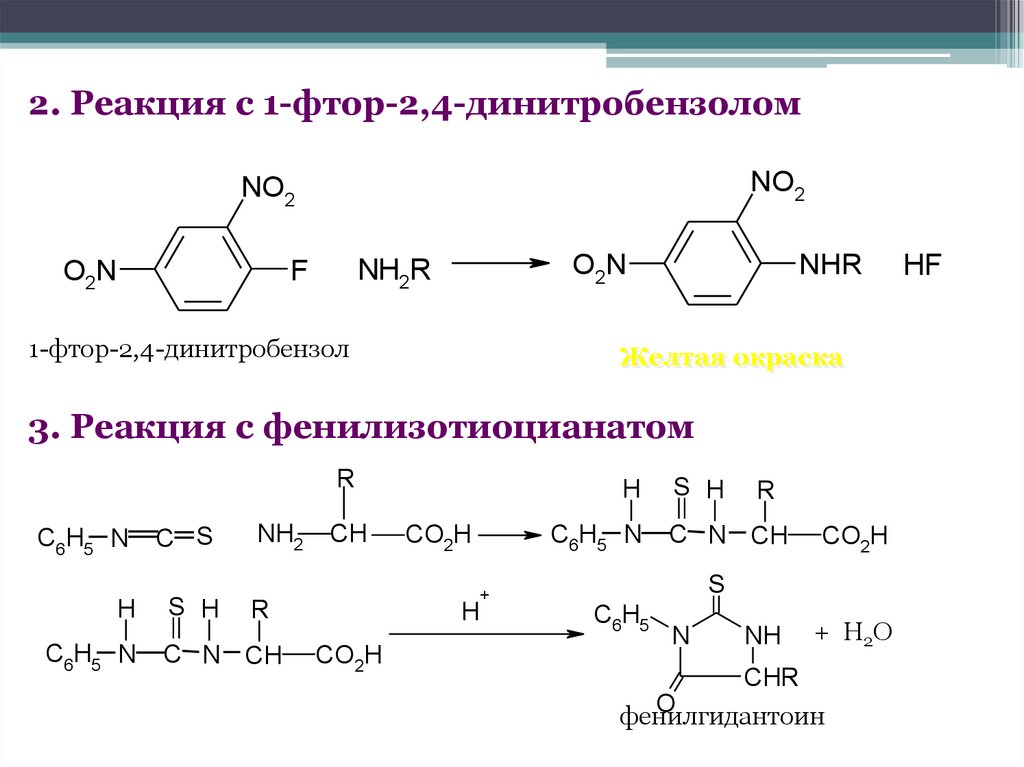
2. Реакция с 1-фтор-2,4-динитробензоломNO2
NO2
O2N
NHR
O2N
NH2R
F
1-фтор-2,4-динитробензол
Желтая окраска
3. Реакция с фенилизотиоцианатом
R
C6H5 N
H
C6H5 N
C S
S H
NH2
CH
C6H5 N
CO2H
+
R
C N CH
H
H
CO2H
S H
R
C N CH
CO2H
S
C6H5
N
NH
+ Н2О
CHR
O
фенилгидантоин
HF
17.
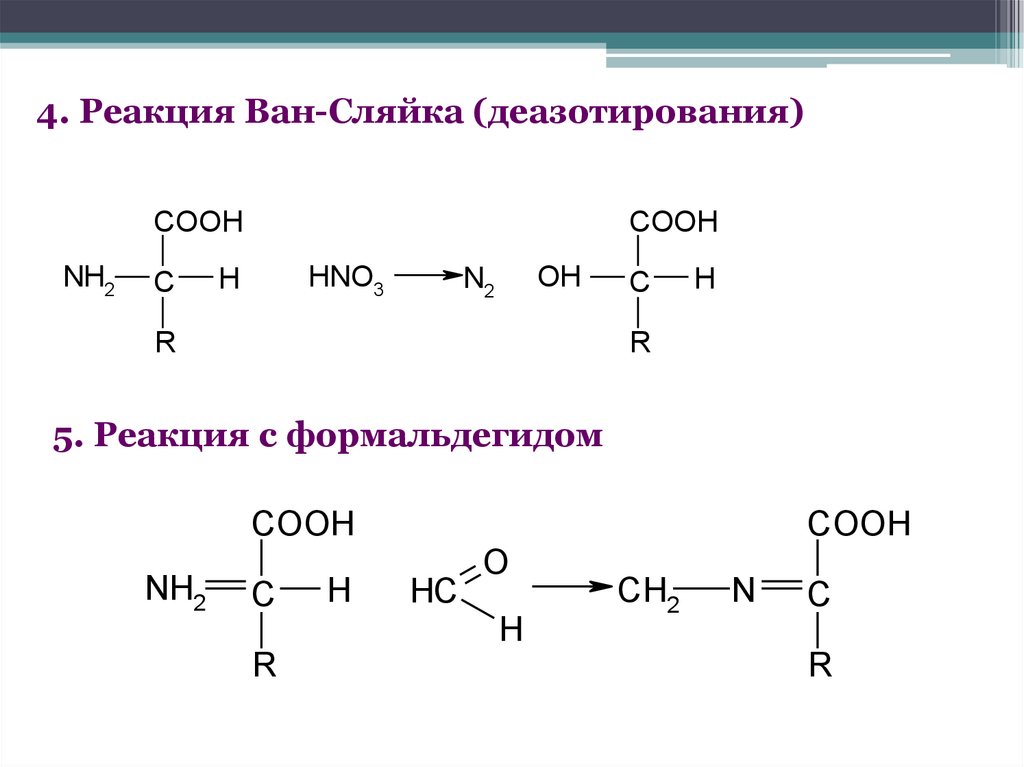
4. Реакция Ван-Сляйка (деазотирования)COOH
NH2
C
COOH
HNO3
H
OH
N2
R
C
H
R
5. Реакция с формальдегидом
COOH
NH2
C
H
COOH
HC
O
H
R
CH2
N
C
R
18.
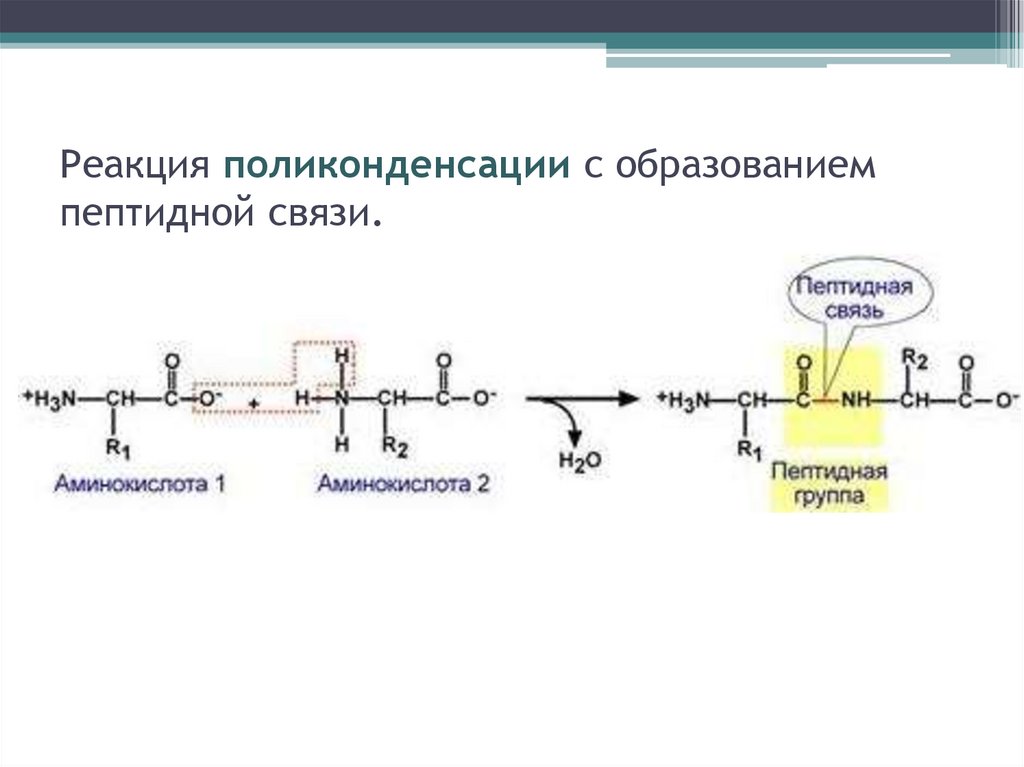
Реакция поликонденсации с образованиемпептидной связи.
19.
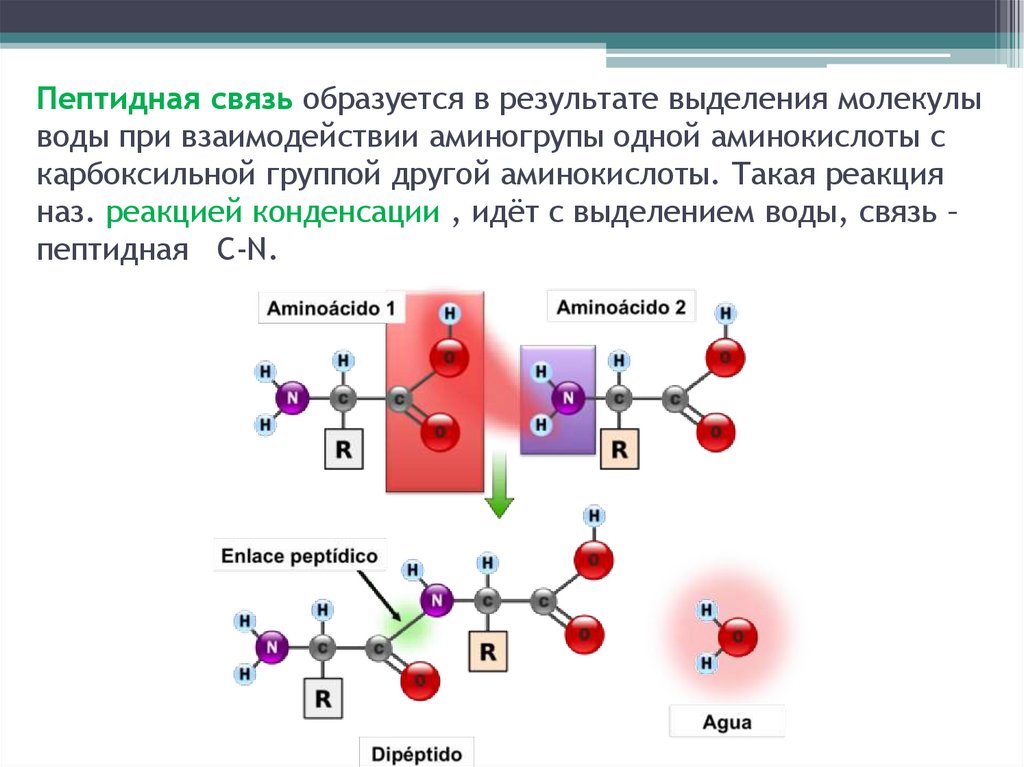
Пептидная связь образуется в результате выделения молекулыводы при взаимодействии аминогрупы одной аминокислоты с
карбоксильной группой другой аминокислоты. Такая реакция
наз. реакцией конденсации , идёт с выделением воды, связь –
пептидная C-N.
20.
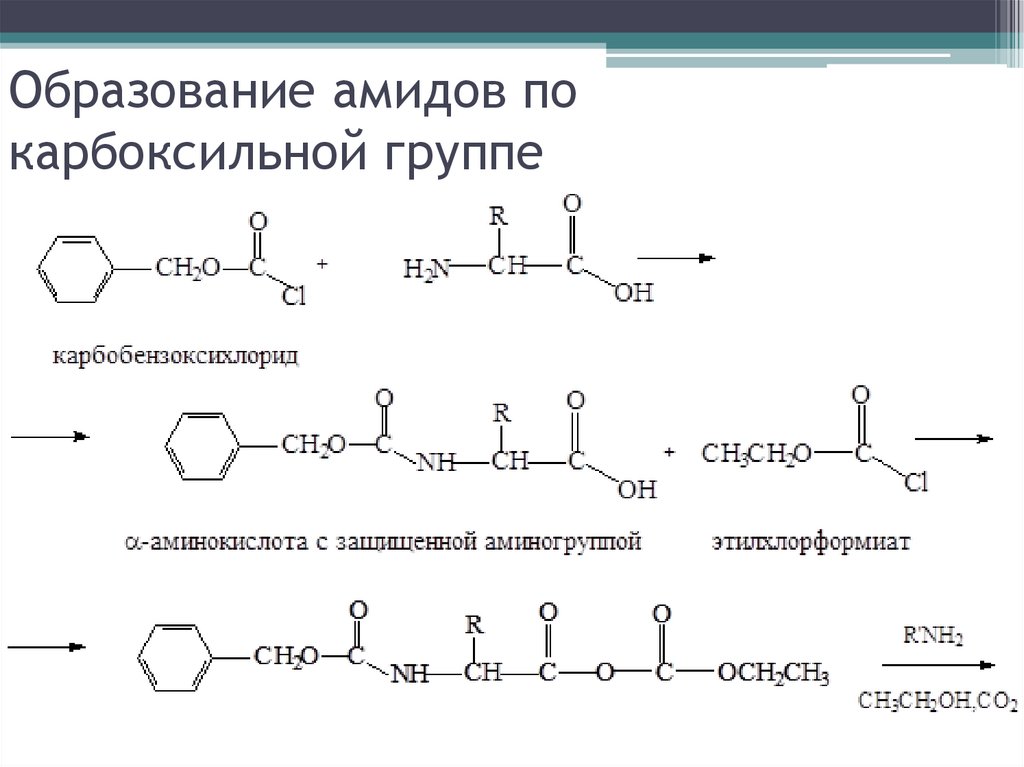
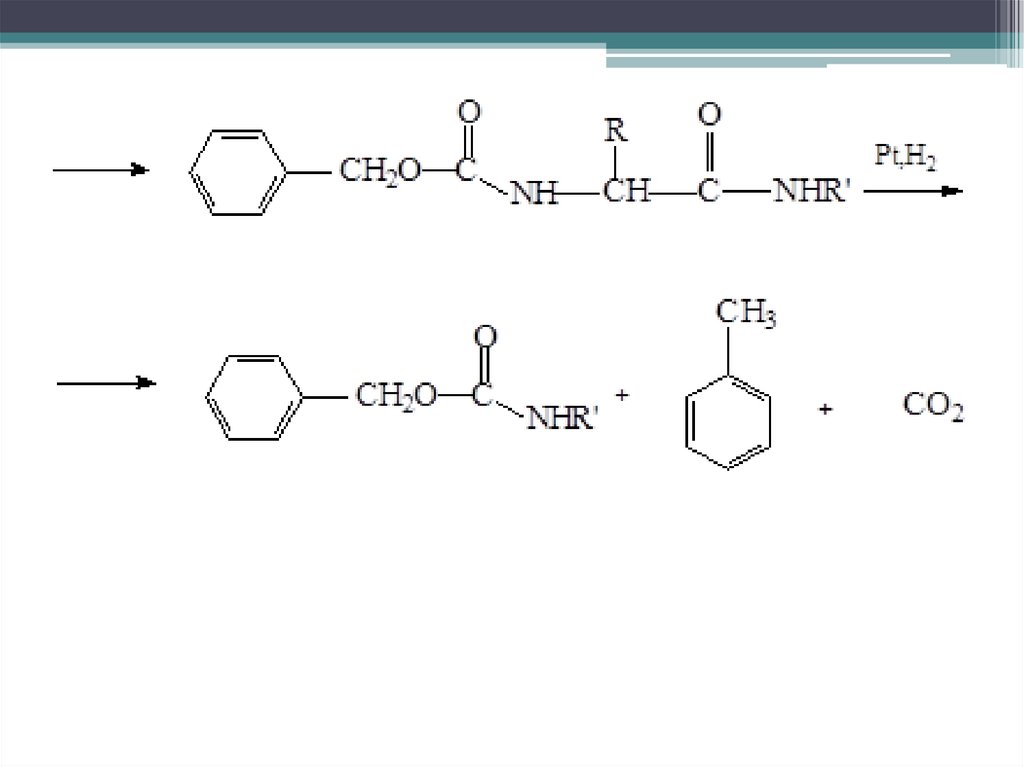
Образование амидов покарбоксильной группе







 chemistry
chemistry








