Similar presentations:
Общая характеристика элементов подгруппы углерода. Углерод, нахождение в природе, аллотропные видоизменения
1. Урок химии 9 класс
Общая характеристика элементовподгруппы углерода. Углерод,
нахождение в природе,
аллотропные видоизменения,
химические свойства углерода.
2. Характеристика подгруппы углерода
Углерод, кремний, германий, олово и свинецсоставляют главную подгруппу 4 группы.
Среди них наибольшее значение имеют углерод и
кремний
Латинское название сагboneum Углерод получил от
carbo - уголь.
1. Характеристика углерода по ПСХЭ.
а) неметалл
б) IV группа, главная подгруппа
в) II период ,
г) степени окисления -4,0,+2,+4
д) оксиды- СО( не образует кислот)- угарный газ
СО2 ( кислотообразующий) – углекислый газ
e) СН4 - метан
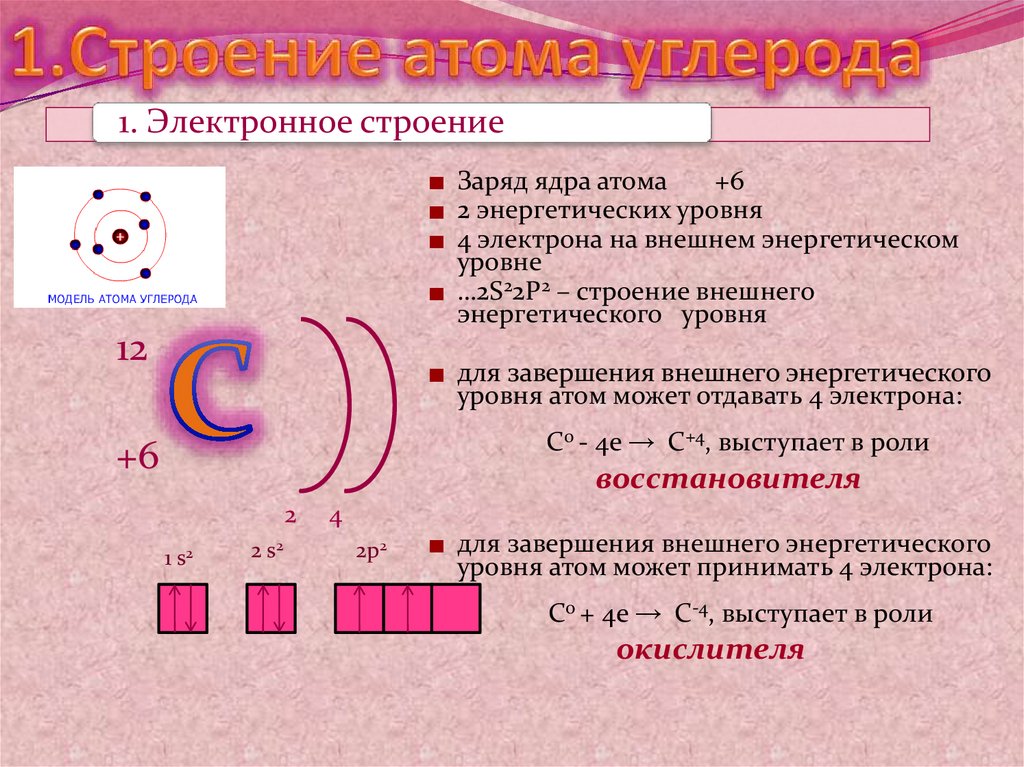
3. 1.Строение атома углерода
1. Электронное строениеЗаряд ядра атома
+6
2 энергетических уровня
4 электрона на внешнем энергетическом
уровне
…2S22P2 – строение внешнего
энергетического уровня
12
для завершения внешнего энергетического
уровня атом может отдавать 4 электрона:
С0 - 4е → С+4, выступает в роли
+6
восстановителя
2
1 s2
2 s2
4
2p2
для завершения внешнего энергетического
уровня атом может принимать 4 электрона:
С0 + 4е → С-4, выступает в роли
окислителя
4. Аллотропные модификации углерода
Образует аллотропные модификации:Аллотропия- явление существования в виде 2-х или
нескольких простых веществ, различных по строению и
свойствам
Причина аллотропии: различное строение кристаллической
решетки:
алмаз – объемная тетраэдрическая решетка
графит – плоскостная атомная решетка
карбин - линейная решетка
фуллерен – экзотическая модификация в виде футбольных
мячей
аморфный углерод – никакой кристаллической структуры
5. А Л М А З
АЛМАЗАЛМАЗ - (от греческого "адамас" неодолимый)
бесцветное кристаллическое вещество с атомной решеткой.
Каждый атом углерода в алмазе окружен четырьмя другими,
расположенными от него в направлениях от центра тетраэдра к его
вершинам.
Алмаз имеет высокую твердость, плотность 3,5 г/см2, плохо проводит
тепло и практически не проводит электрический ток.
Это самое тугоплавкое природное вещество tпл =3730С.
В чистом виде алмаз сильно преломляет свет.
Применение: как украшение, а также для резки стекла, бурения
горных пород и шлифования особо твердых материалов.
6. Применение алмазов.
7. А что такое «карат»?
Карат – это единица измерения драгоценныхкамней.
В Аравийской пустыне растет дерево Caratina
silikva (каратина силиква), косточка плодов
которого весит всегда, - в любое время года и на
любом дереве 0.2 г.
Искусственно ограненные алмазы
называются бриллиантами и
являются предметом роскоши.
8.
Да, алмаз - нестареющий камень. Он - самый-самый из минералов по всемпоказателям. Имеет самую высокую твердость - 10, алмаз режется только алмазом.
Он - самый прозрачный. Не зря его называют "ангельской слезой". Бывают
желтоватые и голубоватые и очень редко - черные разновидности. Его отличает
изумительная игра света при бриллиантовой огранке. Он самый дорогой, причем
при увеличении размеров стоимость возрастает многократно. Скажем, камень в 10
каратов будет стоить не в десять раз больше, алмаза в 1 карат, а примерно в 100 раз!
Индийский алмаз Кох-и-Нор ("Гора света") известен
несколько тысячелетий. По преданию им владели
последовательно 18 правителей Индостана. Сейчас
бриллиант в 108,9 каратов - в Англии, в короне
королевы Елизаветы II.
9. Промышленные месторождения связаны с кимберлитами, россыпями. Главные зарубежные добывающие страны: ЮАР, Конго (Заир),
Ботсвана, Намибия.В Российской Федерации месторождения в Якутии, на Урале.
10.
Самым большим алмазом из известных в мире был "Куллинан" (название- по имени президента южноафриканской алмазодобываюшей компании)
- 3106 каратов, подаренный в начале прошлого века англий-скому королю
Эдуарду VII. Но что делать с таким громадным кристаллом? В корону не
вставишь, и для скипетра великоват. Его аккуратно раскололи на 105
частей. Самый крупный осколок, названный "Куллинан-I", после
бриллиантовой огранки величиной в 530,2 карата - украсил скипетр
короля Великобритании и хранится в лондонском Тауэре
11. Алмаз «Орлов» - подарок императрице.
Алмаз в Российском скипетре - "Орлов" - поменьше - 189,62 карата, ноистория его теряется в веках. Когда-то этот камень, найденный в
индийских копях Голконды, сверкал в глазнице статуи Брахмы в храме.
Его украл французский солдат (это было уже в XVIII веке) и продал
капитану английского судна. В Лондоне алмаз был продан в шесть раз
дороже. Князь Орлов купил его уже в Амстердаме в 1773 году и подарил
Екатерине II. Императрица украсила им скипетр, который сейчас
хранится в Алмазном фонде в Москве.
12. Алмаз « Шах» - плата за смерть Грибоедова А. С.
Здесь же находится другой печально знаменитый алмаз "Шах" - 88,7карата, подаренный персидским шахом русскому правительству для
улучшения отношений после убийства в 1829 г. русского посла - поэта А. С.
Грибоедова. На гранях алмаза - арабские надписи - имена трех его
предыдущих владельцев, начиная с XVI в. Теперь в нашем Алмазном
фонде немало крупных отечественных якутских кристаллов, размером от
50 до нескольких сотен каратов.
13. Портретный алмаз
14.
Малая императорская коронаЗвезда ордена
Св. Андрея Первозванного
Большая императорская корона
Скипетр императорский
15.
ГРАФИТКристаллическая решётка графита:
для графита характерна гексагональная
кристаллическая решетка. Состоит из
параллельных слоев, образованных
правильными шестиугольниками из
атомов углерода.
Графит имеет слоистую структуру.
В кристаллической решетке графита
атомы углерода, лежащие в одной
плоскости, прочно связаны в
правильные шестиугольники. Связи
между слоями малопрочны.
16.
Жирное на ощупь вещество черного или серого цвета с металлическимблеском, тугоплавок (плавится под давлением 105 атм и при температуре
свыше 3700 °C), электропроводен, мягок, легко расслаивается.
Видоизменения графита, часто встречающиеся в природе- кокс, сажа.
древесный уголь.
Применение графита:
• Электроды для электролиза
• Облицовка сопел ракетных двигателей
• Смазка для трущихся поверхностей,
работающих при очень высоких и очень низких
температурах
• Стержни для карандашей
•Изготавливают электротехнические изделия,
•Краски, смазки,
•Антифрикционные материалы и изделия.
•Графит применяется в атомной технике как
замедлитель нейтронов, изоляционный
материал
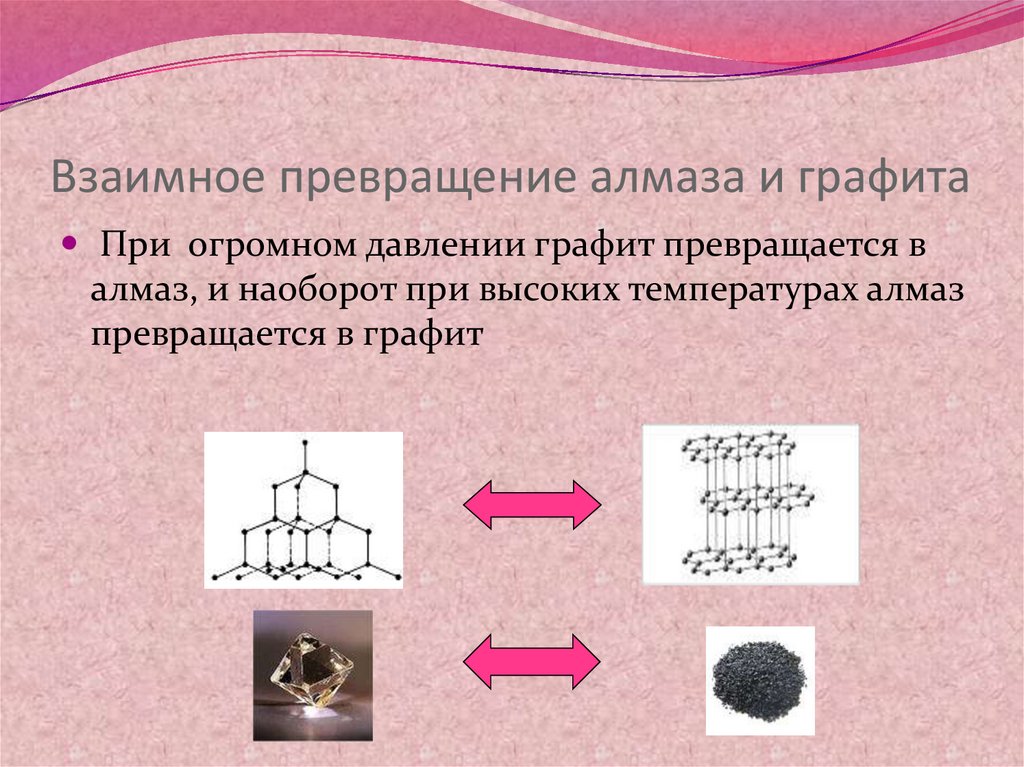
17. Взаимное превращение алмаза и графита
При огромном давлении графит превращается валмаз, и наоборот при высоких температурах алмаз
превращается в графит
18.
Аморфный углерод«Аморфный углерод», как было установлено исследованиями, не
является еще одним аллотропным видоизменением углерода, а
представляет собой мелкокристаллический графит.
Сортами этого углерода являются древесный уголь, кокс и сажа.
Сажу получают преимущественно при разложении метана.
Она используется для приготовления типографской краски,
картриджей, резины, косметической туши.
Кокс представляет собой в основном свободный углерод, он
получается при нагревании каменного угля без доступа воздуха.
Кокс применяется в доменных печах при выплавки чугуна из руд.
Древесный уголь получается при нагревании без доступа воздуха
древесины( из него получают активированный уголь).
Он применяется в качестве топлива в кузнечных горнах, жаровнях,
самоварах, используется в металлургии при выплавке некоторых
цветных металлов и особо чистых сортов чугуна, так как не
содержит вредных примесей, имеющихся в коксе.
19.
Наиболее достопримечательное свойство аморфного угля– способность поглощать газы и растворенные в воде
вещества
Адсорбция - поглощение газообразных
или растворённых веществ поверхностью
твёрдого вещества.
Обратный процесс - выделение этих
поглощённых веществ - десорбция.
Адсорбент- вещество, на поверхности
которого происходит адсорбция.
20.
Кроме угля есть другиеадсорбенты, например
синтетические и природные
смолы.
Адсорбция растворённых
веществ углем открыта ещё в
конце XVIII века русским
академиком Ловицем.
Изучена она более подробно
Зелинским Николаем
Дмитриевичем, он и
предложил использовать
активированный уголь в
противогазах.
Товий Егорович Ловиц
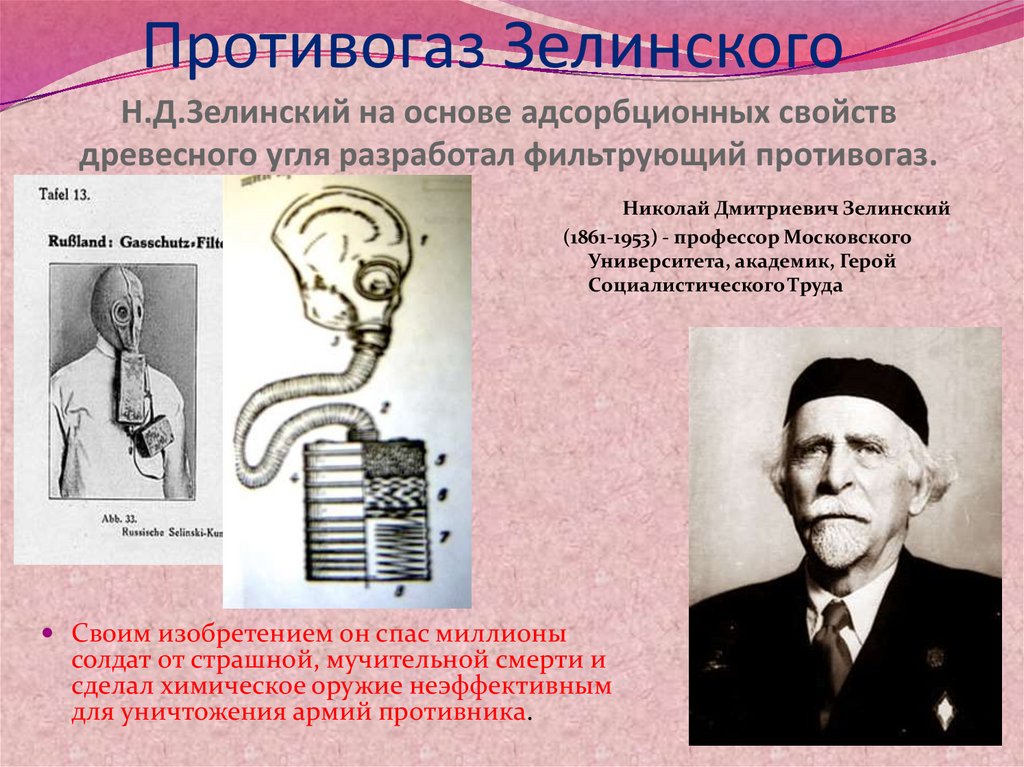
21. Н.Д.Зелинский на основе адсорбционных свойств древесного угля разработал фильтрующий противогаз.
Противогаз ЗелинскогоН.Д.Зелинский на основе адсорбционных свойств
древесного угля разработал фильтрующий противогаз.
Николай Дмитриевич Зелинский
(1861-1953) - профессор Московского
Университета, академик, Герой
Социалистического Труда
Своим изобретением он спас миллионы
солдат от страшной, мучительной смерти и
сделал химическое оружие неэффективным
для уничтожения армий противника.
22. Боевые отравляющие вещества. Нет ничего бесчеловечнее химического оружия!
23. Химическое оружие- ужас человечества и позорная страница в истории химической науки.
24.
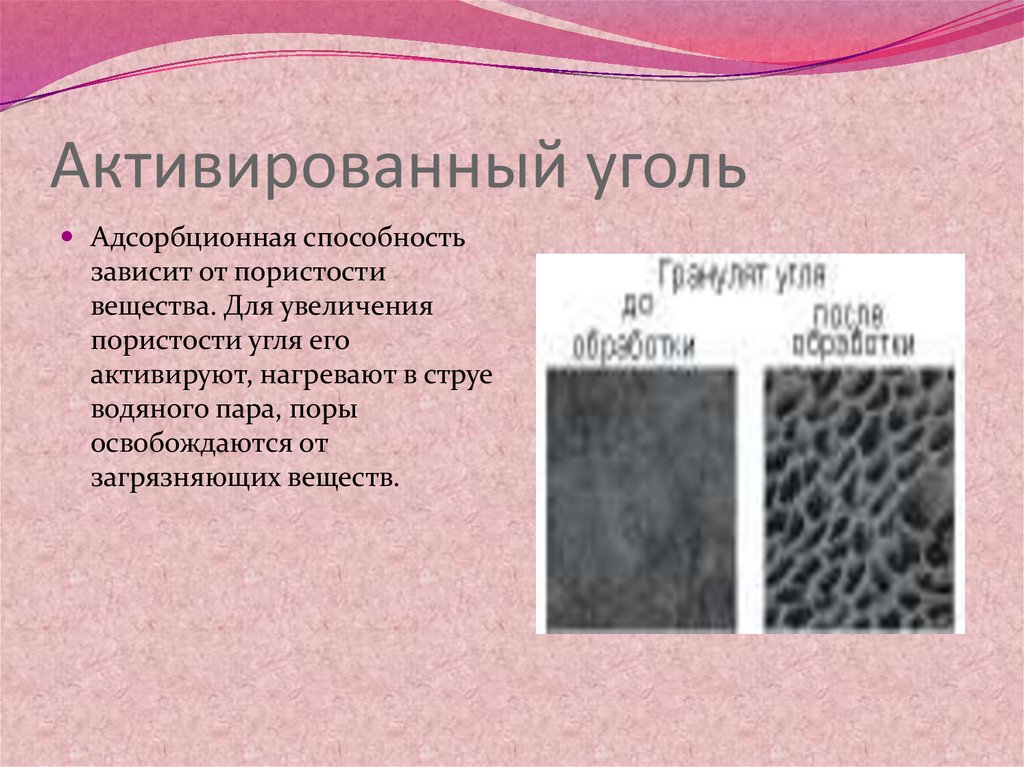
25. Активированный уголь
Адсорбционная способностьзависит от пористости
вещества. Для увеличения
пористости угля его
активируют, нагревают в струе
водяного пара, поры
освобождаются от
загрязняющих веществ.
26. Применение активированного угля
Активированный угольшироко используют в
медицине и пищевой
промышленности.
В бытовых фильтрах, в промышленном
производстве, на очистных сооружениях – уголь
поглощает вредные вещества из воды
27.
аллотропная модификация углерода. Представляет собойчерный порошок.
Карбин является полупроводником и его проводимость
возрастает под действием света. Впервые карбин получен в
1963 году при каталитическом окислении ацетилена
(учеными В. В. Коршак, А. М. Сладковым, В. Ш.
Касаточкиным). Позднее карбин обнаружили в природе.
Состоит из линейных цепочек –C C–C C– и =С=С=С=С=
При нагревании переходит в графит.
28.
29.
Фуллерены молекулярныесоединения,
принадлежащие к классу
аллотропных форм
углерода
представляющие собой
выпуклые замкнутые
многогранники,
составленные из чётного
числа
трёхкоординированных
атомов углерода.
30.
В молекулах фуллеренов атомы углерода расположены ввершинах правильных шести- и пятиугольников, из
которых составлена поверхность сферы или эллипсоида
По своей форме молекула С60
напоминает футбольный мяч,
который также имеет форму
Архимедового усеченного
икосаэдра.
31.
Своим названиемэти соединения
обязаны инженеру и
дизайнеру Ричарду
Бакминстеру
Фуллеру, чьи
сферические
конструкции
построены по этому
принципу.
Впервые сумели
измерить объект
размером 1 нм.
1996 год Нобелевская
премия.
Первый фуллерен, и вообще
представитель данного класса
соединений, бакминстерфуллерен
(C60) был обнаружен в 1985 году
Ричардом Смолли, Робертом Керл,
Джеймсом Хит, Шоном О'Брайен, и
Гарольдом Крото в Университете Райса
(Хьюстон, штат Техас, США).
32.
Единственным способом полученияфуллеренов в настоящий момент является их
искусственный синтез.
Так же фуллерены в значительном
количестве содержатся в саже,
образующейся в дуговом разряде на
графитовых электродах
33.
•созданияорганических
солнечных батарей
• химических лазеров
• "молекулярных
компьютеров»
•материалов с
высокотемпературной
сверхпроводимостью.
Антиоксиданты и
биофармпрепараты
Как полупроводник
(акцептор электронов)
Добавки для
получения
искусственных
алмазов
34.
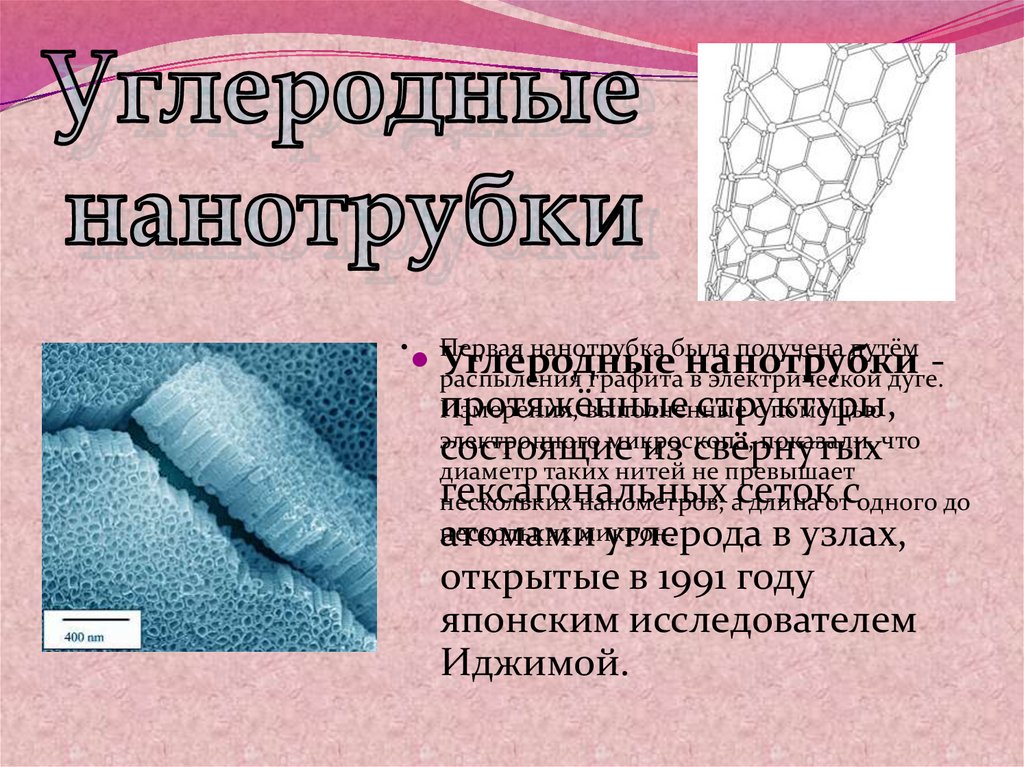
нанотрубка была получена путём
Первая
Углеродные
нанотрубки распыления графита в электрической дуге.
протяжённые
структуры,
Измерения,
выполненные
с помощью
электронного
микроскопа,
показали, что
состоящие
из свёрнутых
диаметр таких нитей не превышает
гексагональных
нескольких
нанометров, асеток
длина отсодного до
нескольких
атомамимикрон.
углерода в узлах,
открытые в 1991 году
японским исследователем
Иджимой.
35.
Создание микроскопических весов.Как трос для космического лифта.
Создания искусственных мускулов.
36.
Уже показано, что искусственные мускулы будут по меньшейВ 1999
году
мере втрое
"сильнее"
обычных, а используемые для их
исследовательская
работы напряжениегруппа
и сила токаво
невелики.
главе с Рэем Баухманом
Искусственные
мускулы
со временем
можно будет
выступила
с
докладом
о
использовать для протезирования органов и отдельных
применениимышц
нанотрубок
для
(скажем, сердечной).
создания искусственных
мышц.
37. Химические свойства.
Углерод - окислитель:а) с металлами образует карбиды
4Al+3 C→Al4C3 ( карбид алюминия)
Ca+2C→CaC2 ( карбид кальция)
б) с водородом
С +2H2→ CH4 (метан) ( при нагревании)
38. Свойства восстановителя
в) восстанавливает металлы из их оксидов2CuO + C →CO2 +Cu, 2Fe2O3 + 3C→3CO2 + 4Fe
г) горит в кислороде с выделением большого
количества тепла
2C + O2 → 2CO +Q
недост
C + O2 → CO2 + 402 к ДЖ
избыток
C+2S →CS2 (сероуглерод)
C+2F2→CF4 (фторид углерода)
Углерод – это особый химический элемент, он основа многообразия
органических соединений, из которых построены все живые организмы на
нашей планете.
39. Биологическое значение углерода
Все без исключения живые организмыпостроены из соединений углерода.
40.
. Среднее содержание Углерода в земной коре 2,3·10-2%, вдревесине 50%, каменном угле 80%, в нефти 85%, антрацит
96%. Значительная часть Число собственных минералов
Углерода - 112; . Большую геохимическую роль в земной кор
играют СО2 и угольная кислота. Углерод широко
распространен также в космосе; на Солнце он занимает 4место после водорода, гелия и кислорода.
41.
Содержиться в виде белков,жиров и углеводов.
•В наземных
растениях,животных и
бактерий - 54%
В водных растениях и
животных - 45,4-46,5%
42.
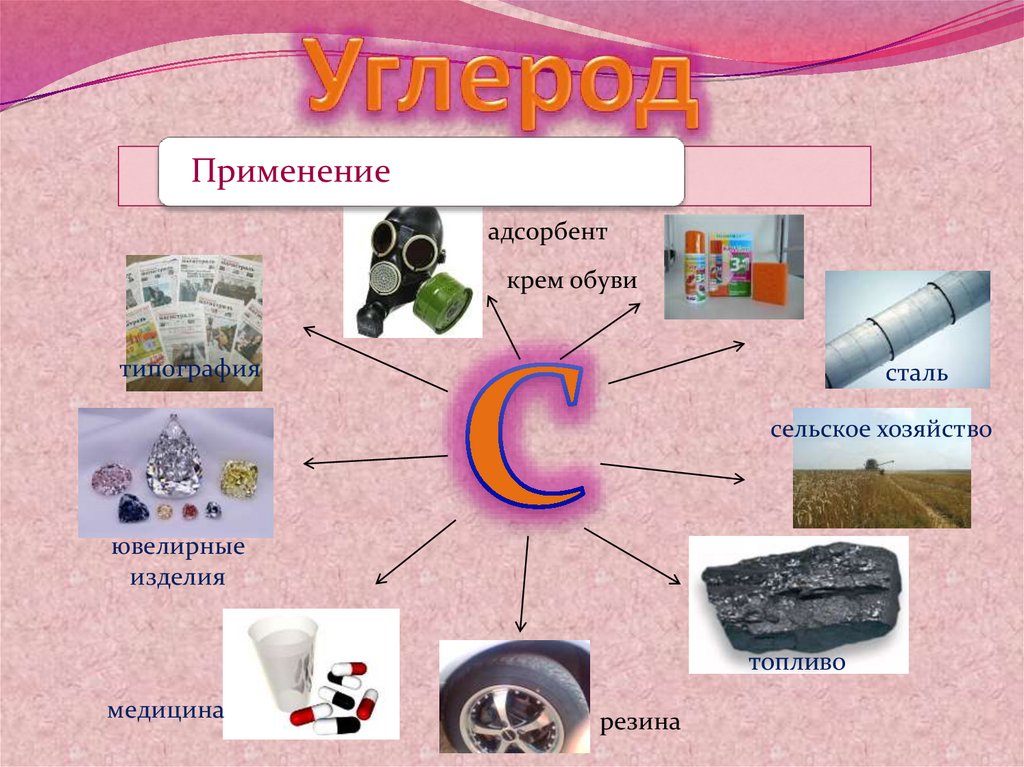
Применениеадсорбент
крем обуви
типография
сталь
сельское хозяйство
ювелирные
изделия
топливо
медицина
резина
43.
44.
ТестТест
1. Конфигурация внешнего
электронного уровня элементов
подгруппы углерода:
а) ns2np2
б) ns2np3
в) ns2np4
г) ns1np2
2. Наиболее характерная валентность
элементов подгруппы углерода:
а) II
б) III
в) IV
г) V
3. Неметаллические свойства
элементов подгруппы углерода в
группе сверху вниз:
а) уменьшаются
б) уменьшаются, затем возрастают
в) возрастают
г) не изменяются
4. Углерод является:
а) восстановителем
б) восстановителем и окислителем
в) окислителем
г) не проявляет окислительно-восстановительных свойств
5. Атомную слоистую кристаллическую решетку имеет:
а) алмаз
б) фуллерен
в) графит
г) карбин
6. Наибольшей прочностью отличается кристаллическая
решетка:
а) атомная
б) ионная
в) атомная слоистая
г) молекулярная
7. Наиболее химически активна аллотропная модификация
углерода:
а) алмаз
б) фуллерен
в) графит
г) карбин
45. Закрепление. Тестовая работа.
1. В IV группе главной подгруппы в периодической системе Д.И.Менделеева расположеныследующие элементы:
– Б) Бериллий, магний, кальций, стронций, барий;
– В) Бор, алюминий, галлий, индий, таллий;
– А) Литий, натрий, калий, рубидий, цезий, франций;
– Г) углерод, кремний, германий, олово, свинец.
2. У элементов IV группы главной подгруппы на внешнем энергетическом уровне расположено …
электронов:
А) 1;
Б) 2;
В) 3;
Г) 4;
3. Высший оксид характерный для элементов IV группе главной подгруппы в периодической системе
Д.И.Менделеева имеет общую формулу:
А) RO;
Б) R2O3;
В) RO2;
Г) R2O5.
4. Формула водородного соединения этого элемента:
А) RH4;
Б) RH3;
В) H2R;
Г) HR.
5. Наиболее характерная валентность элементов подгруппы углерода:
а) II
б) III
в) IV
г) V
46.
6. Из аллотропных видоизменений углерода наибольшую твердость проявляет:А) Уголь;
Б) Графит;
В) Алмаз;
Г) Карбин.
7. Мягкий, слоистая структура, большие расстояния и непрочные связи между слоями. Отметьте
аллотропную модификацию углерода, соответствующую приведенным свойствам:
А) Уголь;
Б) Алмаз;
В) Графит;
Г) Карбин.
8. Адсорбция представляет собой:
А) Процесс разложения вещества;
Б) Процесс выделения адсорбируемых веществ;
В) Химическое взаимодействие угля с газами;
Г) Поглощение газов или растворенных веществ поверхностью твердого вещества.
9. Сортами аморфного углерода являются:
А) Алмазы и бриллианты;
Б) Каменный, бурый уголь;
В) Древесный уголь, кокс и сажа.
Г) Не знаю.
10. Назовите фамилию ученного - химика, который впервые разработал противогаз:
А) Д.И. Менделеев;
Б) Н.Д. Зелинский;
В) Н.Н.Бекетов;
Г) Генри Кавендиш.
11 . Углерод является:
а) восстановителем
б) восстановителем и окислителем
в) окислителем
г) не проявляет окислительно-восстановительных свойств
47. Домашнее задание
§ 24,25.Из меня состоит все живое:
Я - графит, антрацит и алмаз.
Я на улице, в школе и в поле
Я в деревьях и в каждом из вас.
Спасибо!!!
Углерод








































 chemistry
chemistry








