Similar presentations:
Общая характеристика элементов подгруппы углерода. Углерод как простое вещество
1.
Общая характеристикаэлементов подгруппы
углерода. Углерод как простое
вещество
2.
IV A – группаподгруппа углерода:
С, Si, Ge, Sn, Pb
ns2np2
3.
Высшая с.о. +4, низшая с.о. -4На внешнем уровне 4е, ns2np2
Высший оксид RO2
Высший гидроксид H2RO3
Летучее водородное соединение RН4
4.
УглеродC
6
12,011
Углерод
Происхождение названия
Международное название происходит от
латинского carbo — уголь, связанного с
древним корнем kar — огонь. Этот же
корень в латинском cremare — гореть, а
возможно, и в русском «гарь», «жар»,
«угореть» (в древнерусском «угорати» —
обжигать, опалять). Отсюда — и «уголь».
5.
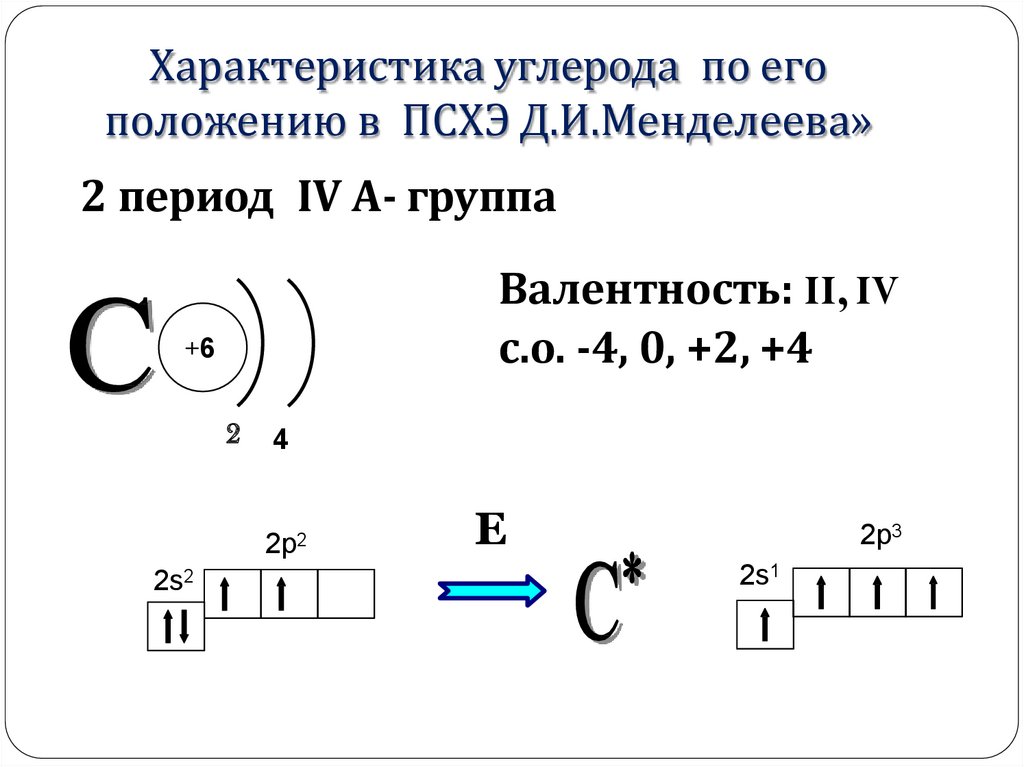
Характеристика углерода по егоположению в ПСХЭ Д.И.Менделеева»
2 период IV А- группа
Валентность: II, IV
с.о. -4, 0, +2, +4
+6
2
4
2p2
2s2
Е
2p3
2s1
6.
Строение атома, возможные с.о.7.
Распространение углерода в природе8.
Распространение кремния вприроде
Второй по распространённости элемент в
земной коре после кислорода (27,6% по
массе). В свободном виде не встречается.
9.
АморфныйС
Кокс
Сажа
Древесный
уголь
Аллотропные
модификации С
Графит
Карбин
Фуллерен
Алмаз
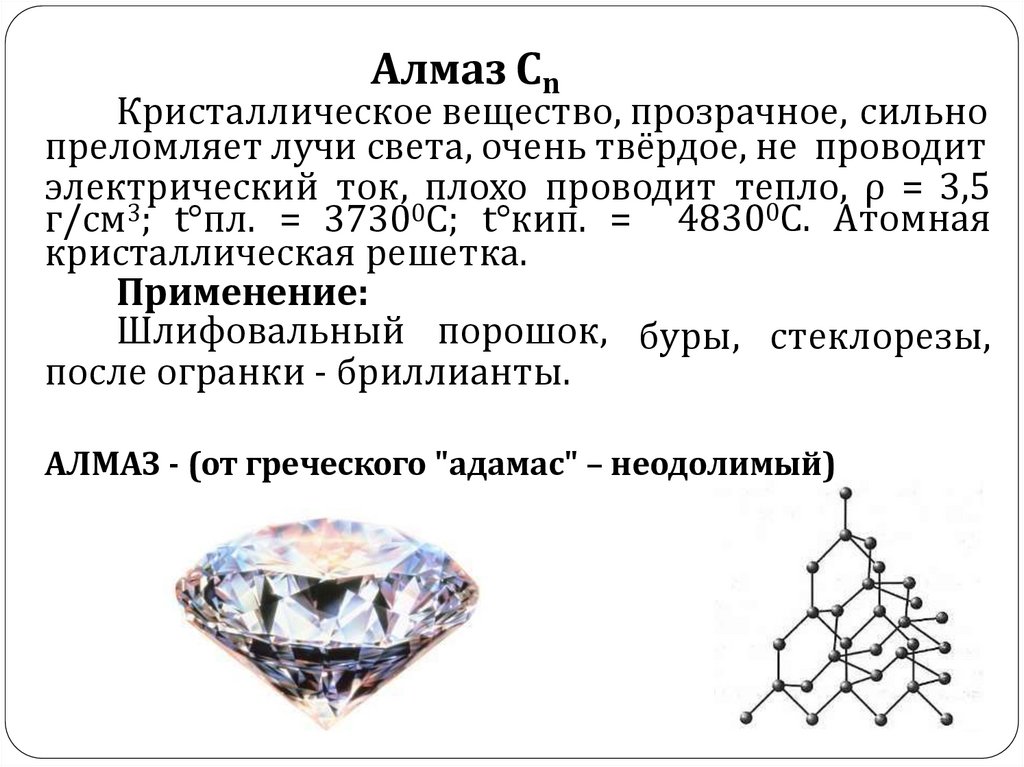
10.
Алмаз СnКристаллическое вещество, прозрачное, сильно
преломляет лучи света, очень твёрдое, не проводит
электрический ток, плохо проводит тепло, ρ = 3,5
г/см3; t°пл. = 37300C; t°кип. = 48300C. Атомная
кристаллическая решетка.
Применение:
Шлифовальный порошок, буры, стеклорезы,
после огранки - бриллианты.
АЛМАЗ - (от греческого "адамас" – неодолимый)
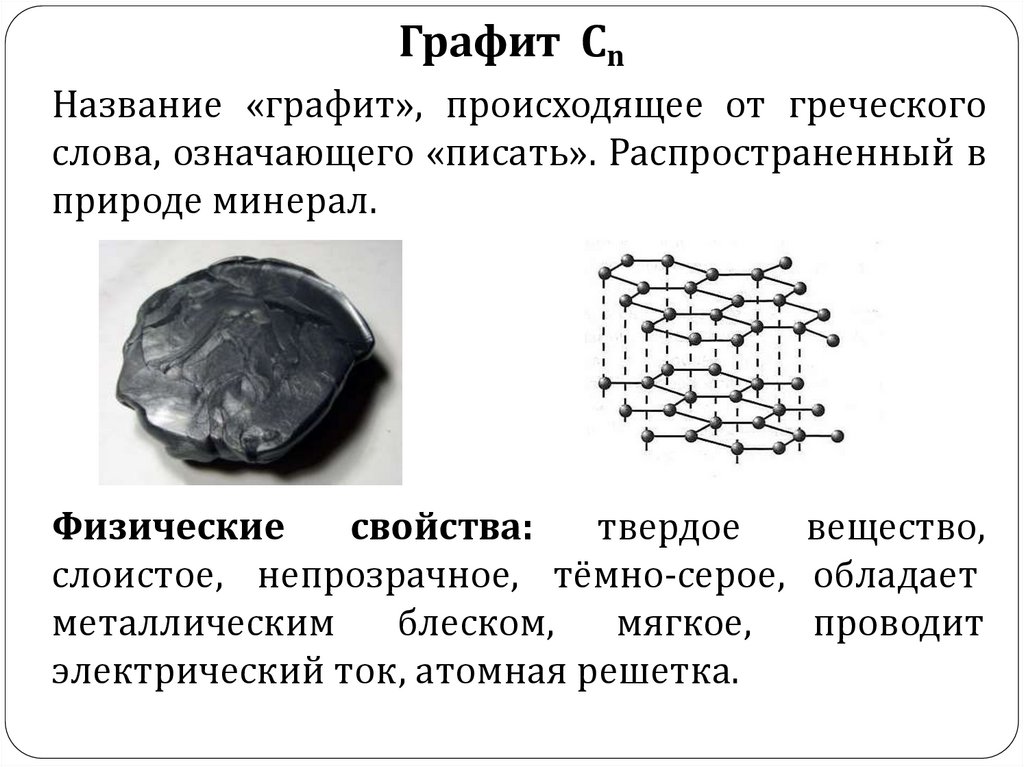
11.
Графит СnНазвание «графит», происходящее от греческого
слова, означающего «писать». Распространенный в
природе минерал.
Физические
свойства:
твердое
вещество,
слоистое, непрозрачное, тёмно-серое, обладает
проводит
металлическим
блеском,
мягкое,
электрический ток, атомная решетка.
12.
ПРИМЕНЕНИЕГрафитовый порошок –
изготовление минеральных
красок.
Смазочный материал (в смеси с
маслом).
Графитовые стержни –
электроды –
электропроводность.
Изготовление простых
карандашей.
13.
КарбинБелые кристаллы
Состоит из цепей, образованных участками:
-С С-С С(карбин)
или
=С=С=С=С=
(поликумулен). Получен искусственным путем.
Впервые
получено
советскими химиками 60-х
гг. в
СВОЙСТВА
Обладает полупроводниковыми свойствами.
При сильном нагревании без доступа воздуха
пУрчиетевльрхаимщииаМАеОтУс"ВяадвскагярСОаШф" ит.
14.
ФуллеренВиды молекул фуллеренов: чётное число атомов
углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д.
Поверхность «мяча» образована пяти- и шестиугольниками
с общими рёбрами.
Простейший фуллерен – состоит из 12 пятиугольников и 20
шестиугольников. Форма близка к сфере.
15.
ФуллеренКристаллические вещества чёрного
цвета с металлическим блеском.
Полупроводники.
При высоком давлении и комнатной
температуре легко превращаются в
алмаз.
ПРИМЕНЕНИЕ
Получение полимерных материалов и
металлофуллеренов.
Запоминающие устройства.
Сверхпроводники.
Лекарства с противоопухолевой активностью.
УКчитрелаьсхиимитиеМлАОиУ.
16.
Древесный угольОбразуется при разложении древесины без
доступа воздуха.
Адсорбция – процесс поглощения газов и
растворенных веществ твердым углем.
Применение адсорбции:
Очистка от примесей (в производстве сахара
и др.), для защиты органов дыхания
(противогазы),
в
медицине
(таблетки
"Карболен") и др.
17.
Аллотропиякремния
Тёмно-серое вещество с
металлическим
блеском,
большая твёрдость, хрупок,
полупроводник; t°пл =1400°C.
Структура подобна алмазу.
Инертен. Атомная решетка.
Бурый
порошок,
более
реакционноспособен.
18.
Химические свойства углеродаI. Восстановительные свойства (с.о.+2, +4)
1. С кислородом:
C + O2
CO2
При недостатке кислорода наблюдается
неполное сгорание образуется угарный газ:
2C + O2 2CO
19.
Л.о.№10. Восстановительныесвойства водорода и углерода.
Цель:
изучить
восстановительные
свойства водорода и углерода.
Ход опыта:
С правилами т.б. познакомился
Раскалите кусочек древесного угля.
C + O2 CO2
CuO + H2 = Cu + H2O
20.
1. Восстановительные свойства (с.о.+2, +4)2. С оксидами:
C0 + 2CuO = 2Cu + C
C + СO2 =
+4O
2CO
2
21.
II. Окислительные свойства (с.о. -4)1. С металлами образует карбиды
4Al + 3C0 → Al4C3-4
Ca + 2C0 → CaC2-1
2. С водородом
C0 + 2H2 → CH4


















 chemistry
chemistry








