Similar presentations:
Химическая связь. Лекция
1. Лекция Химическая связь
ЛекторМамонтов Виктор Васильевич
2.
Химия начинается там, где кончаетсяизолированный атом и начинается молекула.
Все свойства веществ обусловлены
особенностями связей в них.
Химическая связь - взаимодействие двух или
нескольких атомов, в результате которого
образуется химически устойчивая
многоатомная микросистема (молекула,
кристалл, комплекс).
Химическая связь между атомами заключается в
том, что ее образование определяется
изменением состояния электронов в
молекуле, по сравнению с исходными атомами.
3.
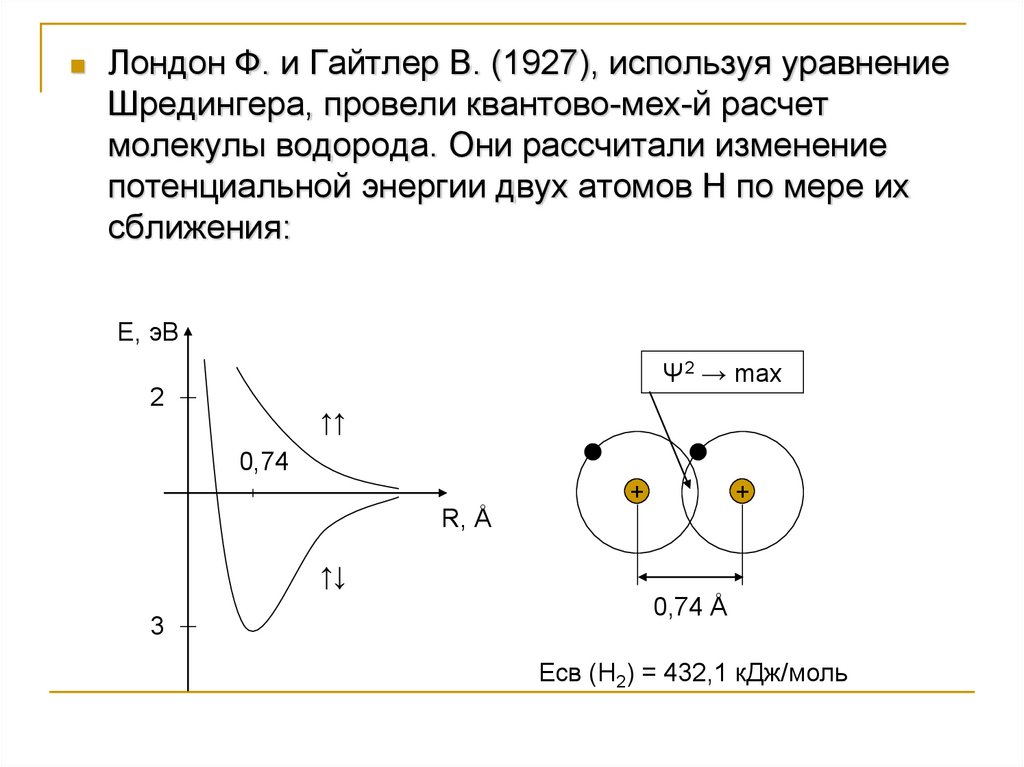
Лондон Ф. и Гайтлер В. (1927), используя уравнениеШредингера, провели квантово-мех-й расчет
молекулы водорода. Они рассчитали изменение
потенциальной энергии двух атомов Н по мере их
сближения:
Е, эВ
Ψ2 → max
2
↑↑
0,74
R, Å
+
+
↑↓
3
0,74 Å
Есв (Н2) = 432,1 кДж/моль
4.
1.2.
3.
4.
Выводы:
Причина соединения атомов в молекулу –
электростатическое взаимодействие между
ядрами и движущимися электронами.
Связь образуется электронной парой с
антипараллельными спинами.
Валентные связи между атомами
осуществляются неспаренными электронами.
Если для распаривания электронов требуется
энергии меньше, чем та которая выделяется
при образовании хим. связи, то это
энергетически выгодно.
5.
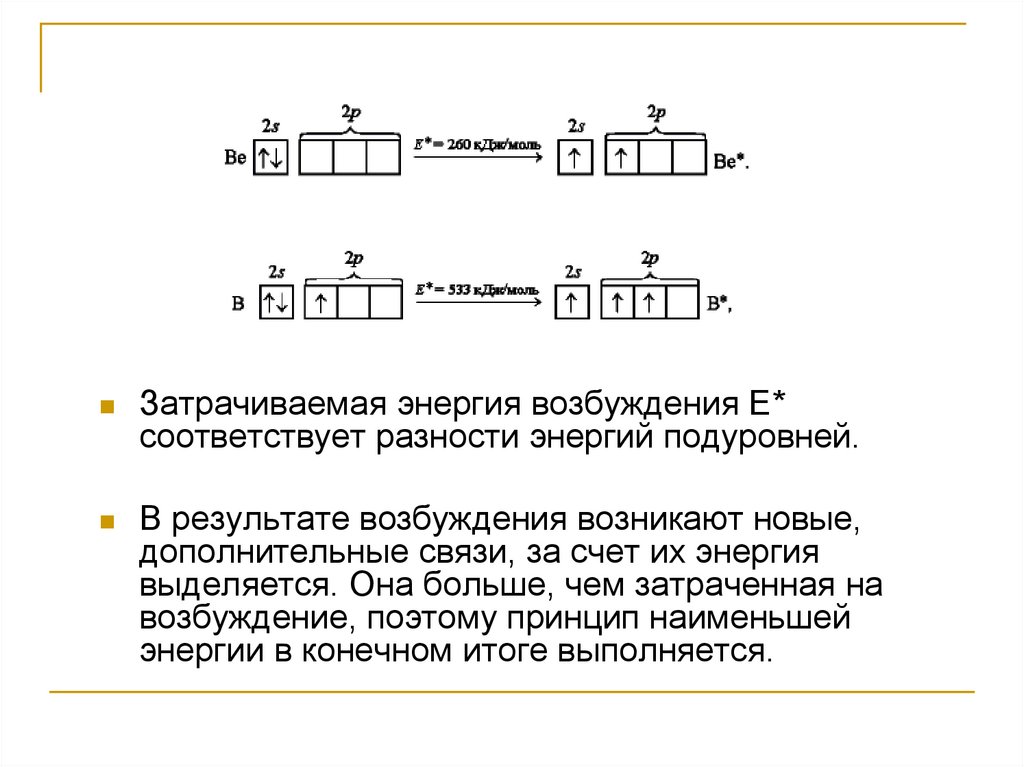
Затрачиваемая энергия возбуждения Е*соответствует разности энергий подуровней.
В результате возбуждения возникают новые,
дополнительные связи, за счет их энергия
выделяется. Она больше, чем затраченная на
возбуждение, поэтому принцип наименьшей
энергии в конечном итоге выполняется.
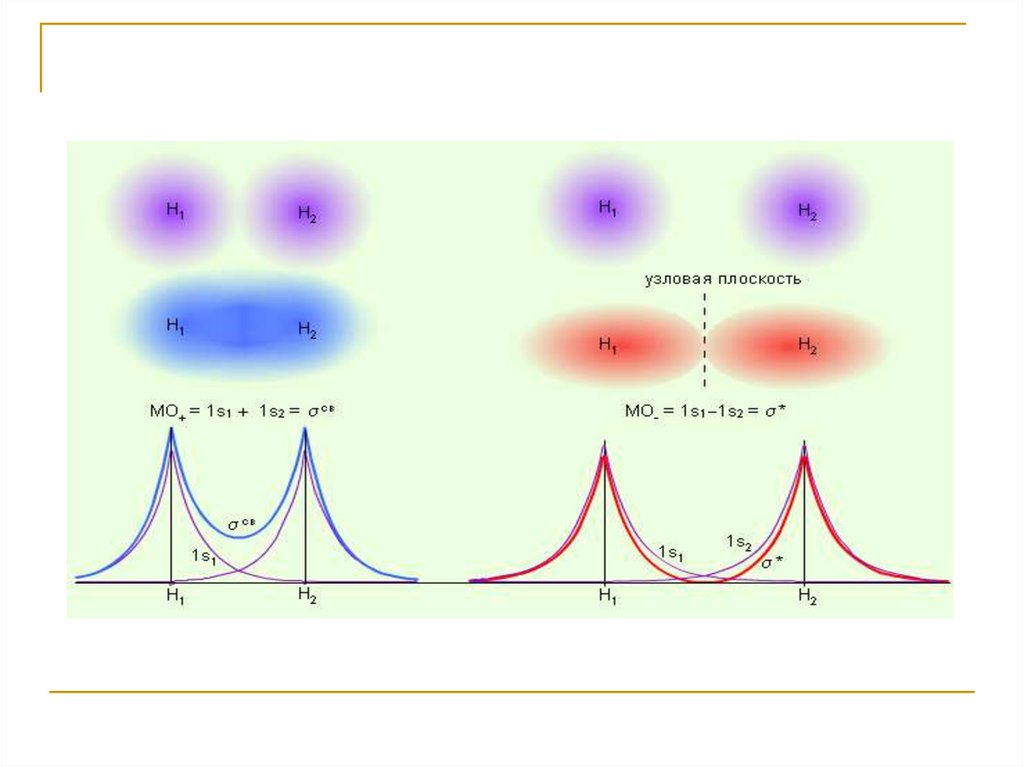
6. 1. Метод валентных связей. Ковалентная связь.
Для объяснения хим. связи применяется дваметода – МВС и ММО.
По методу ВС хим. связь образуется по двум
механизмам:
1.
2.
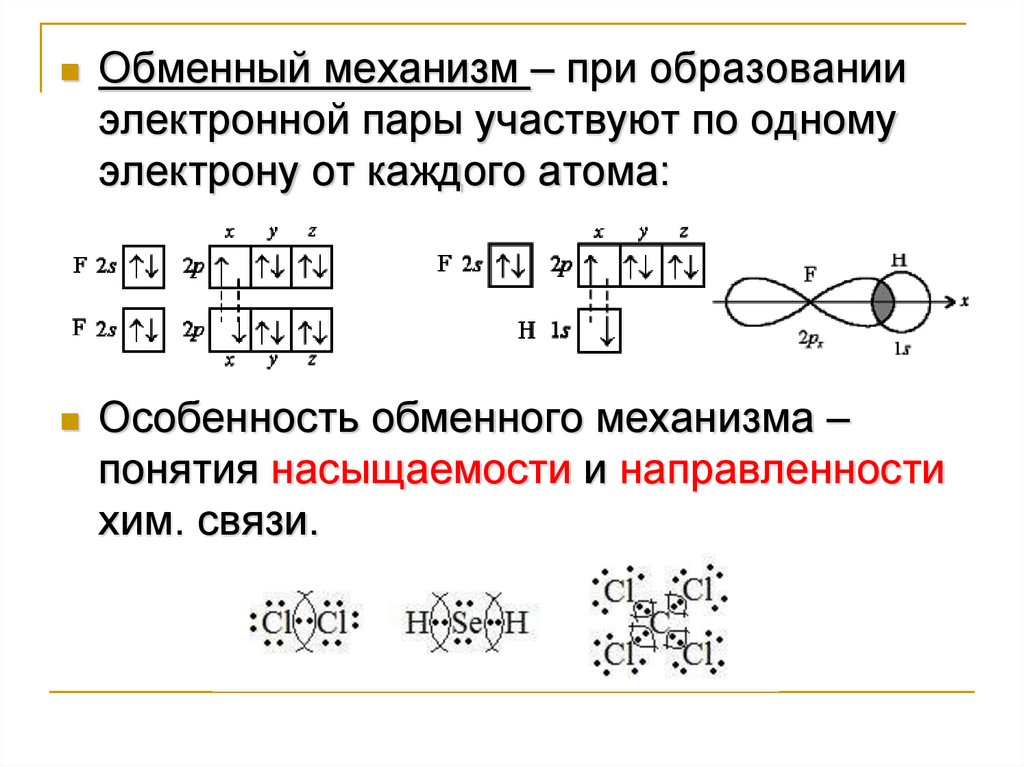
Обменный механизм - при образовании хим. связи
учитывают только не спаренные электроны.
Донорно-акцепторный механизм – учитывают свободные
орбитали одного атома и электронную пару другого.
Хим. связь осуществляемая электронными
парами называется ковалентной.
7.
Обменный механизм – при образованииэлектронной пары участвуют по одному
электрону от каждого атома:
Особенность обменного механизма –
понятия насыщаемости и направленности
хим. связи.
8.
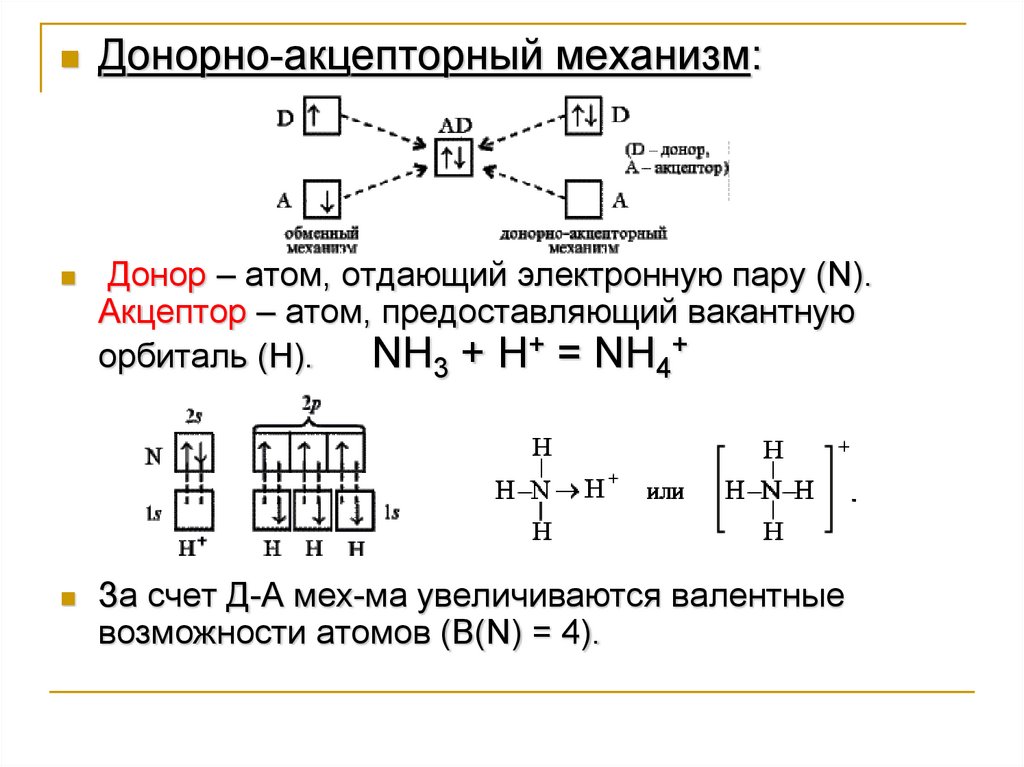
Донорно-акцепторный механизм:Донор – атом, отдающий электронную пару (N).
Акцептор – атом, предоставляющий вакантную
орбиталь (Н).
NH3 + H+ = NH4+
За счет Д-А мех-ма увеличиваются валентные
возможности атомов (В(N) = 4).
9. 2. Параметры ковалентной связи
Учение о хим. связи рассматривает:механизмы образования связи, строение
молекул, прочность связи и способность
веществ вступать в химические реакции.
Основные характеристики хим. связи
определяются строением и св-вами атомов:
валентными орбиталями, атомными
радиусами, потенциалом ионизации,
сродством к электрону, поляризуемостью и
поляризующей способностью атомов.
10.
Энергия связи – энергия которая выделяетсяпри образовании молекулы из одиночных
атомов.
Процесс
Есв, кДж/моль
O + O = O2
Cl + Cl = Cl2
N + N = N2
493,8
239,2
940,5
Энергия связи = энергии разрыва связи
В среднем Есв = 250 - 300 кДж/моль.
11.
Кратность связи – количествоэлектронных пар, связывающих два
атома.
Молекула
Формула
Кратность
связи
Есв,
кДж/моль
ℓсв (С - С),
Å
Этан
Н3С - СН3
Этилен
Н2С = СН2
Ацетилен
НС ≡ СН
1
2
3
412,6
587,3
822,2
1,54
1,34
1,2
При увеличении кратности связи, энергия связи
увеличивается, а длина уменьшается.
12.
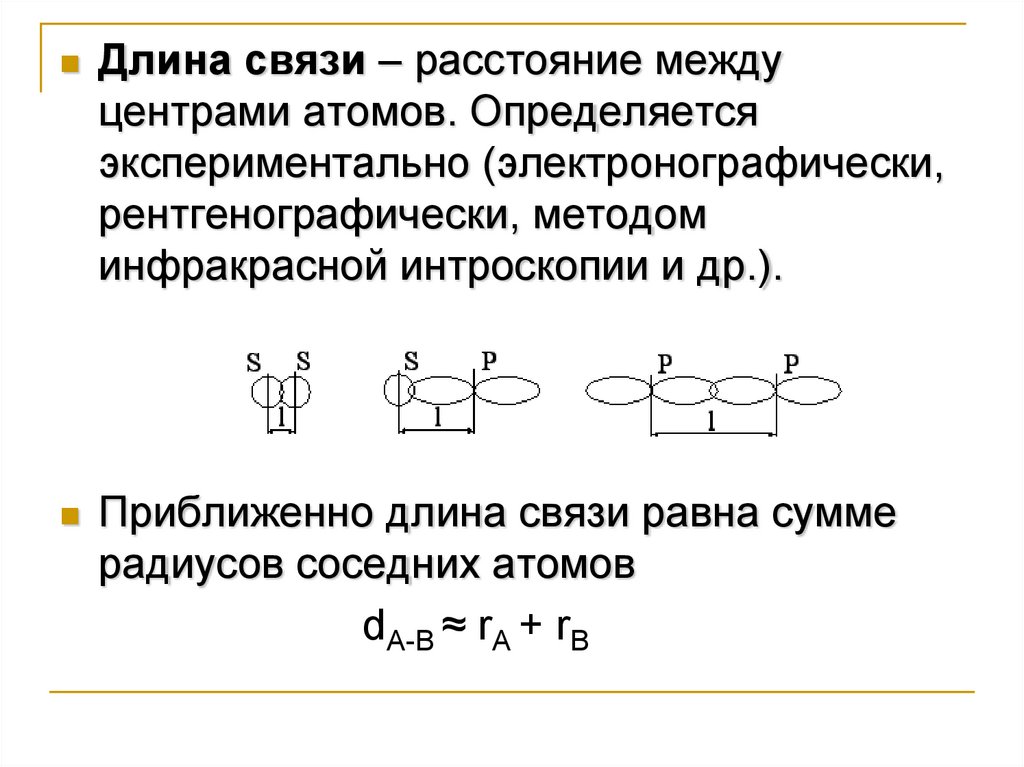
Длина связи – расстояние междуцентрами атомов. Определяется
экспериментально (электронографически,
рентгенографически, методом
инфракрасной интроскопии и др.).
Приближенно длина связи равна сумме
радиусов соседних атомов
dA-B ≈ rA + rB
13.
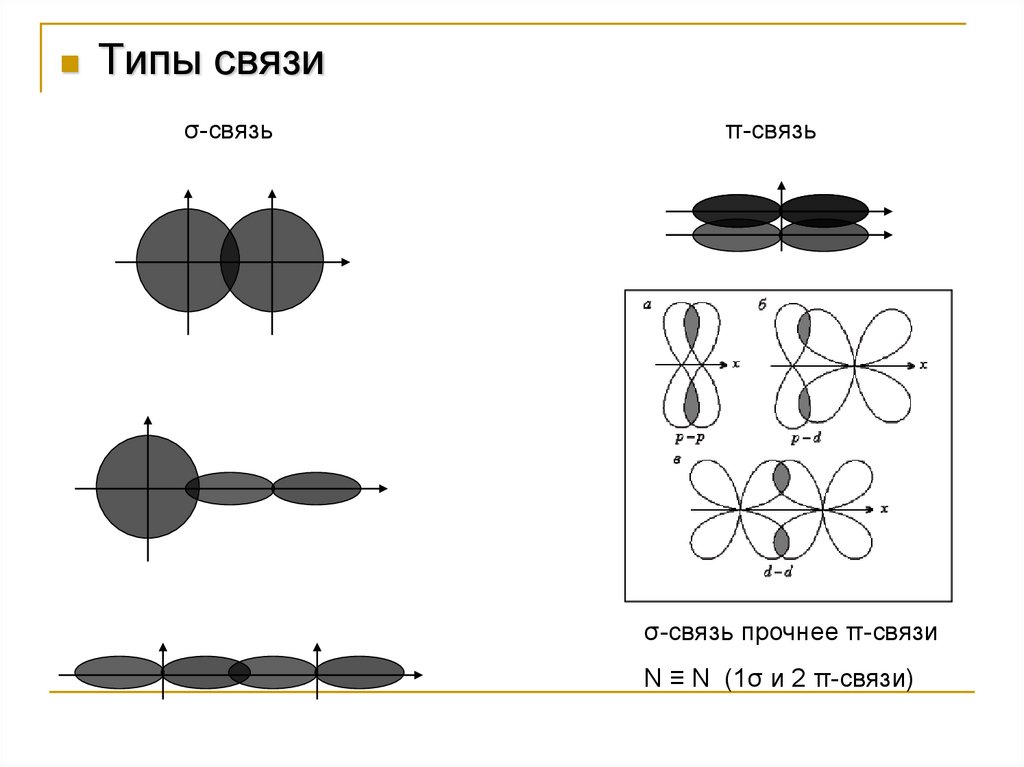
Типы связиσ-связь
π-связь
σ-связь прочнее π-связи
N ≡ N (1σ и 2 π-связи)
14.
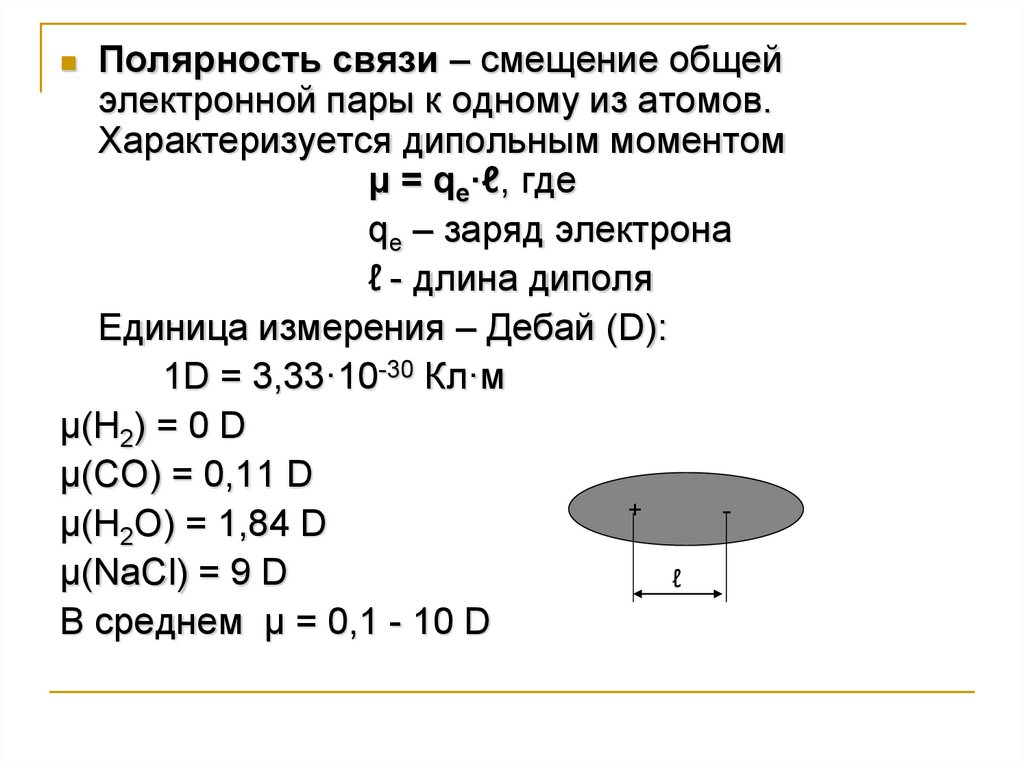
Полярность связи – смещение общейэлектронной пары к одному из атомов.
Характеризуется дипольным моментом
μ = qe·ℓ, где
qe – заряд электрона
ℓ - длина диполя
Единица измерения – Дебай (D):
1D = 3,33·10-30 Кл·м
μ(Н2) = 0 D
μ(CO) = 0,11 D
+
μ(Н2O) = 1,84 D
μ(NaCl) = 9 D
ℓ
В среднем μ = 0,1 - 10 D
15.
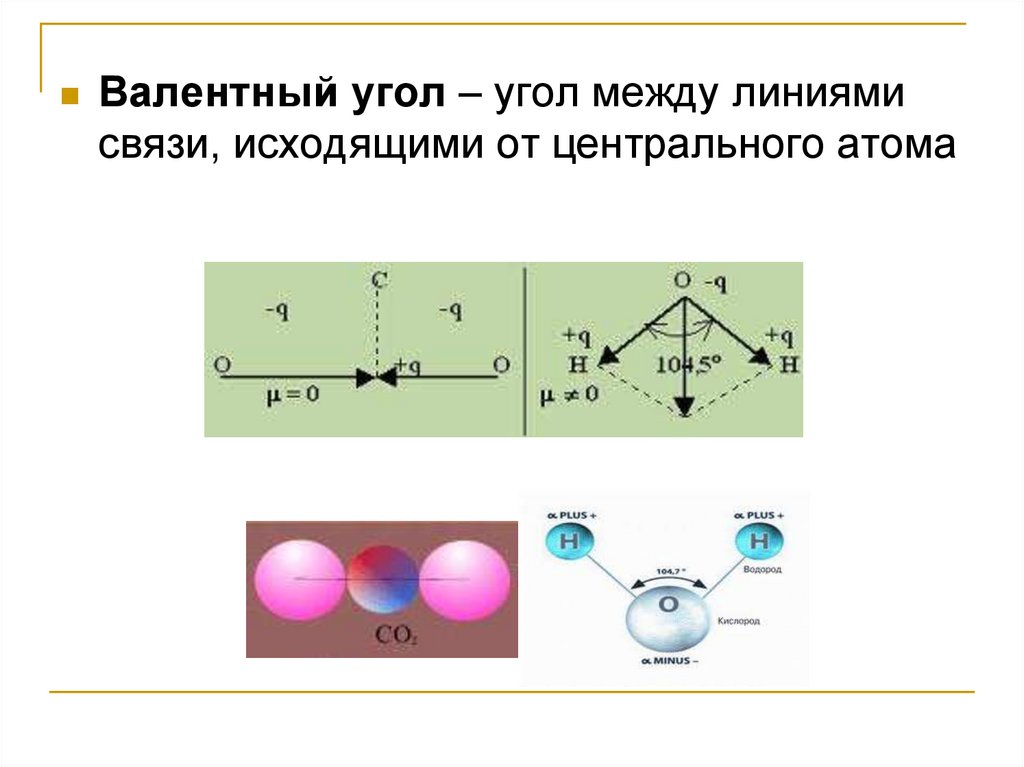
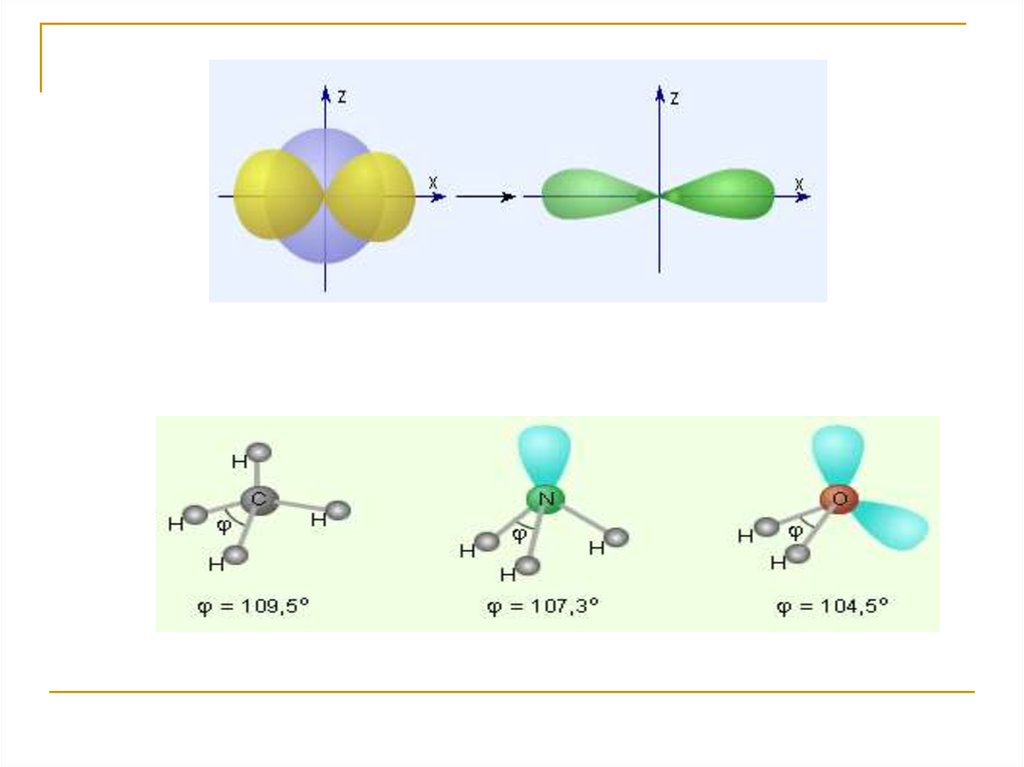
Валентный угол – угол между линиямисвязи, исходящими от центрального атома
16.
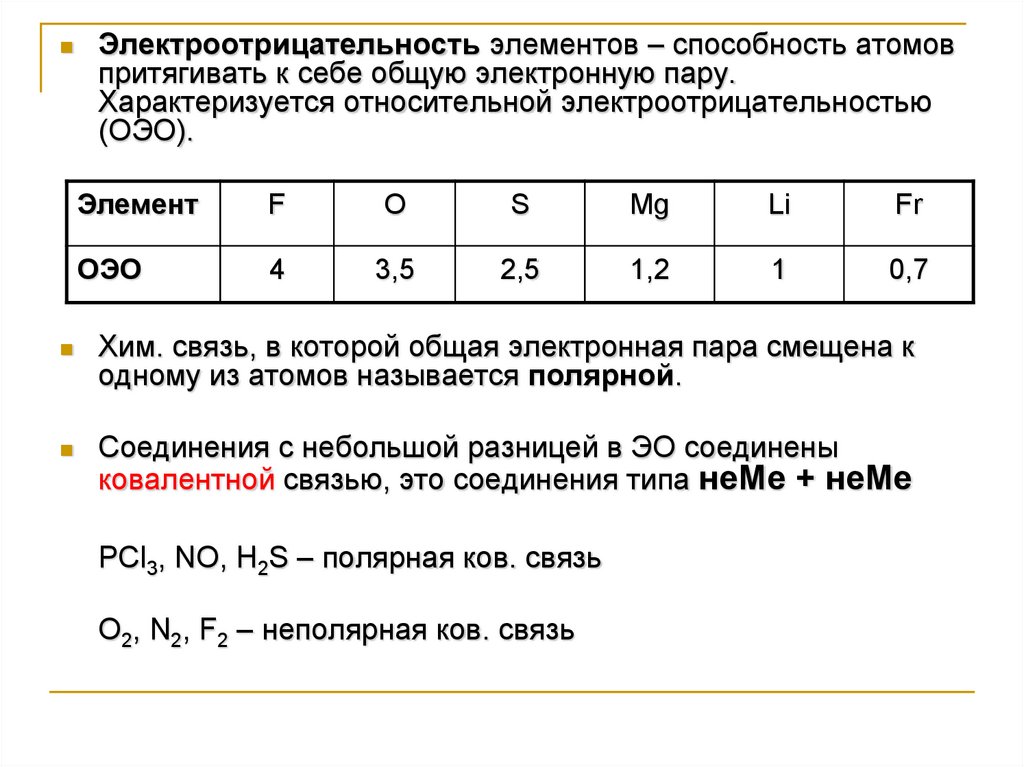
Электроотрицательность элементов – способность атомовпритягивать к себе общую электронную пару.
Характеризуется относительной электроотрицательностью
(ОЭО).
Элемент
F
O
S
Mg
Li
Fr
ОЭО
4
3,5
2,5
1,2
1
0,7
Хим. связь, в которой общая электронная пара смещена к
одному из атомов называется полярной.
Соединения с небольшой разницей в ЭО соединены
ковалентной связью, это соединения типа неМе + неМе
PCl3, NO, H2S – полярная ков. связь
O2, N2, F2 – неполярная ков. связь
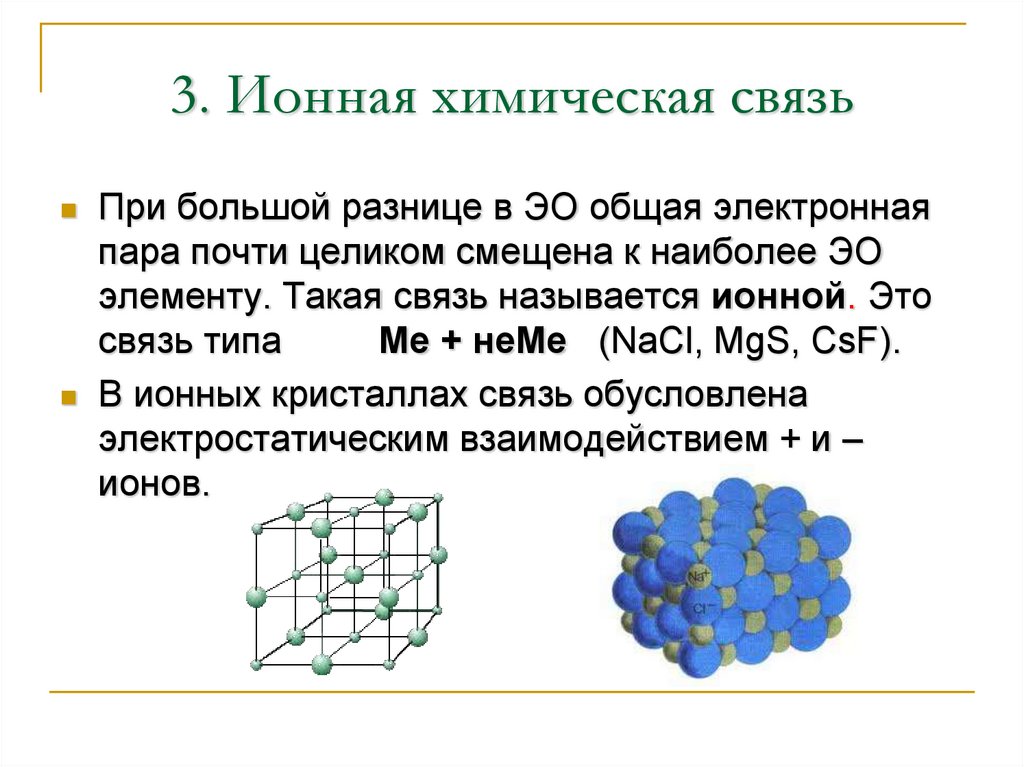
17. 3. Ионная химическая связь
При большой разнице в ЭО общая электроннаяпара почти целиком смещена к наиболее ЭО
элементу. Такая связь называется ионной. Это
связь типа
Ме + неМе (NaCl, MgS, CsF).
В ионных кристаллах связь обусловлена
электростатическим взаимодействием + и –
ионов.
18.
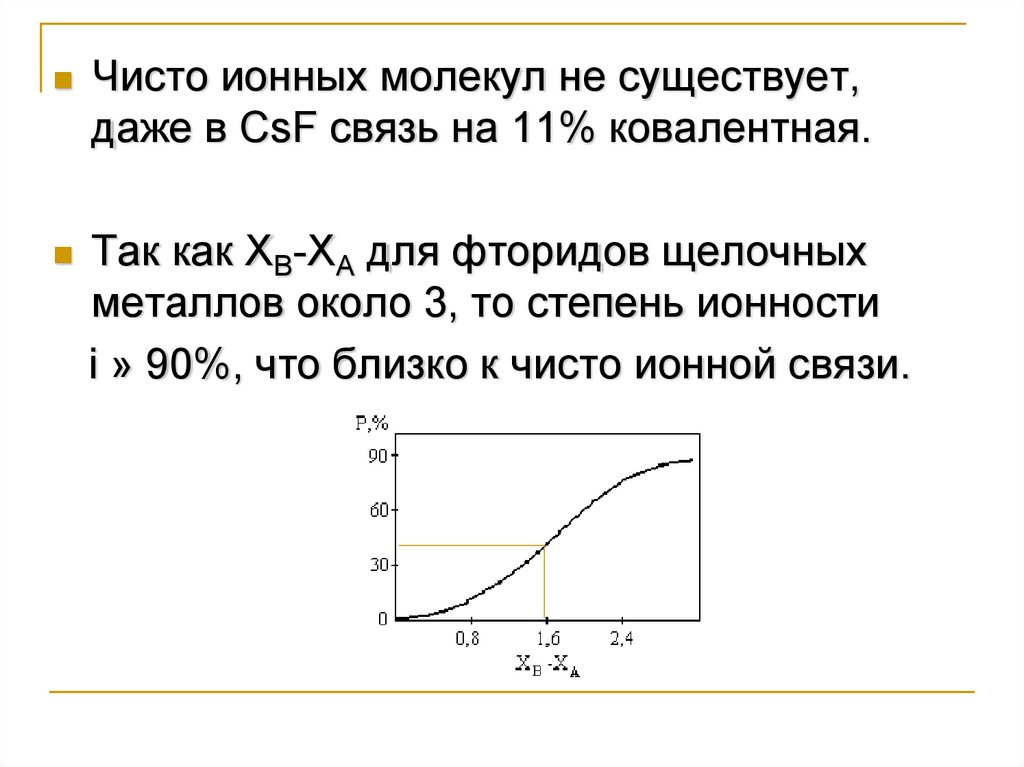
Чисто ионных молекул не существует,даже в CsF связь на 11% ковалентная.
Так как ХВ-ХА для фторидов щелочных
металлов около 3, то степень ионности
i » 90%, что близко к чисто ионной связи.







 chemistry
chemistry








