Similar presentations:
Химическая связь
1. Химическая связь
Мороз Борис Львович2. Химическая связь: определение
Химическая связь – общее название различныхвзаимодействий, обусловливающих существование
двух- и многоатомных соединений (молекул,
молекулярных ионов и радикалов, кристаллов).
2
3. Энергетический критерий химической связи
Полная энергия многоатомной системы, в которой естьхимическая связь, всегда ниже, чем сумма энергий
изолированных атомов, из которых состоит эта система.
А+B
А−B + Q
EA-B < EA + EB
Следствие: Образование химической связи является
самопроизвольным
процессом,
который
сопровождается выделением энергии.
всегда
3
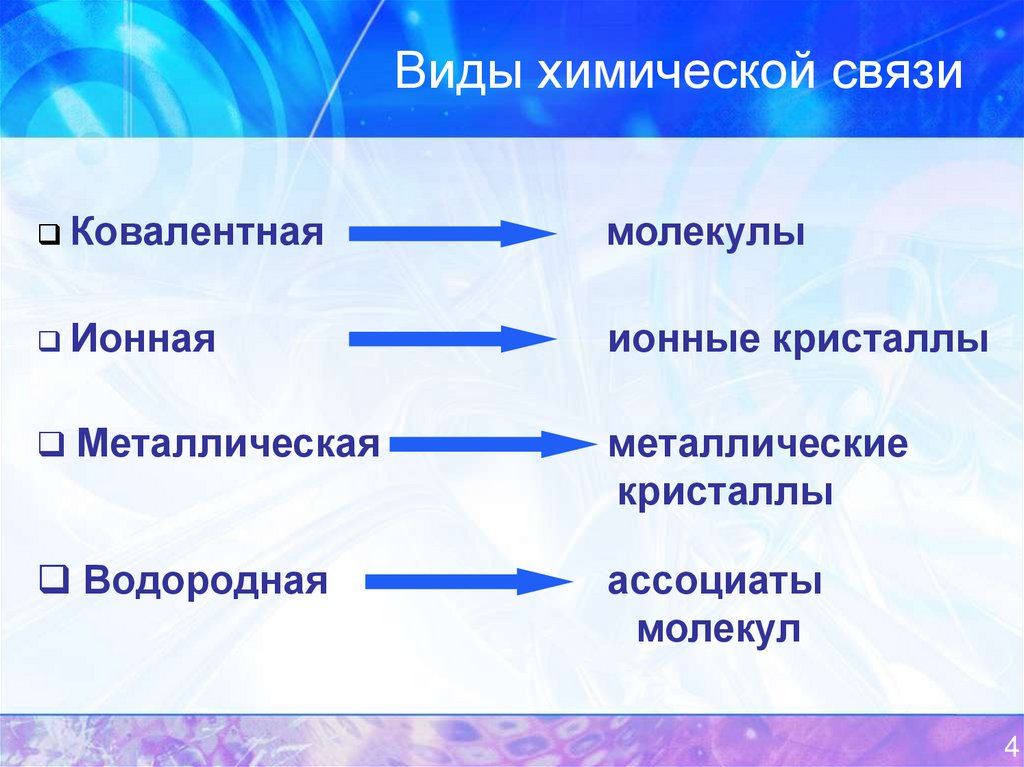
4. Виды химической связи
Ковалентнаямолекулы
Ионная
ионные кристаллы
Металлическая
металлические
кристаллы
Водородная
ассоциаты
молекул
4
5. Ковалентная связь: основные понятия
Ковалентная связь − химическая связь между атомами,осуществляемая обобществленными электронами.
Двухцентровая связь − ковалентная связь, образованная с
участием 2-х атомов и одной или нескольких пар электронов.
Простая связь − двухцентровая связь, образованная с
участием пары электронов (двухцентровая двухэлектронная
связь).
Кратная связь − двухцентровая связь, образованная с
участием нескольких (обычно двух или трех) пар электронов.
Многоцентровая связь − ковалентная связь, образованная с
участием трех и более атомов одновременно.
5
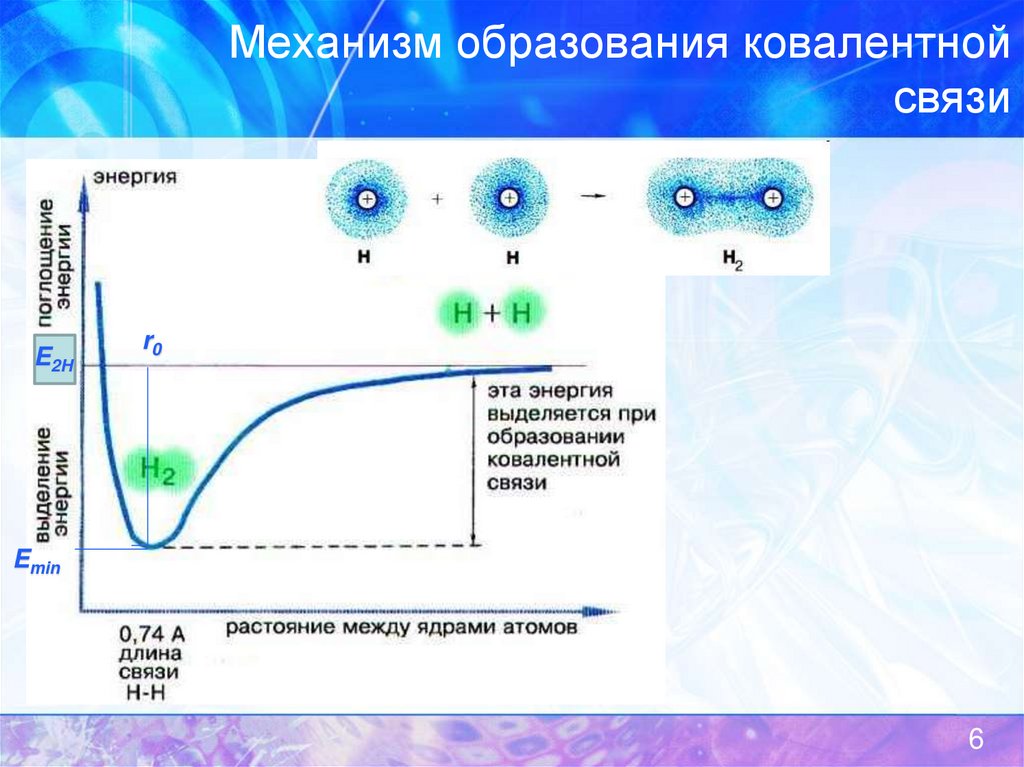
6. Механизм образования ковалентной связи
Гайтлер и Лондон, 1927E2H
r0
Emin
6
7. Условия образования ковалентной связи
Электронные облака (или атомные орбитали)взаимодействующих атомов должны перекрываться
с возникновением общей электронной пары.
Ковалентная связь тем прочнее, чем
больше площадь области перекрывания
атомных орбиталей (критерий Полинга).
7
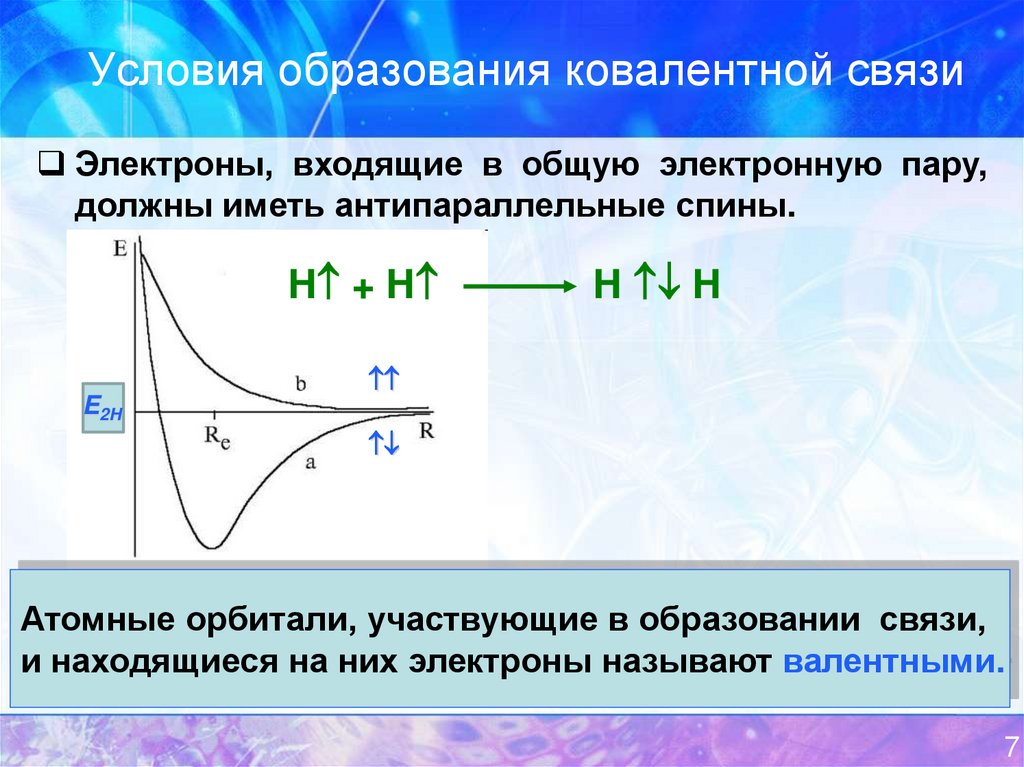
8. Условия образования ковалентной связи
Электроны, входящие в общую электронную пару,должны иметь антипараллельные спины.
H + H
H H
E2H
Атомные орбитали, участвующие в образовании связи,
и находящиеся на них электроны называют валентными.
7
9. Способы обозначения двухцентровой связи
с помощью пар точек (электронные формулы)H:O:H
поделенная
электронная пара
: :
N ::: N
: :
: :
H
H:C:H
H
неподеленная
электронная пара
H:N:H
H
8
10. Способы обозначения двухцентровой связи
с помощью пар точек (электронные формулы)H:O:H
поделенная
электронная пара
: :
N ::: N
: :
: :
H
H:C:H
H
неподеленная
электронная пара
H:N:H
H
посредством валентных штрихов
(классические структурные формулы)
H
..
H O
N N
H C H
.. H
H
..
H N H
H
8
11. Полярность ковалентной связи
Неполярная ковалентная связь − связь, при которойобщая электронная пара располагается симметрично
относительно ядер связанных атомов.
Полярная ковалентная связь − связь, при которой общая
электронная пара смещена к одному из атомов.
: :
: :
: :
:Cl : Cl:
+
-
H :Cl:
< e
эо(H) << эо(Cl)
Электроотрицательность (эо) − способность атомов в
молекуле смещать к себе общие электроны, то есть
оттягивать электроны у других атомов, с которыми они
связаны.
9
12. Электроотрицательность атомов в зависимости от положения элемента в ПС
Правило 1: Электроотрицательность атомовэлементов одного и того же периода возрастает
с увеличением порядкового номера элемента.
Li < Be < B < C < N < O < F
1.0
1.5
2.0 2.5 3.0 3.4 4.0
10
13. Электроотрицательность атомов в зависимости от положения элемента в ПС
Правило 2: Электроотрицательность атомовэлементов одной и той же подгруппы
уменьшается с увеличением
порядкового
номера элемента.
Li > Na > K Rb Cs
1.0
0.9
0.8
0.8
0.8
Cl > Br > I > At
3.0
2.8 2.5 0.8
эо < 2.0 ковалентная связь
эо 2.0 ионная связь
10
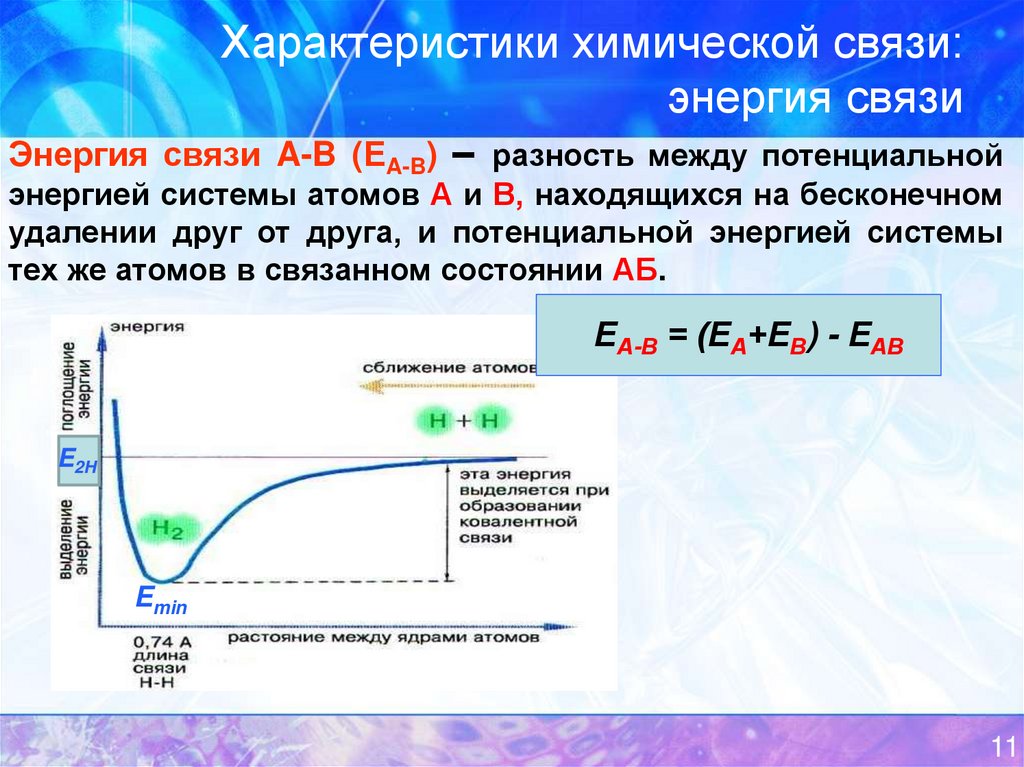
14. Характеристики химической связи: энергия связи
Энергия связи A-B (ЕA-B) – разность между потенциальнойэнергией системы атомов А и В, находящихся на бесконечном
удалении друг от друга, и потенциальной энергией системы
тех же атомов в связанном состоянии АБ.
ЕА-В = (ЕА+ЕВ) - ЕАВ
E2H
Emin
11
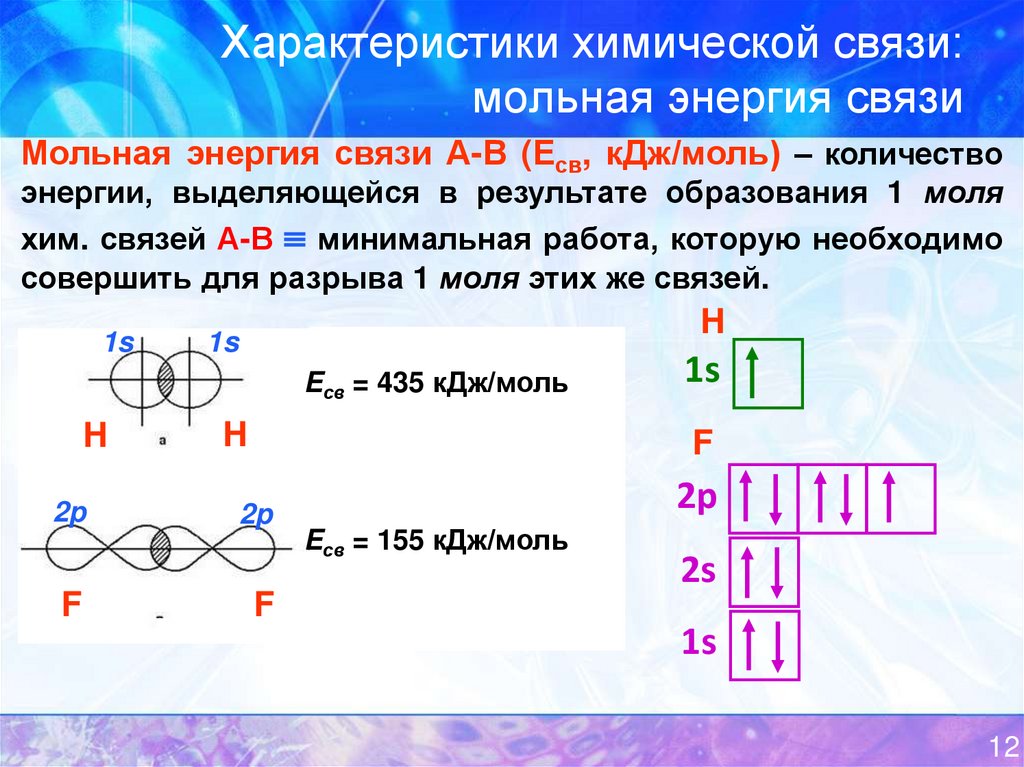
15. Характеристики химической связи: мольная энергия связи
Мольная энергия связи А-В (Есв, кДж/моль) – количествоэнергии, выделяющейся в результате образования 1 моля
хим. связей А-В минимальная работа, которую необходимо
совершить для разрыва 1 моля этих же связей.
1s
H
1s
Eсв = 435 кДж/моль
H
2p
F
1s
H
F
2p
2p
F
Eсв = 155 кДж/моль
2s
1s
12
16. Характеристики химической связи: длина связи
Длина связи А-В (rсв) – расстояние между ядрами атомов А иВ, при котором потенциальная энергия системы этих атомов
минимальна.
[rсв] = Å = 0.1нм = 10-10 м
E2H
rH-H
rH-H
E
min
2EH
Emin
13
17. Характеристики химической связи: длина связи
1s1s
EН-Н = 435 кДж/моль
H
H
rH-H = 0.74 Å
2p
2p
EF-F = 155 кДж/моль
F
F
rF-F = 1.42 Å
Чем больше
энергия связи ихимической
чем меньше ее длина,
тем
Характеристики
связи:
прочнее химическая связь!
энергия связи
13
18. Характеристики химической связи: дипольный момент
Дипольный момент хим. связи ( ) – векторнаявеличина, характеризующая полярность связи.
-q
−
+q
[ ] = D – дебай
= q l
+
1D = 3.33 10-30 кл м
l
диполь
эо
HCl > HBr > HI
1.04
0.79
0.38
(D)
14
19. Полярность связи и полярность молекулы
Дипольный момент молекулы – векторная суммадипольных моментов отдельных связей в молекуле.
молек = S i св
i
-q
O
1
+q
C
2
-q
1 = 2 = 2.70 D
O
1 + 2 = 0
< O-C-O = 180
Полярные молекулы – молекулы с ассиметричным
распределением положительного
электрических зарядов.
и
отрицательного
15
20.
СПАСИБО ЗА ВНИМАНИЕ!20















 chemistry
chemistry








