Similar presentations:
Азот. Его свойства и значение
1. Азот. Его свойства и значение
9 классАзот.
Его свойства и
значение
2. План урока:
Открытие азота
Положение азота в периодической таблице
Строение атома азота
Азот - простое вещество
Химические свойства азота
Содержание азота в природе
Применение азота
Получение азота
Тестовый контроль
ММЦ 74212
3. Открытие азота
• 12 сентября 1772 года — ДаниельРезерфорд
• 1771 - 1773 гг. — Г. Кавендиш и Дж.
Пристли
• 1770 -1777 гг. — К. Шееле
• 1787 год — А. Лавуазье, Л. Гитоном де
Морво и А. Фуркруа было предложено
название «азот» (от греч., означающего
безжизненный)
Антуан Лоран Лавуазье
4.
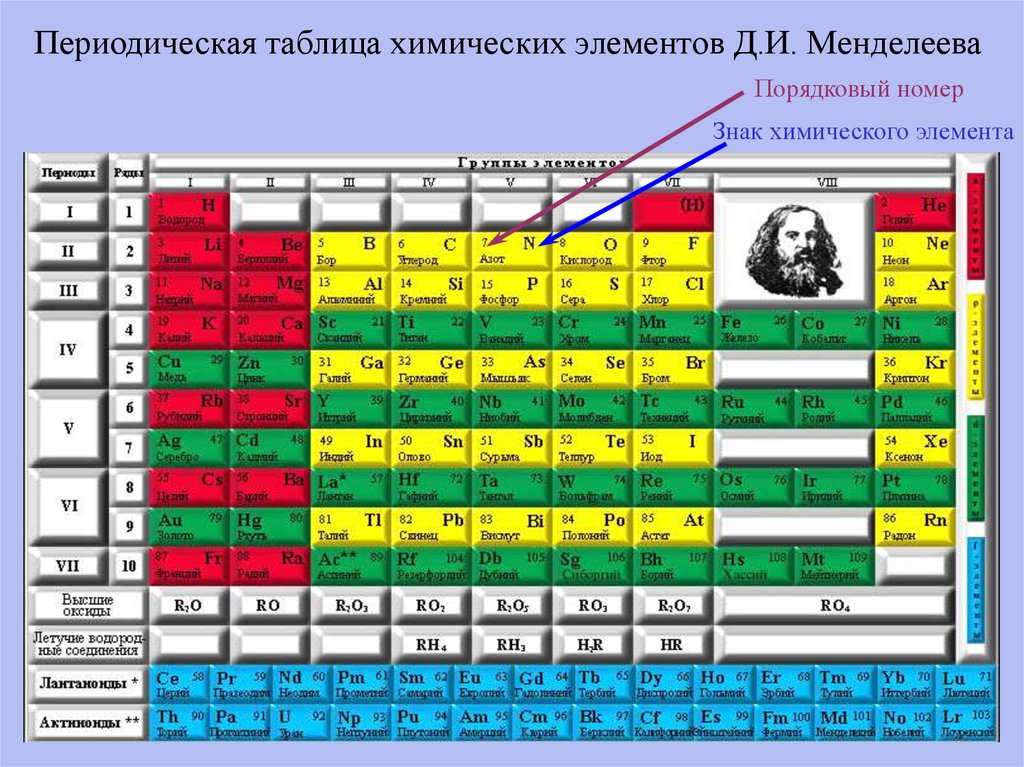
Периодическая таблица химических элементов Д.И. МенделееваПорядковый номер
Знак химического элемента
ММЦ 74212
5.
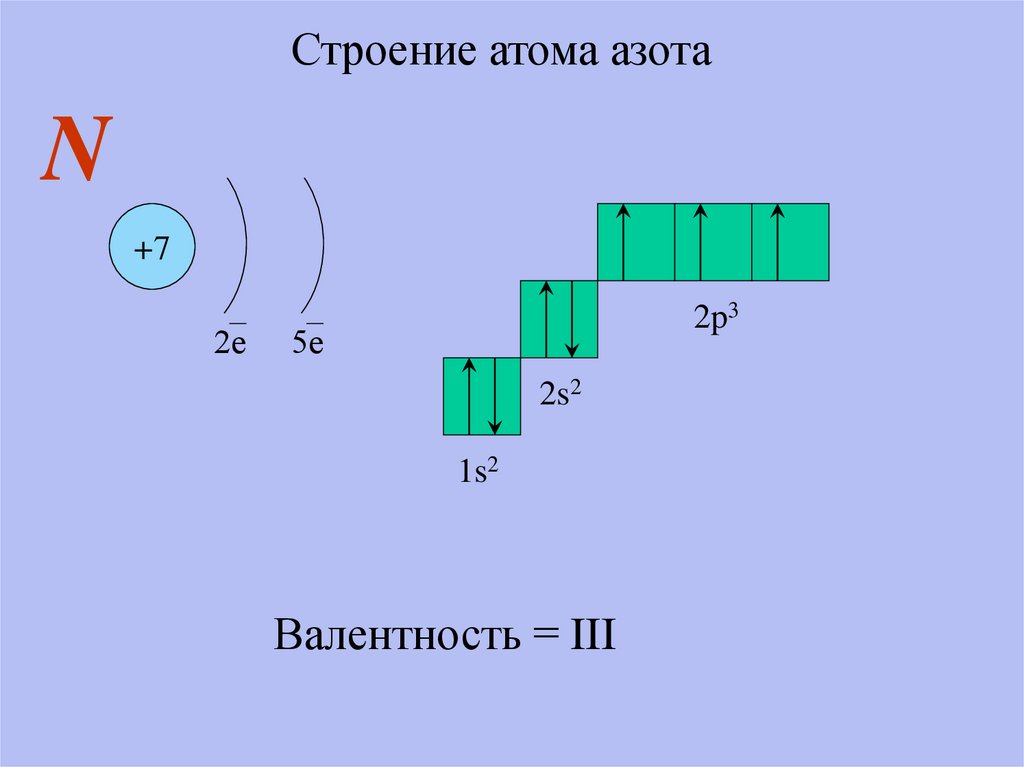
Строение атома азотаN
+7
2е
2p3
5е
2s2
1s2
Валентность = III
6. Азот - простое вещество
N2N N
Молекулярная
формула
Электронная
формула
N N
Структурная
формула
ковалентная
неполярная
связь
Газ без цвета, запаха и вкуса. Малорастворим в воде.
При t = -196oC жидкость
При t = -210oC белая снегообразная масса
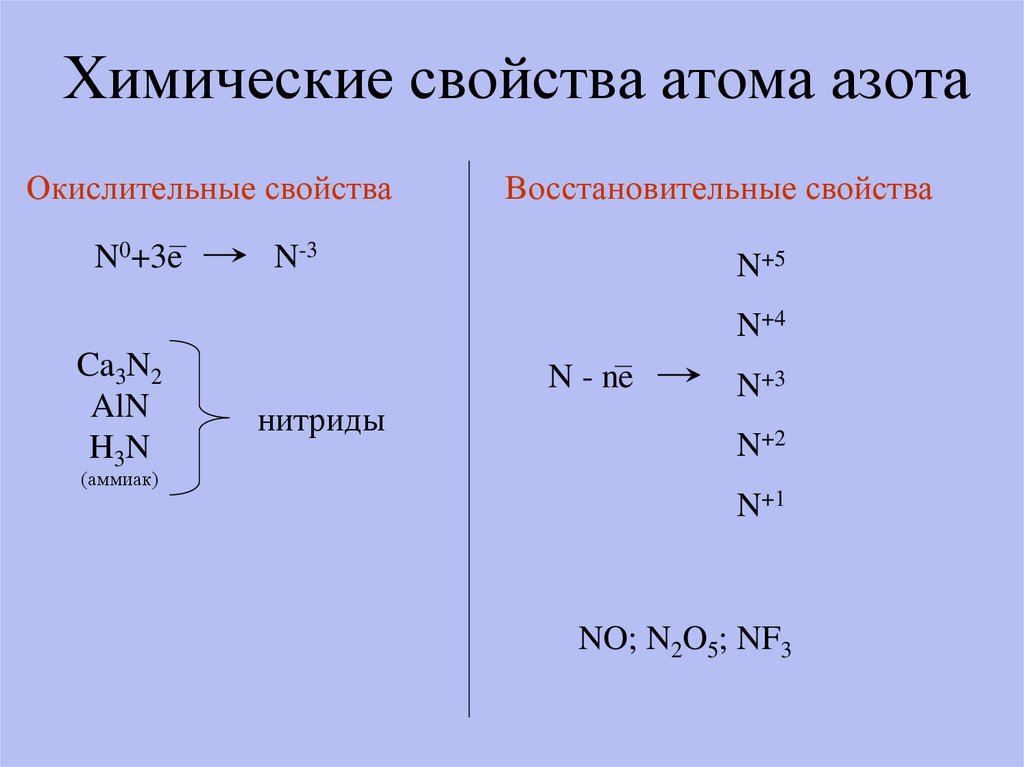
7. Химические свойства атома азота
Окислительные свойстваN0+3e
Восстановительные свойства
N-3
N+5
N+4
Ca3N2
AlN
H3N
N - ne
нитриды
N+3
N+2
(аммиак)
N+1
NO; N2O5; NF3
8. Задание:
Расставьте степени окисления и дайте названия следующимсоединениям азота
+3
-2
+4
-2
+1
-3
N2O3
NO2
Li3N
Оксид азота (III)
Оксид азота (IV)
Нитрид лития
9. Химические свойства вещества азота
Окислительные свойства• Взаимодействие с металлами (to, с
литием при комнатной to):
0
0
+2
-3
3Mg + N2 = Mg3N2 нитрид магния
в-ль
о-ль
0
N2 + 3H2
о-ль
в-ль
• Взаимодействие с кислородом
0
Kat.
-3 +1
2NH3 + Q
аммиак
Классификация реакции:
•соединения
•обратимая
•каталитическая
•ОВР
•экзотермическая
ММЦ 74212
•гомогенная
0
N2 + O2
в-ль
• Взаимодействие с водородом:
0
Восстановительные свойства
3000 - 4000oС
+2 -2
2NO - Q
о-ль
Классифицируйте реакцию
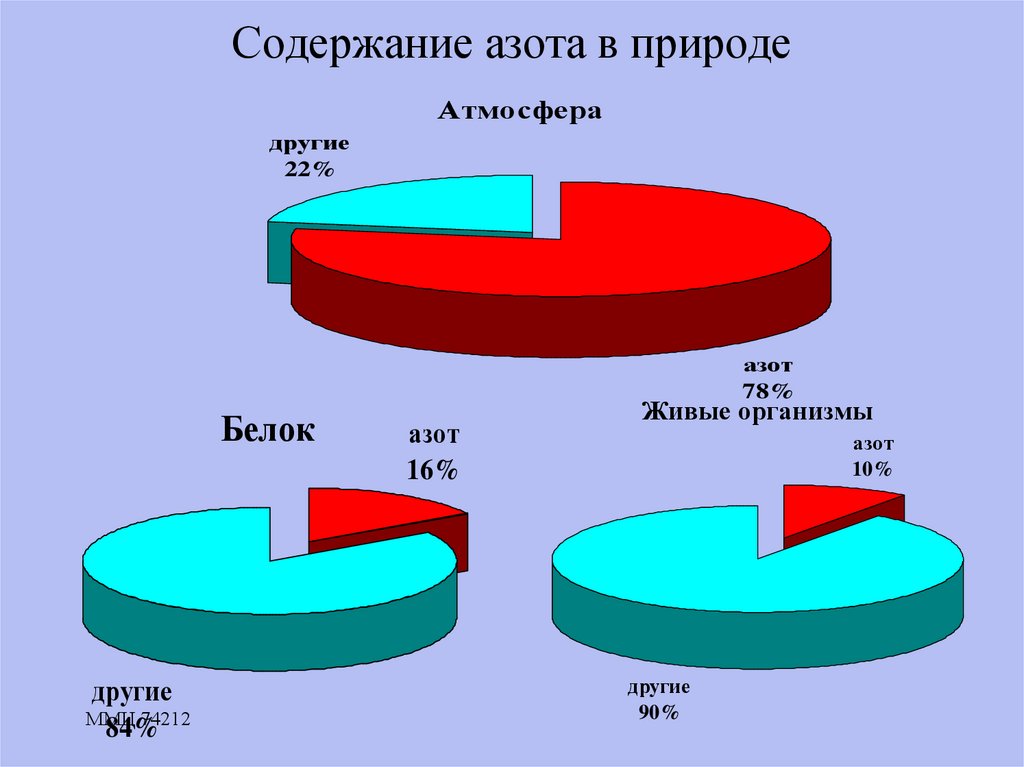
10. Содержание азота в природе
Атмосферадругие
22%
азот
78%
Белок
другие
ММЦ 74212
84%
азот
16%
Живые организмы
азот
10%
другие
90%
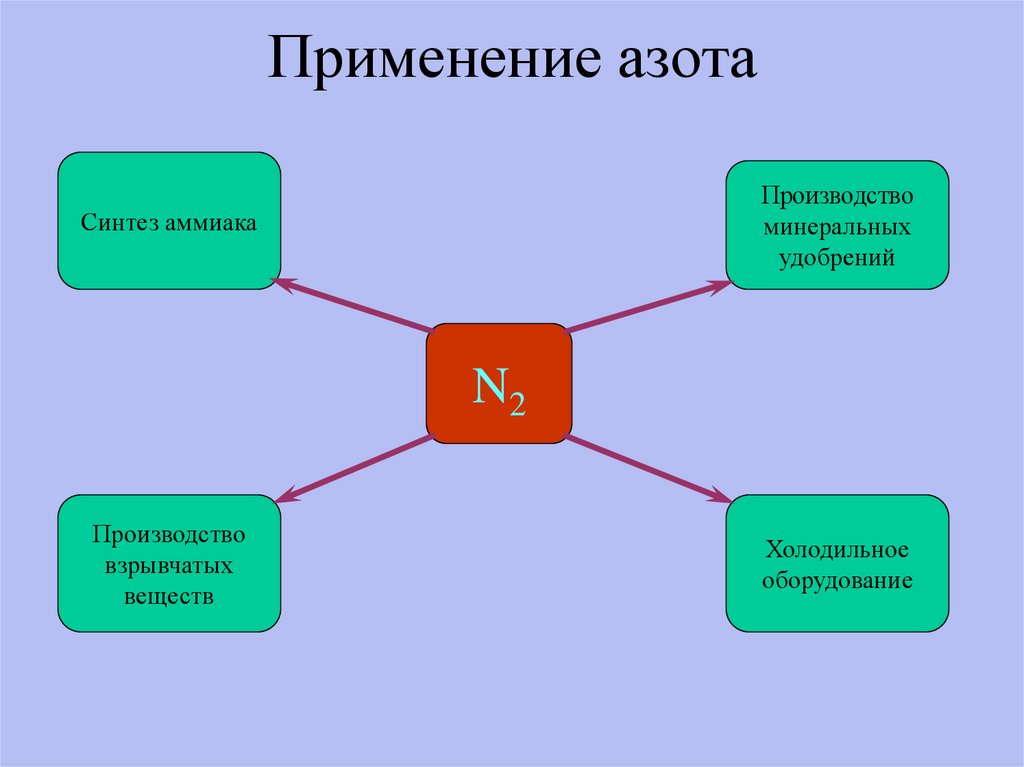
11. Применение азота
Производствоминеральных
удобрений
Синтез аммиака
N2
Производство
взрывчатых
веществ
Холодильное
оборудование
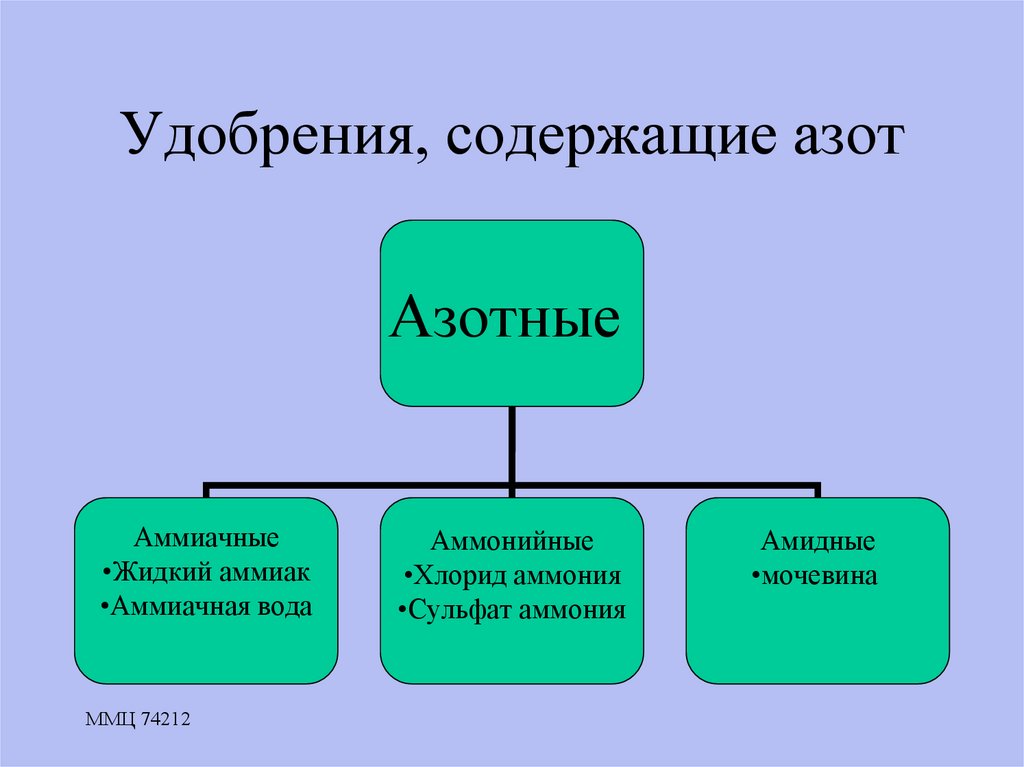
12. Удобрения, содержащие азот
АзотныеАммиачные
•Жидкий аммиак
•Аммиачная вода
ММЦ 74212
Аммонийные
•Хлорид аммония
•Сульфат аммония
Амидные
•мочевина
13. Получение азота
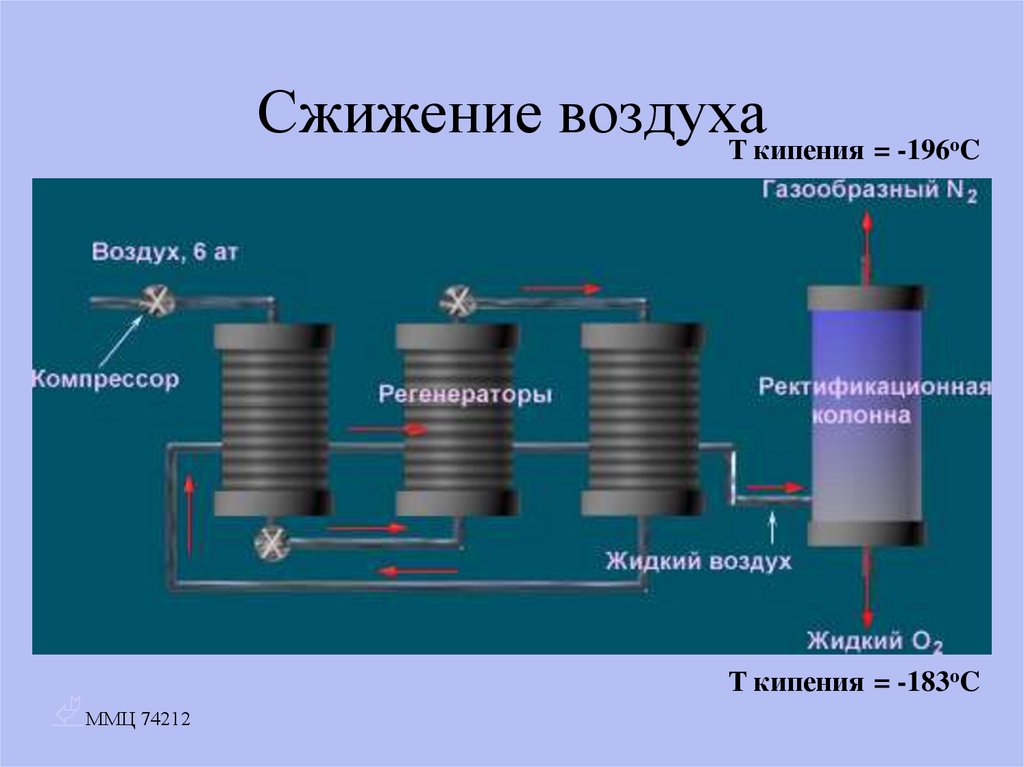
• Сжижение воздуха• Взаимодействие нитрита натрия с хлоридом аммония
• Из аммиака
•Разложение нитрита аммония (лаборатория)
ММЦ 74212
14. Сжижение воздуха
T кипения = -196 Co
ММЦ 74212
T кипения = -183oC
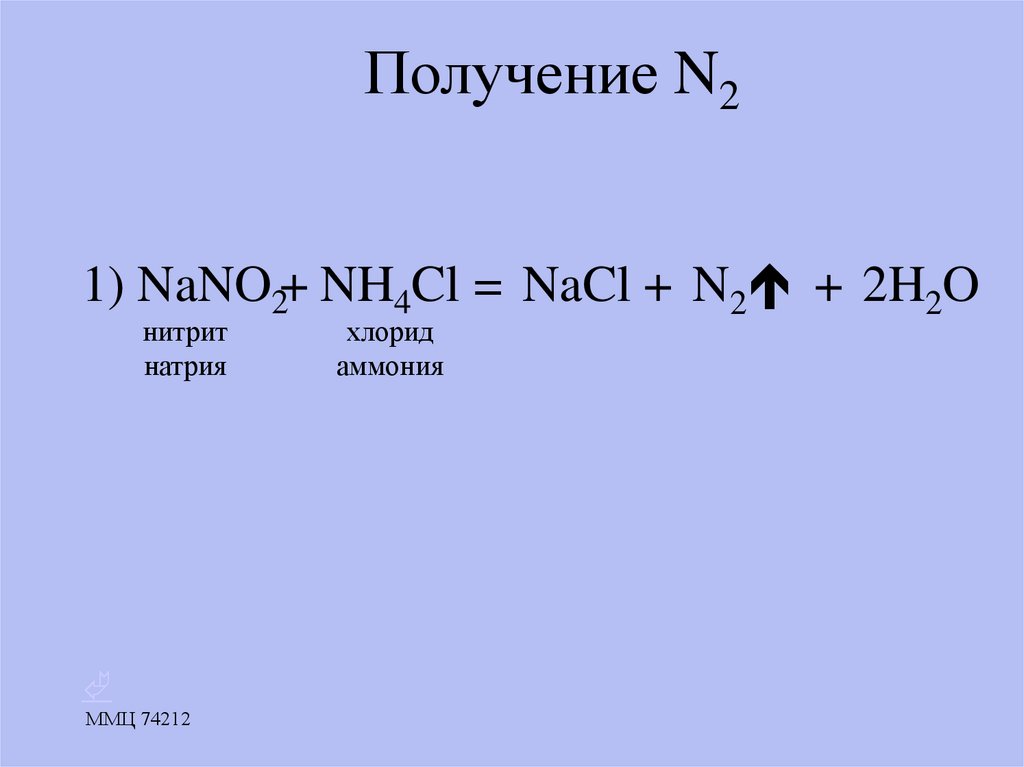
15. Получение N2
1) NaNO2+ NH4Cl = NaCl + N2 + 2H2Oнитрит
натрия
ММЦ 74212
хлорид
аммония
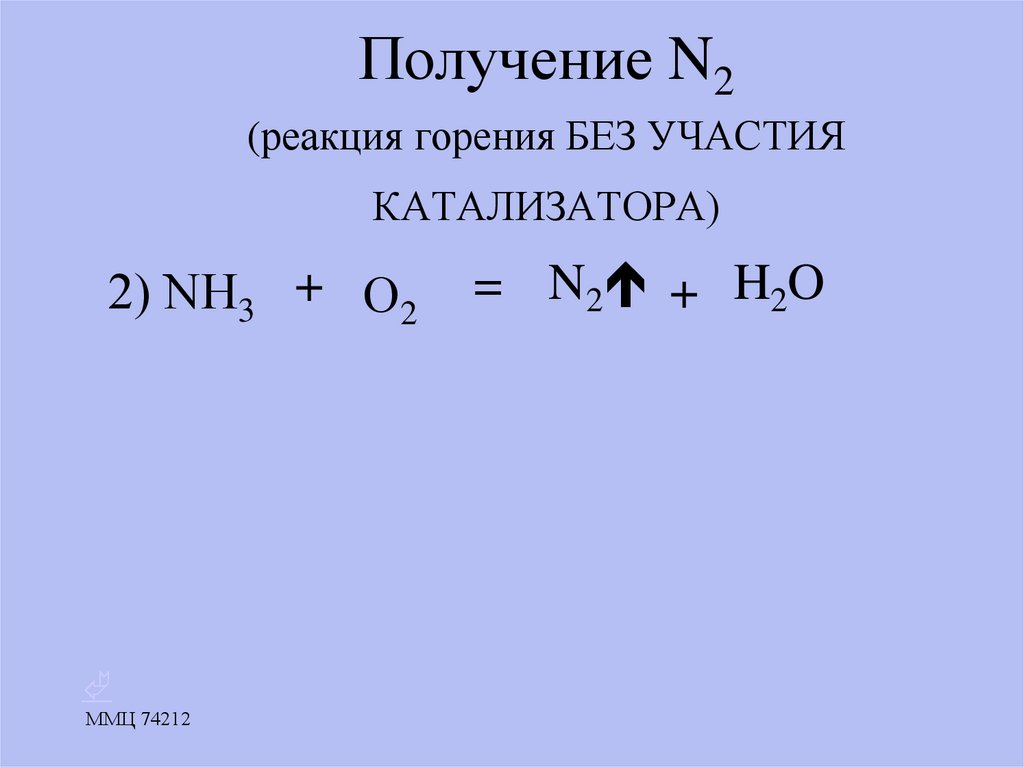
16. Получение N2 (реакция горения БЕЗ УЧАСТИЯ КАТАЛИЗАТОРА)
2) NН3 + О2ММЦ 74212
= N2 + H2O
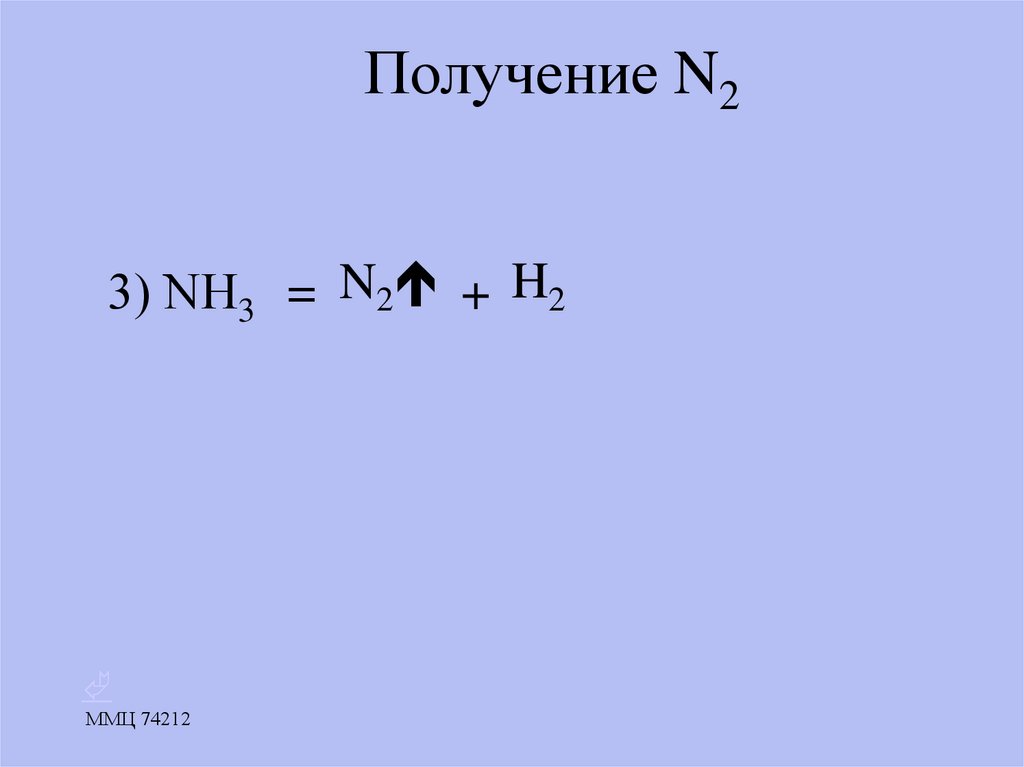
17. Получение N2
3) NН3 = N2 + H2ММЦ 74212
18. Получение N2
4) NН3 + CuO = Cu + N2 + 2H2OММЦ 74212







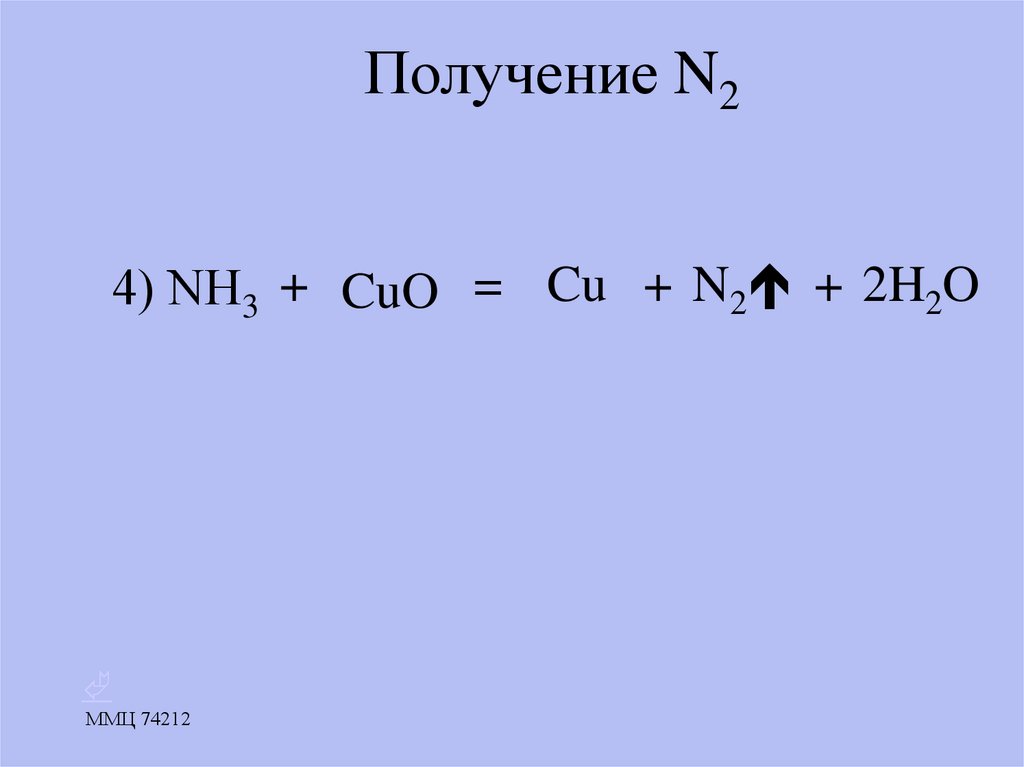
 chemistry
chemistry








