Similar presentations:
Азот и его свойства
1.
2.
3.
4.
5.
6.
7.
8. История одного открытия
В 1772 г. Англичанин Д.Резерфорд установил, что воздух,
оставшийся под колоколом, где
жила несколько дней мышь,
освобожденный от углекислоты,
не поддерживает горения и
дыхания. Этот воздух он назвал
«ядовитым воздухом».
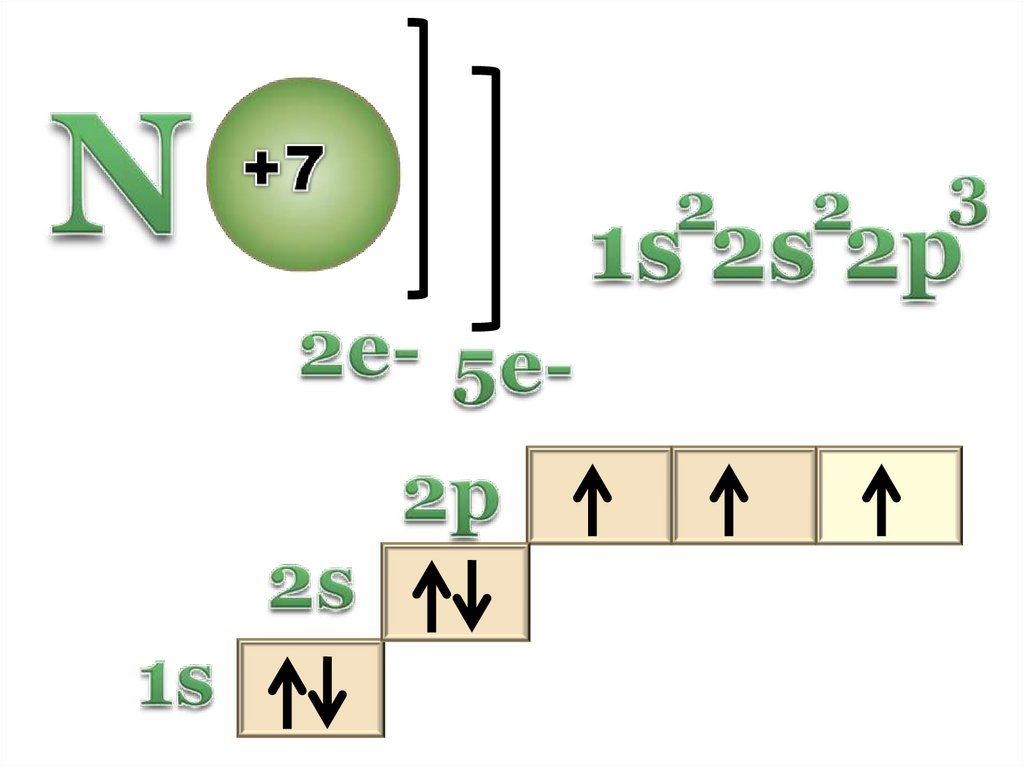
9. Азот и его свойства.
10.
11.
Возможные степени окисления12. ФИЗИЧЕСКИЕ СВОЙСТВА.
1. Газ без цвета, запаха и вкуса2. Плохо растворим в воде
3. Немного легче воздуха, плотность 1,2506 кг/м3
4. Tºпл.= -210ºС
5. Tºкип.= -196ºС
6. Не поддерживает дыхание и горение
13. 1. Взаимодействие с металлами
14. 2. Взаимодействие с водородом
Реакция с водородом протекает обратимо при высокихтемпературе и давлении в присутствии катализатора –
металлического железа:
15. 3. Взаимодействие со фтором и кислородом
16.
При нагревании с другимиметаллами(Ca, Al, Fe)
При комнатной tº только с Li
При высокой tº, р, kat (Fe,
оксиды Al, K) с H2
17.
Способы полученияВ лаборатории
В промышленности
18.
19. Аммиак. Получение аммиака
В промышленности аммиак получают синтезом из простыхвеществ:
Реакцию проводят при высоких температуре и давлении в
присутствии катализатора — металлического железа
В лаборатории аммиак получают действием щелочей на твёрдые
соли аммония:
Аммиак собирают в перевернутую кверху дном пробирку, так как
он легче воздуха.
20.
Распознавание аммиака можно проводить несколькимиспособами:
1. по характерному резкому запаху;
2. по посинению влажной лакмусовой бумажки или
покраснению бумажки, смоченной фенолфталеином;
3. по появлению белого дыма от поднесённой стеклянной
палочки, смоченной концентрированной соляной кислотой.
21. Химические свойства аммиака
Реакции, протекающие без изменения степени окисления атомаазота
1. Взаимодействие с водой
2. Взаимодействие с кислотами
3. Активные металлы способны замещать в аммиаке атом
водорода с образованием амидов:
22. Аммиак-восстановитель
1. При горении аммиака образуются азот и вода:2. В присутствии катализатора аммиак окисляется до
оксида азота(II)
3. Аммиак окисляется оксидами тяжелых металлов, галогенами,
пероксидом водорода до молекулярного азота:
23.
KMnO4 + NH3 +H2SO4 →N2 +MnSO4 +K2SO4 +H2OKClO3 + NaOH + NH3 → NaNO3 + KCl + H2O





















 chemistry
chemistry








