Similar presentations:
Минералогия
1.
МИНЕРАЛОГИЯ2.
3.
В 1636 году – итальянский натуралистБернард Цезиус: минералогия - наука обо
всех природных ископаемых телах.
Вернер А.Г. (1749-1817)
Создал
описательную
минералогию,
выделил
минералогию
как науку
4.
Ломоносовит, Кольский п-в5.
Севергин В.М.(1765-1826)
Разделил ископаемые
тела на:
простые - минералы и
сложные - горные
породы и фоссилии.
В 1804 г. издал учебник
минералогии
6.
7.
Бетехтин А.Г. (1897-1962), с. Стригино,Никольский уезд, Вологодская губерния
8.
ОСНОВЫКРИСТАЛЛОГРАФИИ
Наука о кристаллах, их
структуре, возникновении и
свойствах
Разделы:
- физическая,
- геометрическая,
- кристаллогенез,
- кристаллохимия.
9.
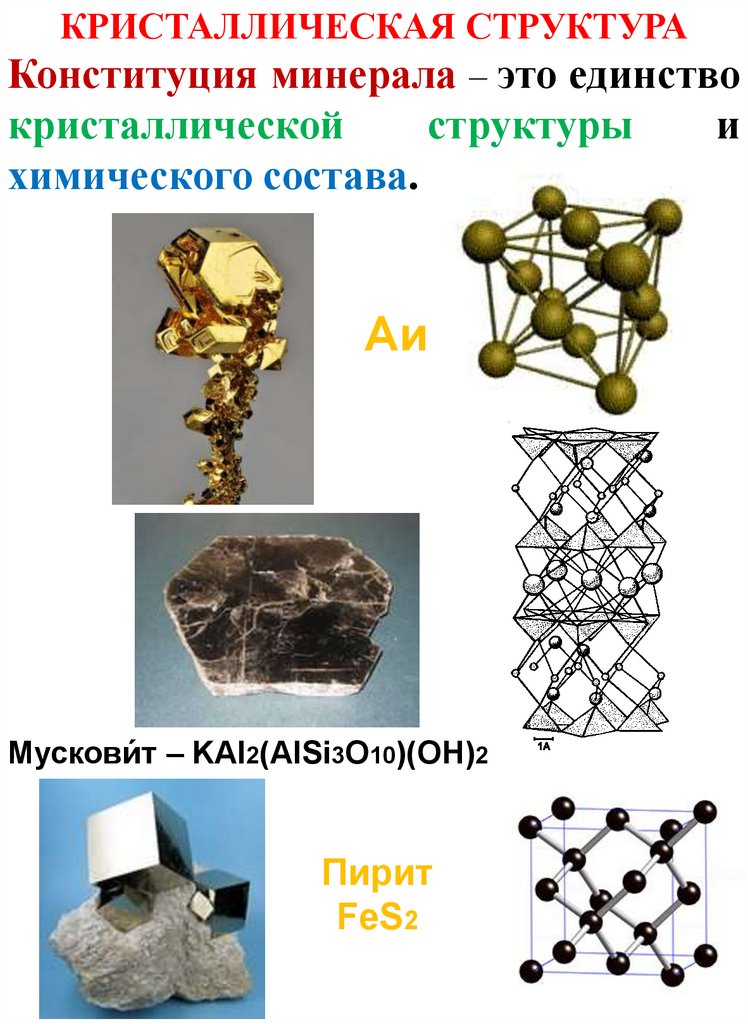
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРАКонституция минерала – это единство
кристаллической
структуры
химического состава.
Аи
Мускови́т – KAl2(AlSi3O10)(OH)2
Пирит
FeS2
и
10.
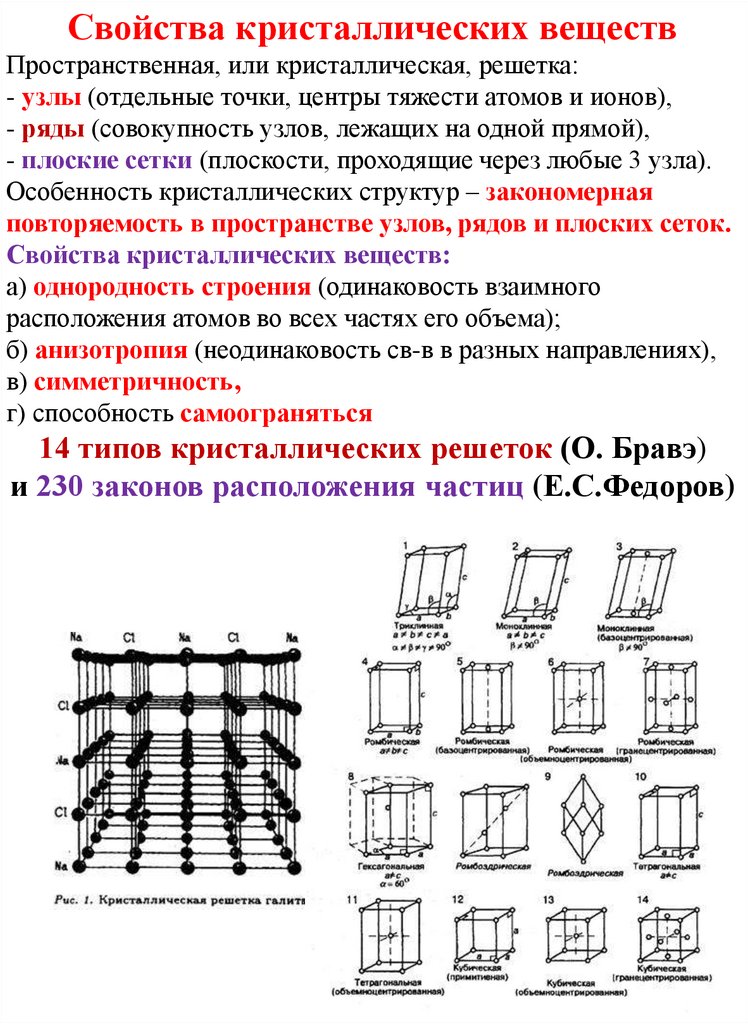
Свойства кристаллических веществПространственная, или кристаллическая, решетка:
- узлы (отдельные точки, центры тяжести атомов и ионов),
- ряды (совокупность узлов, лежащих на одной прямой),
- плоские сетки (плоскости, проходящие через любые 3 узла).
Особенность кристаллических структур – закономерная
повторяемость в пространстве узлов, рядов и плоских сеток.
Свойства кристаллических веществ:
а) однородность строения (одинаковость взаимного
расположения атомов во всех частях его объема);
б) анизотропия (неодинаковость св-в в разных направлениях),
в) симметричность,
г) способность самоограняться
14 типов кристаллических решеток (О. Бравэ)
и 230 законов расположения частиц (Е.С.Федоров)
11.
Химическая связь в минералахТипы химической связи
Ионная – электростатическое притяжение
между ионами: галенит, PbS
Ковалентная – обобществление внешних
электронов у электронейтральных атомов:
алмаз, С
12.
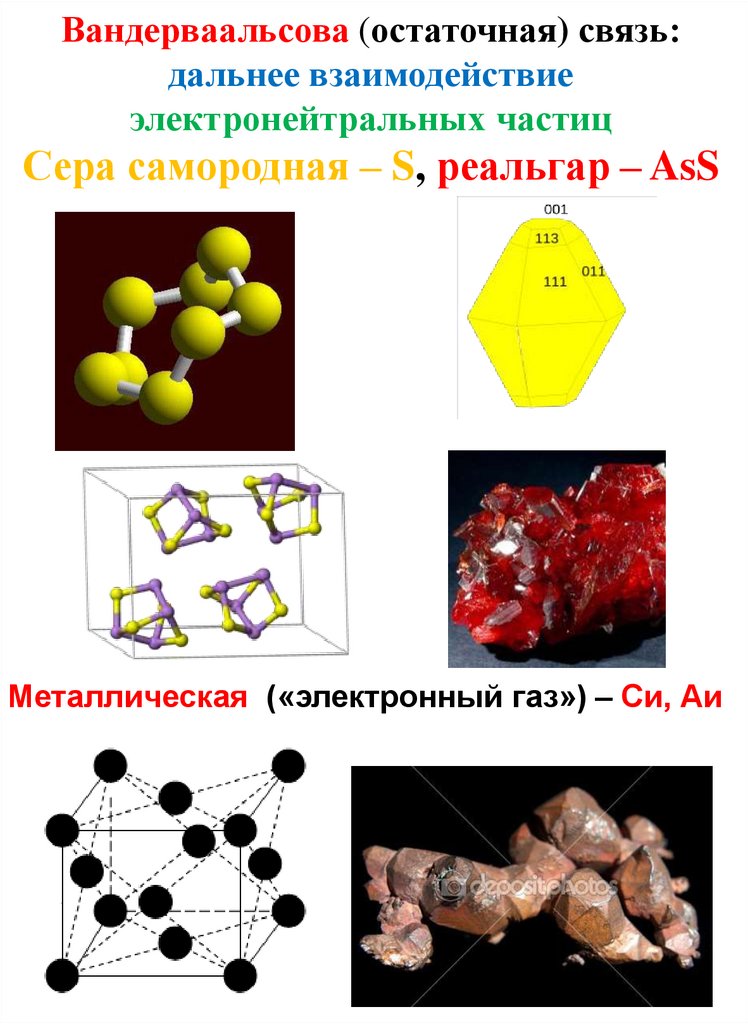
Вандерваальсова (остаточная) связь:дальнее взаимодействие
электронейтральных частиц
Сера самородная – S, реальгар – AsS
Металлическая («электронный газ») – Си, Аи
13.
Плотнейшая упаковка1) форма атомов и ионов сферическая,
2) весь объем кристалла – из плотно соприкасающихся
атомов и ионов
Галенит - PbS
Плотнейшие упаковки
Двуслойная
(гексагональная)
Трехслойная
(кубическая)
14.
КООРДИНАЦИОННЫЕ ЧИСЛА АТОМОВЧисло ближайших соседних атомов в
структуре минерала
Галит (NaCl): у атомов натрия и хлора – 6
Самородное золото (Au) – 12
15.
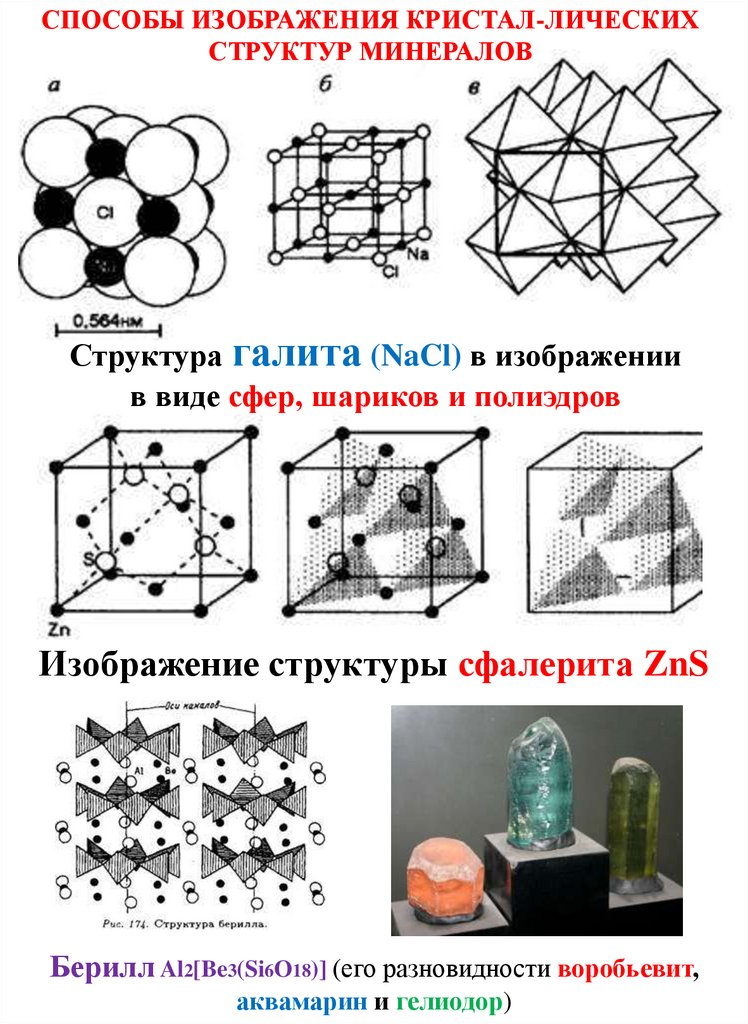
СПОСОБЫ ИЗОБРАЖЕНИЯ КРИСТАЛ-ЛИЧЕСКИХСТРУКТУР МИНЕРАЛОВ
Структура галита (NaCl) в изображении
в виде сфер, шариков и полиэдров
Изображение структуры сфалерита ZnS
Берилл Al2[Be3(Si6O18)] (его разновидности воробьевит,
аквамарин и гелиодор)
16.
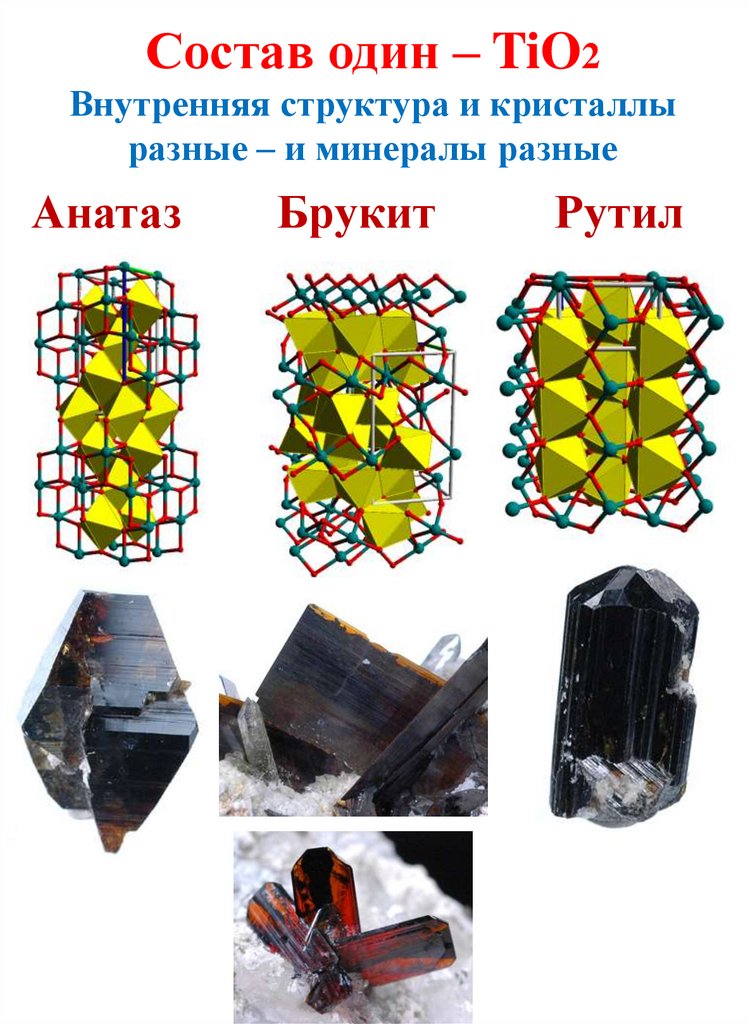
ПолиморфизмВещества одного состава, но разной структуры:
- полиморфные модификации (в физике и химии),
- разные минералы (в минералогии).
CaCO3: кальцит и арагонит
17.
Состав один – TiO2Внутренняя структура и кристаллы
разные – и минералы разные
Анатаз
Брукит
Рутил
18.
Устойчивость модификаций – вопределенных пределах t° и Р.
Переход происходит через
энергетический барьер
Структуры графита и алмаза,
поля их устойчивости
(шарик на кривой – точка барьера)
19.
ИЗОМОРФИЗМ – одинаковыекристаллы у разных минералов
Fе2Оз (гематит) и Аl2Оз (корунд),
SпО2 (касситерит), МпО2 (пиролюзит
Шпинель MgAl2O4 и магнетит Fe3O4
20.
Твердые растворыЯвления замещения атомов, соответствующих по
заряду и размеру – непрерывное изменение
химического состава минералов. Без изменения
решётки.
Условия изоморфизма:
а) близость радиусов атомов: Mg2+ – 0,078 нм, Fe 2+ – 0,082
нм, Mп2+ – 0,08 нм;
б) сходство химических свойств элементов;
в) сохранение электронейтральности структуры минерала
(двухвалентны).
21.
Типы изоморфизмаПо характеру сохранения электронейтральности
кристаллической решетки:
а) изовалентный – замена ионов одинаковой
валентности: Mg2+ на Fe2+ в магнезите;
б) гетеровалентный – замена ионов разной
валентности:
- дефектная структура минералов (твердые
растворы вычитания).
Химическая примесь индия (Iп3+) в сфалерите ZпS.
Ионы Zп2+ (радиус 0,082 нм) в трех узлах
кристаллической решетки «уступают» место двум
ионам Iп3+ (радиус 0,093 нм) и одной вакансии
(красный).
22.
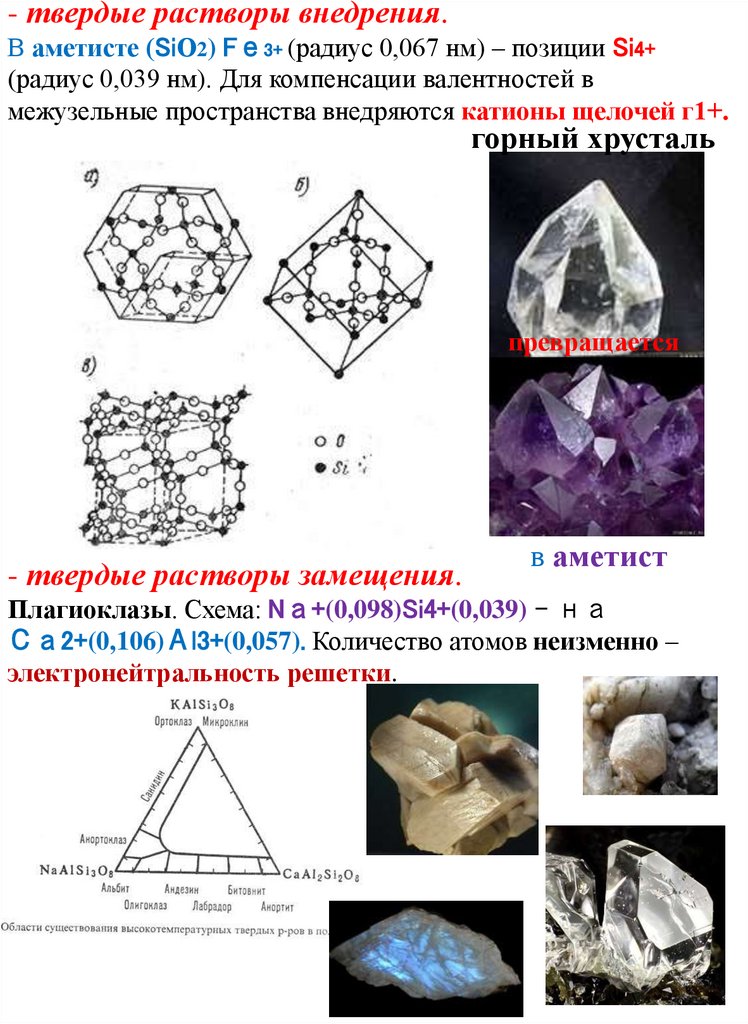
- твердые растворы внедрения.В аметисте (SiО2) Fе3+ (радиус 0,067 нм) – позиции Si4+
(радиус 0,039 нм). Для компенсации валентностей в
межузельные пространства внедряются катионы щелочей г1+.
горный хрусталь
превращается
- твердые растворы замещения.
в аметист
Плагиоклазы. Схема: Nа+(0,098)Si4+(0,039) – на
Са2+(0,106)Аl3+(0,057). Количество атомов неизменно –
электронейтральность решетки.
















 chemistry
chemistry








