Similar presentations:
Кристаллофизика, кристаллохимия
1.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮФедеральное государственное образовательное учреждение
высшего и профессионального образования
Сибирский федеральный университет
Кафедра: Геологии, минералогии и
петрографии
Красноярск, 2011
2.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮФедеральное государственное образовательное учреждение
высшего и профессионального образования
Сибирский федеральный университет
Кафедра: Геологии, минералогии и петрографии
Автор: Попова Наталья Николаевна, доцент, к.г.-м.н.
КРИСТАЛЛОФИЗИКА,
КРИСТАЛЛОХИМИЯ
Лекция 3
Направление: 130400.65 «Горное дело»
Специализация: 130400.65.00.06
«Обогащение полезных ископаемых»
Дата последнего изменения: 14.10.2011
Кристаллофизика, кристаллохимия
2
3. План лекции:
1.2.
3.
Основы кристаллофизики
механические свойства кристаллов
оптические свойства кристаллов
Основы кристаллохимии
атомные и ионные радиусы
типы связей в структурах минералов
Понятия изоморфизма и полиморфизма
Кристаллофизика, кристаллохимия
3
4.
1. Основы кристаллофизики• Кристаллофизика изучает
зависимость между физическими
свойствами кристаллов и их
внутренним строением. Физика
кристаллов привлекает все больший
интерес как с научной, так и с
практической точек зрения
Кристаллофизика, кристаллохимия
4
5.
1. Основы кристаллофизикиФизические свойства кристаллов
представлены механическими, оптическими,
электрическими и пр. свойствами кристаллов.
Обусловлены основными свойствами
кристаллического вещества: однородностью,
анизотропией, способностью к
самоогранению, а также постоянством
фазовых превращений
Кристаллофизика, кристаллохимия
5
6. Механические свойства кристаллов
1. Основы кристаллофизикиМеханические свойства кристаллов
• К механическим свойствам кристаллов
относятся свойства, связанные с такими
механическими воздействиями на них,
как удар, сжатие, растяжение –
спайность, пластическая деформация,
излом, твердость, хрупкость
Кристаллофизика, кристаллохимия
6
7.
1. Основы кристаллофизики• Спайностью называется свойство
кристаллов раскалываться или расщепляться
по определенным кристаллографическим
направлениям с образованием ровных
гладких плоскостей, называемых
плоскостями спайности
Кристаллофизика, кристаллохимия
7
8.
1. Основы кристаллофизикиВ зависимости от степени
совершенства выделяют несколько
видов спайности:
1.
2.
3.
4.
5.
весьма совершенная
совершенная
средняя
несовершенная
весьма несовершенная
Кристаллофизика, кристаллохимия
8
9.
1. Основы кристаллофизикиВесьма совершенная
спайность – кристалл
способен расщепляться
на тонкие листочки,
получить излом иначе,
чем на спайности,
весьма трудно (это
слюды, хлориты);
Кристаллофизика, кристаллохимия
9
10.
1. Основы кристаллофизикиСовершенная
спайность
при ударе молотком
выколки по спайности,
внешне очень напоминают
настоящие кристаллы.
Например, при разбивании
галенита получаются
правильные кубики,
кальцита – ромбоэдры
Кристаллофизика, кристаллохимия
10
11.
1. Основы кристаллофизикиСредняя
спайность
– на обломках
кристаллического
вещества
различаются следы
спайности и неровные
изломы по случайным
направлениям
(пироксены)
Кристаллофизика, кристаллохимия
11
12.
1. Основы кристаллофизикиНесовершенная
спайность
обнаруживается с
трудом, ее нужно искать
на обломке минерала.
Изломы представляют
неровные поверхности
(апатит, касситерит,
самородная Сu)
Кристаллофизика, кристаллохимия
12
13.
1. Основы кристаллофизикиВесьма
несовершенная
спайность
практически
отсутствует. Такие
тела имеют
раковистый излом
(подобно обсидиану)
Кристаллофизика, кристаллохимия
13
14.
1. Основы кристаллофизикиСпайность может быть
в нескольких
направлениях, под
постоянными углами:
(пироксен – 90о
амфибол – 120о)
Кристаллофизика, кристаллохимия
14
15.
1. Основы кристаллофизикиИзлом – способность минералов
раскалываться не по плоскостям
спайности, а по сложной неровной
поверхности.
Кристаллофизика, кристаллохимия
15
16. Типы изломов
1. Основы кристаллофизикиТипы изломов
раковистый
занозистый
крючковатый
ровный
ступенчатый
неровный
Кристаллофизика, кристаллохимия
16
17.
1. Основы кристаллофизикиРаковистый
излом
похож на внутреннюю
поверхность
раковины, характерен
для кристаллов, у
которых отсутствует
спайность (кварц,
халцедон, обсидиан)
Кристаллофизика, кристаллохимия
17
18.
1. Основы кристаллофизикиЗанозистый
излом напоминает
поперечный излом
древесины и
свойственен
волокнистым
минеральным
агрегатам – (асбест,
амфиболы)
Кристаллофизика, кристаллохимия
18
19.
1. Основы кристаллофизикиКрючковатый
излом поверхность
излома как бы
покрыта мелкими
крючочками
(самородная медь,
серебро и другие
ковкие металлы)
Кристаллофизика, кристаллохимия
19
20.
1. Основы кристаллофизикиЗемлистый
излом поверхность
излома матовая и
как бы покрыта
мелкой пылью
(каолин)
Кристаллофизика, кристаллохимия
20
21.
1. Основы кристаллофизикиРовный излом
типичен для
кристаллов с
совершенной
спайностью.
Свойственен очень
мелкозернистым
агрегатам, например,
яшмам
Кристаллофизика, кристаллохимия
21
22.
1. Основы кристаллофизикиСтупенчатый
излом
для кристаллов со
спайностью в
нескольких
направлениях,
например, полевой
шпат
Кристаллофизика, кристаллохимия
22
23.
1. Основы кристаллофизики• Удельный вес (плотность) – соответствует
массе минерала в граммах, заключенной в
одном кубическом сантиметре его объема.
Примеры:
легкие минералы (менее 2,5г/см3) – гипс,
галит,
средние минералы (2,5-4г/см3) – кварц,
полевые шпаты, амфиболы, пироксены.
тяжелые минералы (4-6г/см3) – пирит и
большинство сульфидов, магнетит, гематит
очень тяжелые минералы (больше 6г/см3)
– барит, галенит
Кристаллофизика, кристаллохимия
23
24.
1. Основы кристаллофизикиМагнитность –
способность некоторых
минералов
действовать на
магнитную стрелку
компаса (сильно
отклоняя ее) или
притягиваться
магнитом
(магнетит, пирротин,
ферроплатина,
самородное железо)
Кристаллофизика, кристаллохимия
24
25.
1. Основы кристаллофизикиТвердостью
кристаллов
называется степень
сопротивления
вещества какому-либо
внешнему
механическому
воздействию
(царапанию).
Кристаллофизика, кристаллохимия
25
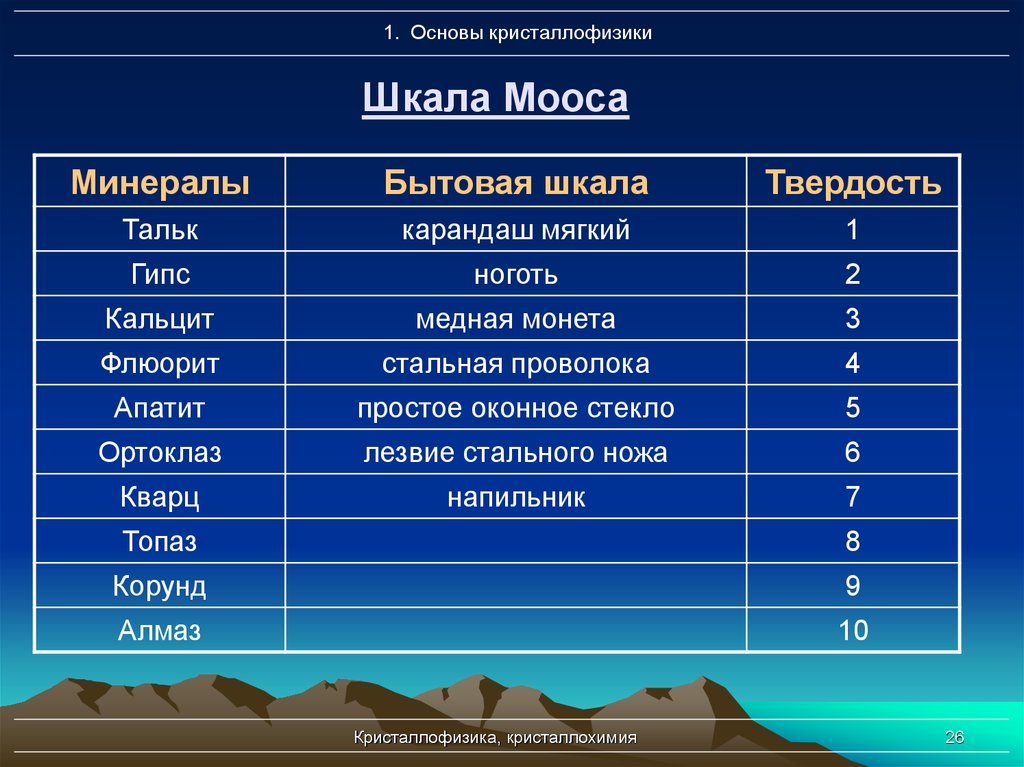
26. Шкала Мооса
1. Основы кристаллофизикиШкала Мооса
Минералы
Бытовая шкала
Твердость
Тальк
карандаш мягкий
1
Гипс
ноготь
2
Кальцит
медная монета
3
Флюорит
стальная проволока
4
Апатит
простое оконное стекло
5
Ортоклаз
лезвие стального ножа
6
Кварц
напильник
7
Топаз
8
Корунд
9
Алмаз
10
Кристаллофизика, кристаллохимия
26
27. Оптические свойства кристаллов
1. Основы кристаллофизикиОптические свойства кристаллов
1.
2.
3.
4.
Прозрачность
Цвет
Блеск
Двупреломление
Кристаллофизика, кристаллохимия
27
28.
1. Основы кристаллофизикиПрозрачность – способность минерала
пропускать свет. В зависимости от степени
прозрачности все минералы делятся на 3
группы:
• Прозрачные (сквозь минерал можно легко
видеть различные предметы) – горный
хрусталь, исландский шпат, топаз и др.
• Полупрозрачные (сквозь минерал виден свет,
но контуры предметов уже не различимы) –
сфалерит, киноварь и др.
• Непрозрачные – пирит, магнетит, графит и др.
Кристаллофизика, кристаллохимия
28
29. Типы окраски минералов:
1. Основы кристаллофизикиТипы окраски минералов:
• идиохроматическая (от греческого идиос –
собственный) – минерал имеет отчетливо
выраженный собственный цвет;
• аллохроматическая (от греческого аллос чужой) – минерал окрашен примесями;
• псевдохроматическая – «ложная окраска».
Иногда тонкий поверхностный слой минерала
имеет дополнительную окраску. Это явление
называется побежалостью
Кристаллофизика, кристаллохимия
29
30. Идиохроматическая окраска минералов
1. Основы кристаллофизикиИдиохроматическая окраска минералов
Золото
Медь
Кристаллофизика, кристаллохимия
30
31. Аллохроматическая окраска минералов
1. Основы кристаллофизикиАллохроматическая окраска минералов
Агат + Fe
Берилл + Mn
Кристаллофизика, кристаллохимия
31
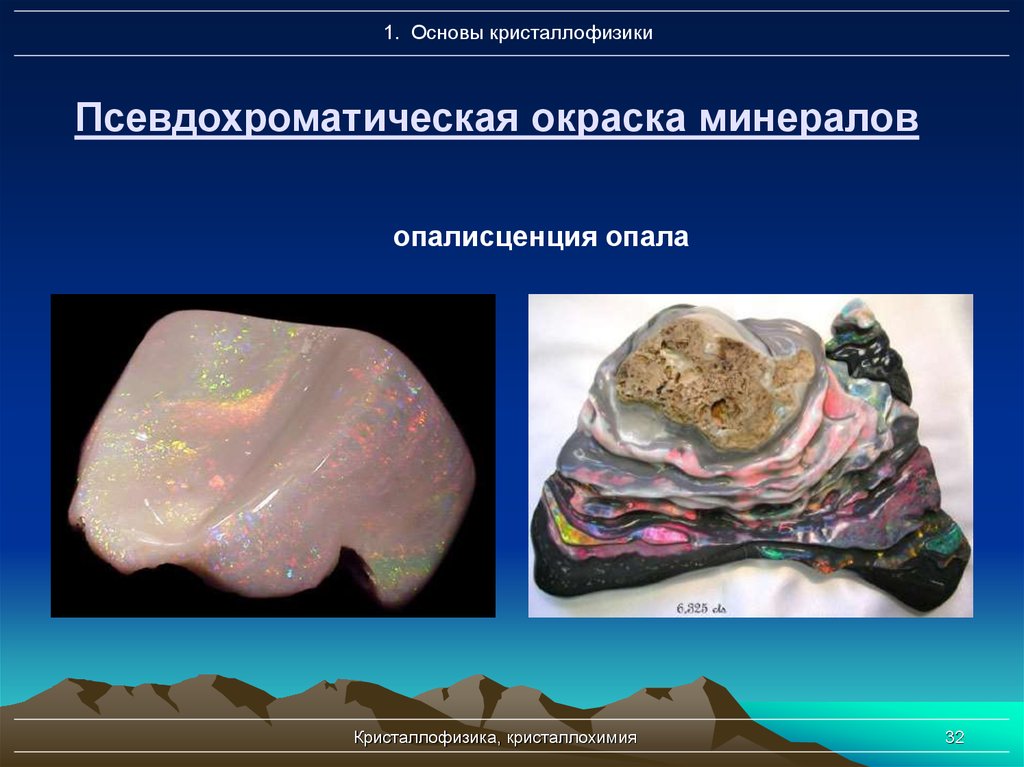
32. Псевдохроматическая окраска минералов
1. Основы кристаллофизикиПсевдохроматическая окраска минералов
опалисценция опала
Кристаллофизика, кристаллохимия
32
33. Разновидности псевдохроматической окраски
1. Основы кристаллофизикиРазновидности
псевдохроматической окраски
побежалость борнита
Кристаллофизика, кристаллохимия
ирризация лабрадора
33
34.
1. Основы кристаллофизики• Блеск – способность минералов с
различной интенсивностью отражать
падающий на них свет
Кристаллофизика, кристаллохимия
34
35.
1. Основы кристаллофизикиПо убыванию интенсивности различают
следующие виды блеска:
Металлический
Полуметаллический
Алмазный
Перламутровый
Шелковистый
Жирный
Смоляной
Восковой
Кристаллофизика, кристаллохимия
35
36.
1. Основы кристаллофизикиМеталлический –
напоминает блеск
полированного металла
(серебро, золото,
сульфиды). Минералы,
обладающие
металлическим блеском
всегда непрозрачны
Кристаллофизика, кристаллохимия
36
37.
1. Основы кристаллофизикиПолуметаллический
блеск – более тусклый
чем металлический, как у
потускневших от
времени металлов
(гематит) или как у
грифеля простого
карандаша (графит).
Минералы, обладающие
полуметаллическим
блеском также всегда
непрозрачны
Кристаллофизика, кристаллохимия
37
38.
1. Основы кристаллофизикиАлмазный – сильный
блеск, обусловленный
неоднократным
отражением света от
внутренних
поверхностей
прозрачных и
полупрозрачных
минералов (алмаз,
сера, сфалерит,
киноварь)
Кристаллофизика, кристаллохимия
38
39.
1. Основы кристаллофизикиСтеклянный –
поверхность минерала
блестит как стекло.
Стеклянным блеском
обладает
большинство (около
70%) прозрачных и
полупрозрачных
минералов. Например,
кварц, топаз, гипс и др
Кристаллофизика, кристаллохимия
39
40.
1. Основы кристаллофизикиПерламутровый –
минерал блестит и
переливается как поверхность
перламутра или жемчуга.
Наблюдается у прозрачных и
просвечивающих минералов,
имеющих тонкое пластинчатое
строение или обладающих
весьма совершенной
спайностью. Примеры: слюды,
тальк, гипс
Кристаллофизика, кристаллохимия
40
41.
1. Основы кристаллофизикиШелковистый –
обусловлен
волокнистым строением
минерала, поэтому
минерал блестит
и переливается, как
шелк или моток
шелковых нитей
(гипс-селенит, асбест,
иногда малахит
Кристаллофизика, кристаллохимия
41
42.
1. Основы кристаллофизикиЖирный – поверхность
минерала кажется
смазанной жиром или
покрытой маслянистой
пленкой (нефелин, каолин).
Возникает тогда, когда
поверхности минерала
покрыта мельчайшими
неровностями. В результате
при рассеянии получается
эффект «жирной
поверхности»
Кристаллофизика, кристаллохимия
42
43.
1. Основы кристаллофизикиСмоляной – блеск,
напоминающий блеск
застывшей смолы или
гудрона (обсидиан,
янтарь). Аналог
жирного блеска для
минералов с темной
окраской
Кристаллофизика, кристаллохимия
43
44.
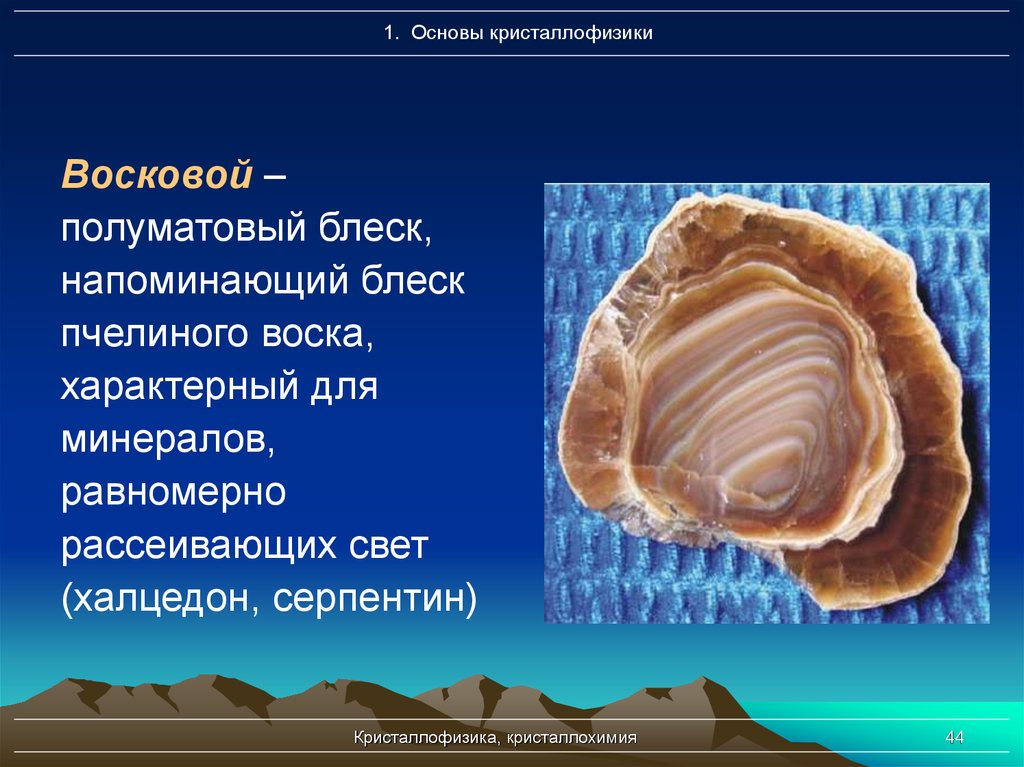
1. Основы кристаллофизикиВосковой –
полуматовый блеск,
напоминающий блеск
пчелиного воска,
характерный для
минералов,
равномерно
рассеивающих свет
(халцедон, серпентин)
Кристаллофизика, кристаллохимия
44
45.
1. Основы кристаллофизики• Двупреломление –
разложение в
анизотропных средах
светового луча,
входящего в кристалл
на два преломленных
поляризованных луча со
взаимно
перпендикулярными
световыми колебаниями
Кристаллофизика, кристаллохимия
45
46. Раздвоение надписи, рассматриваемой через кристалл исландского шпата
1. Основы кристаллофизикиРаздвоение надписи, рассматриваемой через
кристалл исландского шпата
Кристаллофизика, кристаллохимия
46
47.
2. Основы кристаллохимииКристаллохимия изучает связь между
атомным строением (структурой)
кристаллов и их химическими,
физическими и геометрическими
свойствами.
Кристаллофизика, кристаллохимия
47
48. Атомные и ионные радиусы
2. Основы кристаллохимииАтомные и ионные радиусы
Относительные размеры ионов,
слагающие наиболее
распространенные минералы
Ионы в структуре минералов можно
условно рассматривать как сферы
различного размера. Формирование
внутренней структуры растущих
кристаллов минерала зависит от
размера ионов, слагающий данный
минерал.
Положительно заряженные
ионы называются катионами,
а отрицательно заряженные –
анионами
Кристаллофизика, кристаллохимия
48
49.
2. Основы кристаллохимииАтомные и ионные радиусы
– это минимальное расстояние, на которое
центр сферы данного атома (иона) может
приблизиться к поверхности соседних
атомов (ионов)
Кристаллофизика, кристаллохимия
49
50.
2. Основы кристаллохимииВеличина радиуса зависит от ряда
причин:
1. заряд иона;
2. поляризационная способность атома
или иона;
3. термодинамические условия
(температура, давление).
Кристаллофизика, кристаллохимия
50
51.
2. Основы кристаллохимииВо время роста кристаллов
ионы, слагающие минерал,
стремятся заполнить
пространство наиболее
экономичным образом, то есть
расположиться как можно
ближе друг к другу. Если
катионы и анионы имеют
одинаковый ионный радиус,
они образуют кубическую
структуру
Кристаллофизика, кристаллохимия
51
52.
2. Основы кристаллохимииВ минерале галите
(NaCl) атомы хлора и
натрия отличаются по
ионному радиусу и
образуют
октаэдрическую
структуру
Кристаллофизика, кристаллохимия
52
53.
2. Основы кристаллохимииКогда размеры ионов
сильно отличаются по
размеру, они образуют
тетраэдрическую
структуру
Кристаллофизика, кристаллохимия
53
54. Типы химических связей между атомами
2. Основы кристаллохимииТипы химических связей между атомами
Ковалентная связь –
осуществляется в атомных
и частично в ионных
кристаллических
постройках с помощью
спаренных
(обобществленных)
электронов: два внешних
электрона с
противоположными
спинами принадлежат
одновременно двум атомам
Кристаллофизика, кристаллохимия
54
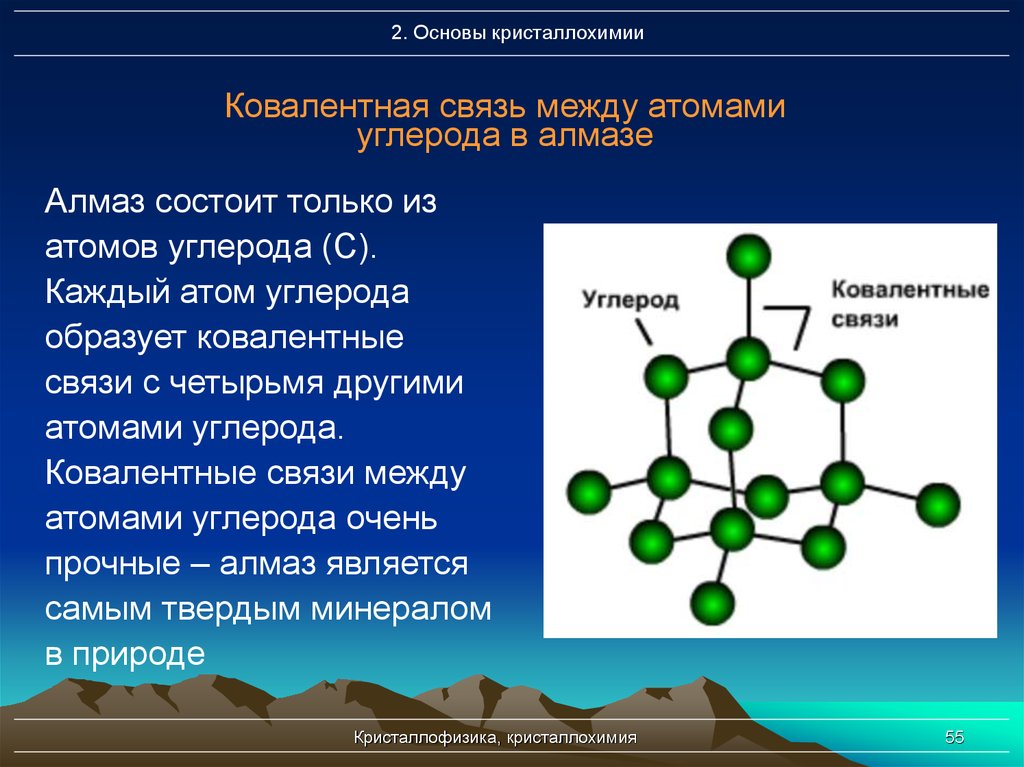
55. Ковалентная связь между атомами углерода в алмазе
2. Основы кристаллохимииКовалентная связь между атомами
углерода в алмазе
Алмаз состоит только из
атомов углерода (С).
Каждый атом углерода
образует ковалентные
связи с четырьмя другими
атомами углерода.
Ковалентные связи между
атомами углерода очень
прочные – алмаз является
самым твердым минералом
в природе
Кристаллофизика, кристаллохимия
55
56. Ионная связь
2. Основы кристаллохимииИонная связь
– характеризуется тем, что
силы связи обусловлены
электростатическим
притяжением противоположно
заряженных ионов, каждый из
которых окружен
максимальным количеством
ионов противоположного
заряда. Эта связь возникает
потому, что атомы стремятся
приобрести наиболее
устойчивую внешнюю
оболочку с полным числом
электронов во внешнем слое
Кристаллофизика, кристаллохимия
56
57.
2. Основы кристаллохимииИонные связи достаточно
прочные, но не такие
прочные как ковалентные.
Ионные и ковалентные
связи – наиболее важные
типы химических связей
между атомами в
минералах.
Кристаллофизика, кристаллохимия
57
58. Химические связи в кремнекислородном тетраэдре SiO4
2. Основы кристаллохимииПромежуточная связь –
большинство химических связей в
минералах является комбинацией
ковалентных и ионных связей.
Атом кислорода в
кремнекислородном тетраэдре
SiO4 «пытается» отнять один
электрон у атома кремния. Часть
времени «захваченный» электрон
по-прежнему проводит на
электронной оболочке атома
кремния. Поэтому связь между Si
и О является на 50% ионной, а на
50% ковалентной
Химические связи в кремнекислородном
тетраэдре SiO4
Кристаллофизика, кристаллохимия
58
59. Другие типы химических связей
2. Основы кристаллохимииДругие типы химических связей
Металлическая связь
характерна для атомов металлов,
которые имеют тенденцию легко
расставаться с электронами
внешней оболочки.
Свободные электроны становятся
общими для всех ионов в
структуре металла. Минералы с
металлическими связями являются
хорошими проводниками и имеют
металлический блеск
Кристаллофизика, кристаллохимия
59
60.
2. Основы кристаллохимииВан-дер Ваальсовые связи
– это слабые химические
связи, которые возникают
между электрически
нейтральными частицами.
Минералы, в которых атомы
связаны Ван-дер Ваальсовыми
связями, обычно отличаются
низкой твердостью
Кристаллофизика, кристаллохимия
60
61.
2. Основы кристаллохимииВодородные связи это слабые связи, возникающие в некоторых
соединениях, где есть атомы водорода. Молекулы, внутри которых атомы
связаны прочной ковалентной связью, могут образовывать с другими
молекулами воды водородные связи. Водородные связи образуются потому,
что внутренние связи в молекуле воды не являются на 100% ковалентными,
общие электроны более тяготеют к ядру атома кислорода, чем к ядрам атомов
водорода. Поэтому вокруг ядер атомов водорода образуется слабый
положительный заряд, а вокруг ядра кислорода – отрицательный.
Положительно заряженная часть одной молекулы воды притягивается к
отрицательно заряженной части другой молекулы – между ними возникает
водородная связь.
Кристаллофизика, кристаллохимия
61
62. 3. Понятия изоморфизма и полиморфизма
Понятия изоморфизма иполиморфизма впервые
было введено в научную
терминологию немецким
химиком
Эйльхайдом Митчерлихом
в 1919-1921 гг.
Кристаллофизика, кристаллохимия
62
63.
3. Понятия изоморфизма и полиморфизма• Изоморфизм (от греч. «изос» — равный,
«морфэ» — форма) - явление взаимного
замещения атомов, ионов или их групп в
кристаллических решетках минералов без
изменения их строения.
Результатом процесса изоморфного замещения
являются изоморфные смеси (смешанные
кристаллы, твердые растворы, кристаллы
переменного состава).
Кристаллофизика, кристаллохимия
63
64. Виды изоморфизма:
3. Понятия изоморфизма и полиморфизмаВиды изоморфизма:
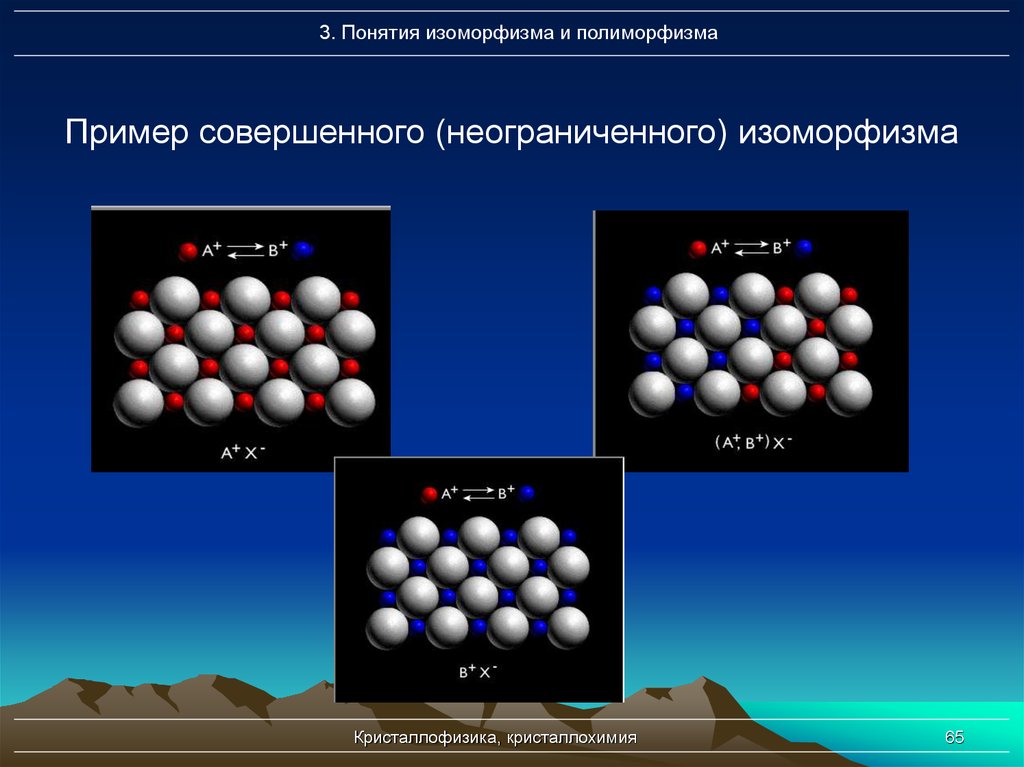
1. Совершенный (неограниченный)
изоморфизм – это явление полного без
ограничений замещения, т.е. наблюдается
полный переход от одного крайнего члена
изоморфного ряда к другому (группа
плагиоклазов Na[AlSi3O8] - Ca[Al2Si208] )
Кристаллофизика, кристаллохимия
64
65. Пример совершенного (неограниченного) изоморфизма
3. Понятия изоморфизма и полиморфизмаПример совершенного (неограниченного) изоморфизма
Кристаллофизика, кристаллохимия
65
66.
3. Понятия изоморфизма и полиморфизма2. Ограниченный (неполный)
изоморфизм – когда крайние члены
изоморфного ряда не могут образовывать
между собой непрерывного перехода и состав
изоморфной смеси достигает определенного
предельного уровня для каждого из крайних
членов в определенных соотношениях
(кальцит Са,MgСО3)
Кристаллофизика, кристаллохимия
66
67. Причины проявления изоморфизма
3. Понятия изоморфизма и полиморфизмаПричины проявления изоморфизма
Внутренние причины, обусловленные
строением атомов
1. Близость ионных радиусов
2.
Близость свойств атомов:
валентности
строения
внешней электронной оболочк,
потенциалов ионизации
сродства к электрону
3. Характер возникающего соединения и его строение
тип химических связей
структура решетки
Кристаллофизика, кристаллохимия
67
68.
3. Понятия изоморфизма и полиморфизмаВнешние причины:
1. Термодинамическая обстановка
(температура, давление)
2. Смена окислительно – восстановительных
условий.
Кристаллофизика, кристаллохимия
68
69. Значение изоморфизма для изучения природных процессов
3. Понятия изоморфизма и полиморфизмаЗначение изоморфизма
для изучения природных процессов
1. Осуществляет миграцию элементов в
земной коре
2. Индикатор P-T условий геологических
процессов
Кристаллофизика, кристаллохимия
69
70.
3. Понятия изоморфизма и полиморфизма• Полиморфизм (от греч. «поли» — много,
«морфэ» — форма) - свойство соединений и
простых веществ в зависимости от внешних
условий (T, P, x – концентрация растворов)
кристаллизоваться в различных структурных
типах
Кристаллофизика, кристаллохимия
70
71.
3. Понятия изоморфизма и полиморфизмаПолиморфные превращения –
переходы из одной кристаллической формы в
другую. Устойчивые в тех или иных
термодинамических условиях
кристаллические формы вещества
называются полиморфными
модификациями
Кристаллофизика, кристаллохимия
71
72.
3. Понятия изоморфизма и полиморфизмаКристаллофизика, кристаллохимия
72
73.
Спасибо за внимание!Кристаллофизика, кристаллохимия
73



































































 chemistry
chemistry