Similar presentations:
Свободное окисление. Активные формы кислорода
1.
Свободное окисление.Активные формы кислорода
2.
Свободное окисление - это кислородзависимые процессы, которыене связаны с образованием АТФ. В реакциях свободного окисления
участвуют оксидазы и оксигеназы, которые используют кислород
как субстрат:
Оксидазы –забирают водород от субстрата и передают его на
кислород
Оксигеназы (моно- и диоксигеназы) внедряют кислород в
молекулу субстрата
3.
ОксидазыХотя почти во всех клетках большая часть всего потребляемого
кислорода восстанавливается с участием цитохромоксидазы
дыхательной цепи, возможно частичное восстановление
кислорода с образованием пероксида водорода. Так действуют
НАДФН-оксидазы плазматической мембраны фагоцитирующих
лейкоцитов:
НАДФН + H+ + О2 → НАДФ+ + Н2О2
Образующийся пероксид водорода способствует уничтожению
поглощенных лейкоцитами бактерий.
4.
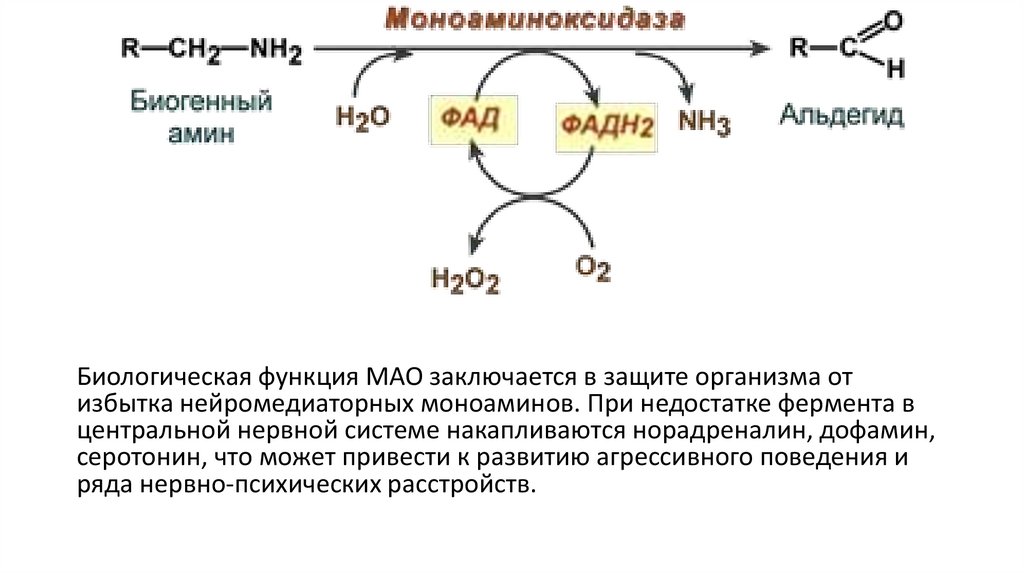
Флавинсодержащие моноаминооксидазыФлавинсодержащие моноаминооксидазы (МАО) катализируют
окислительное дезаминирование биогенных аминов, используя в
качестве кофермента – ФАД, чем поддерживают постоянную
концентрацию эндогенных моноаминов в тканях, что особенно
важно для нервной ткани. Реакция протекает в 2 стадии:
1. Дегидрирование амина с восстановлением ФАД и
образованием имина
2. Имин реагирует с водой и превращается в альдегид, а
восстановленный кофермент окисляется кислородом с
образованием Н2О2
5.
Биологическая функция МАО заключается в защите организма отизбытка нейромедиаторных моноаминов. При недостатке фермента в
центральной нервной системе накапливаются норадреналин, дофамин,
серотонин, что может привести к развитию агрессивного поведения и
ряда нервно-психических расстройств.
6.
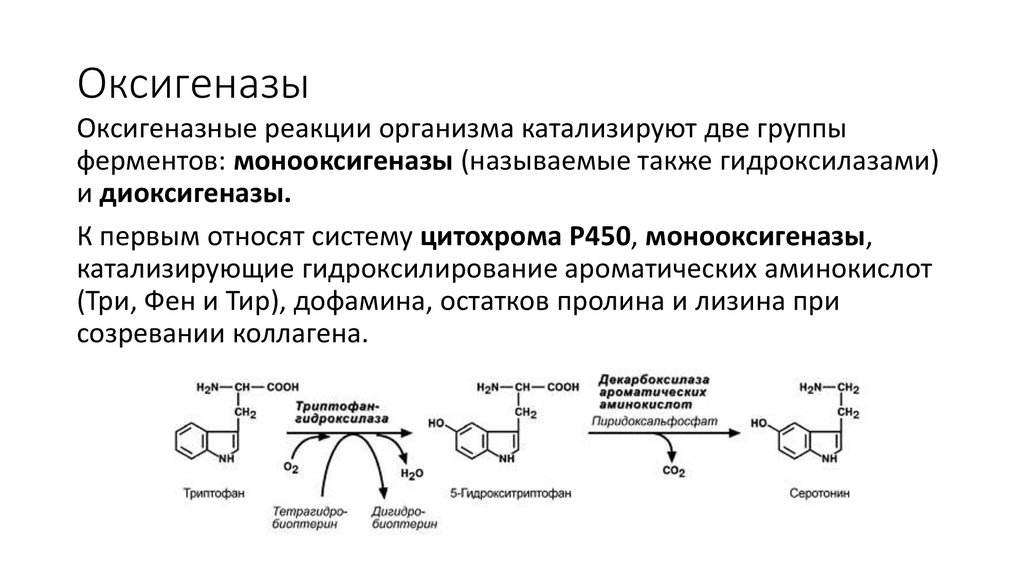
ОксигеназыОксигеназные реакции организма катализируют две группы
ферментов: монооксигеназы (называемые также гидроксилазами)
и диоксигеназы.
К первым относят систему цитохрома Р450, монооксигеназы,
катализирующие гидроксилирование ароматических аминокислот
(Три, Фен и Тир), дофамина, остатков пролина и лизина при
созревании коллагена.
7.
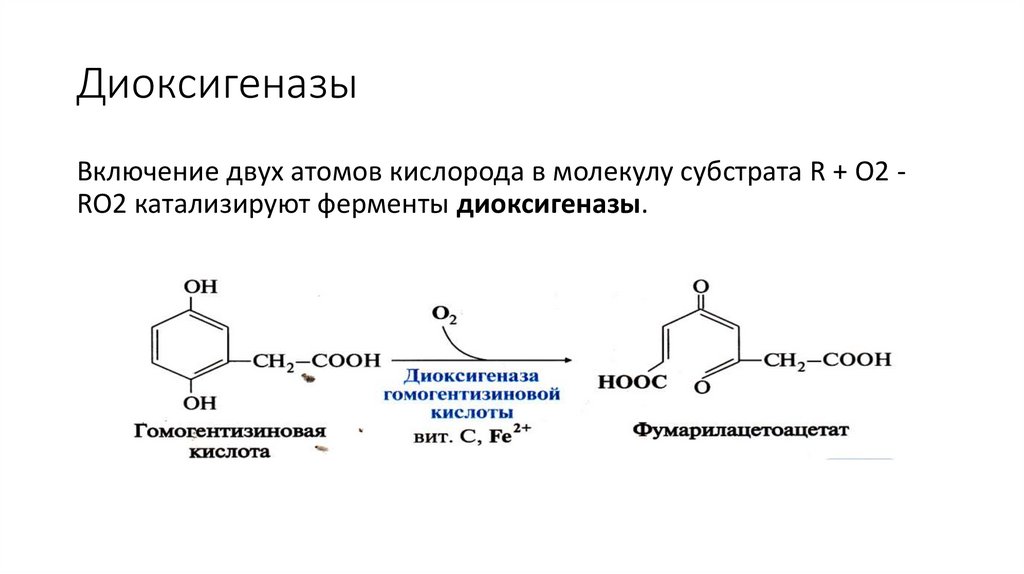
ДиоксигеназыВключение двух атомов кислорода в молекулу субстрата R + O2 RO2 катализируют ферменты диоксигеназы.
8.
9.
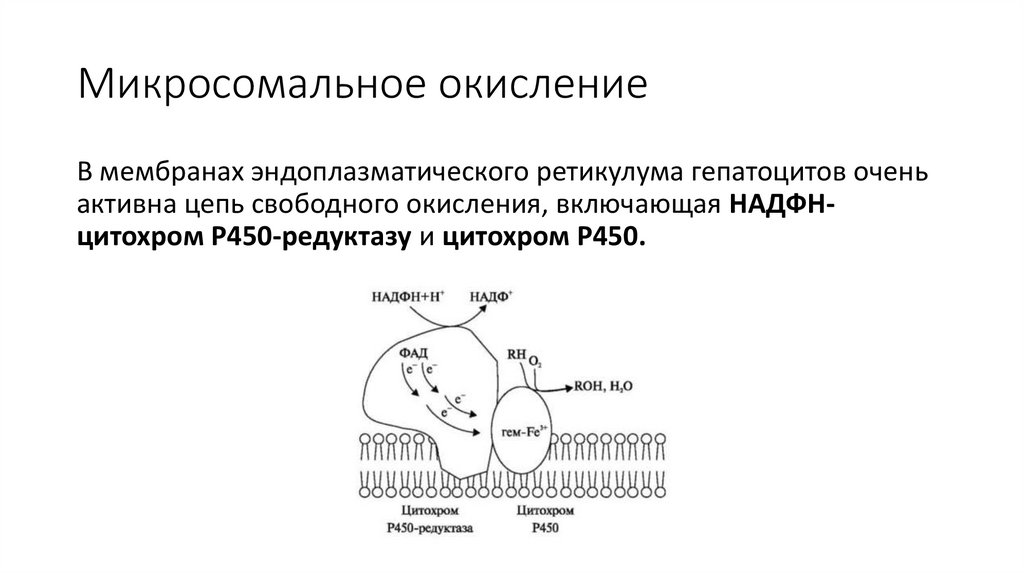
Микросомальное окислениеВ мембранах эндоплазматического ретикулума гепатоцитов очень
активна цепь свободного окисления, включающая НАДФНцитохром Р450-редуктазу и цитохром Р450.
10.
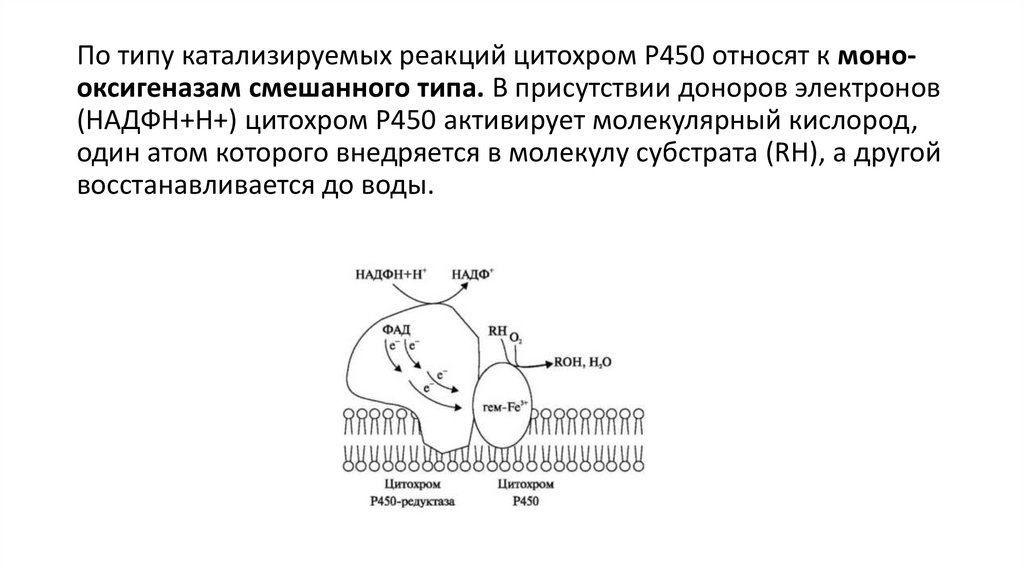
По типу катализируемых реакций цитохром Р450 относят к монооксигеназам смешанного типа. В присутствии доноров электронов(НАДФН+Н+) цитохром Р450 активирует молекулярный кислород,
один атом которого внедряется в молекулу субстрата (RH), а другой
восстанавливается до воды.
11.
Cуммарную реакцию микросомального окисления можно описатьследующим образом:
RH + НАДФН + Н+ + О2 = ROH + НАДФ+ + H2O
где RH - гидрофобный субстрат; НАДФН + Н+ - донор электронов;
ROH - гидроксилированный продукт.
12.
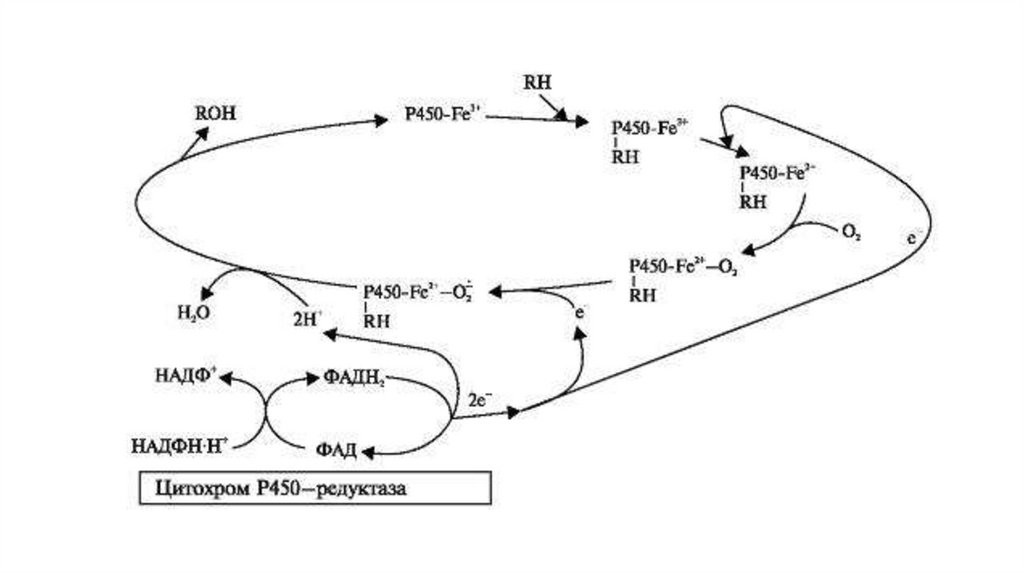
Весь каталитический процесс микросомального окисления можноразбить на несколько стадий:
• I - гидрофобное вещество (RH) взаимодействует с окисленной
формой цитохрома Р450 (Fe3+) с образованием ферментсубстратного комплекса RH-Р450-Fe3+. Трехвалентное железо не
может связать кислород.
• II - два электрона с участием цитохром Р450 - редуктазы
переносятся от НАДФН + Н+, при этом один электрон связывается с
комплексом RH-Р450-Fe3+ и переводит его в RH-Р450-Fe2+.
• III - восстановленный фермент-субстратный комплекс
взаимодействует с молекулой кислорода с образованием
оксигенированного фермент-субстратного комплекса RH-Р450Fe2+-О2.
13.
14.
• IV - за счет второго электрона происходит восстановлениекислорода и превращение его в свободный радикал
• V - образовавшийся восстановленный комплекс подвергается
внутримолекулярным превращениям с высвобождением молекулы
воды и гидроксилированного субстрата - ROH. При этом цитохром
Р450 возвращается в исходное состояние и готов к взаимодействию
со следующей молекулой гидрофобного субстрата.
15.
Биологическая роль микросомальногоокисления
Микросомальный гидроксилазный цикл цитохрома Р450 в печени
необходим для окисления ксенобиотиков (от греч. xenos - чужой и
bios - жизнь), к числу которых относят лекарственные средства,
яды, продукты промышленного загрязнения, пестициды,
канцерогены и т.д. В результате гидроксилирования растворимость
ксенобиотиков в воде возрастает, что облегчает их выведение из
организма с мочой.
Помимо обезвреживания ксенобиотиков, цитохром Р450 играет
важную роль в окислении многочисленных эндогенных
соединений - стероидов, желчных и жирных кислот, в синтезе
простагландинов, лейкотриенов.
16.
Свободные радикалыВ биологических системах могут образовываться промежуточные
продукты восстановления молекулы кислорода : пероксид
водорода, супероксидный и гидроксильный радикалы.
Свободные радикалы отличаются от обычных молекул тем, что у
них на внешней электронной оболочке имеется неспаренный
(одиночный) электрон. Это делает радикалы химически
активными, поскольку радикал стремится вернуть себе
недостающий электрон, отняв его от окружающих молекул и тем
самым их повреждая. Так как эти соединения обладают высокой
реакционной способностью, они получили название "активных
форм кислорода"
17.
Главный источник свободных радикалов - дыхательная цепь. Утечкаэлектронов происходит из комплексов I и II в реакциях с
убихиноном. Неполное восстановление кислорода приводит к
образованию свободных супероксидных радикалов. Ионы меди
(Cu+) и железа (Fe2+) катализируют образование опасных
гидроксильных радикалов из пероксида водорода.
18.
Перекисное окисление липидовАктивные формы кислорода оказывают повреждающее
воздействие на структуры клеток и тканей, активируя процесс
перекисного окисления липидов. ПОЛ – это цепная реакция
расширенного воспроизводства свободных радикалов, когда
каждый свободный радикал обеспечивает образование нового
свободного радикала.
19.
Основные стадии перекисного окисления липидов1. инициирование цепной реакции;
2. развитие и разветвление цепи;
3. разрушение структуры липидов;
4. обрыв цепей.
20.
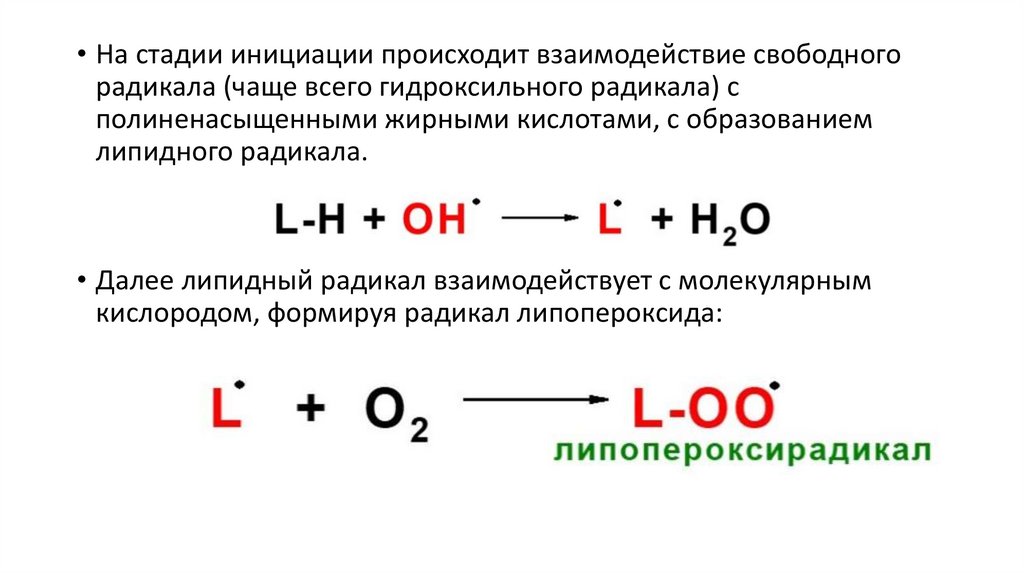
• На стадии инициации происходит взаимодействие свободногорадикала (чаще всего гидроксильного радикала) с
полиненасыщенными жирными кислотами, с образованием
липидного радикала.
• Далее липидный радикал взаимодействует с молекулярным
кислородом, формируя радикал липопероксида:
21.
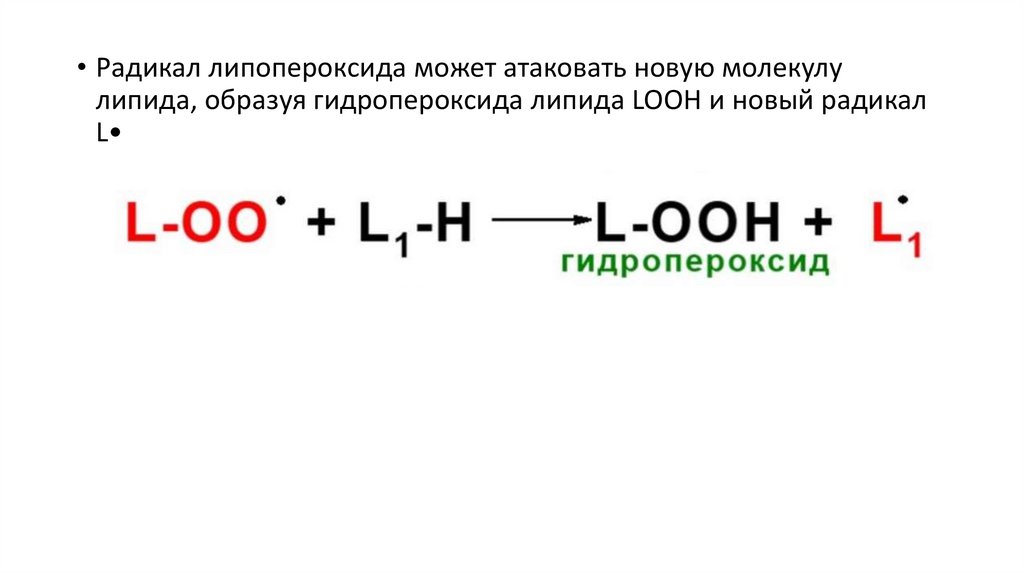
• Радикал липопероксида может атаковать новую молекулулипида, образуя гидропероксида липида LOOН и новый радикал
L
22.
Продукты перекисного окисления липидовПервичные продукты ПОЛ:
• перекиси липидов
Вторичные продукты ПОЛ:
• альдегиды, кетоны, спирты
Конечные продукты ПОЛ:
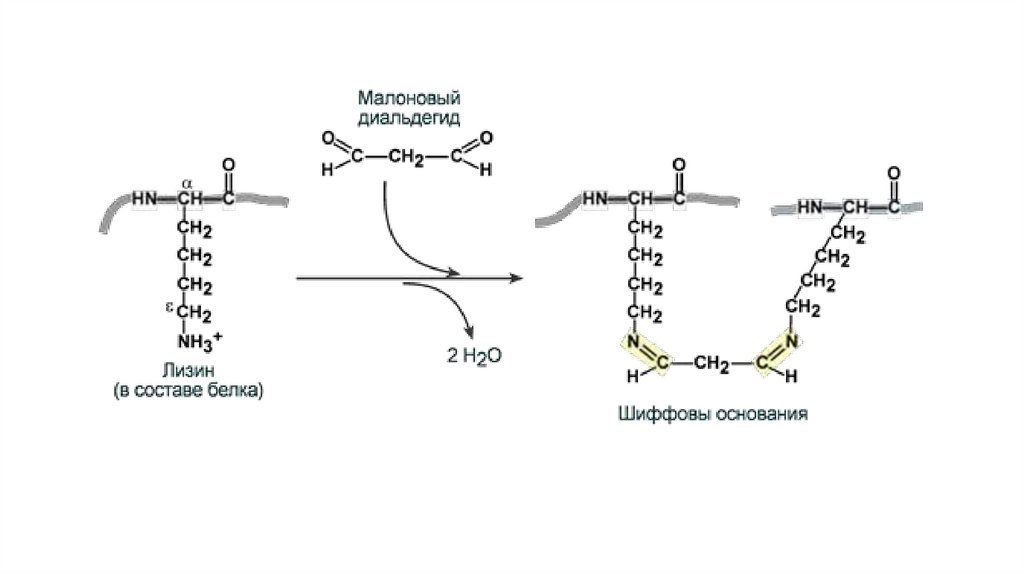
• Шиффовы основания - продукт взаимодействия альдегидов с
аминокислотами, пептидами
23.
24.
Обрыв цепи• LOO• + L• -> LOOH + LH
• L• + vit E -> LH + vit E
• vit E• + L• -> LH + vit Еокисл.
Развитие цепи может останавливаться при взаимодействии
свободных радикалов между собой или при взаимодействии с
различными антиоксидантами, например, витамином Е, который
отдаёт электроны, превращаясь при этом в стабильную
окисленную форму.
25.
Помимо ПОЛ, активные формы кислорода вызывают химическуюмодификацию нуклеиновых кислот, белков, в первую очередь,
сульфгидрильных групп ферментов. Следует отметить, что ряд
свободнорадикальных реакций имеет особое значение для
нормальной жизнедеятельности организма. Например,
фагоцитирующие клетки активно выделяют супероксид, пероксид
водорода и гидроксильные радикалы, которые оказывают
бактерицидное действие.
Нейтрофилы содержат фермент миелопероксидазу,
катализирующий образование гипохлорит-аниона в реакции:
Н2О2 + Cl- → Н2О + ОСlГипохлорит-анион может окислять многие биологические
молекулы, особенно SH-группы в них, и оказывать прямое
токсическое действие на бактерии.
26.
Применение активных форм кислорода вмедицине
Для антибактериальной обработки ран и глубоких кариозных
полостей применяют 0,2% раствор хлоргексидина и 3% раствор
пероксида водорода. Эти препараты в химических реакциях
образуют активные формы кислорода, в том числе гипохлорит. В
стоматологической практике также нередко используют
гидроксикарбамид и пероксид водорода для процедуры
отбеливания зубов, которая основана на инициировании
выделения атомарного кислорода из пероксидных соединений. В
избыточных количествах указанные соединения могут оказывать
повреждающее действие на эмаль, дентин и клетки пульпы зуба,
что проявляется в виде микропористости твердых тканей и
гиперстезии зубов.
27.
Защита от активных форм кислородаИзбыточное образование активных форм кислорода может быть
губительным для клеток, поэтому в организме существует так
называемая эшелонированная оборона от активных форм
кислорода.
Защита клетки обеспечивается благодаря работе антиоксидантной
системы (АОС), которая может осуществляться энзиматическим и
неэнзиматическим путем.
Ферменты антиоксидантной защиты:
1.супероксиддисмутаза
2. каталаза
3. глутатионпероксидаза
28.
СупероксиддисмутазаСупероксиддисмутаза (СОД) — фермент, который широко
распространен в природе. В активном центре цитозольной СОД
содержатся ионы металлов (меди, железа, марганца, цинка).
СОД присутствует во всех аэробных организмах и служит для
эффективного удаления супероксидных радикалов. СОД
катализирует реакцию превращения двух анион-радикалов в
перекись водорода (Н202 ) и молекулярный кислород:
29.
30.
Каталаза расщепляет пероксид водорода с образованием воды имолекулярного кислорода:
2Н2О2 → 2Н2О + О2
Глутатионпероксидаза использует восстановленный глутатион для
восстановления пероксида водорода и гидропероксиды жирных
кислот:
Эта реакция служит для предотвращения гемолиза при
образовании пероксида водорода (Н2О2 ) и гидропероксидов
жирных кислот ( ROOH ) в мембране эритроцитов.
31.
Окисленный глутатион (GS-SG) в следующей реакциивосстанавливается при участии фермента глутатионредуктазы (ГР):
32.
Неферментативные антиоксидантыНеферментативная защита включает природные и синтетические
комплексоны, связывающие металлы этилендиаминтетрауксусная кислота,
водорастворимые вещества - витамин С, мочевая кислота,
ароматические амины, соединения содержащие сульфгидрильные
группы, дипептиды - карнозин и анзерин;
соединения, растворимые в липидной фазе, жирорастворимые
витамины А и Е, β-каротин.
33.
Превентивные антиоксидантыИсточником электронов для образования активных форм
кислорода служат металлы с переменной валентностью: Fe, Cu, Zn.
В связанном с белком состоянии эти металлы неактивны.
Транспорт ионов металлов с переменной валентностью в плазме
крови осуществляют специальные белки-переносчики:
• Церулоплазмин транспортирует медь,
• Трансферрин - железо,
• Альбумин связывает ион меди,
• Металлотионеины (цитоплазматические белки богатые
цистеином) связывают ионы цинка, меди, кадмия, ртути























 chemistry
chemistry








