Similar presentations:
Внемитохондриальное окисление. Активные формы кислорода. Система антиоксидантной защиты
1.
Внемитохондриальное окисление.Активные формы кислорода.
Система антиоксидантной защиты.
лектор: доц. И.Л. Соловцова
2.
Внемитохондриальноеокисление
Различают четыре типа:
• Десатуразное
• Оксидазное
• Монооксигеназное
• Диоксигеназное
3.
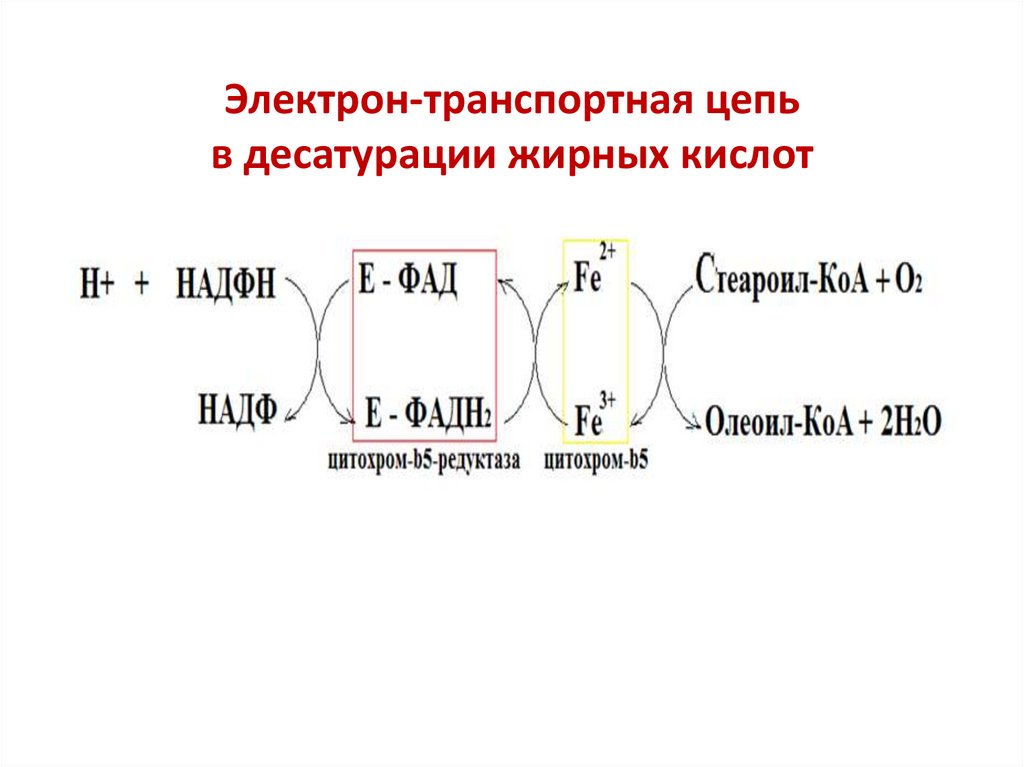
Десатуразы (катализируют 4- электронноевосстановление кислорода)
• Биологическая роль: образование ненасыщенных
жирных кислот из насыщенных
• Наиболее значимой является стеароил-КоА-десатураза
(Δ9-десатураза). Представляет собой белковый комплекс,
встроенный в мембрану эндоплазматического
ретикулума, состоящий из цитохрома b5, цитохром b5редуктазы, которая содержит ФАД и использует НАДФН2
для восстановления Fe3+ цитохрома b5
Стеароил-КоА + О2 + НАДФН2
олеил-КоА + 2Н2О + НАДФ
(пальмитоил-КоА)
(пальмитоолеил-КоА)
• У человека имеются также Δ5-десатураза и Δ6-десатураза, которые
участвуют в реакциях превращения линолевой кислоты (С18:2;9,12)
в арахидоновую (С20:4;5,8,11,14)
4.
Электрон-транспортная цепьв десатурации жирных кислот
5.
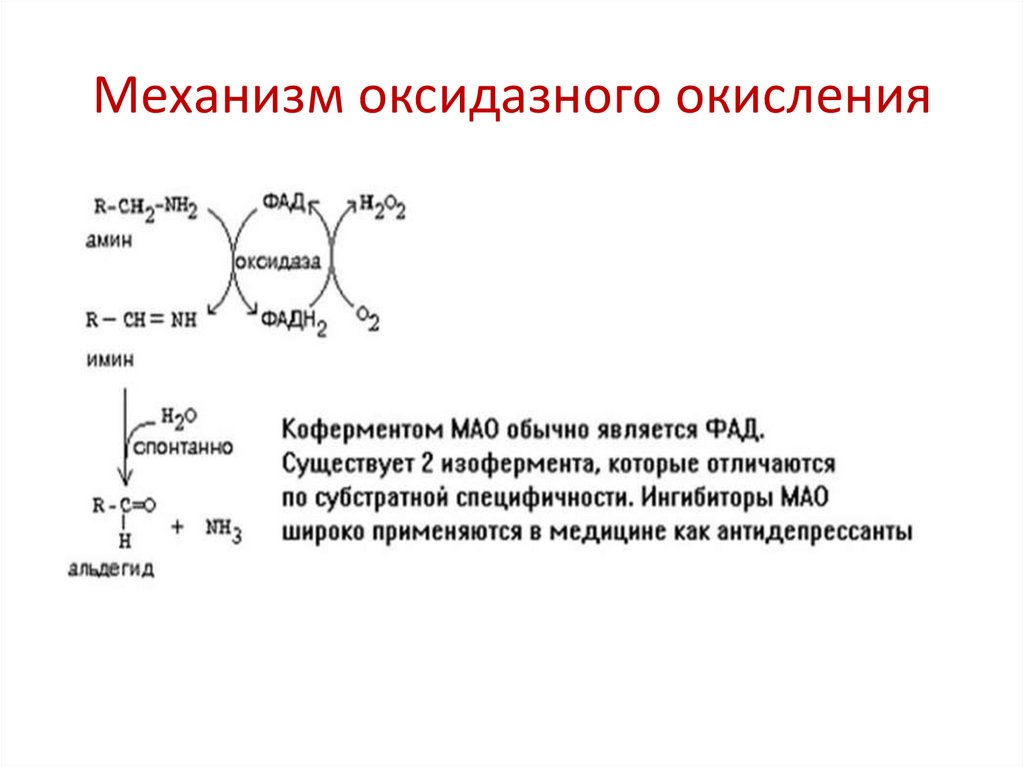
ОксидазыСодержатся в пероксисомах, являются
металлофлавопротеинами ( содержат ФАД или ФМН и
ионы металлов с переменной валентностью: Cu, Mo, Fe)
SH2 + O2
S + H2O2
Биологическая роль:
1. Участвуют в катаболизме аминокислот, биогенных
аминов, пуринов
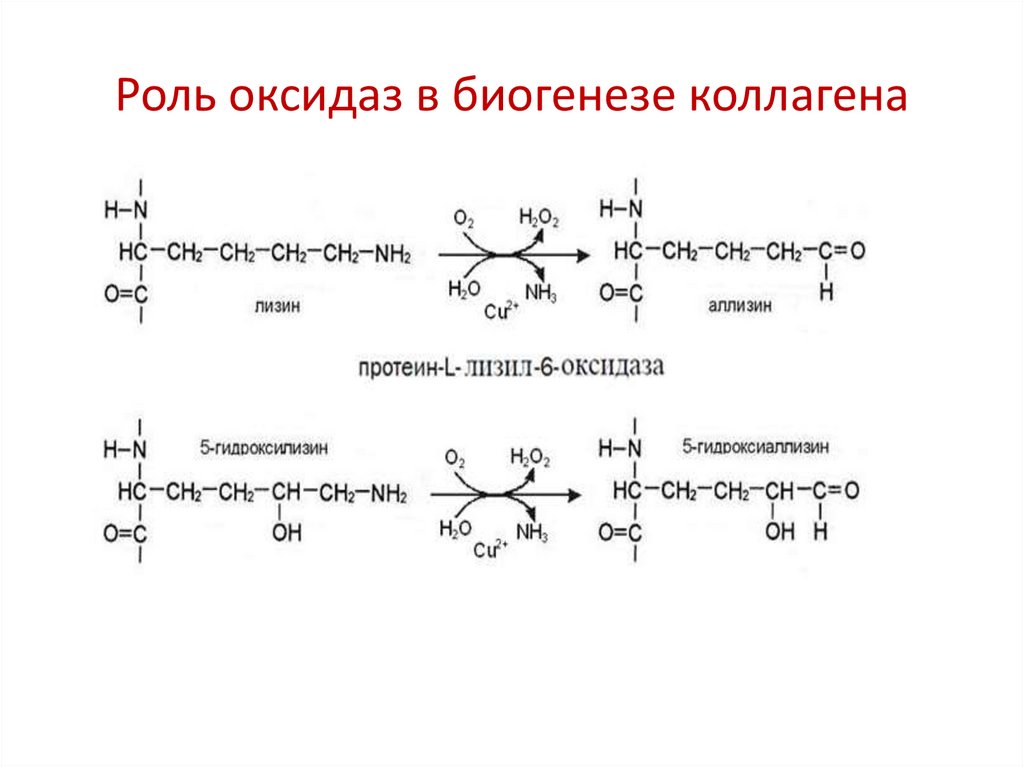
2. Участвуют в образовании поперечных сшивок в
коллагене и эластине
3. Продуцируют H2O2 – окислитель, участвующий в
фагоцитозе
6.
Механизм оксидазного окисления7.
Роль оксидаз в биогенезе коллагена8.
Формирование ковалентных сшивок вфибриллах коллагена
Альдегидные группы самопроизвольно взаимодействуют друг с другом или реагируют с
аминогруппой остатков лизина или 5-гидроксилизина, обеспечивая образование ковалентных
сшивок между соседними молекулами тропоколлагена
9.
На рисунке схематически представленытрехспиральные молекулы тропоколлагена
после наложения внутри и межмолекулярных
сшивок, которые изображены в виде стрелок.
Трехспиральные
молекулы
тропоколлагена
Гидроксигруппы
Внутри и межмолекулярные
сшивки
Углеводные
компоненты
10.
МонооксигеназыКатализируют реакции внедрения в субстрат одного атома
«О» , т.е. реакции гидроксилирования
SН + О2 + НАДФН2
S-ОН + Н2О + НАДФ
В передаче 2-ух атомов «Н» от НАДФН2 на О2 участвуют
разные дополнительные переносчики. В зависимости от
их строения монооксигеназы делят на 4 группы:
1. Цитохром Р450 монооксигеназа
2. Биоптериновые монооксигеназы
3. Медьсодержашие монооксигеназы, зависимые от
аскорбиновой кислоты
4. Монооксигеназы, сопряжённые с окислением αкетокислот, зависимые от аскорбата
11.
Цитохром Р450 монооксигеназаПредставляет собой белковый комплекс встроенный в
мембраны ЭПР, содержащий флавиновую цитохром Р450редуктазу, цитохром Р450 или цитохром b5, и/или Fe/S.
Субстраты содержат алифатические или ароматические
циклы
Биологическая роль:
1. Участвует в синтезе БАВ ( витамин D3, желчные кислоты,
стероидных гормонов)
2. Участвует в обезвреживании ксенобиотиков
12.
Электрон-транспортные системы мембран ЭПР13.
Биоптериновые монооксигеназыПредставляют собой белковый комплекс, состоящий из 2-ух
ферментов:
1. Гидроксилазы, содержащей Fe2+ и использующей кофермент
тетрагидробиоптерин (ТГБП)
2. Дигидробиоптеринредуктазы, коферментом которой является
НАДФН2
Субстраты: Трп 5(ОН)Трп
серотонин
Фен Тир
ДОФА
адреналин
Арг
NO (сигнальная молекула, обладает сосудорасширяющим,
бактерицидным действием, снижает агрегацию тромбоцитов)
Бологическая роль: участвуют в синтезе сигнальных молекул
14.
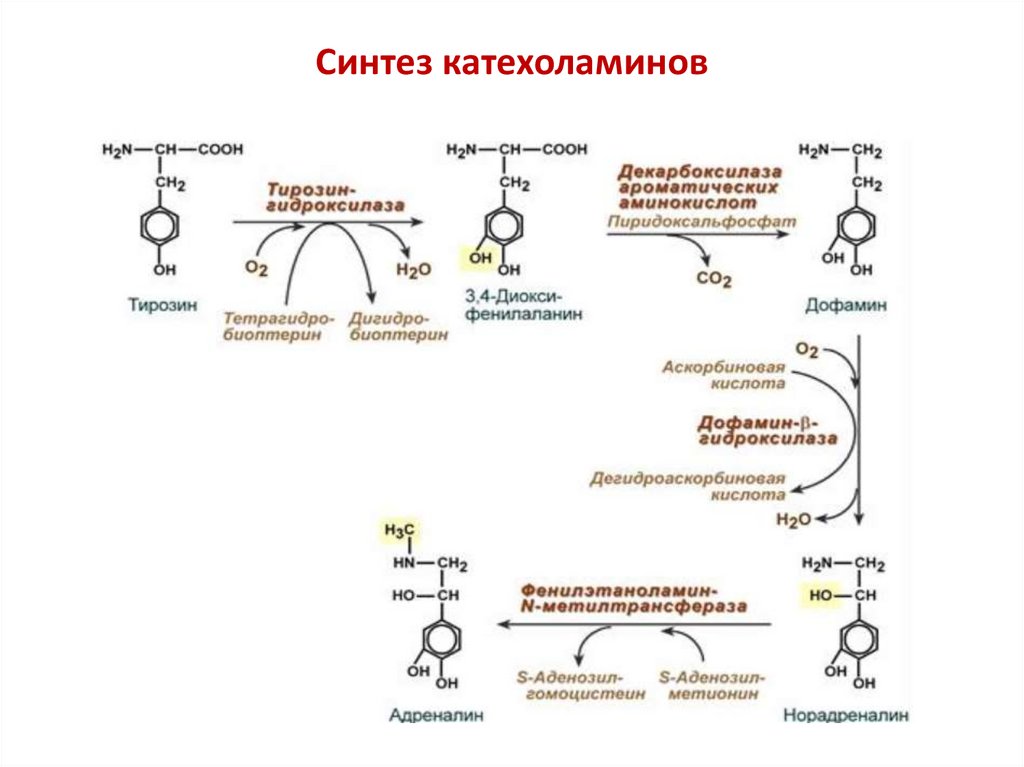
Медьсодержащие монооксигеназы, зависимые отаскорбата
Для восстановления атома «О» используют аскорбиновую
кислоту (витамин С)
SH + O2 + аскорбат
S-OH + H2O + дегидроаскорбат
(дофамин)
(норадреналин)
Биологическая роль: участвуют в синтезе сигнальных молекул
Дегидроаскорбиновая кислота восстанавливается затем под действием
дегидроаскорбатредуктазы ( содержит ФАД и использует кофермент
НАДН2), встроенной во внутреннюю мембрану митохондрий со
стороны матрикса
15.
Синтез катехоламинов16.
Монооксигеназы, сопряженные с окислением αкетокислот, зависимые от аскорбатаЭти монооксигеназы не нуждаются в НАДФН2 (НАДН2) и не
образуют воду. В качестве акцептора одного из атомов
«О» используют α- кетоглутарат, который теряет СО2 и
превращается в сукцинат. Содержат Fe2+, для
поддержания в восстановленном состоянии которого
необходим витамин С.
Локализованы в шероховатом ЭПР
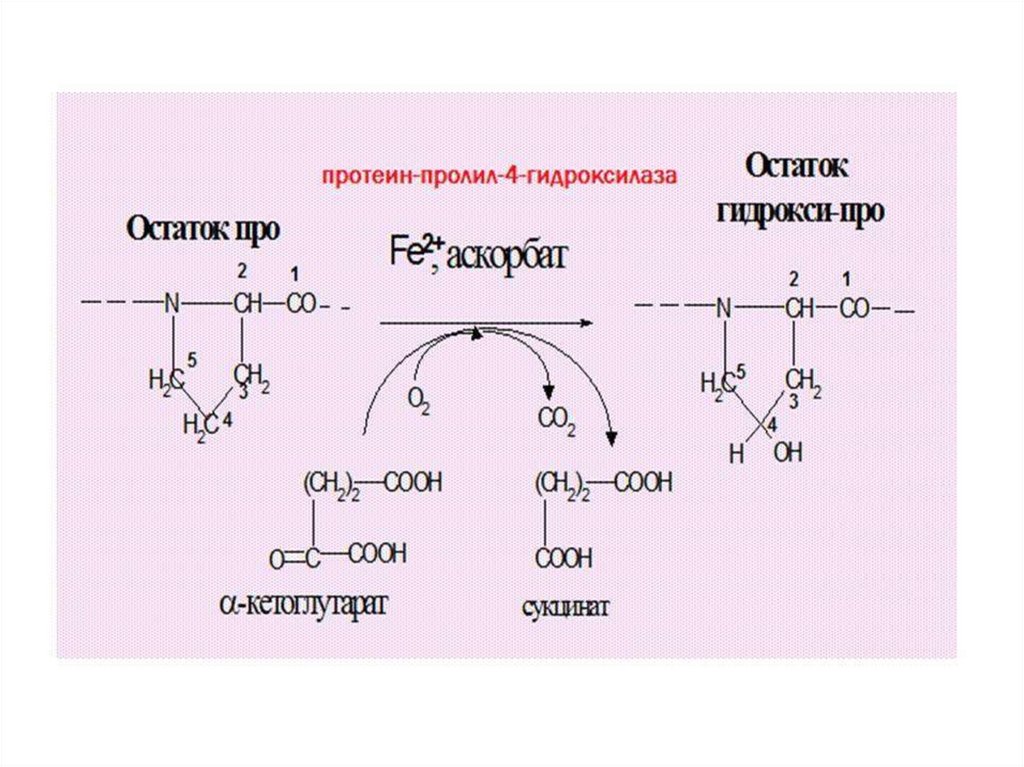
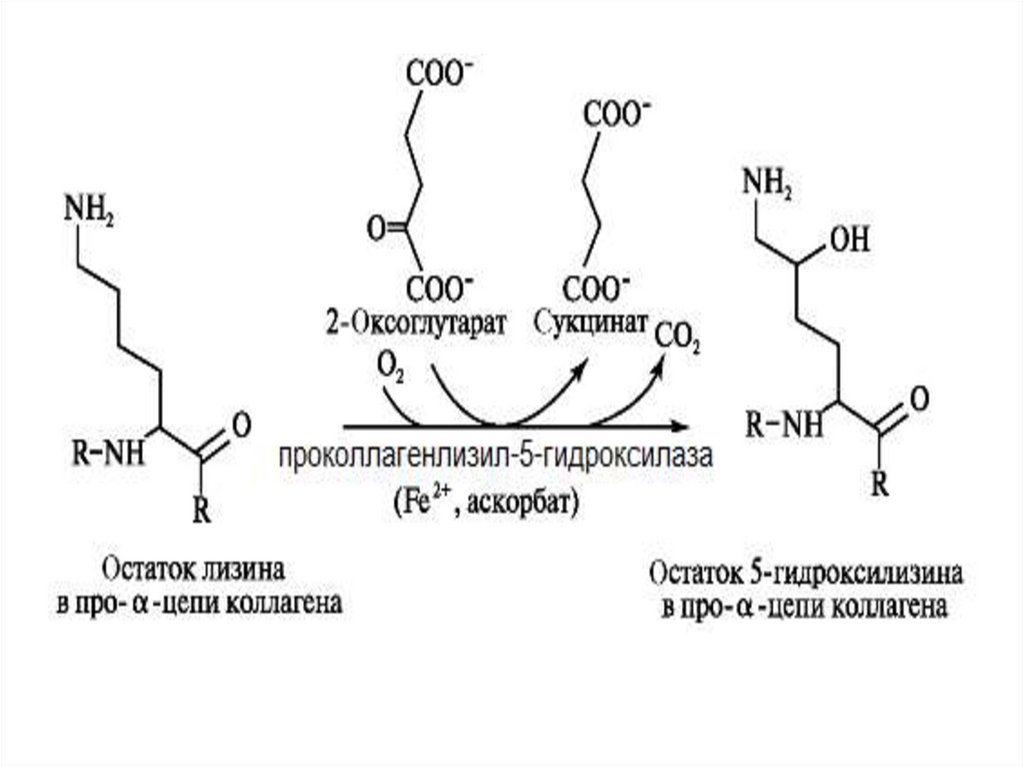
Биологическая роль: участвуют в созревании коллагена
• Протеин-лизил-5-гидроксилаза (диоксигеназа)
• Протеин-пролил-3-гидроксилаза (диоксигеназа)
• Протеин-пролил-4-гидроксилаза (диоксигеназа)
При недостатке витамина С образуется рыхлый коллаген
17.
18.
19.
ДиоксигеназыВключают 2 атома «О» в молекулу субстрата
S + O2
SO2
Субстраты: циклические молекулы, в результате окисления
цикл разрывается, что делает возможным их
дальнейшее расщепление до конечных продуктов
Например: гемдиоксигеназа, диоксигеназа
гомогентизиновой кислоты, L-триптофандиоксигеназа
Биологическая роль: катаболизм циклических структур
20.
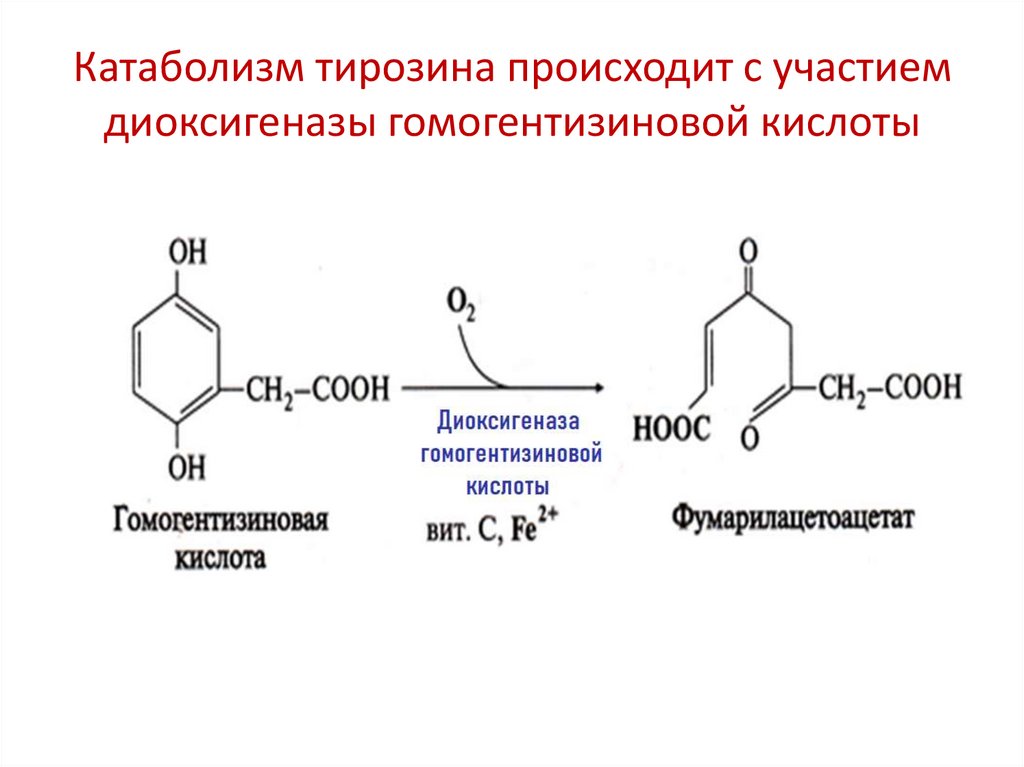
Катаболизм тирозина происходит с участиемдиоксигеназы гомогентизиновой кислоты
21.
Активные формы кислорода.Система антиоксидантной
защиты.
22.
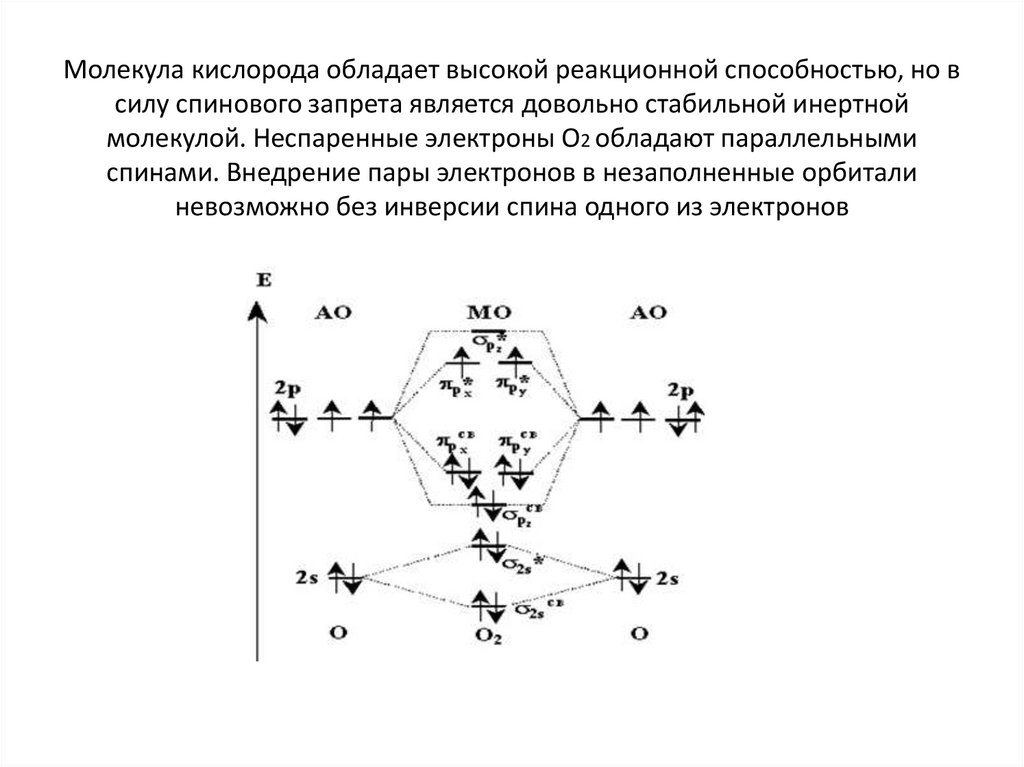
Молекула кислорода обладает высокой реакционной способностью, но всилу спинового запрета является довольно стабильной инертной
молекулой. Неспаренные электроны О2 обладают параллельными
спинами. Внедрение пары электронов в незаполненные орбитали
невозможно без инверсии спина одного из электронов
23.
Основной путь метаболизма О2 в организмесопровождается 4-х электронным
восстановлением и образованием воды
О2 + 4е- + 4Н+
2 Н2О
Этот путь протекает в митохондриях и потребляет
95-98% О2 поступающего в организм
24.
Совокупность окислительно-восстановительных реакций, протекающихв митохондриях с участием кислорода и ферментов обозначают
термином – митохондриальное окисление
Источником электронов и протонов являются субстраты, получившиеся в
ходе катаболизма питательных веществ
25.
В реакциях , связанных с 1-3-х электроннымвосстановлением О2 участвуют вещества,
которые сами содержат неспаренные электроны:
Fe2+, Cu+, Co2+, Mn2+, V2+,Cr4+
KoQ
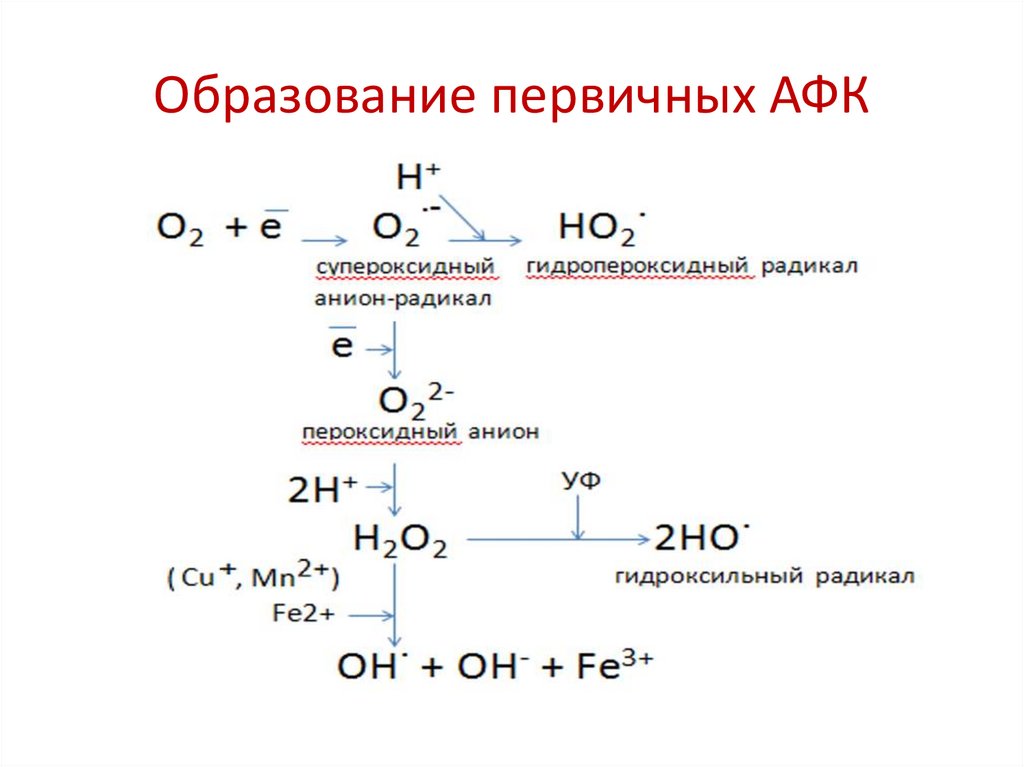
При этом образуются активные формы
кислорода (АФК)
АФК — это, с физико-химической точки зрения,
прежде всего свободные радикалы, которые
имеют на внешней электронной оболочке
неспаренный электрон.
Свободные радикалы отличаются от обычных молекул не только
высокой химической активностью, но и тем, что порождают
цепные реакции. "Отобрав" доступный электрон у оказавшейся
рядом молекулы, радикал превращается в молекулу, а донор
электрона – в радикал, который может продолжить цепь
дальше.
26.
Образование первичных АФК27.
Образование синглетного кислородаS + h√ → T
S – фотосенсибилизатор (пигмент) в основном состоянии
Т - фотосенсибилизатор в возбуждённом состоянии
T + O2 → S + O21
синглетный кислород
О2
1
О2
28.
К АФК также относятся:Образуются ферментативным путем:
Гипогалоиды: HOCl, HOBr, HOJ
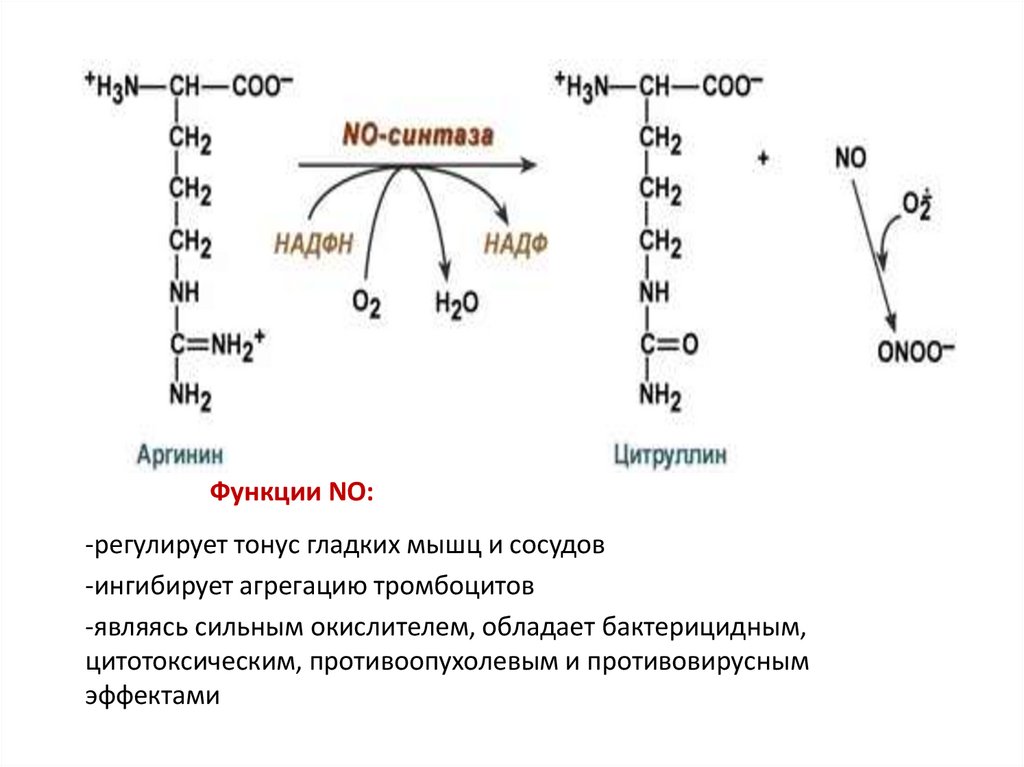
Оксид азота (NO) образуется из Арг под действием NO-синтазы)
Образуются неферментативным путем:
Алкдиоксильный радикал: RO2˙
Алкоксильный радикал: RO ˙
Алкильный радикал: R˙
Пероксинитрит: ONOOˉ
образуются из ВЖК
29.
Функции NO:-регулирует тонус гладких мышц и сосудов
-ингибирует агрегацию тромбоцитов
-являясь сильным окислителем, обладает бактерицидным,
цитотоксическим, противоопухолевым и противовирусным
эффектами
30.
Пероксидазы, использующие Н2О2• Миелопероксидаза нейтрофилов ( врожденная недостаточность
сопровождается грибковыми поражениями слизистой ротовой
полости)
Cl- + H2O2
OCl- + H2O
гипохлорит – очень сильный окислитель,
используется в неспецифической защите от микробов
• Лактопероксидаза вырабатывается слюнными и молочными
железами
SCN- + H2O2
тиоцианат
OSCN- + H2O
гипотиоцианат – обладает широким спектром
антимикробного действия
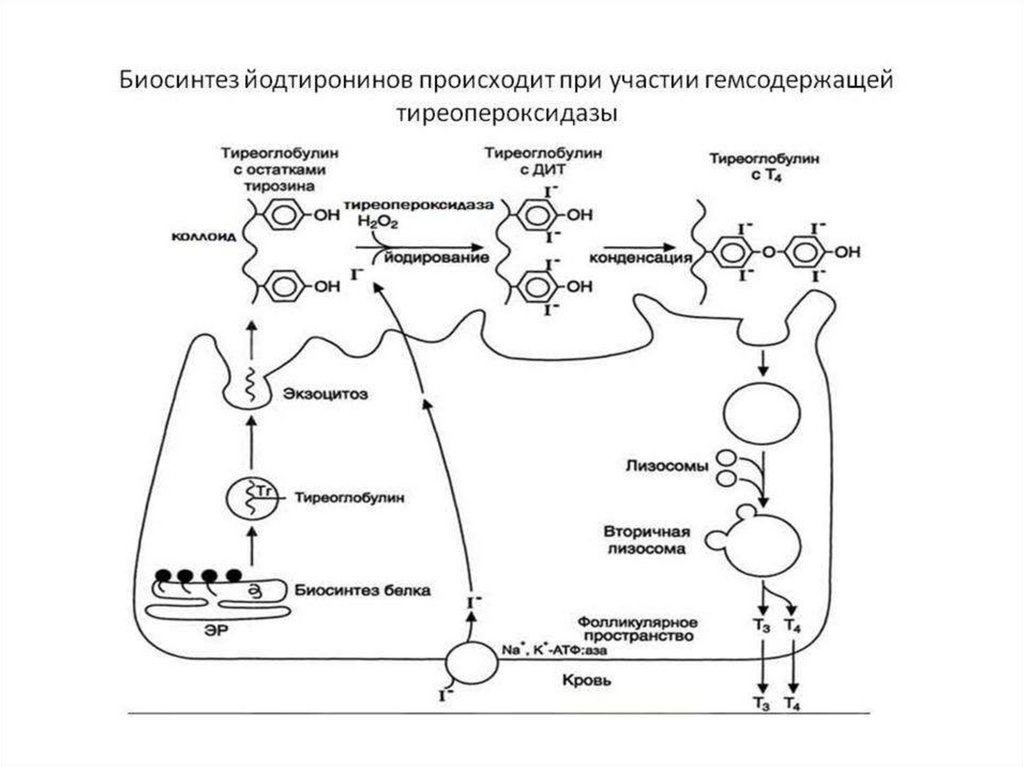
• Йодидпероксидаза (тиреопероксидаза) органифицирует йод,
участвует в синтезе гормонов щитовидной железы Т3 и Т4
31.
32.
Образование АФК может происходитьнеферментативным путём с участием гем-содержащих
белков, биогенных аминов и флавоноидов
Hb-Fe2+ + O2 → Hb-Fe3+ + O2˙ˉ
Гемоглобин
метгемоглобин
Катехоламины + O2 → Меланины + O2˙ˉ
33.
Взаимодействие АФК c липидамиРеакции ПОЛ (перекисного окисления липидов) являются свободнорадикальными
и постоянно протекают в клетке. ПОЛ включает 3 стадии: инициация,
распространение и терминация.
34.
АФК способны к спонтанным превращениям :Реакция супероксида с пероксидом водорода
О2˙ˉ + Н2О2 → О2 + НО˙ + НОˉ
Реакция дисмутации супероксидных анионрадикалов
О2 ˙ˉ + О2 ˙ˉ → О2²ˉ + О2 1
Реакция хлорноватистой кислоты с перекисью водорода
НСlO + H2O2 → H2O + Cl ˉ + О2 1
35.
АФК генерируются во всех частях клетки:1. Митохондриальная электрон-транспортная цепь
2. Пероксисомы ( оксидазы, флавопротеины)
3. Плазматическая мембрана (моноосигеназы,
простагландинсинтетаза, НАДФН-оксидаза при
фагоцитозе, перекисное окисление липидов)
4. Эндоплазматический ретикулум и ядерная
мембрана (транспортная система ц/х Р450 ,
десатуразные комплексы)
36.
Генерация АФК в митохондриях связанас KoQ
KoQH2 + O2 → KoQH˙ + H+ + O2˙ˉ
гидрохинон
семихинон-свободный радикал
KoQH˙ + O2 → KoQ + H+ + O2˙ˉ
хинон
37.
Образование АФК в митохондриях38.
Наибольшее количество АФК продуцируетсяфагоцитирующими клетками в процессе «окислительного
взрыва»
При контакте чужеродных агентов с фагоцитами происходит сборка
мультиферментного мембранного комплекса НАДФН-оксидазы за счет
взаимодействия ее мембранных и цитозольных компонентов
НАДФН (внутриклеточный) + 2О₂ (внеклеточный)
НАДФ⁺ (внутриклеточный) + Н⁺ (внутриклеточный) + 2О₂˙ ̄ (внеклеточный)
Параллельно в процесс фагоцитоза включается миелопероксидаза,
что приводит к генерации гипохлорита, синглетного кислорода.
Уровень Н₂О₂ возрастает за счет активации аминооксидаз и
ксантиноксидазы.
Действие больших количеств АФК направлено на разрушение
чужеродных агентов, при этом происходит их избыточное накопление,
что может вызвать глубокие нарушения в тканях
39.
Полезные функции АФК• Защитная: макрофаги убивают микроорганизмы, разрушают
поврежденные, старые, иммунологически несовместимые,
злокачественные, поврежденные вирусами клетки
• Обновляющая: остеокласты применяют АФК для разрушения кости –
обязательное условие для ее обновления). АФК в низких
субтоксических концентрациях индуцируют экспрессию генов и
деление клеток
• Иммунная: АФК активируют иммунные реакции в лейкоцитах:
индуцируют синтез ряда цитокинов, иммунных рецепторов, белков
острой фазы и адгезии (последние способствуют выходу лейкоцитов в
ткани, что важно при воспалении)
• Регуляторная: стимулируют накопление в клетках цАМФ и цГМФ,
ионов кальция, стимулируют фосфорилирование белков в результате
активации протеинкиназ (особенно протеинкиназы С и
протеинтирозинкиназ).
Клетки эндотелия образуют NO для регуляции кровяного давления.
Перекись водорода используется в синтезе тироксина
40.
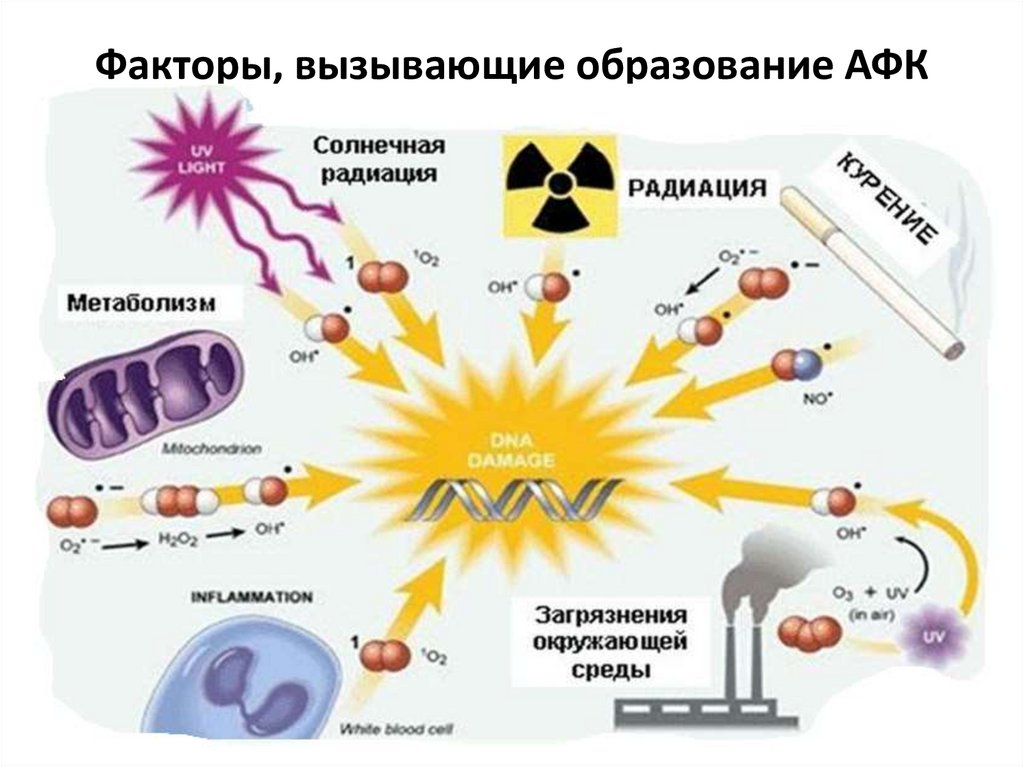
Факторы, вызывающие образование АФК41.
Повреждающее действие АФКОкислению подвергаются биомолекулы:
1) Аминокислоты в белках (Трп, Тир, Гис, Цис, Арг, Лиз), что может
приводить либо к образованию ковалентно сшитых белковых агрегатов,
либо разрыву пептидных связей. Окисленные белки подвергаются
протеолизу.
2) Полиненасыщенные высшие жирные кислоты в составе липидов
мембран ( линолевая, линоленовая и особенно арахидоновая).
Образуются перекисные радикалы ROO*, инициирующие в мембранах
свободнорадикальное окисление по цепному механизму. Продуктами
являются высокореакционные альдегиды, в т. ч. малоновый диальдегид.
Изменяется микровязкость мембран, проницаемость для воды и ионов.
3) Нуклеотиды в ДНК : окисление аденина и гуанина может приводить к
точечным мутациям, атака гидроксильным радикалом дезокси-рибозы –
к разрывам в цепях ДНК
42.
Система антиоксидантной защиты.Ферменты – антиоксиданты
Супероксиддисмутаза (СОД) – очень активный фермент,
содержится в митохондриях, цитоплазме, а также вне клеток
O2˙ˉ + O2˙ˉ + 2 Н+
О2 + Н2О2
Каталаза
2 Н2О2
О2 + 2 Н2О
Глутатионпероксидаза – восстанавливает Н2О2 или
органические пероксиды (ROOH) за счет трипептида глутатиона :
ϒГлу-Цис-Гли (Г-SH)
2 Г – SH + H2O2
восстановленный
глутатион
2ГSH + ROOH
2 H2O + Г - S - S - Г
окисленный
глутатион
ГS-SГ + ROH +H2O
43.
Система антиоксидантной защиты.Антиоксиданты неферментной природы
(«ловушки свободных радикалов»)
Гидрофильные (действуют в жидкой фазе):
Глутатион, мочевая кислота, билирубин, цистеин, витамин С,
белки, переносящие металлы с переменной
валентностью: церулоплазмин (Cu2+) и трансферрин (Fe3+)
Гидрофобные (действуют на уровне мембран)
Токоферолы (витамин Е), ретинол (витамин А),
биофлавоноиды

































 chemistry
chemistry








