Similar presentations:
Термодинамиканың бірінші заңы. Газдың және будың жұмысы
1.
Термодинамиканыңбірінші заңы. Газдың
және будың жұмысы
2.
Оқу мақсаты8.3.2.17 –термодинамиканың бірінші заңының мағынасын
түсіндіру
3.
Термодинамика – энергияның түрленуiне қатыстыжалпы заңдарға негiзделген жылулық процесстер
туралы ғылым. Бұл заңдар молекулалық
құрылымдарына байланыссыз барлық денелер
үшiн орындалады.
4.
Iшкi энергия туралы түсiнiк: Макро денелермеханикалық энергиямен қатар, өздерiнiң iштерiне
тұйықталған энергияға ие. Ол – iшкi энергия. Ол барлық
энергетикалық түрленулердiң балансына кiредi.
Механикалық жұмыс жасамай-ақ денелердi қыздырғанда,
олардың iшкi энергиясы ұлғаяды.
Iшкi энергияның механикалық энергияға
айналуының керi процесi болатыны сөзсiз.
Молекулалық-кинетикалық теория көзқарасынан
макроскопиялық дененiң iшкi энергиясы барлық
молекулалардың ретсiз қозғалыстарының кинетикалық
энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң
потенциалдық энергияларының қосындысына тең.
5.
Термодинамикадағы жұмыс.Термодинамикада қозғалыстағы ортаның аз
бөлшектерiнiң бiр-бiрiне қатысты орын
ауыстыруы ғана қарастырылады.
Нәтижесiнде дене көлемi, оның iшкi энергиясы
өзгередi. Дене жылдамдығы тұтасымен алғанда
нөлге тең болып қалады.
Жұмыс классикалық механикадағы сияқты
анықталады, бiрақ ол дененiң кинетикалық
энергисының өзгеруiне емес, оның iшкi
энергиясының өзгеруiне тең болады.
6.
Мысалы:Газдардың сығылуы кезiнде поршень өзiнiң
механикалық энергиясының бiр бөлiгiн газдарға
бергендiктен, молекулалардың кинетикалық энергиясы
ұлғаяды, газ қызады.
Керiсiнше, егер газ ұлғайса, онда алыстаған поршенмен
соқтығысқаннан кейiн молекулалардың жылдамдығы
азайып, газ суиды.
7.
Жұмысты есептеу.Қозғалмалы ортаның көлемi өзгергендегi iстелген жұмыс
мынаған тең болады
А′ = p·(V2-V1) = p·ΔV.
Ұлғаю кезiнде (V2 > V1) газ оң жұмыс жасайды: А′>0.
Сығылу кезiнде V2<V1, сондықтан оның жұмысы терiс
болады: А′<0. Керiсiнше, газ сығылған кездегi сыртқы
күштердiң жұмысы оң болады да, газ қыза бастайды.
Ұлғаю кезiнде сыртқы күштердiң жұмысы терiс
болады – газ суиды.
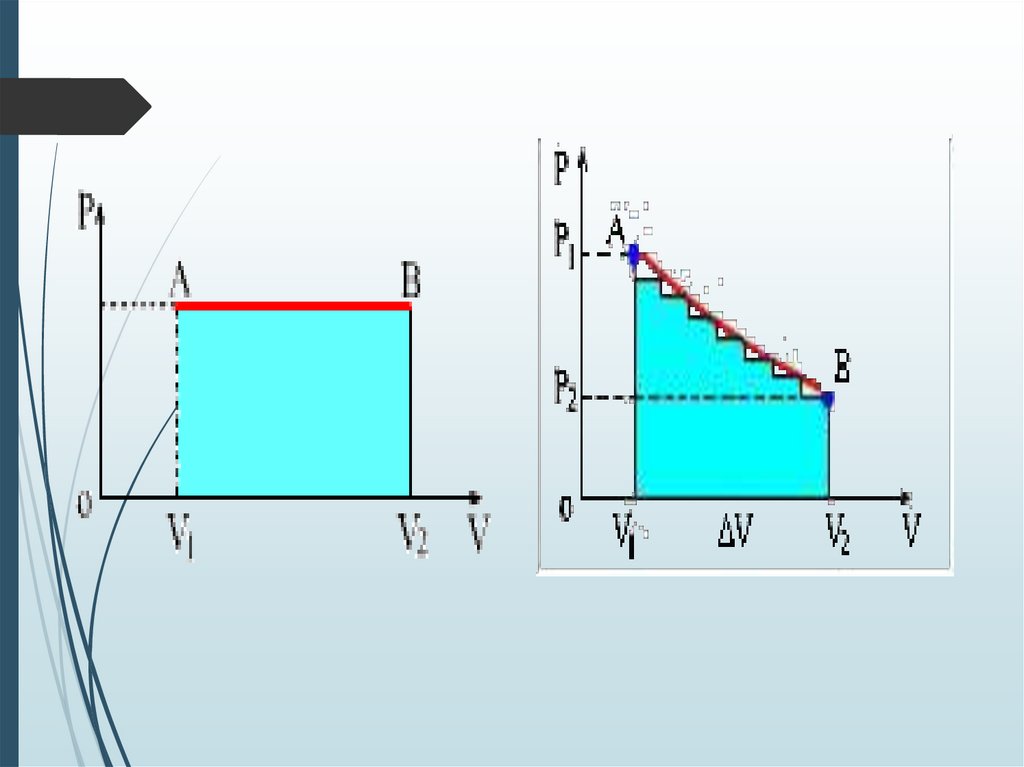
8.
Тұрақты қысым жағдайында, газдың жұмысыгеометриялық тұрғыдан түсiндiргенде 3.1.–суретiнде
келтiрiлген (P-V) графигiндегi V1АВV2 тiк төртбұрышының
ауданына дәлме-дәл тең екендiгiн оңай көруге болады.
Жалпы жағдайда газ қысымы көлемге байланысты
функция болып табылады. Бiрақ, газ жұмысы
бұрынғысынша сандық түрде бастапқы және соңғы
күйлердегi p1 және p2 қысымдарына тең AV1 және AV2
кесiндiлерiмен және P-ның V-ға байланысты графигiмен
шектелген фигураның ауданына тең болады(3.2-сурет).
9.
10.
Бiр атомды идеал газдың iшкi энергиясы,молекулаларының өзара әсерлесуiнiң потенциалдық
энергиясы нөлге тең болғандықтан, көлемге (қысымға)
байланысты емес. Тек газ температурасының өзгеруiнiң
есебiнен ғана газдың энергиясы өзгередi.
Нақты газдар және сұйықтар үшiн молекулалардың
орташа потенциалдық энергиясы нөлден өзгеше. Газдарда
ол кинетикалық энергиямен салыстырғанда өте аз, ал
сұйықтар мен қатты денелер үшiн кинетикалық
энергиямен шамалас болып келедi. Демек, жалпы
жағдайда, iшкi энергия потенциалдық энергия сияқты
қозғалмалы ортаның көлемiне, температурасына тәуелдi
болады.
11.
Термодинамиканың бiрiншi заңы. Көптеген деректердiжинақтаудың негiзiнде энергияның сақталуының жалпылама
заңы тұжырымдалды: табиғатта энергия U жоқтан пайда
болмайды және жоғалмайды, ол тек бiр түрден екiншi түрге
ауысады.
Жылу құбылыстарында таралған энергияның сақталу және
айналу заңы термодинамиканың бiрiншi заңы деп аталады.
Жалпы жағдайда, жүйенiң бiрiншi U1 күйден екiншi U2 күйге
ауысуы кезiнде, iшкi энергия атқарылған жұмыстың есебiнен
қалай өзгерсе, жүйеге сырттан берiлген жылудың әсерiнен де
солай өзгере алады. Термодинамиканың бiрiншi заңы нақ
осылай тұжырымдалады: iшкi энергияның өзгерiсi жүйеге
берiлген жылу мөлшерi мен сыртқы күштердiң жұмысының
қосындысына тең:
ΔU = A + Q.
12.
Термодинамиканың бiрiншi заңынизопроцестерге қолдану
Изохоралық процесс. Бұл процесте газ көлемi өзгермейдi: V
= const. Газдың iшкi энергиясының өзгерiсi оған берiлген
жылу мөлшерiне тең:
ΔU = Q. Егер газ қыздырылса , онда Q > 0 және
ΔU > 0 – iшкi энергия ұлғаяды.
Газды суытқан кезде: Q < 0 және ΔU < 0,
оның iшкi энергиясы азаяды.
13.
Изотермалық процесс. Изотермалық процесскезiнде газдың температурасы тұрақты
болады (Т = const) және оның iшкi энергиясы
өзгермейдi.
Газға берiлген барлық жылу мөлшерi
пайдалы жұмыс атқаруға жұмсалады:
Q = А′. Газ белгiлi жылу мөлшерiн (Q > 0)
алған кезде, ол оң жұмыс атқарады (А′ > 0).
Керiсiнше, егер газ қоршаған ортаға жылу
берсе, онда оның атқарған жұмысы терiс
болып саналады.
14.
Изобаралық процесс.Изобаралық процесс кезiндегi газға берiлген
жылу мөлшерi оның iшкi энергиясының бiрге
өзгеруiне және қысым тұрақты болған кездей
P = const жұмысты атқаруға шығындалады.
ΔU = A + Q.
15.
Адиабаталық процесс. Қоршаған ортамен жылу алмасуыболмайтын жағдайда өтетiн жүйедегi изопроцесс адиабаталық
процесс деп аталады.
Адиабаталық процесс кезiнде
Q = 0 және жүйенiң iшкi энергиясының өзгеруi жұмыс
атқару арқылы ғана жүредi:
ΔU= А. ΔU= А теңдiгi белгiлi қорытынды жасауға
мүмкiндiк бередi.
Егер жүйеде оң жұмыс жасалса, мысалы газ сығылатын
болса, онда оның iшкi энергиясы ұлғаяды және
температурасы өседi. Керiсiнше , газ ұлғайған кезде, ол өзi
оң жұмыс атқарады (Аұ > 0). Оның iшкi энергиясы азаяды
да, газ суиды.














 physics
physics








