Similar presentations:
Классификация химических реакций. Химия. 8 класс
1.
Химия8 класс
Занятие 8
Классификация
химических реакций
Учимся определять типы реакций
Преподаватель:
Чорбу Александр Андреевич
2.
Ваши конспекты2
Групповая работа
Автор: @batek48_1234
3.
Ваши конспекты3
Групповая работа
Автор: @zlatarr_blch
4.
Ваши конспекты4
Групповая работа
Автор: @Ya_ne_zliuka_bebebe
5.
Ваши конспекты5
Групповая работа
Автор: @alice_st_sw
6.
Ваши конспекты6
Групповая работа
Автор: @Egorzz09
7.
РефлексияНапиши в чат номер смайла, который подходит под твоё настроение
1
2
4
7
Рефлексия
3
5
8.
Как дела с домашним заданием?1
8
2
Рефлексия
3
4
5
6
7
8
9
10
9.
Малахит имеет формулуCu2(OH)2CO3. Он образуется
при окислении меди
компонентами воздуха.
Многие медные изделия
постепенно покрываются
слоем малахита
9
Теория
10.
При фотосинтезе растения поглощают углекислый газ и воду ипревращают их в глюкозу (C6H12O6) и кислород
10
Теория
11.
При выпадении кислотныхдождей (они могут
содержать молекулы
вещества HNO3)
происходит разрушение
мраморных памятников
(мрамор – CaCO3).
Образуются углекислый
газ, вода и нитрат кальция
(Ca(NO3)2).
11
12.
О чем поговорим сегодняКлассификация химических реакций
Реакции соединения
Реакции разложения
Реакции замещения
Реакции обмена
12
План занятия
13.
Цель урока● Познакомиться с классификацией химических реакций, основанной
на количестве и составе веществ — участников реакции.
Научиться определять тип химической реакции.
13
Цель занятия
14.
Типы химическихреакций
15.
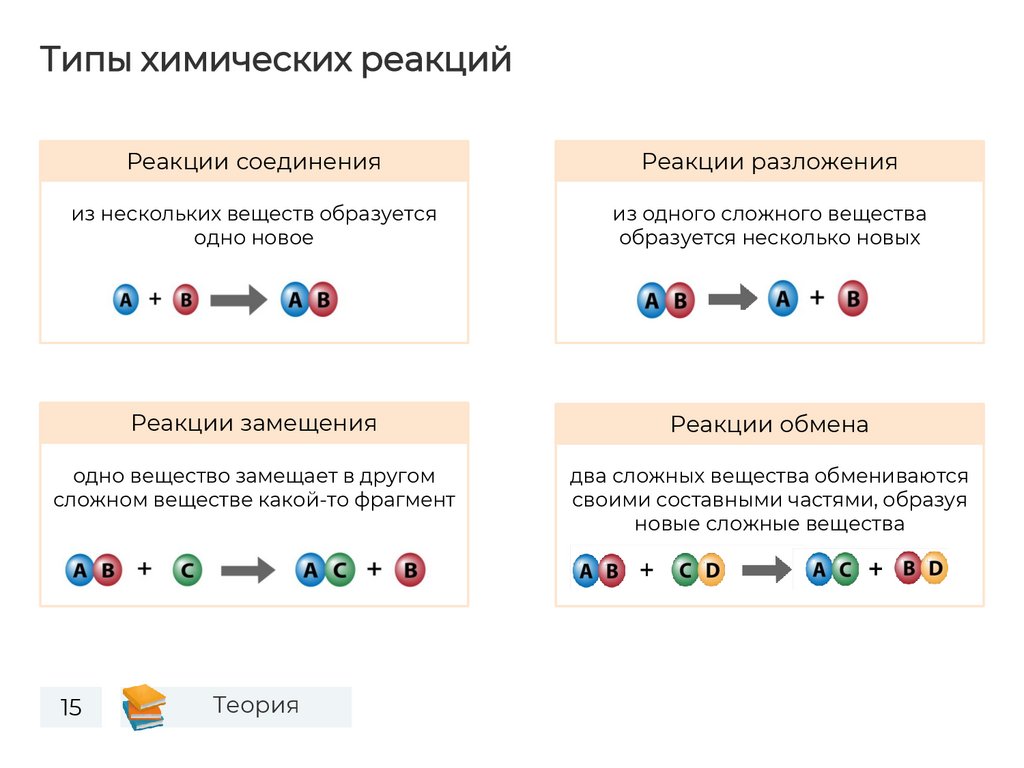
Типы химических реакцийРеакции соединения
Реакции разложения
из нескольких веществ образуется
одно новое
из одного сложного вещества
образуется несколько новых
Реакции замещения
Реакции обмена
одно вещество замещает в другом
сложном веществе какой-то фрагмент
два сложных вещества обмениваются
своими составными частями, образуя
новые сложные вещества
15
Теория
16.
Реакции соединенияЭто реакции, при которых из двух и более простых или
сложных веществ образуется одно более сложное вещество
Пример:
2Na + S = Na2S
СО + Cl2 = COCl2
SO3 + H2O= H2SO4
16
Теория
Сжигание фосфора
4P + 5O2 = 2P2O5
17.
Реакции соединенияПри взаимодействии простых веществ металлов и неметаллов
образуются бинарные соединения.
2Ba + O2= 2BaO
оксид бария
4Al + 3C = Al4C3
карбид алюминия
Mg + Cl2 = MgCl2
хлорид магния
2Na + I2 = 2NaI
иодид натрия
17
Теория
18.
ЗаданиеВыберите все реакции соединения:
1) 2Na + O2 = Na2O2
2) 3CaO + 2Al = 3Ca + Al2O3
3) NH3 + HCl = NH4Cl
4) NH4OH + HCl = NH4Cl + H2O
5) 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
6) 2Cu + O2 + CO2 + H2O → Cu2(OH)2CO3
18
Задание
19.
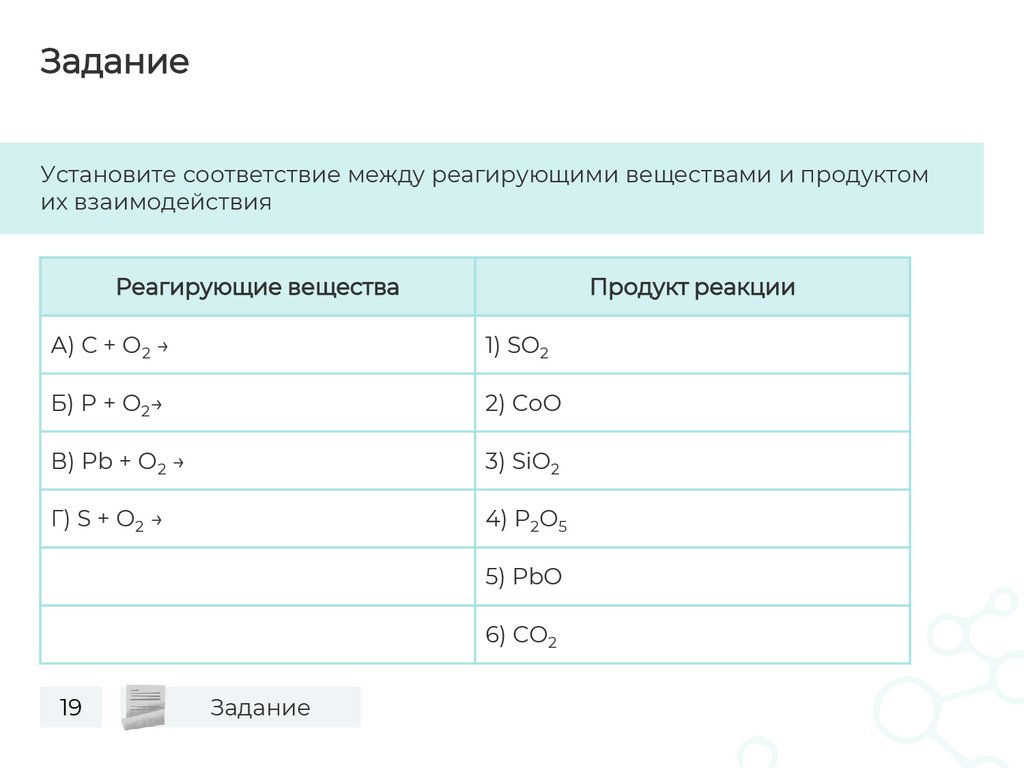
ЗаданиеУстановите соответствие между реагирующими веществами и продуктом
их взаимодействия
Реагирующие вещества
Продукт реакции
А) С + O2 →
1) SO2
Б) P + O2→
2) CoO
В) Pb + O2 →
3) SiO2
Г) S + O2 →
4) P2O5
5) PbO
6) CO2
19
Задание
20.
Реакции разложенияЭто реакции, при которых из одного сложного вещества
образуется несколько простых или менее сложных веществ
Пример:
2Al(OH)3 = Al2O3+ 3H2O
MgCO3 = MgO + CO2
2KNO3 = 2KNO2 + O2
2H2O = 2H2 +O2
20
Теория
21.
ЗаданиеВыберите все реакции разложения:
1.
NH4Cl = NH3 + HCl
2. 2Fe(OH)3 → Fe2O3 + 3H2O
3. Fe2O3 + 3H2 → 2Fe + 3H2O
4. Cu2(OH)2CO3 → 2CuO + CO2 + H2O
5. 2Na + Cl2 = 2NaCl
6. NaCl + AgNO3 = AgCl + NaNO3
7. 2AgNO3 → 2Ag + 2NO2 + O2
21
Задание
22.
Реакции замещенияЭто реакции, в результате которых атомы простого вещества
замещают атомы одного из элементов в сложном веществе
Например:
Fe + CuCl2 = Cu + FeCl2
2NaI + Cl2 = 2NaCl + I2
Получение водорода в лаборатории:
Zn + 2HCl = ZnCl2+ H2
22
Теория
23.
ЗаданиеВыберите все реакции замещения:
1) 2Na + Na2O2 → 2Na2O
2) 3CaO + 2Al → 3Ca + Al2O3
3) СS2 + O2 → 2S + CO2
4) Cu2S + 2O2 → 2CuO + SO2
5) Cu2S + O2 → 2Cu + SO2
6) SnO2 + 2C → Sn + 2CO
7) LiH + H2O → LiOH + H2
23
Задание
24.
Реакции замещенияС помощью реакций замещения можно получить водород
из кислот или воды:
Zn + 2HCl = ZnCl2+ H2↑
3Fe + 4H2O(пар) = Fe3O4 + 4H2↑
Получить металлы и неметаллы из их соединений:
Fe + CuSO4 = FeSO4 + Cu↓
2NaBr + Cl2= 2NaCl + Br2
24
Теория
25.
Ряд активности металловРеакции замещения происходит в том случае, если элемент
входящий в состав простого вещества более сильный, чем
элемент, “выталкиваемый” из сложного вещества
Для прогнозирования возможности протекания реакции замещения
используют электрохимический ряд напряжений металлов:
Cu + ZnCl2 = реакция не происходит
Zn + CuCl2 = Cu + ZnCl2
менее
более
активный активный
более
активный
25
Теория
менее
активный
26.
ЗаданиеВыберите из списка пары веществ, между которыми возможна реакция
замещения.
1. Ag и KNO3
2. CuCl2 и Zn
3. CuSO4 и Fe
4. KBr + Mg
5. CuO + Ni
26
Задание
27.
Реакции обменаЭто реакции между сложными веществами, в результате
которых они обмениваются своими составными частями
Например:
KOH + HCl = KCl + HOH
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
27
Теория
28.
ЗаданиеВыберите все реакции обмена:
1) 4HF + SiO2 → SiF4 + 2H2O
2) SO2 + 2NaOH → Na2SO3 + H2O
3) NH4OH + HCl = NH4Cl + H2O
4) Cu2S + O2 → 2Cu + SO2
5) SnO2 + 2C → Sn + 2CO
6) ZnS + 2HCl → ZnCl2 + H2S
7) LiH + H2O → LiOH + H2
28
Задание
29.
Реакции обменаВ ходе реакций обмена вещества могут выпадать в осадок, если
они не растворяются в воде или мало растворяются в ней
29
Теория
30.
ЗаданиеУстановите соответствие между схемой реакции и формулой
пропущенного вещества X.
Схема реакции
Вещество X
А) X + Cl2 → AlCl3
1) CuO
Б) NH4NO2 → X + H2O
2) C
В) Cu(NO3)2 → X + NO2 + O2
3) Al
Г) CO + X → CO2
4) N2
5) O2
30
Задание
31.
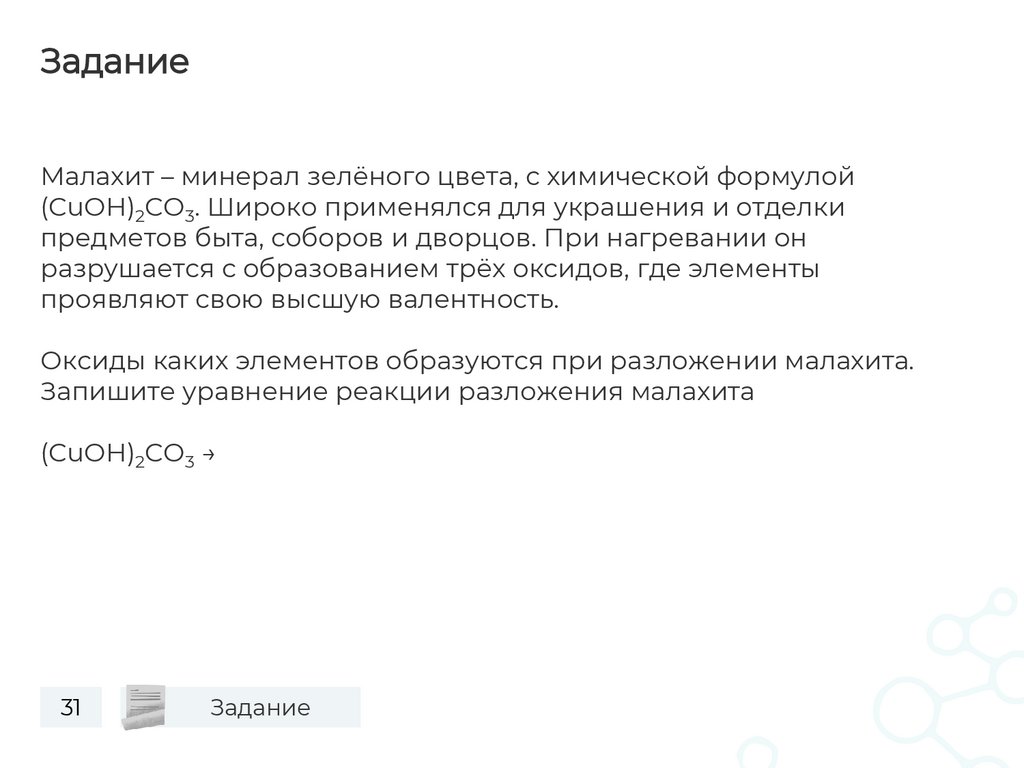
ЗаданиеМалахит – минерал зелёного цвета, с химической формулой
(CuOH)2CO3. Широко применялся для украшения и отделки
предметов быта, соборов и дворцов. При нагревании он
разрушается с образованием трёх оксидов, где элементы
проявляют свою высшую валентность.
Оксиды каких элементов образуются при разложении малахита.
Запишите уравнение реакции разложения малахита
(CuOH)2CO3 →
31
Задание
32.
ИтогиСуществует много различных классификаций химических
реакций.
По составу и числу исходных веществ и продуктов выделяют
реакции соединения, разложения, замещения, обмена.
С помощью закона сохранения массы можно прогнозировать
образующиеся продукты и составлять уравнения химических
реакций.
Химическая реакция - это процесс перекомбинации атомов, в
зависимости от того, какие по составу вещества и в каком
количестве участвовали в процессе перекомбинации, можно
классифицировать реакции.
32
Итоги
33.
Домашнее заданиеИзучить конспекты, прикрепленные к занятию
Решить задачи, прикрепленные к занятию
Эти стикеры показывают сложность задания
Эти стикеры показывают тип задания (расчётная задача,
работа с текстом, мини-исследование,
межпредметная задача и другие)
33
Итоги
34.
РефлексияНапиши в чат, какая ты сегодня молекула
2
3
Скучающая
1
Весёлая
Грустная
6
Довольная
Уставшая
Бодрая
5
4
34
Рефлексия
35.
До встречи!Увидимся
на следующем уроке!
36.
АлександрЧорбу
преподаватель химии
chorbu
@chorbu




























 chemistry
chemistry








