Similar presentations:
Теория атома водорода по Бору. Лекция 29
1.
Часть 5. Квантовая физикаЛекция 29. Теория атома водорода
по Бору
2.
1. Модели атома Томсона и Резерфорда2. Постулаты Бора
3. Линейчатый спектр атома водорода
4. Спектр атома водорода по теории Бора
5. Опыты Франка и Герца
3.
Модели атома Томсона и РезерфордаВо второй половине 19 века опытным путём было
доказано (Дж. Дж. Томсон), что электроны входят в
состав всех атомов.
В начале 20 века встал вопрос о строении атома.
Модель Томсона. Атом — положительно заряженный
шарик, внутри которого распределены колеблющиеся
около положения равновесия электроны. Суммарный
заряд электронов равен положительному заряду шара.
4.
Модель атома Томсона5.
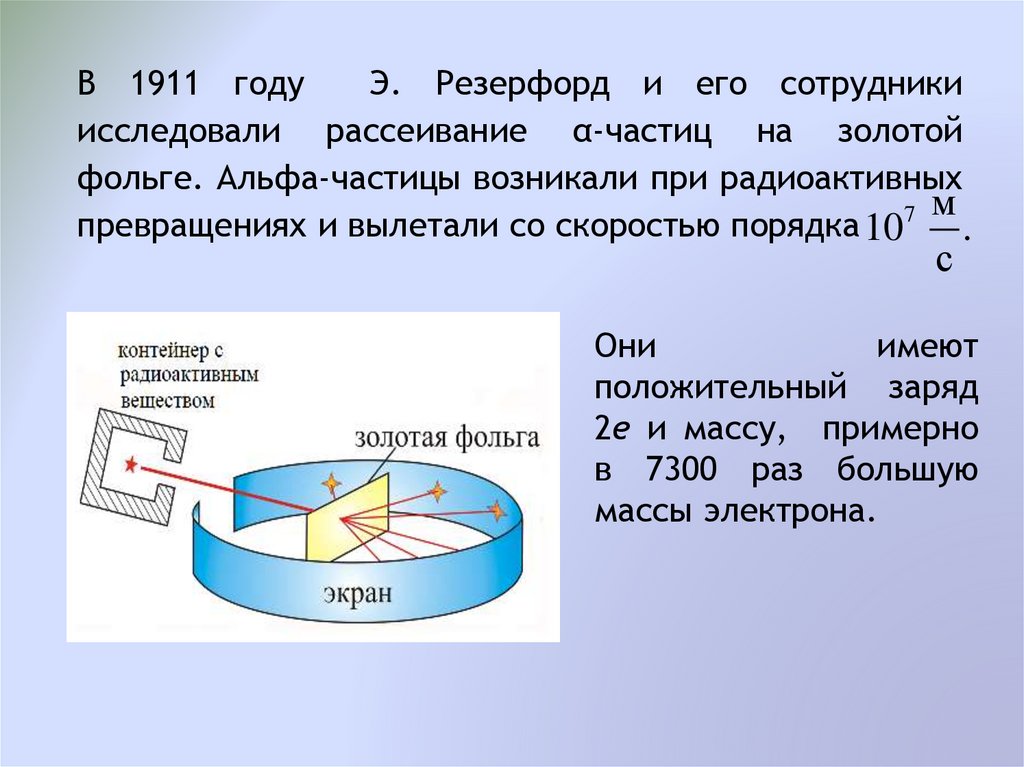
В 1911 годуЭ. Резерфорд и его сотрудники
исследовали рассеивание α-частиц на золотой
фольге. Альфа-частицы возникали при радиоактивных
7 м
превращениях и вылетали со скоростью порядка 10
.
с
Они
имеют
положительный заряд
2е и массу, примерно
в 7300 раз большую
массы электрона.
6.
Припрохождении
через
фольгу
α-частицы
отклонялись от первоначального направления на
различные углы, попадали на цилиндрический экран,
покрытый
сернистым
цинком
и
вызывали
сцинтилляции (вспышки света). Места вспышек и их
количество регистрировались с помощью микроскопа.
Большинство альфа-частиц рассеивалось на углы
порядка нескольких градусов (незначительные
отклонения).
7.
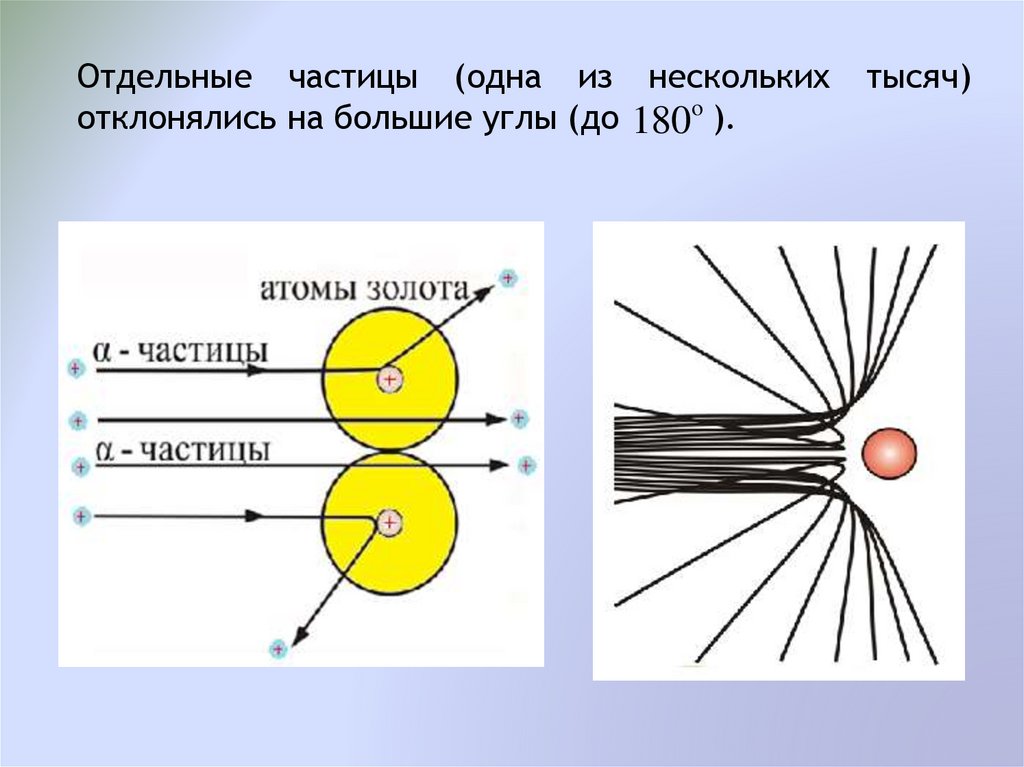
Отдельные частицы (одна из несколькихотклонялись на большие углы (до 180o ).
тысяч)
8.
Такие значительные отклонения могли испытыватьтолько те альфа-частицы, которые пролетали вблизи
массивного
положительного
заряда
(ядра),
занимающего очень малый объем атома и
создающего сильное электростатическое поле.
В этом поле на альфа-частицу действуют силы
отталкивания, которые и вызывают значительные
углы рассеяния.
9.
Эрнест РезерфордПланетарная модель
атома Резерфорда
10.
Ядерная модель атома РезерфордаАтом представляет собой систему зарядов, в центре
которой расположено массивное (99,95% от массы
атома) положительно заряженное ядро (10-15 м) с
зарядом Ze, вокруг которого по замкнутым орбитам
(10-10 м) вращаются Z электронов.
Сила, удерживающая электрон на орбите есть сила
кулоновского притяжения между ядром и электроном:
1 e2 mev 2
,
F
2
r
4πε 0 r
где r — радиус орбиты электрона.
11.
Постулаты БораРезультаты опытов Резерфорда свидетельствовали в
пользу планетарной модели атома.
Однако эта модель оказалась в противоречии с
законами классической механики и электродинамики.
Система неподвижных зарядов не может находиться в
силовом кулоновском поле в состоянии устойчивого
равновесия, следовательно, электроны должны
вращаться
вокруг
ядра
по
криволинейным
траекториям.
12.
В этом случае электрон будет двигаться по траектории снормальным ускорением.
Согласно классической электродинамике, ускоренно
движущаяся заряженная частица должна излучать
электромагнитные волны.
Процесс излучения сопровождается потерей энергии,
уменьшением скорости движения и падением на ядро.
13.
Бор пришел к выводу, что приописании
поведения
атомных
систем следует отказаться от
некоторых
представлений
классической физики.
Нильс Бор
Первый постулат: атом может
находиться в стационарных
состояниях.
Этим состояниям соответствуют дискретные
орбиты
электрона,
находясь
на
которых
электрон не излучает электромагнитных волн.
14.
Условие для стационарных орбит электрона:момент импульса электрона Le должен быть равен
h
целому кратному величине
.
2π
h
Le mevr n
n ,
2π
где n = 1, 2, 3, …называется главным квантовым
числом.
15.
Второй постулат: излучениеили
поглощение
энергии в виде кванта энергии hν происходит лишь
при переходе электрона из одного стационарного
состояния в другое.
Световой
квант
равен
разности
энергий
тех
стационарных состояний, между которыми совершается
квантовый скачок электрона:
hν mn E m En ,
где m и n — номера состояний.
16.
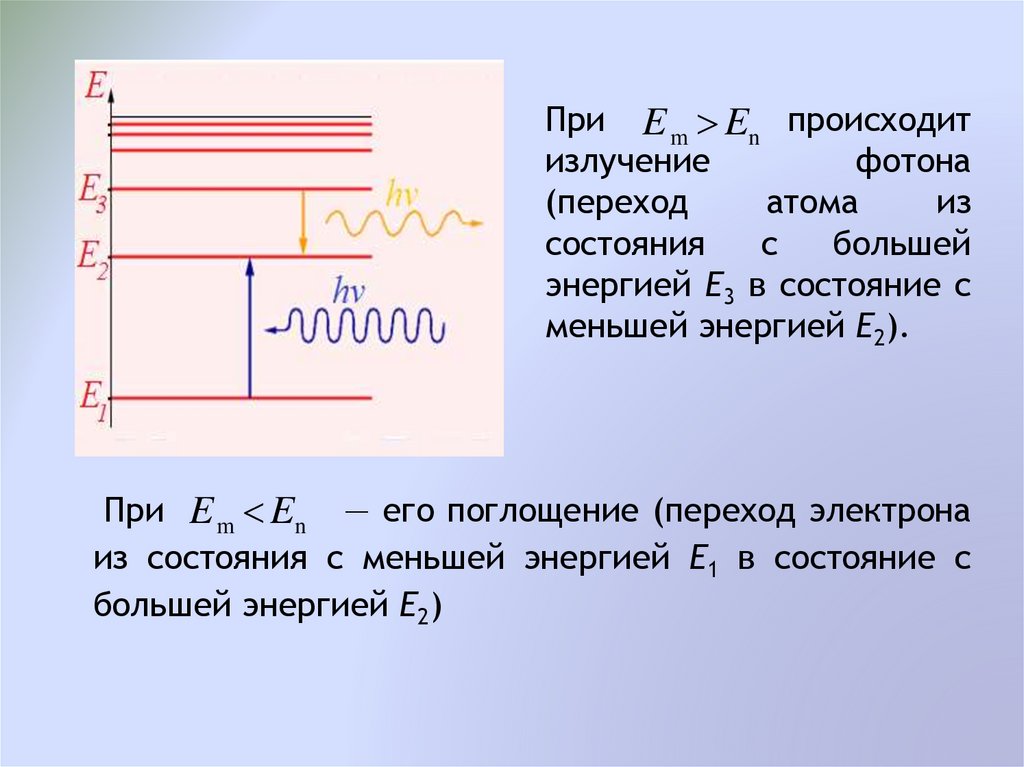
При E m En происходитизлучение
фотона
(переход
атома
из
состояния
с
большей
энергией Е3 в состояние с
меньшей энергией Е2).
При E m En — его поглощение (переход электрона
из состояния с меньшей энергией Е1 в состояние с
большей энергией Е2)
17.
18.
Линейчатый спектр атома водородаЕщё в начале 19 века опытным путём было
установлено, что изолированные атомы в виде
разреженного газа или паров металлов испускают
спектр, состоящий из отдельных (дискретных)
спектральных линий (линейчатый спектр).
Закономерности в спектральных линиях в видимой
части спектра атома водорода были подробно изучены
в 1885 г. швейцарским физиком Иоганном Бальмером.
19.
Совокупность спектральных линий излучения атомаводорода в видимой части спектра была названа
серией Бальмера.
Длины волн в этой части спектра вычислялись по
формуле:
1
1 1
R 2 2 ,
λ
2 n
где R 1,10 107 м 1
n 3,4,5...
Позже аналогичные серии спектральных линий были
обнаружены другими учеными в УФ и ИК частях
спектра атома водорода
20.
21.
В 1890 году И. Ридберг получил эмпирическуюобобщенную формулу для частот спектральных линий
атома водорода:
1
1
ν nm R 2 2 ,
m n
где R 3,29 1015 с 1; m 1,2,3,4,5,6 — постоянные
для каждой серии целые числа, n — целые числа,
начинающие с m + 1, которые определяют отдельные
линии в данной серии.
22.
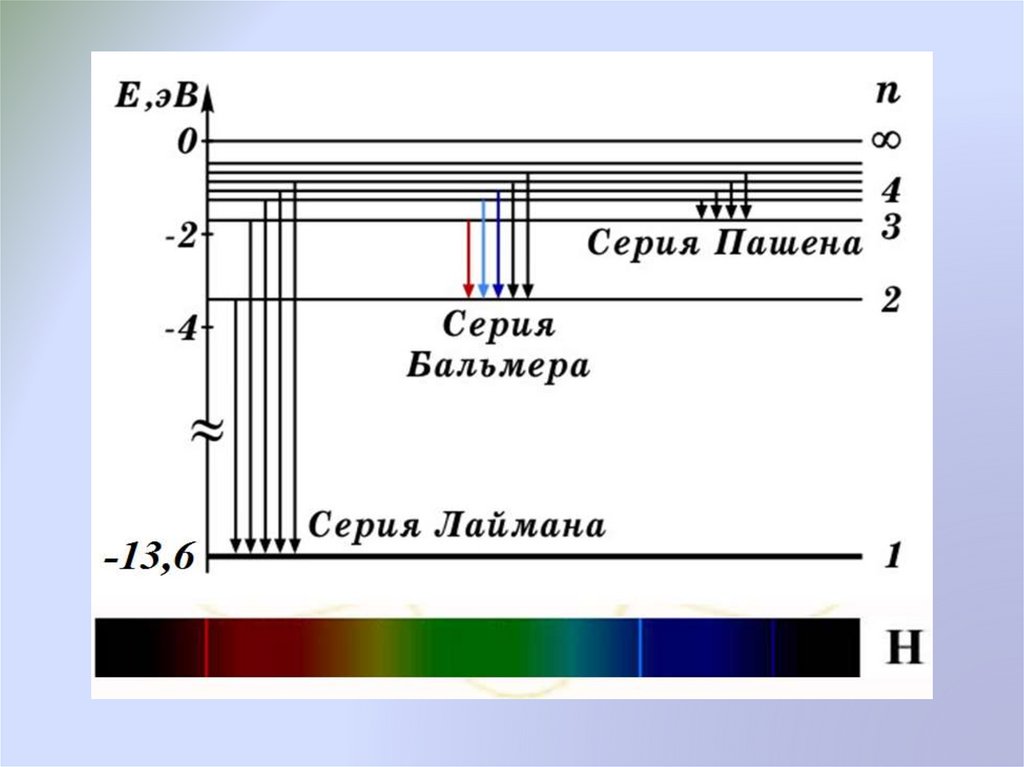
Для УФ серии Лаймана: m = 1, n = 2, 3, 4, …;Для серии Бальмера: m = 2, n = 3, 4, 5, …
Для ИК серии Пашена: m = 3, n = 4, 5, 6, …
До
теории
атома
водорода
Бора
механизм
происхождения линейчатых спектров и физический
смысл
целых
спектральных
непонятными.
чисел,
входящих
линий
водорода,
в
формулы
оставались
23.
Спектр атома водородапо теории Бора
Пусть электрон вращается вокруг ядра по одной из
разрешенных правилом
квантования
круговой
стационарной орбите.
h
n .
mevr n
2π
Решая совместно это
движения электрона
уравнение
1 e2 mev 2
F
2
r
4πε 0 r
с
уравнением
24.
найдёморбит:
радиусы
стационарных
2
4πε
0
rn n 2
,
2
mee
(«неизлучающих»)
где n = 1, 2, 3…
Самой близкой к ядру орбите соответствует значение
n = 1 (боровский радиус):
4πε 0 2
10
r1
0,53
10
м.
2
mee
Полная энергия электрона в атоме водорода будет
2
m
v
складываться из его кинетической энергии e
2
потенциальной
энергии
взаимодействия
2
e
электростатическом поле ядра
:
4πε 0 r
и
в
25.
mev 2e2
1 e2
E
.
2
4πε 0 r 2 4πε 0 r
Подставив в эту формулу радиусы орбит для
стационарных состояний, получим, что энергия
электрона может принимать только дискретные
(квантованные) значения:
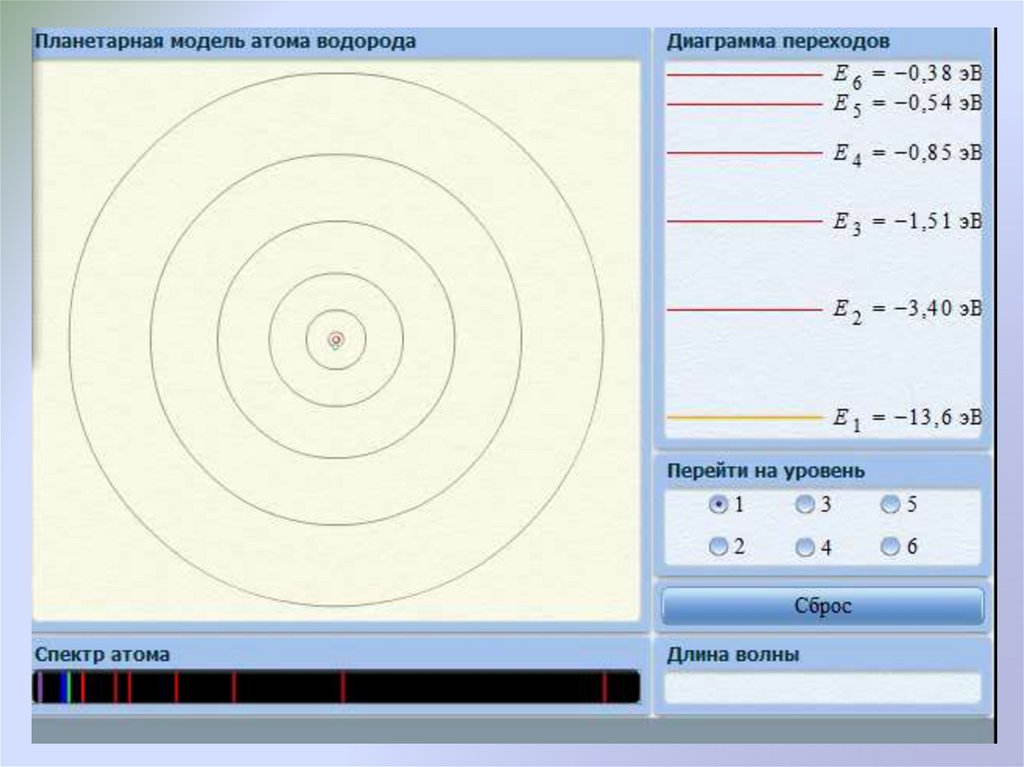
1 mee4
En 2 2 2 , (n 1,2,3...).
n 8h ε 0
Подстановка значений физических постоянных в эту
формулу позволяет определить минимальную энергию
(n = 1) атома водорода —13,6 эВ. Это состояние
называется основное состояние.
26.
Состояния с n > 1 называются возбужденными.Энергия ионизации Ei — энергия необходимая для
отрыва
электрона,
находящегося
в
основном
состоянии, от атома. Для атома водорода Ei 13,6 эВ.
Согласно второму постулату Бора при переходе
электрона с одной стационарной орбиты с энергией En
на другую стационарную орбиту с энергией Em < En
атом испускает квант света с частотой
Enm mee4 1
1
nm
3 2 2 2 .
h
8h ε 0 m n
27.
Эта формула в точности совпадает с эмпирической(полученной опытным путём) формулой Ридберга для
спектральных серий атома водорода,
1
1
nm R 2 2 ,
m n
если положить что
mee4
R 3 2.
8h ε 0
Подстановка значений физических постоянных в эту
формулу
позволяла
определить
теоретическое
значение постоянной Ридберга, которое очень хорошо
совпало с экспериментальным значением.
28.
Опыты Франка и ГерцаПочти
одновременно
с
теоретическими
исследованиями Бора по атому водорода было
получено
прямое
экспериментальное
доказательство
существования
стационарных
состояний атома и квантования энергии.
Дискретность энергетических состояний атома
была доказана в 1913 году в опыте Д. Франка
и Г. Герца, в котором исследовалось столкновение
электронов с атомами ртути.
29.
Оказалось,что
если
кинетическая
энергия
электронов меньше 4,9 эВ, то их столкновение с
атомами ртути происходит по закону абсолютно
упругого удара.
Если же энергия электронов равна 4,9 эВ, то их
столкновения
с
атомами
ртути
становятся
неупругими, т. е. в результате столкновения с
атомами ртути электроны полностью теряют свою
кинетическую энергию.
30.
Это означает, что атомы ртути поглощают определеннуюпорцию энергии электрона и переходят из основного
состояния в первое возбужденное состояние:
E2 E1 4,9эВ.
Согласно теории Бора, при обратном самопроизвольном
переходе атома ртути в основное состояние должны
испускаться кванты с частотой.
E2 E1
1,2 1015 Гц.
h
Спектральная линия с такой частотой действительно была
обнаружена в УФ части спектра излучения атомов ртути.
31.
Прекрасное согласие теории атома водорода Бора сэкспериментом, вычисление постоянной Ридберга,
объяснение наличия энергетических уровней у атома
водорода служили вескими аргументами в пользу её
справедливости.
Однако теория Бора поставила перед физиками ряд ещё
более трудноразрешимых загадок:
теория не могла объяснить различие интенсивности
спектральных линий и причины тех или иных
квантовых скачков;
невозможность применить теорию для объяснения
спектра гелия.
32.
После открытия волновых свойств вещества сталосовершенно ясно, что теория Бора, опирающаяся на
классическую механику,
могла
быть только
переходным
этапом
на
пути
к
созданию
последовательной
квантовой
теории
атомных
явлений.




























 physics
physics








