Similar presentations:
Модели атомов. Атом водорода по теории Бора (лекция № 6)
1.
Сегодня: понедельник, 26 декабря 2022 г.Лекция №6. Модели атомов.
Атом водорода по теории Бора.
Курбанисмаилов В.С.1
2.
хТема 1. Модели атомов.
Атом водорода по теории Бора.
1.1. Закономерности в атомных спектрах.
1.2. Ядерная модель атомов.
1.3. Элементарная теория Бора.
1.4. Опыт Франка и Герца.
3.
4.
5.
6.
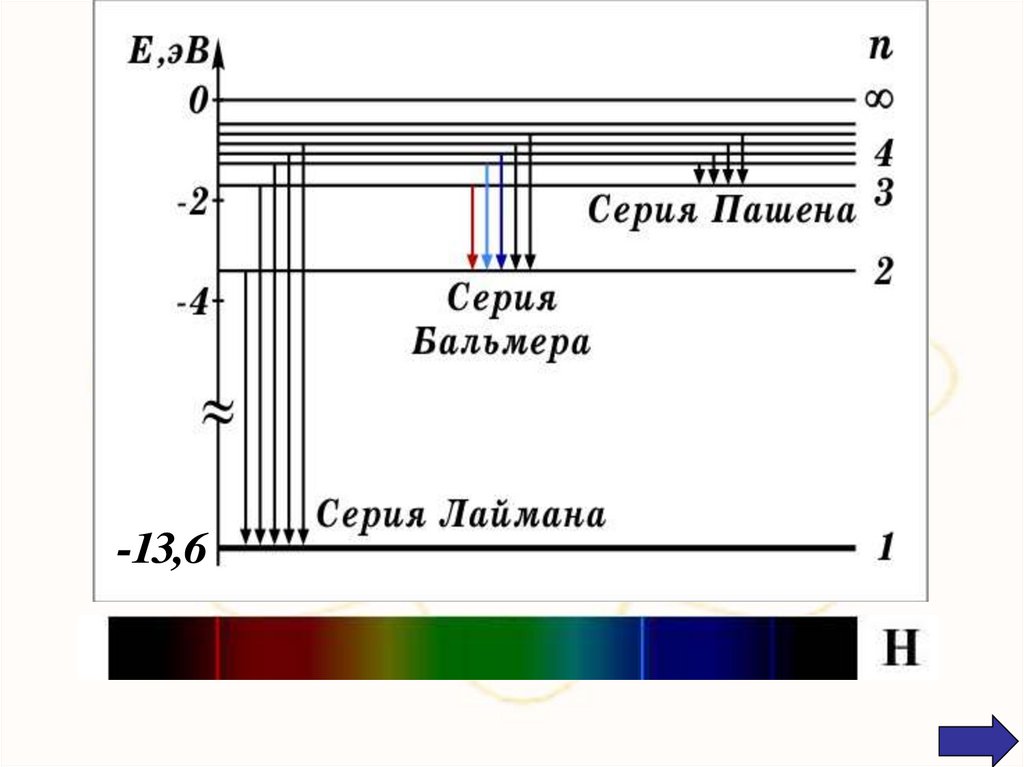
х1.1. Закономерности в атомных спектрах.
Итак, что же такое атом?
Изолированные атомы в виде разреженного
газа или паров металлов испускают спектр,
состоящий из отдельных спектральных линий
(линейчатый спектр). Изучение
атомных
спектров послужило ключом к познанию
строения атомов.
Прежде всего было замечено, что линии в
спектрах расположены не беспорядочно, а
сериями. Расстояние между линиями в серии
закономерно уменьшается по мере перехода от
длинных волн к коротким.
7.
-13,68.
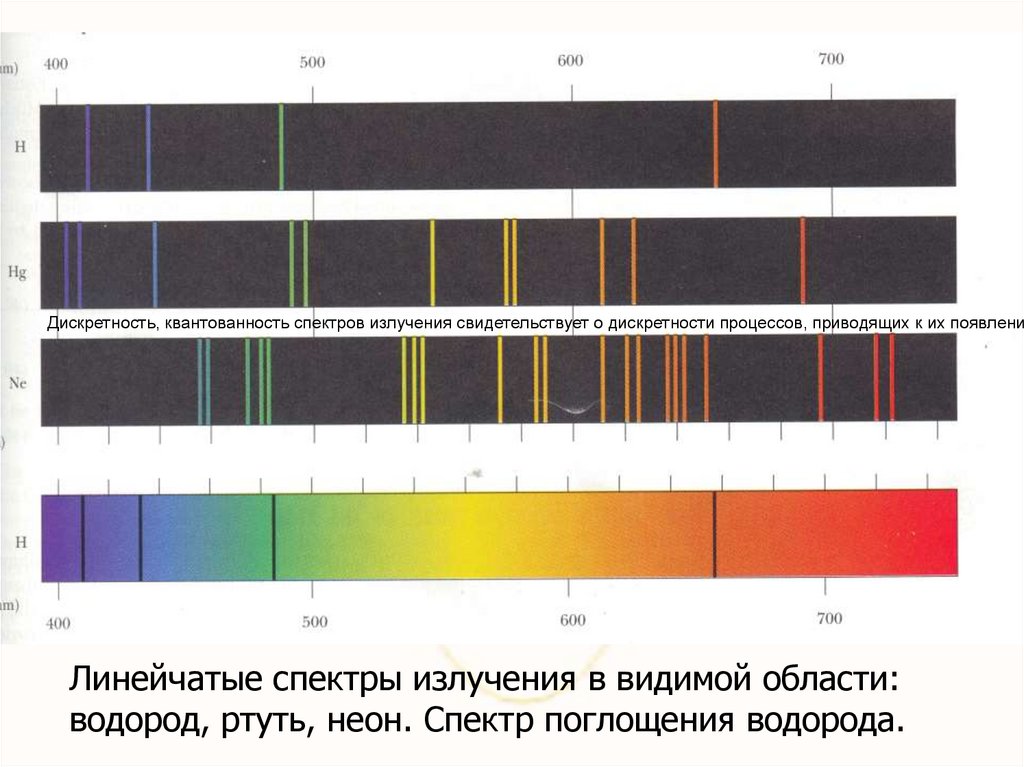
Дискретность, квантованность спектров излучения свидетельствует о дискретности процессов, приводящих к их появлениюЛинейчатые спектры излучения в видимой области:
водород, ртуть, неон. Спектр поглощения водорода.
9.
хШвейцарский физик Й. Бальмер в 1885 году
установил, что длины волн серии в видимой части
спектра водорода могут быть представлены
формулой (формула Бальмера):
2
n
0 = const, n = 3, 4, 5,…
λ λ0
n 4
1
1
1
R' 2 2
λ
n
2
2
или
1 1
R 2 2
2 n
R = 1,09·107 м-1 – постоянная Ридберга, n = 3, 4, 5,…
В физике постоянной Ридберга называют и
другую величину равную R = R ·с.
R = 3,29·1015c-1
10.
хДальнейшие исследования показали, что в
спектре водорода имеется еще несколько серий:
1 1
Серия Лаймона ν R 2 2
1 n
n = 2, 3, 4,…
Серия Пашена
1 1
ν R 2 2
3 n
n = 4, 5, 6,…
Серия Брэкета
1 1
ν R 2 2
4 n
n = 5, 6, 7,…
Серия Пфунда
1 1
ν R 2 2
5 n
n = 6, 7, 8,…
11.
Обобщенная формула Й. Бальмера1
1
R 2 2
n
k
или
1
1
1
R' 2 2
λ
n
k
где k = 1, 2, 3,…,
n = k + 1, k + 2,….
12.
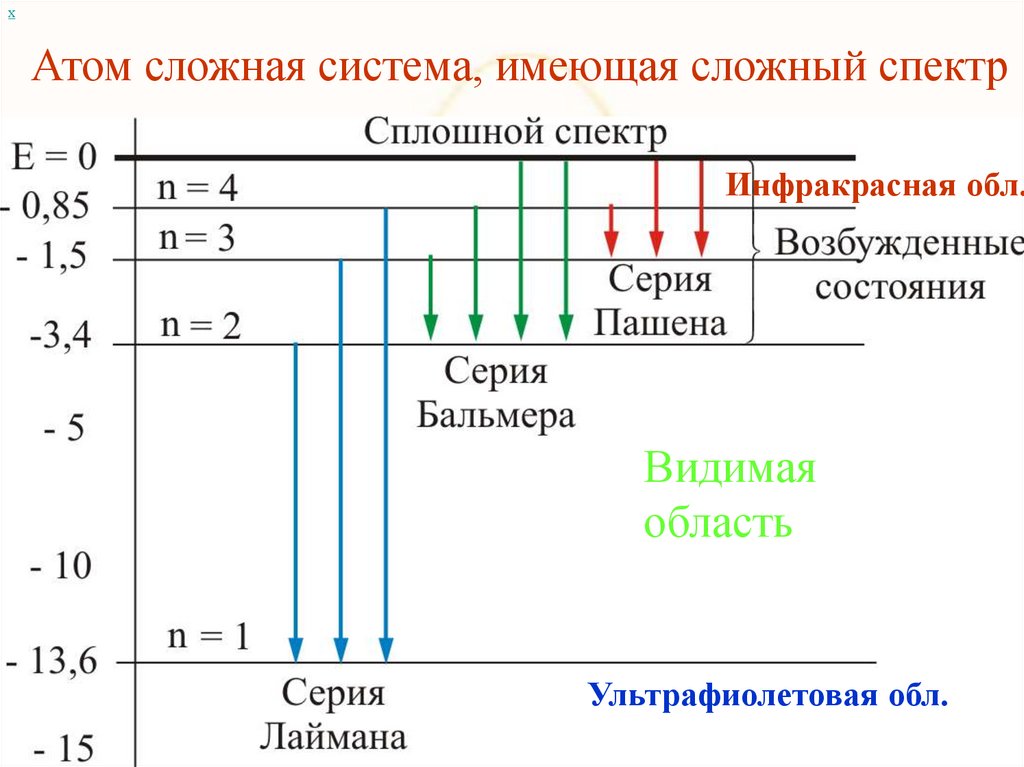
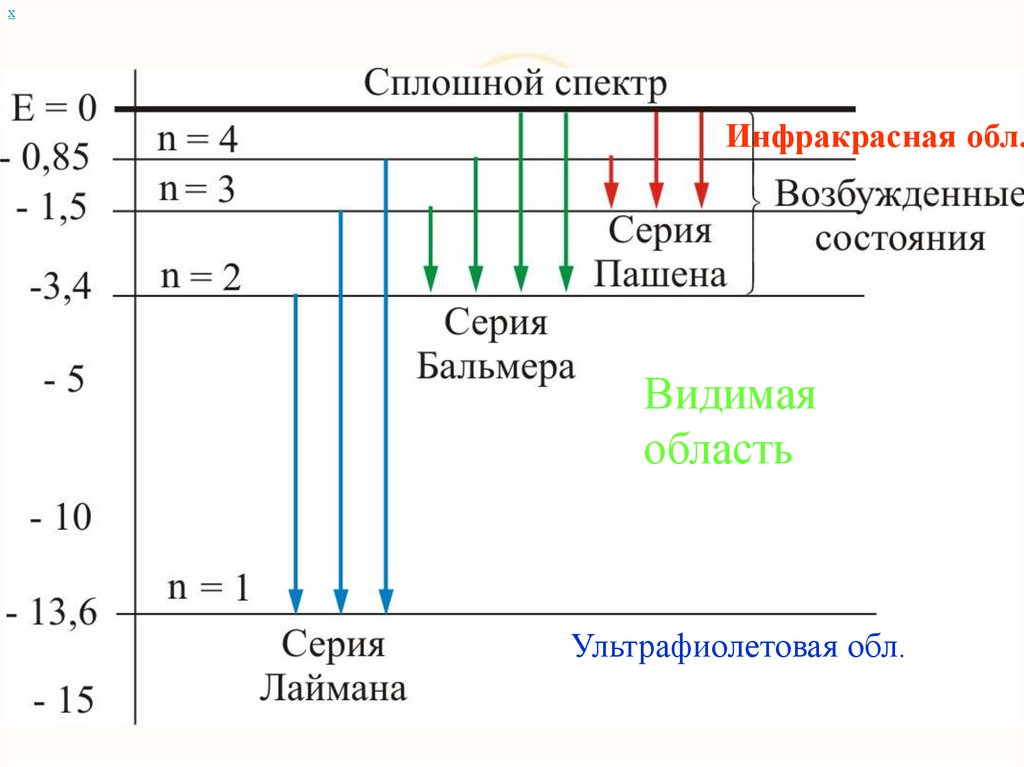
хАтом сложная система, имеющая сложный спектр
Инфракрасная обл.
Видимая
область
Ультрафиолетовая обл.
13.
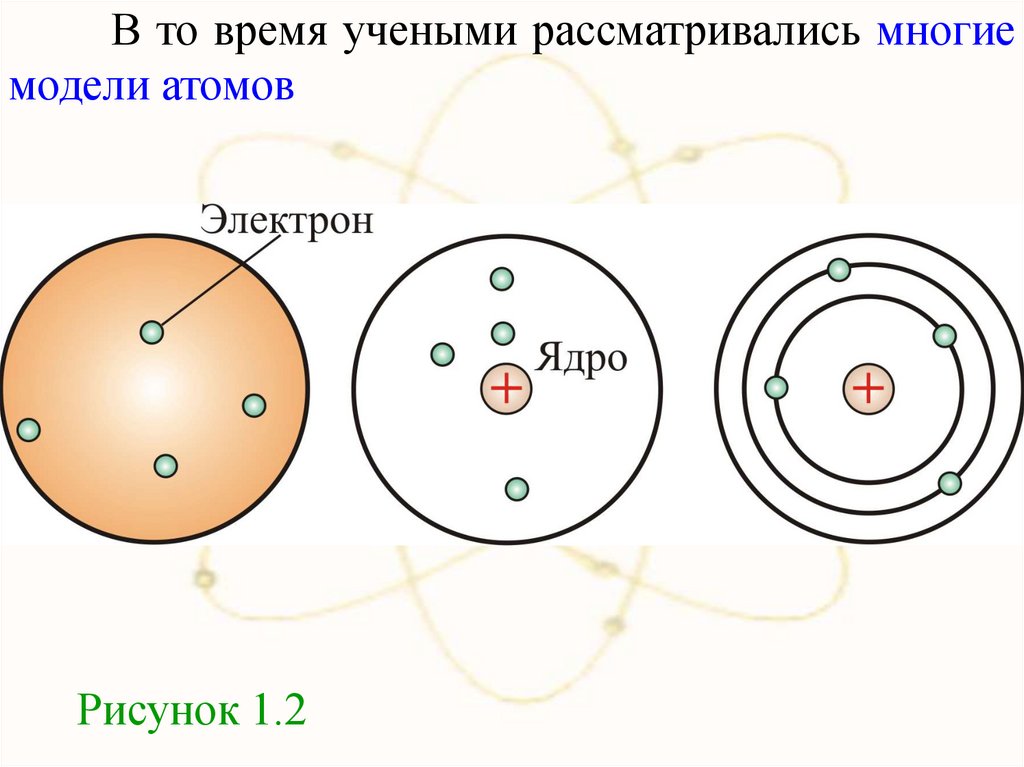
В то время учеными рассматривались многиемодели атомов
Рисунок 1.2
14.
«То, что внизу, подобнотому, что вверху»
15.
Планетарнаямодель строения
атома
16.
Конец ХIХ -- начало ХХ века
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
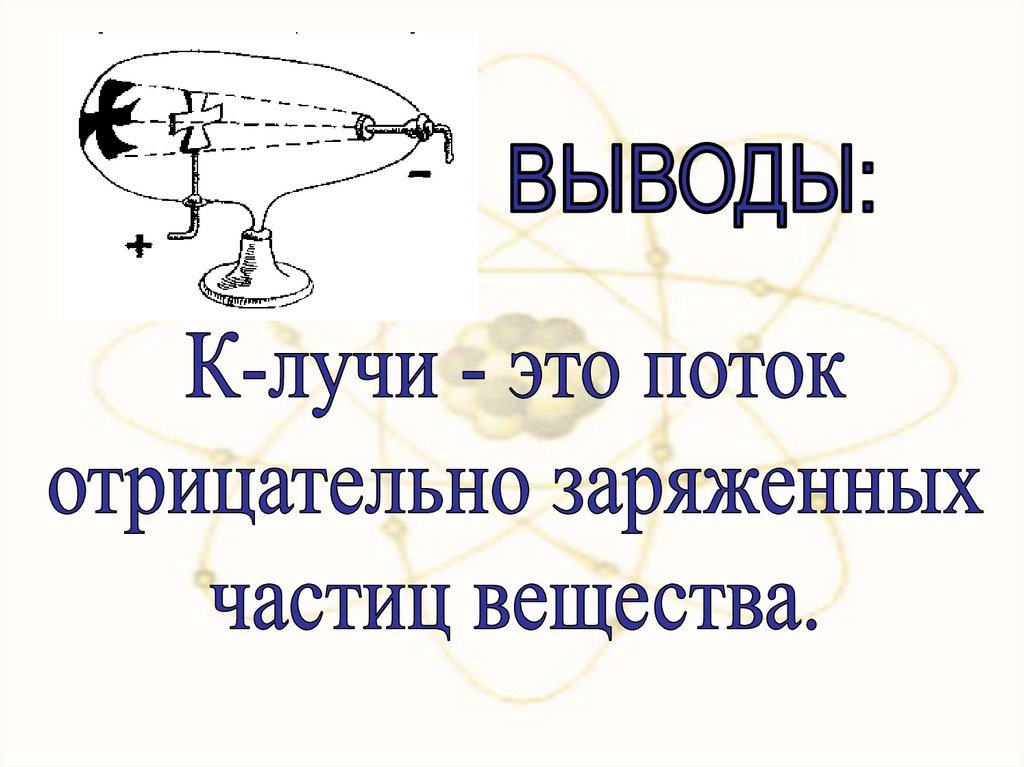
1895- открытие Хлучей Рентгеном1896- открытие
радиоактивности
Беккерелем
27.
1896 - основаниеТПУ!
1897 - открытие
электрона
28.
Физики«отобрали»
атом у
химиков
29.
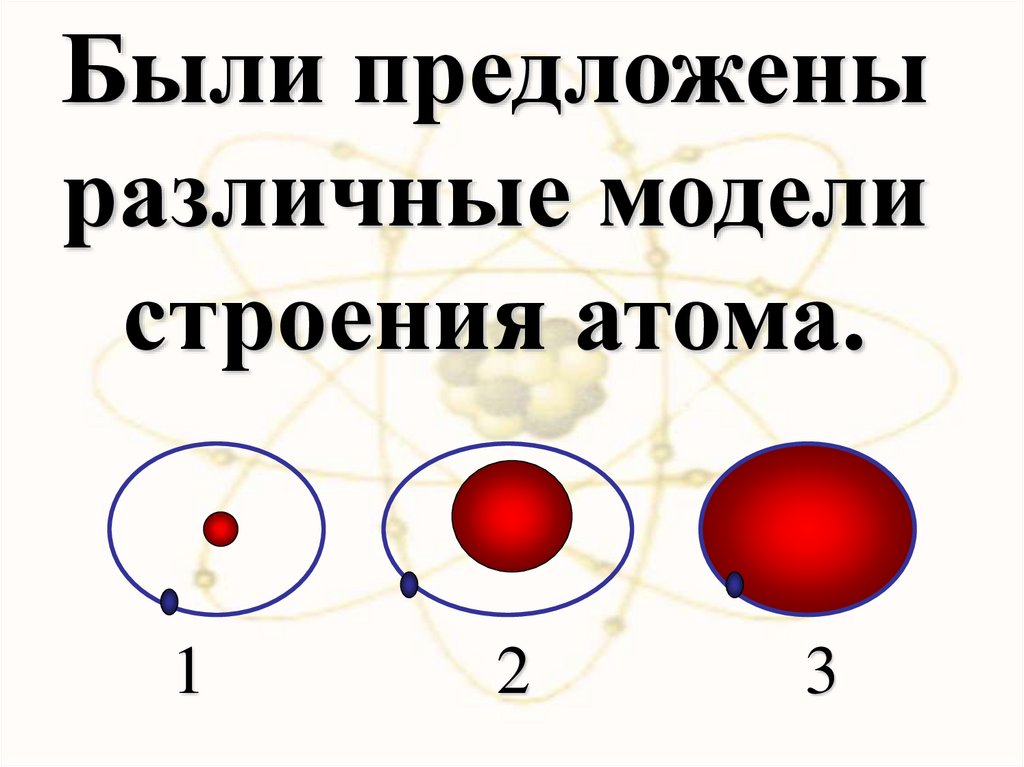
Были предложеныразличные модели
строения атома.
1
2
3
30.
31.
«То, что находится внизу,подобно тому,
что находится вверху»
Гермес Тримегист
(древний Египет)
32.
Модель Ж. Перрена(1901)
33.
Модель Х. Нагаока(1904)
34.
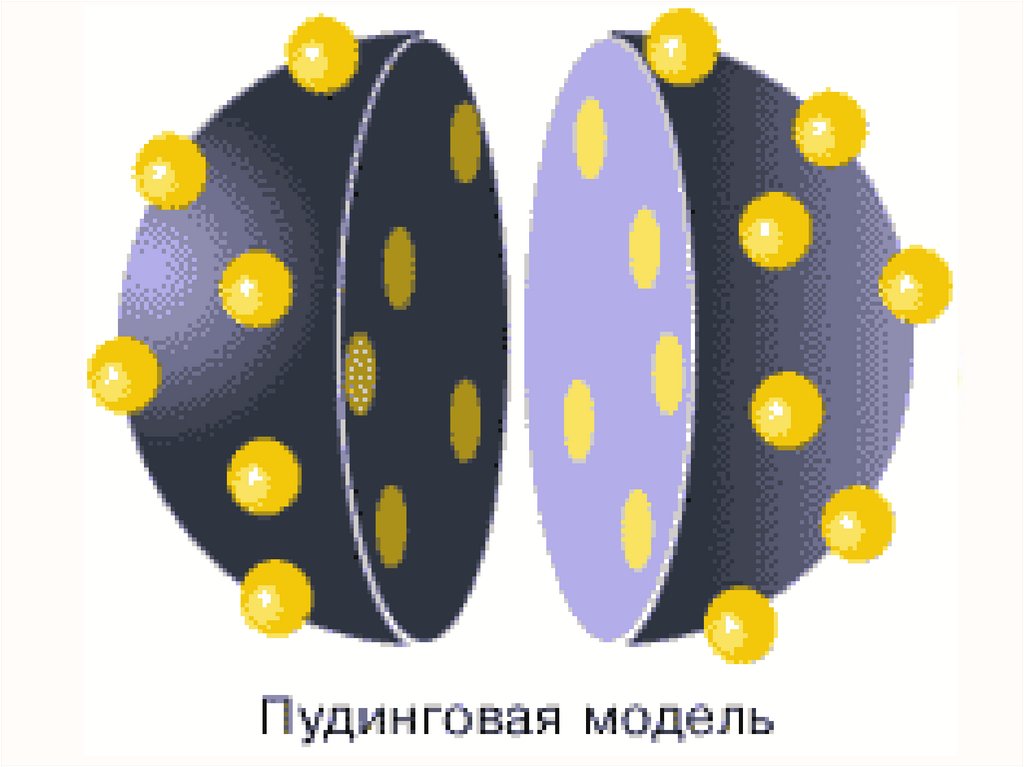
хВ 1903 году Дж. Дж. Томсон, предложил
модель атома: сфера, равномерно заполненная
положительным электричеством, внутри которой
находятся электроны (рисунок 1.2, а). Суммарный
заряд сферы равен заряду электронов. Атом в
целом нейтрален. Теория такого атома давала, что
спектр должен быть сложным, но никоим образом
не линейчатым, что противоречило экспериментам.
35.
МодельДж.Дж
Томсона (1904)
36.
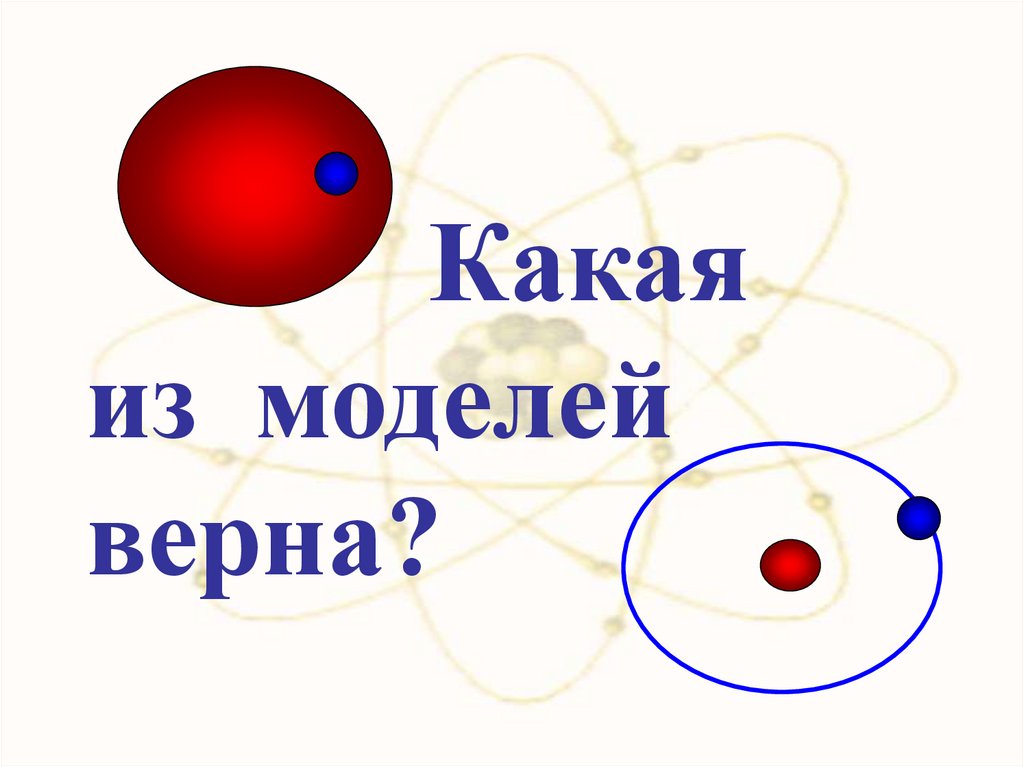
Какаяиз моделей
верна?
37.
Планетарнаямодель строения
атома
38.
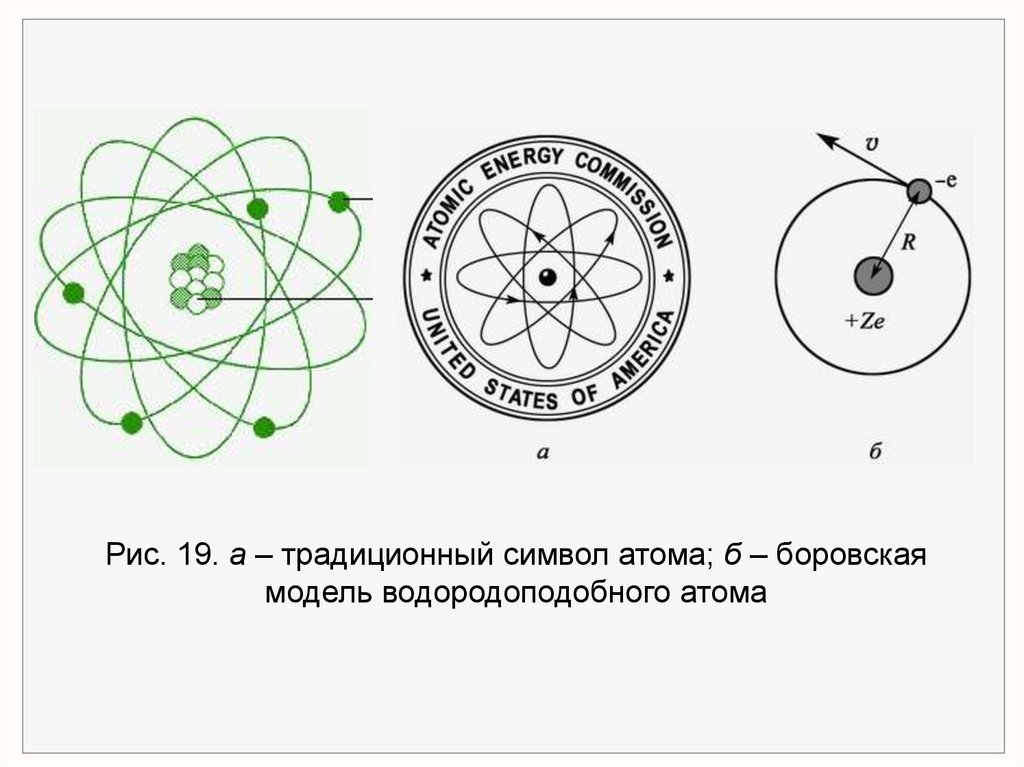
Рис. 19. а – традиционный символ атома; б – боровскаямодель водородоподобного атома
39.
Резерфорд Эрнест (1871–1937)– английский физик, основоположник ядерной физики.
Исследования посвящены
атомной и ядерной физике,
радиоактивности.
Своими фундаментальными открытиями в этих областях
заложил основы современного учения о радиоактивности и
теории строения атома. В 1899 г. открыл альфа - и бета-лучи.
Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного
распада и установил закон радиоактивных превращений. В
1903году доказал, что альфа-лучи состоят из положительно
заряженных частиц. Предсказал существование трансурановых
элементов.
В 1908 г. ему была присуждена Нобелевская премия.
40.
RUTHERFORDErnest, Lord
of NELSON
(1871-1937)
41.
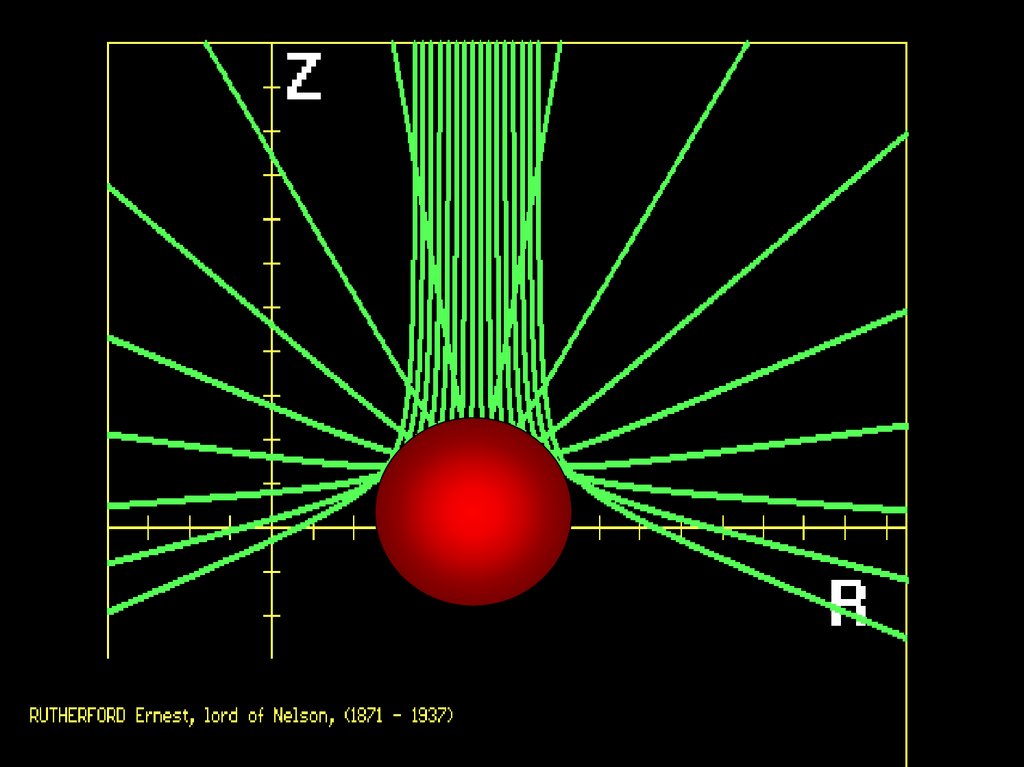
х1.2. Ядерная модель атома (модель Резерфорда).
Скорость – частиц = 107 м/с = 104 км/сек.
– частица имеет положительный заряд равный +2е.
Схема опыта Резерфорда
Рассеянные частицы ударялись об экран из сернистого
цинка, вызывая сцинтилляции – вспышки света.
Количество вспышек в темноте фиксировалось через микроскоп
42.
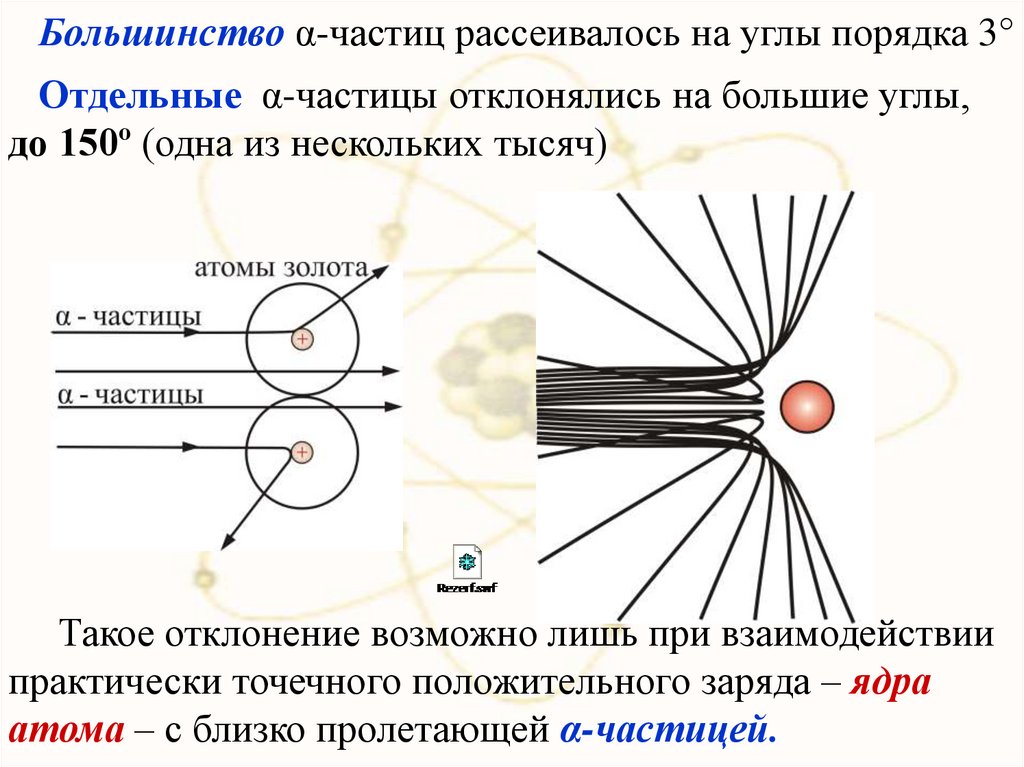
Большинство α-частиц рассеивалось на углы порядка 3°Отдельные α-частицы отклонялись на большие углы,
до 150º (одна из нескольких тысяч)
Такое отклонение возможно лишь при взаимодействии
практически точечного положительного заряда – ядра
атома – с близко пролетающей α-частицей.
43.
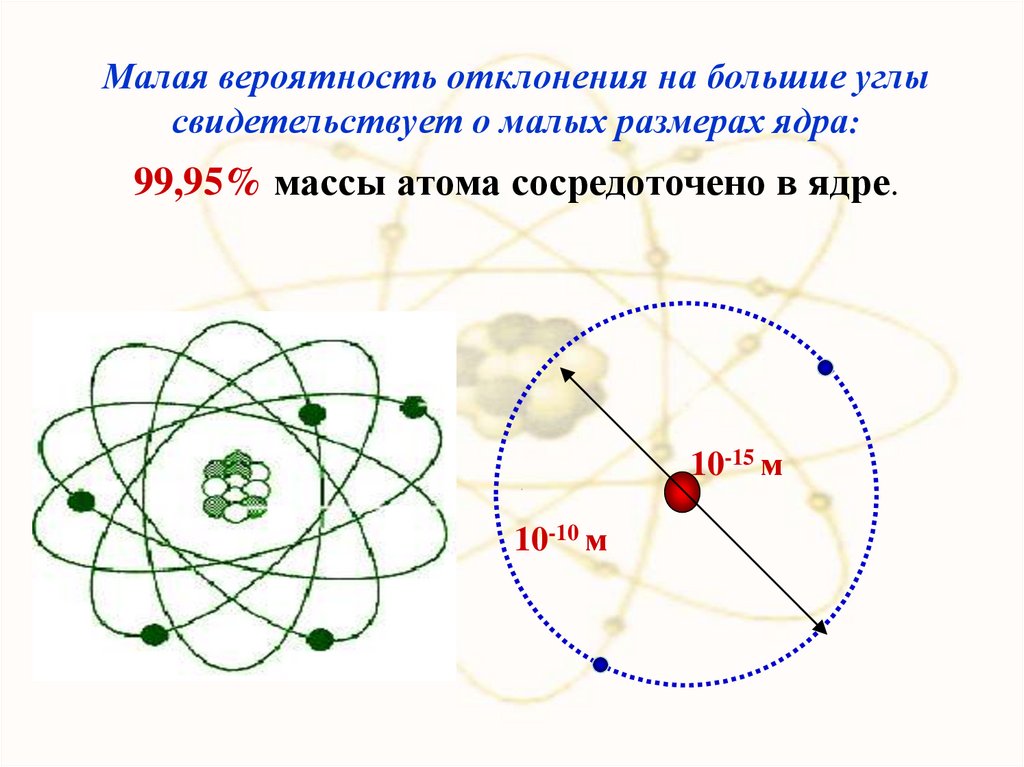
Малая вероятность отклонения на большие углысвидетельствует о малых размерах ядра:
99,95% массы атома сосредоточено в ядре.
10-15 м
10-10 м
44.
Движение α-частицы происходит по гиперболе:Угол рассеяния равен углу между асимптотами гиперболы
mbv
ctg
2
2 2 Ze
2
m – масса α-частицы,
v – ее скорость вдали от ядра;
Ze – заряд ядра;
b – прицельный параметр.
45.
Дифференциальное сечение рассеяния – отношение числачастиц, рассеянных атомом в единицу времени в телесный угол
dΩ, к интенсивности падающих частиц.
- формула
Ze
d
d
2
4
m
v
sin
/ 2 Резерфорда
2
2
Частицы с разными прицельными параметрами отклоняются
на разные углы.
46.
47.
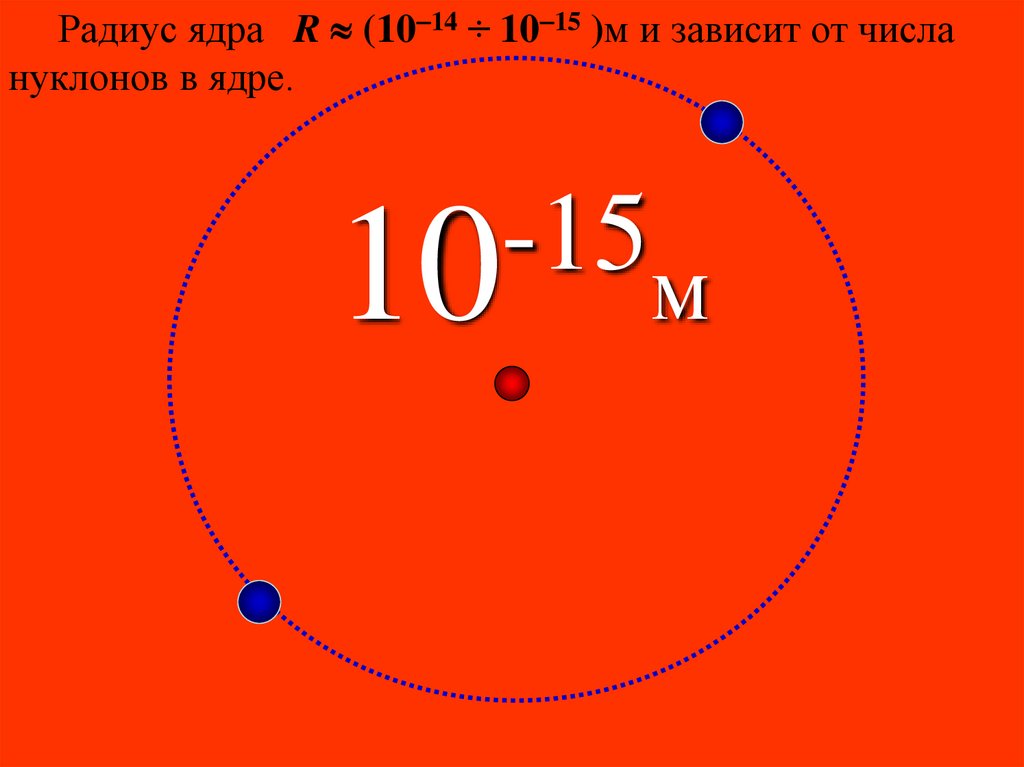
Радиус ядра R (10 14 ÷ 10 15 )м и зависит от числануклонов в ядре.
-15
10 м
48.
Атом золотаАльфа - частица
49.
Сравним силывзаимодействия двух
положительно
заряженных частиц в
разных моделях
50.
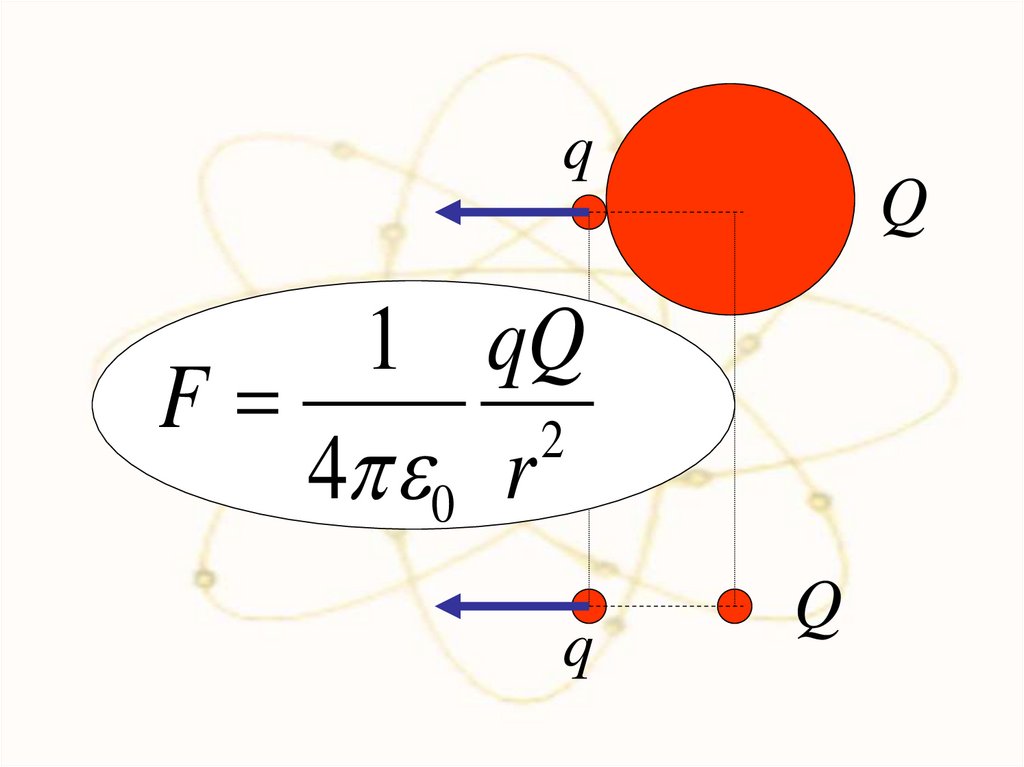
qQ
1 qQ
F
2
4 0 r
q
Q
51.
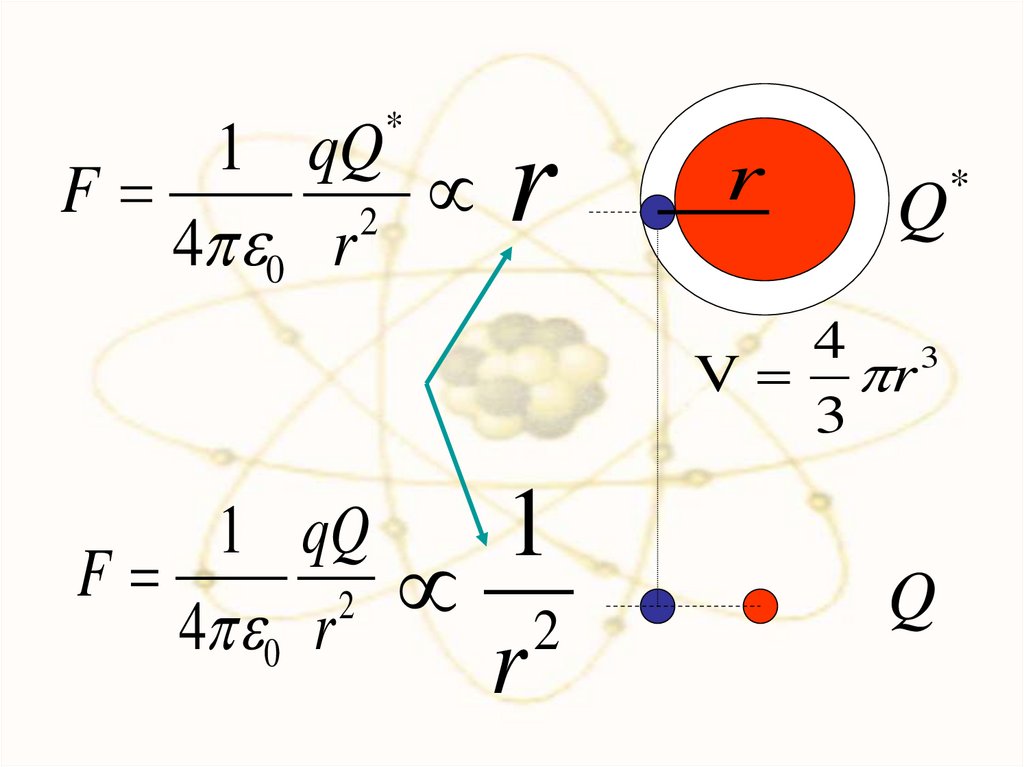
*1 qQ
F
2
4 0 r
r
r
Q
4 3
V r
3
1 qQ
1
F
2
2
4 0 r
r
Q
*
52.
F r1
F 2
r
Q
*
Q
53.
Спомощью
компьютера ...
54.
55.
Планетарная модель атомаОднако, планетарная модель была в явном
противоречии с классической электродинамикой:
электрон, двигаясь по окружности, т.е. с
нормальным ускорением, должен был излучать
энергию, следовательно, замедлять скорость и
упасть на ядро.
Т.о. модель Резерфорда не могла объяснить, почему атом устойчив
56.
57.
Планетарнаямодель атома
противоречит
электродинамике
Максвелла!!!
58.
Согласно теорииМаксвелла, ускоренно
движущийся заряд
излучает
электромагнитные
волны.
59.
При движении по окружностиимеется
центростремительное
ускорение. Поэтому электрон
должен терять энергию на
электромагнитное излучение и
падать на ядро.
60.
… излучатьи падать...
61.
Падать на ядро!Нестабильный атом?!
62.
Попыткойспасения
планетарной
модели атома
стали постулаты
Н. Бора
63.
х1.3. Элементарная теория Бора.
БОР Нильс Хендрик Давид (1885–
1962) – Выдающийся датский физиктеоретик,
один
из
создателей
современной физики.
Сформулировал идею о дискретности
энергетических состояний атомов, в свете новых идей
построил атомную модель, открыв условия устойчивости
атомов, и объяснил большой круг явлений. Создал первую
квантовую модель атома, основанную на двух постулатах,
которые
прямо
противоречили
классическим
представлениям и законам. Бор много сделал для развития
ядерной физики. Он – автор теории составного ядра, один
из создателей капельной модели ядра и теории деления
атомного ядра.
64.
65.
1. Атом следует описыватькак «пирамиду»
стационарных
энергетических состояний.
Пребывая в одном из
стационарных состояний,
атом не излучает энергию.
66.
67.
2. При переходах междустационарными состояниями
атом поглощает или излучает
квант энергии. При
поглощении энергии атом
переходит в более
энергетическое состояние.
68.
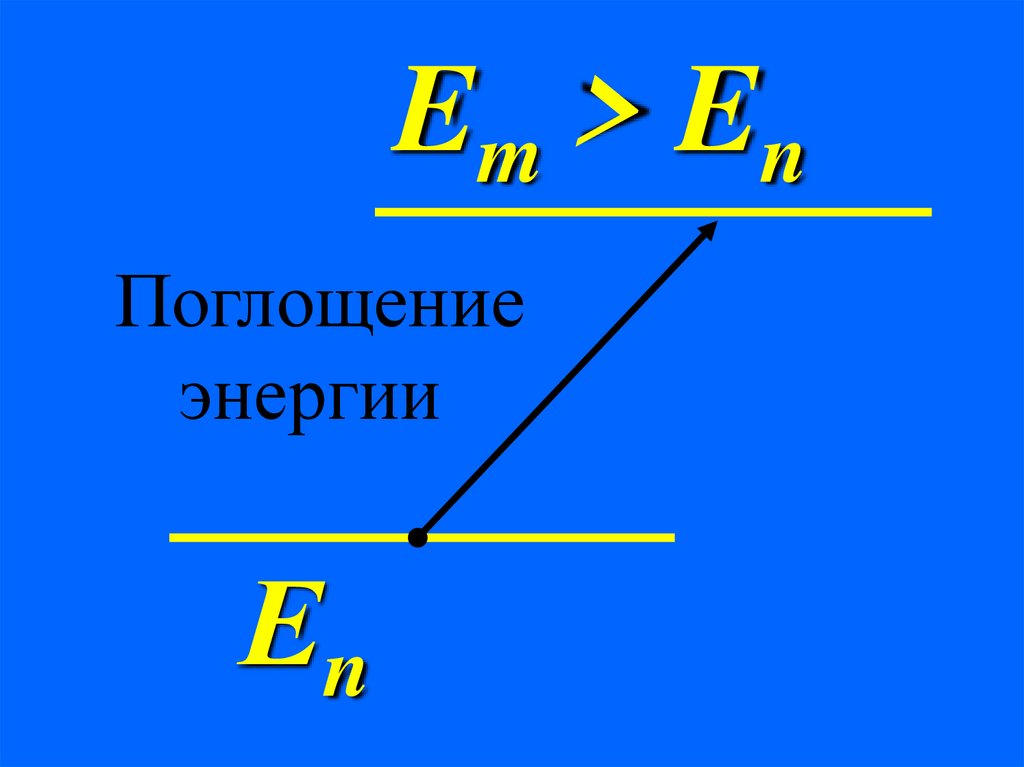
Em > EnПоглощение
энергии
Еn
69.
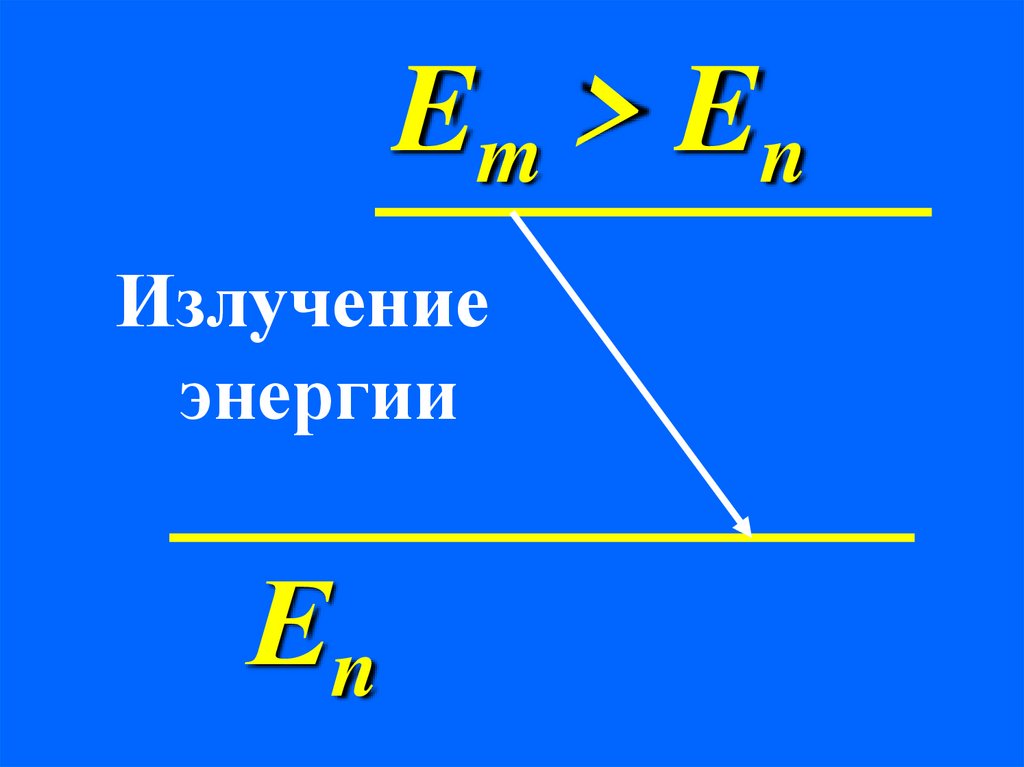
Em > EnИзлучение
энергии
Еn
70.
Теория Бора71.
Постулаты Бора1. Электроны движутся только по определенным
(стационарным) орбитам. При этом не происходит
излучения энергии.
Условие для стационарных орбит:
из всех орбит электрона возможны только те, для
которых момент импульса электрона, равен целому
кратному постоянной Планка:
me vr = nħ
n = 1, 2, 3,… главное
квантовое число.
72.
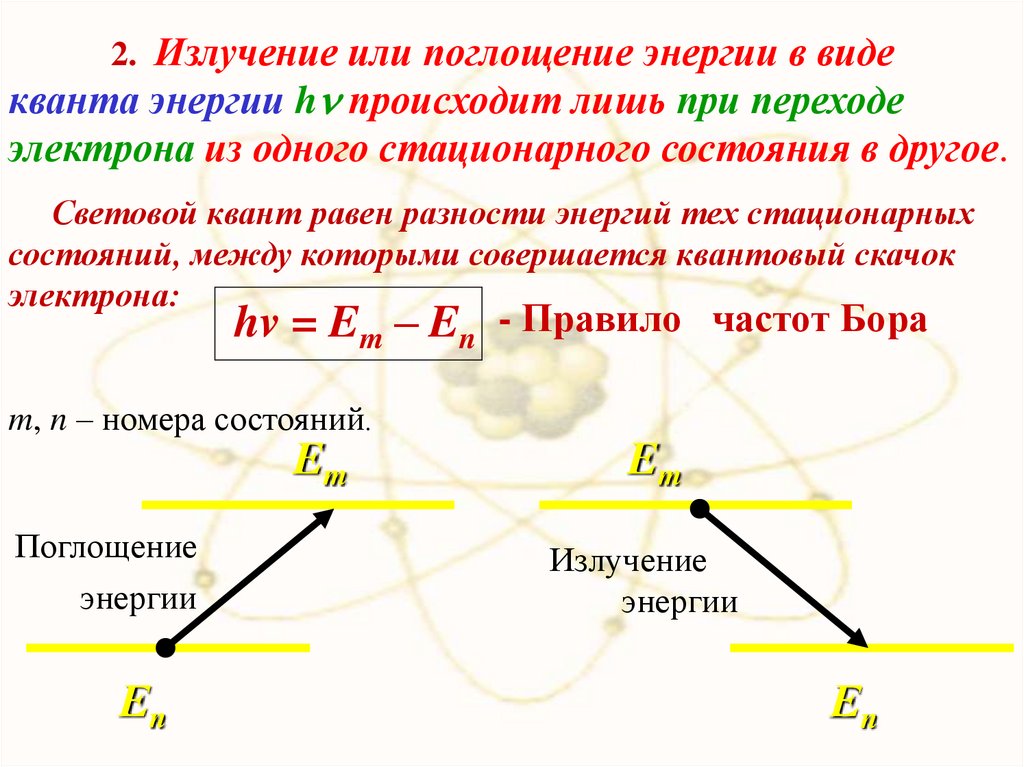
2. Излучение или поглощение энергии в видекванта энергии h происходит лишь при переходе
электрона из одного стационарного состояния в другое.
Световой квант равен разности энергий тех стационарных
состояний, между которыми совершается квантовый скачок
электрона:
hv = Em – En - Правило частот Бора
m, n – номера состояний.
Em
Поглощение
энергии
Еn
Em
Излучение
энергии
Еn
73.
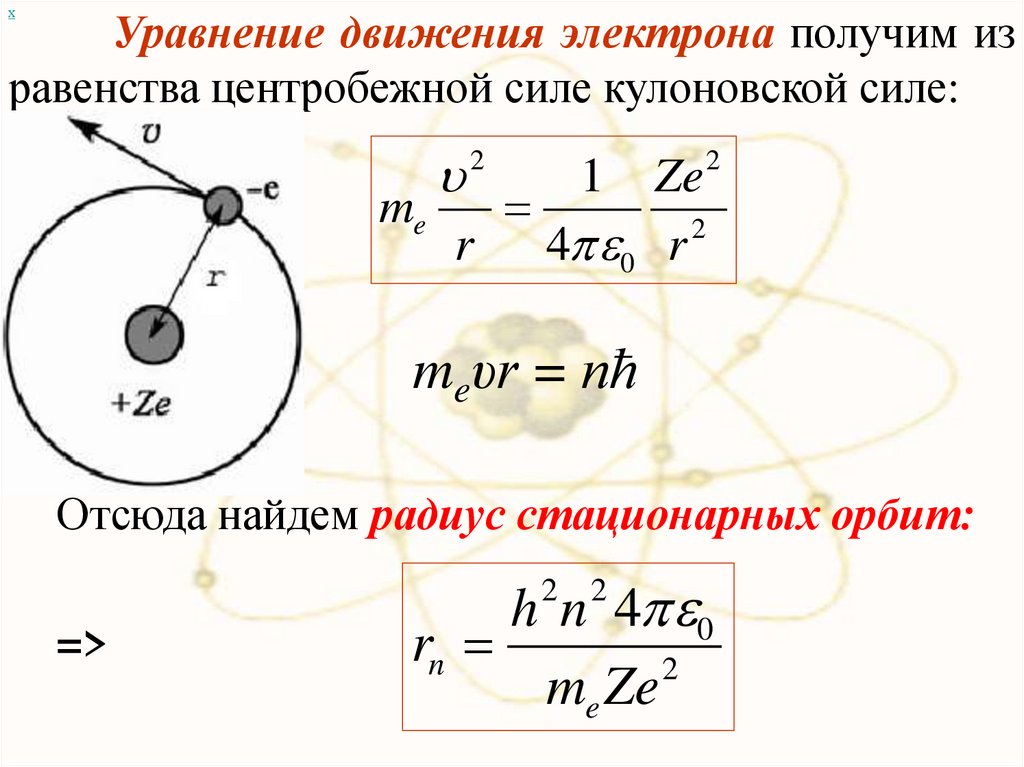
хУравнение движения электрона получим из
равенства центробежной силе кулоновской силе:
2
Ze 2
me
r 4 0 r 2
1
meυr = nħ
Отсюда найдем радиус стационарных орбит:
h n 4 0
rn
2
me Ze
2
=>
2
74.
хРадиус первой орбиты водородного атома
называют Боровским радиусом:
При n =1, Z = 1 для водорода имеем:
h
r1 4πε0
0,529 Å=
2
mee
= 0,529·10–10 м.
75.
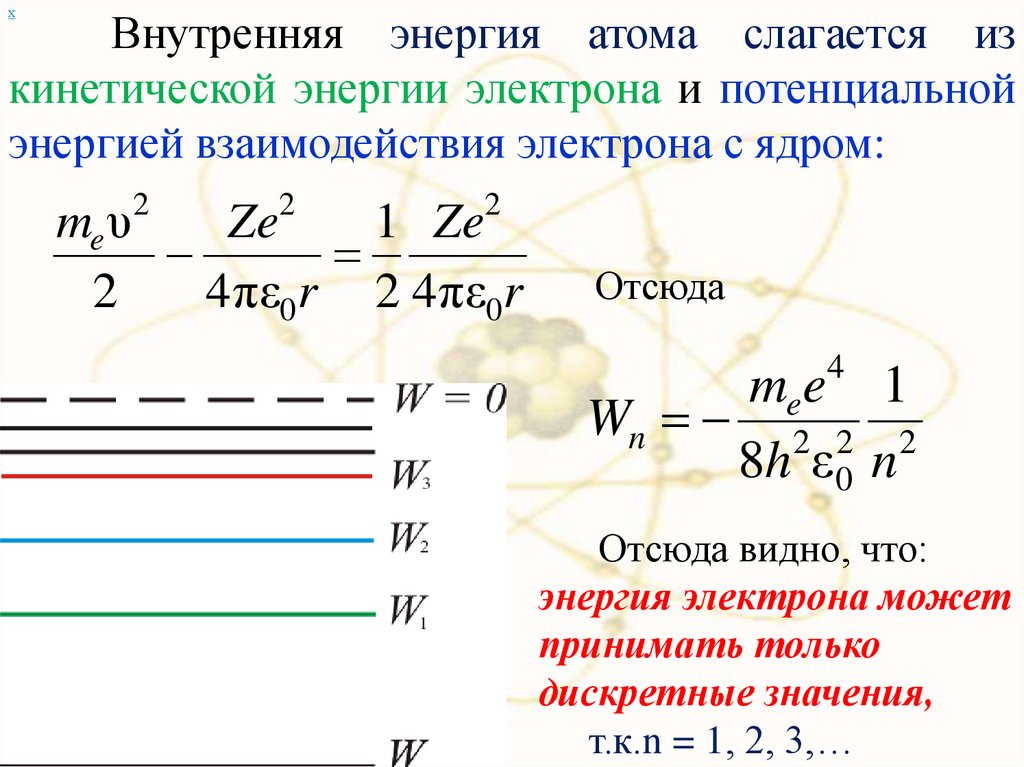
хВнутренняя энергия атома слагается из
кинетической энергии электрона и потенциальной
энергией взаимодействия электрона с ядром:
me υ
Ze
1 Ze
2
4πε0r 2 4πε0r
2
2
2
Отсюда
4
mee 1
Wn 2 2 2
8h ε 0 n
Отсюда видно, что:
энергия электрона может
принимать только
дискретные значения,
т.к.n = 1, 2, 3,…
76.
хИнфракрасная обл.
Видимая
область
Ультрафиолетовая обл.
77.
При переходе электрона в атоме водорода изсостояния n в состояние k излучается фотон с
4
энергией :
me 1 1
х
hν
и частота излучения,
e
2
2 2 2
8h ε 0 n k
mee 1 1
ν 3 2 2 2
8h ε 0 k
n
4
Мы получили обобщенную формулу Бальмера,
которая хорошо согласуется с экспериментом, где
4
постоянная Ридберга
me
R
2 3
8ε 0 h
78.
Серьезным успехом теории Бораявилось:
• вычисление постоянной Ридберга
для водородоподобных систем и
• объяснение структуры их
линейчатых спектров.
Бору удалось объяснить линии
спектра ионизованного гелия.
79.
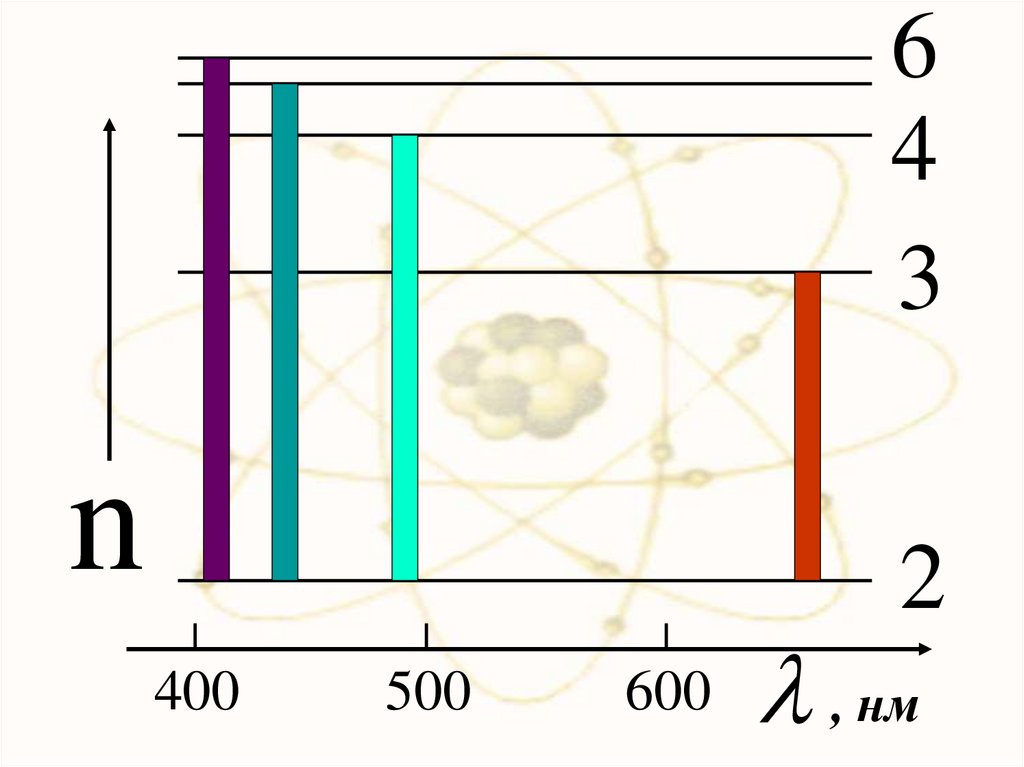
64
3
n
2
400
500
600
, нм
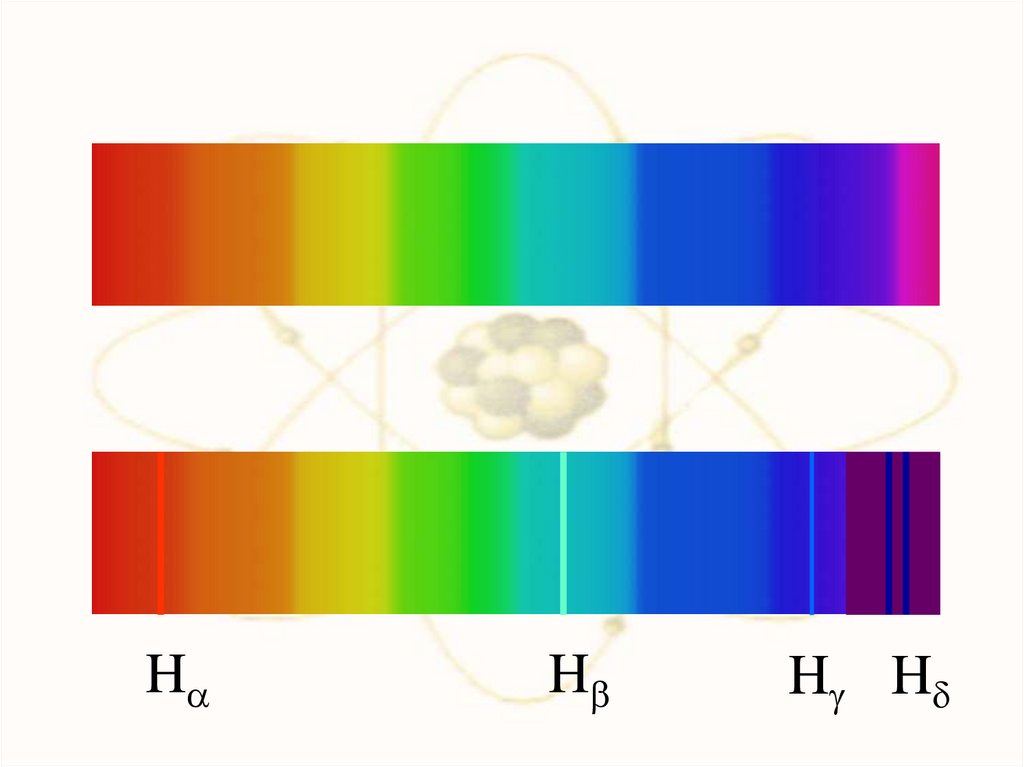
80.
HH
H H
81.
хБор теоретически вычислил отношение
массы протона к массе электрона mp/me = 1847, это
находится в соответствии с экспериментом.
Все
это было важным подтверждением основных идей,
содержащихся в теории Бора.
Теория Бора сыграла огромную роль в
создании атомной физики. В период ее развития
(1913 – 1925 г.г.) были сделаны важные открытия,
навсегда вошедшие в сокровищницу мировой
науки.
82.
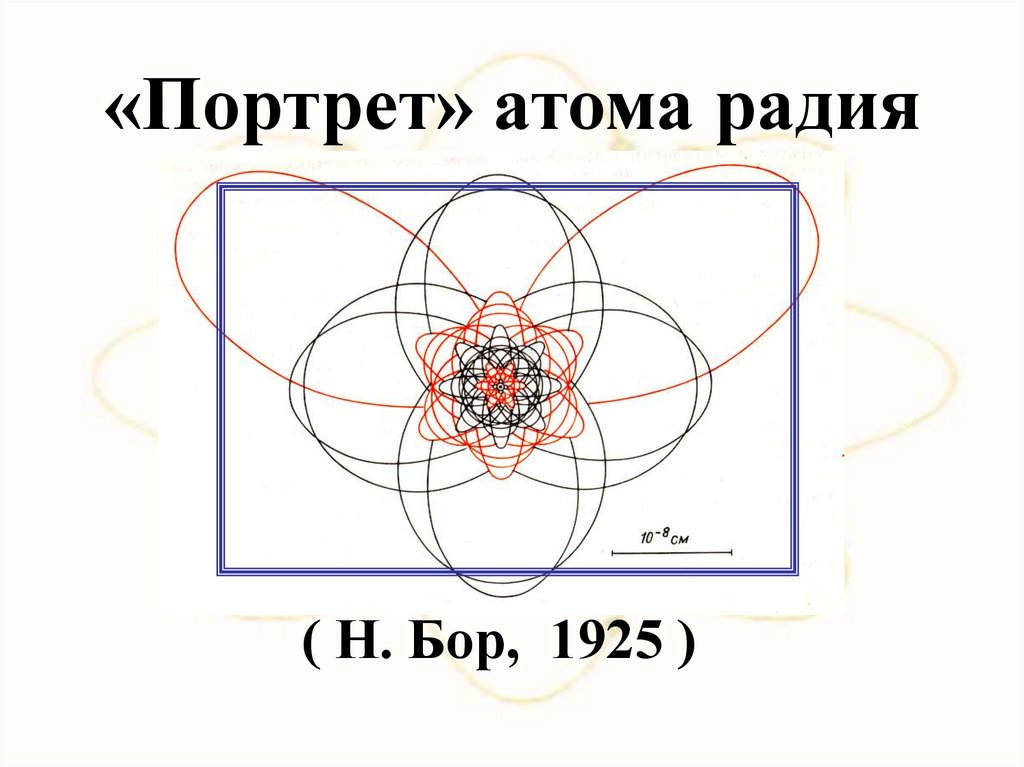
«Портрет» атома радия( Н. Бор, 1925 )
83.
хОднако наряду с успехами в теории Бора с
самого начала обнаружились существенные
недостатки.
Главнейшее
–
внутренняя
противоречивость
теории:
механическое
соединение классической физики с квантовыми
постулатами.
Теория не могла объяснить вопрос об
интенсивностях спектральных линий.
Серьезной неудачей являлась абсолютная
невозможность применить теорию для объяснения
спектров гелия (He) (два электрона на орбите, и
уже теория Бора не справляется).
84.
Аналогиятеории Бора
как слияния
двух описаний
микромира
(Feline)
85.
хСтало ясно, что теория Бора является
лишь переходным этапом на пути создания
более общей и правильной теории. Такой
теорией и являлась квантовая (волновая)
механика.
86.
Дальнейшее развитиеквантовой механики
привело к отказу от
механической картины
движения электрона в
поле ядра.
87.
х1.4. Опыт Франка и Герца.
Существование дискретных энергетических
уровней атома и доказательство правильности
теории Бора подтверждается опытом Франка и
Герца.
Немецкие ученые Джеймс Франк и Густав
Герц, за экспериментальные исследования
дискретности энергетического уровня получили
Нобелевскую премию в 1925 г.
88.
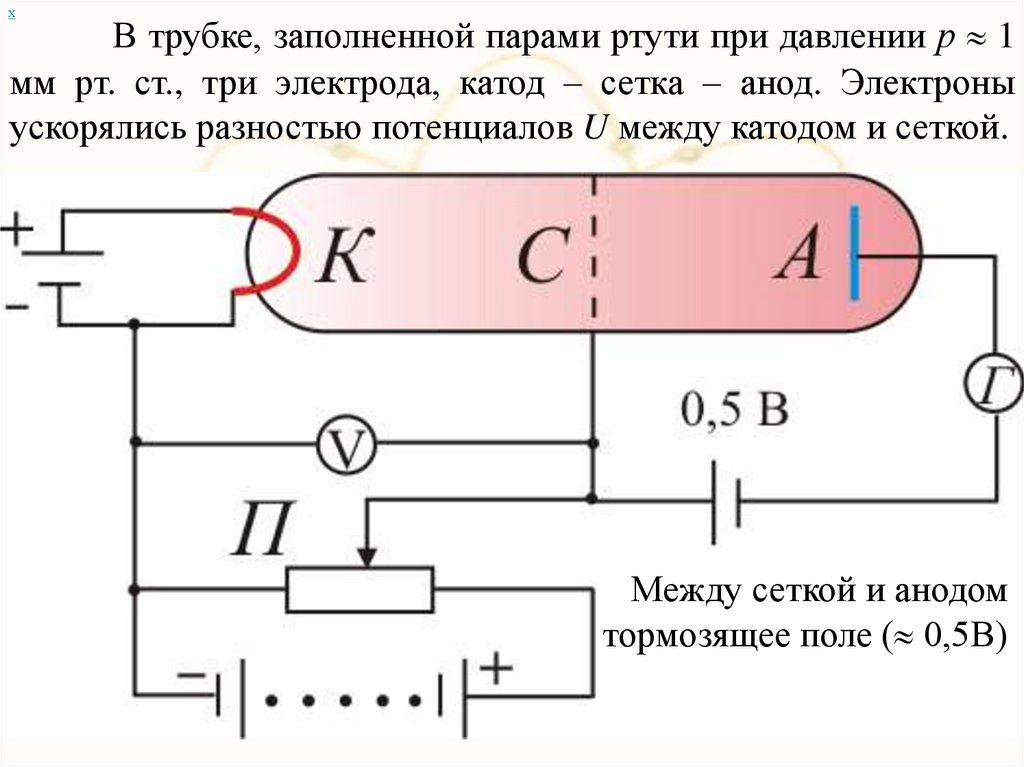
хВ трубке, заполненной парами ртути при давлении р 1
мм рт. ст., три электрода, катод – сетка – анод. Электроны
ускорялись разностью потенциалов U между катодом и сеткой.
Между сеткой и анодом
тормозящее поле ( 0,5В)
89.
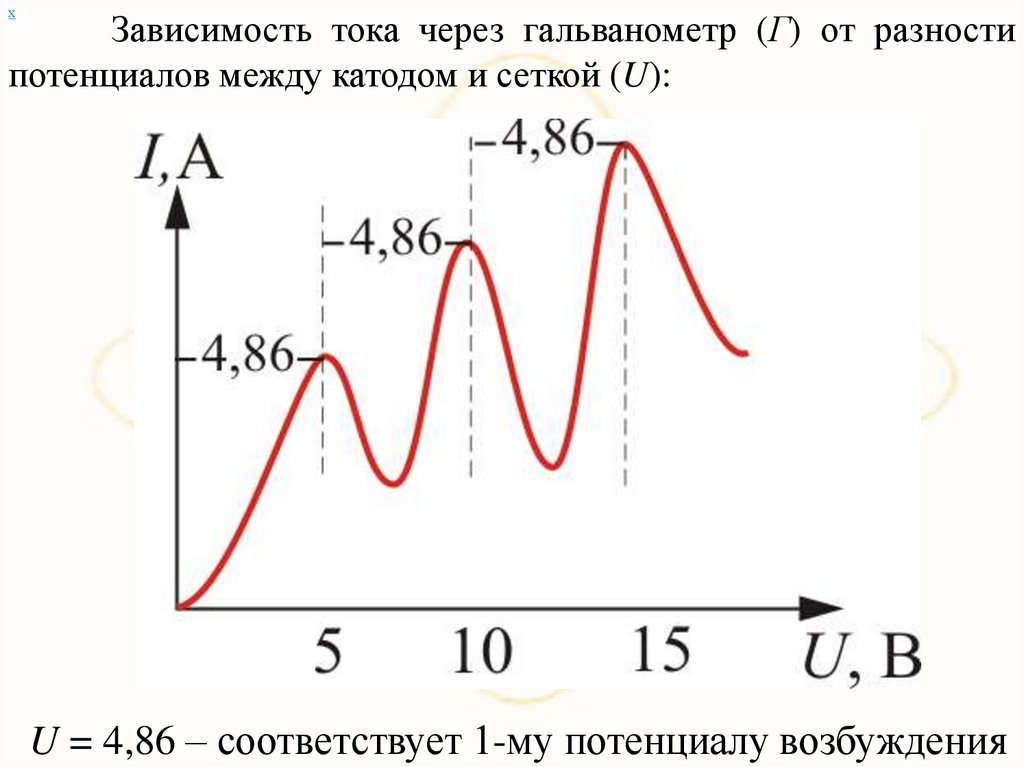
хЗависимость тока через гальванометр (Г) от разности
потенциалов между катодом и сеткой (U):
U = 4,86 – соответствует 1-му потенциалу возбуждения
90.
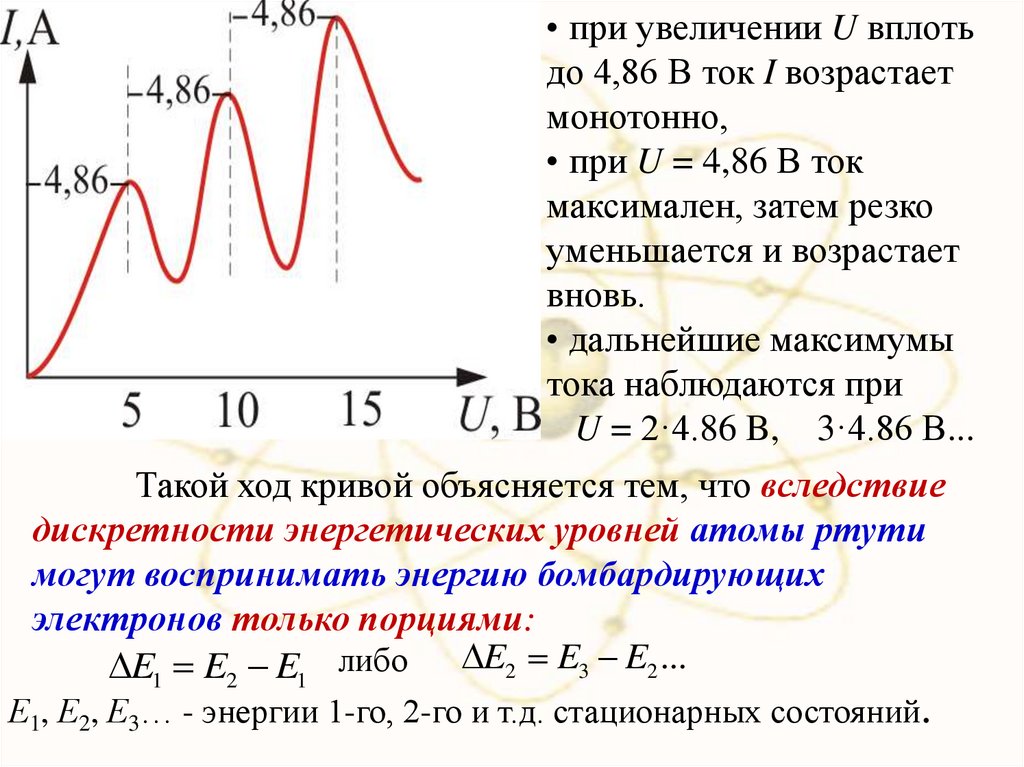
• при увеличении U вплотьдо 4,86 В ток I возрастает
монотонно,
• при U = 4,86 В ток
максимален, затем резко
уменьшается и возрастает
вновь.
• дальнейшие максимумы
тока наблюдаются при
U = 2·4.86 B, 3·4.86 B...
Такой ход кривой объясняется тем, что вследствие
дискретности энергетических уровней атомы ртути
могут воспринимать энергию бомбардирующих
электронов только порциями:
E1 E2 E1 либо E2 E3 E2 ...
Е1, Е2, Е3… - энергии 1-го, 2-го и т.д. стационарных состояний.
91.
При U < 4,86 В• энергия электронов меньше ΔЕ1;
• соударения между электронами и атомами ртути носят упругий
характер.
При U = 4,86 В
• энергия электрона становится достаточной, чтобы вызвать
неупругий удар, при котором электрон отдает атому ртути
энергию ΔЕ1 и продолжает двигаться с меньшей скоростью;
• число электронов, достигающих А, резко уменьшается и ток падает
• атом ртути переходит в возбужденное состояние.
При U, кратном 4,86 В
• электроны могут испытывать с атомами ртути 2, 3, … неупругих
соударения, теряя при этом полностью свою энергию.
• анодный ток каждый раз резко уменьшается.
92.
Атомы ртути, получившие при соударении сэлектронами энергию ΔЕ1 и перешедшие в возбужденное
состояние, спустя время ~ 10-8 с должны вернуться в
основное состояние, излучая, согласно второму
постулату Бора фотон с частотой (правило частот):
E1
h
При этом длина волны светового кванта:
λ hс / ΔE 255 нм -что соответствует
ультрафиолетовому
излучению.
Опыт действительно обнаруживает
ультрафиолетовую линию с λ 255 нм
93.
Таким образом, опыты Франка и Герцаэкспериментально подтвердили не только
первый, но и второй постулат Бора.
Эти опыты сыграли огромное значение в
развитии атомной физики.

































































 physics
physics








