Similar presentations:
Модели атома. Атом Резерфорда - Бора
1.
Модели атома2.
Демокрит (древнегреческий ученый)введено понятие атомаДуша тоже состоит из атомов
3.
Начало ХХ века1833 год Фарадеем был определен
заряд электрона
1869 система элементов Менделеева
1885 – спектр излучения атома –
линейчатый – формула Бальмера
1896- радиоактивность Беккерель
1897 – Томсон – удельный заряд
электрона
4.
Атомы имеют сложное строениеАтомы электрически нейтральны
Основная масса атома приходится на
его положительный заряд
5.
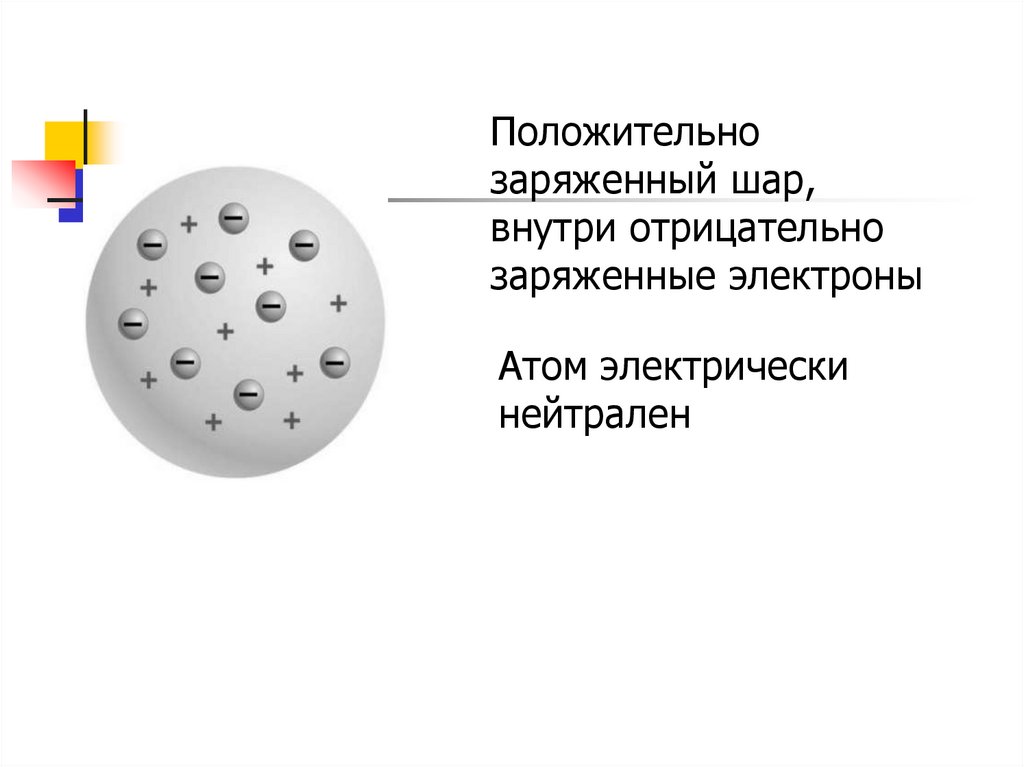
Модель атома Томсона6.
Положительнозаряженный шар,
внутри отрицательно
заряженные электроны
Атом электрически
нейтрален
7.
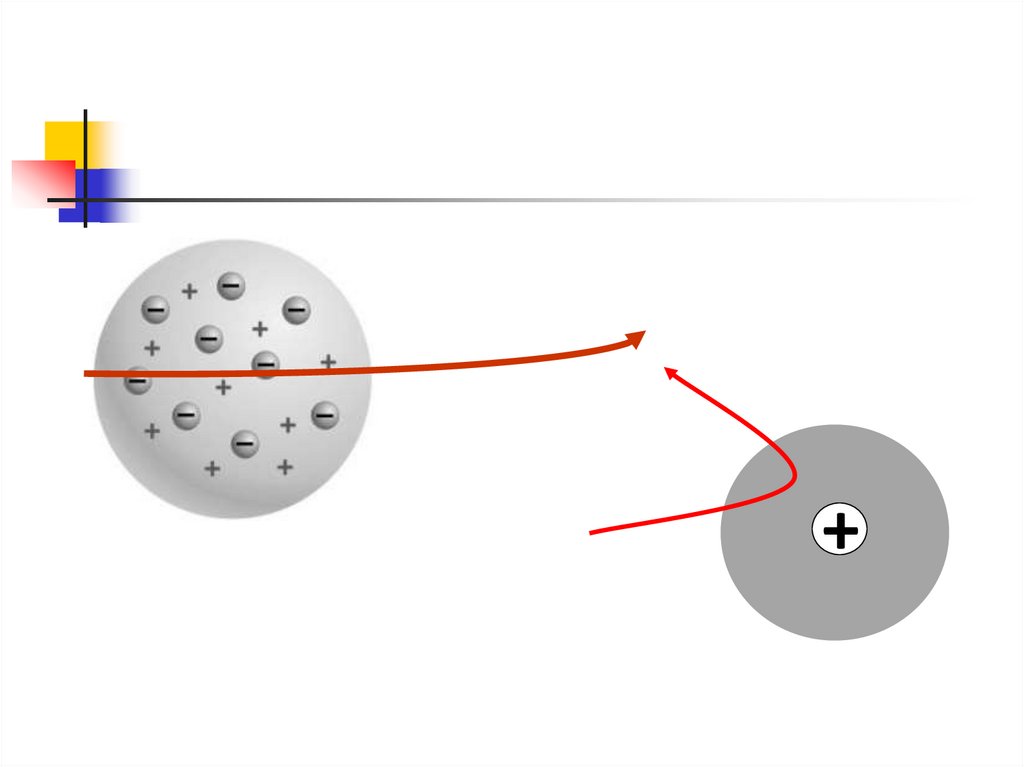
Атом Резерфорда Бора8.
Опыты по рассеяниючастиц на
тонких металлических пластинках
m 7300me
q 2 e
Рассеянные частицы попадали на
экран, покрытый сульфидом цинка
В месте попадания частицы- свечение
Обнаружены частицы сильно
отклоняющиеся от своего
первоначального направления
движения
9.
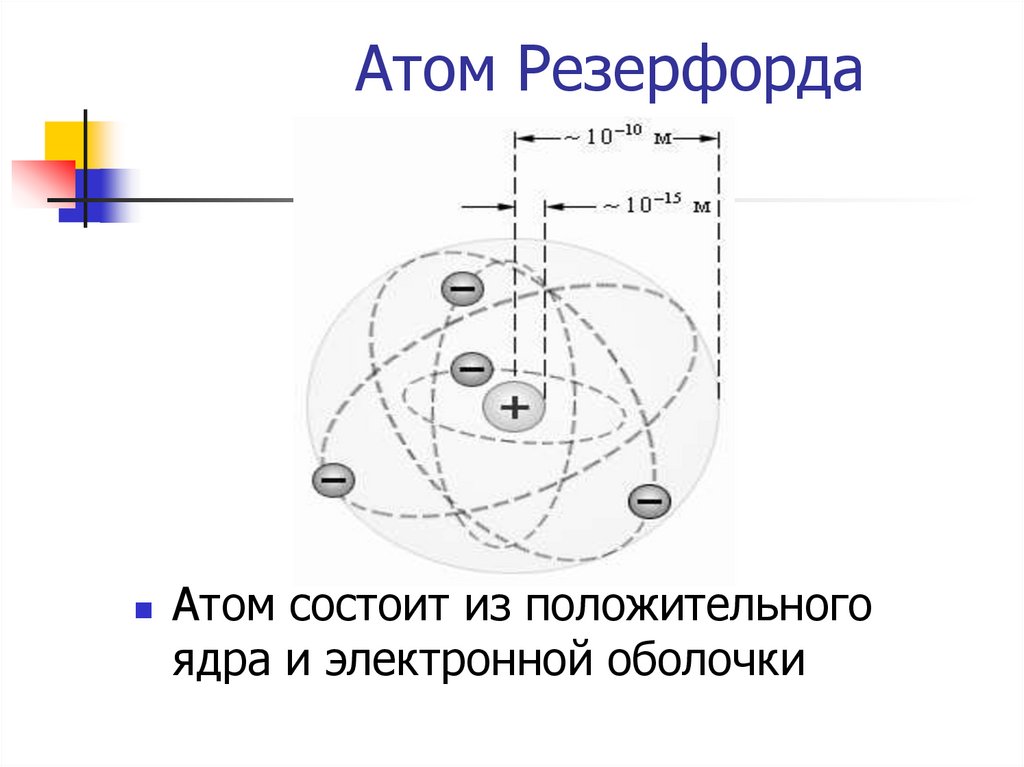
+10.
Атом РезерфордаАтом состоит из положительного
ядра и электронной оболочки
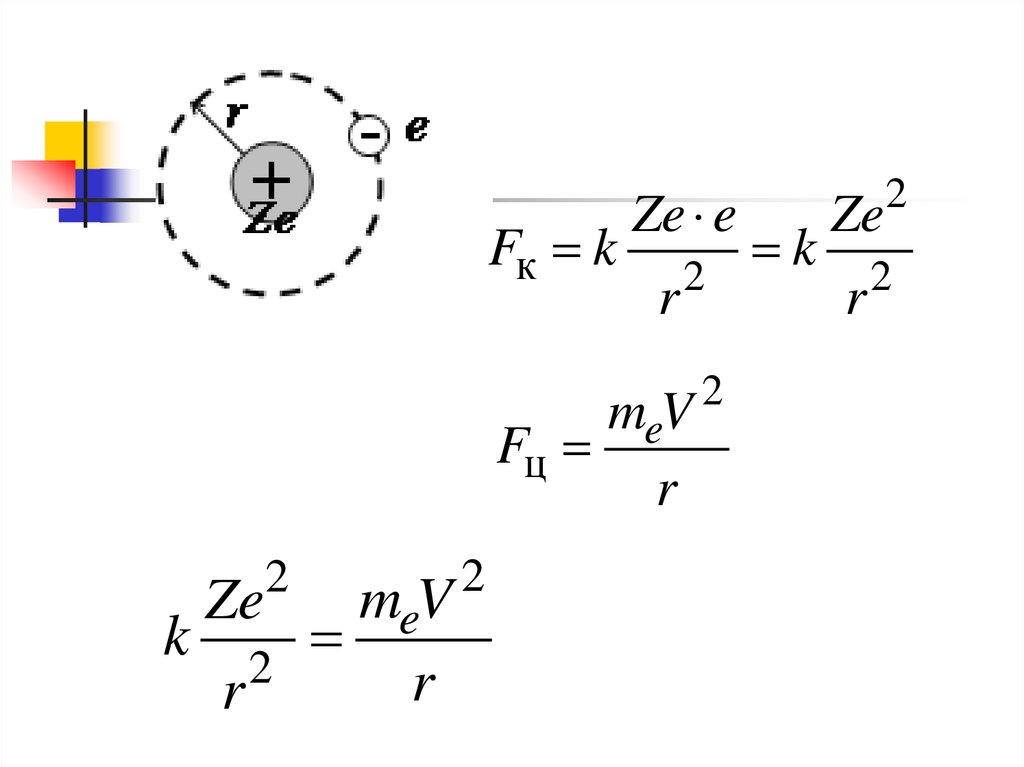
11.
Fк kZe e
r
2
meV
Fц
r
k
Ze
r
2
2
meV
r
2
2
k
Ze
r
2
2
12.
Противоречие с классическойэлектродинамикой
Электроны двигаются по круговым
орбитам
Радиус орбиты может быть любой –
спектр излучения – сплошной (экспер
линейчатый)
Должны излучать электромагнитные
волны
Происходит потеря энергии
Электрон должен упасть на ядро
13.
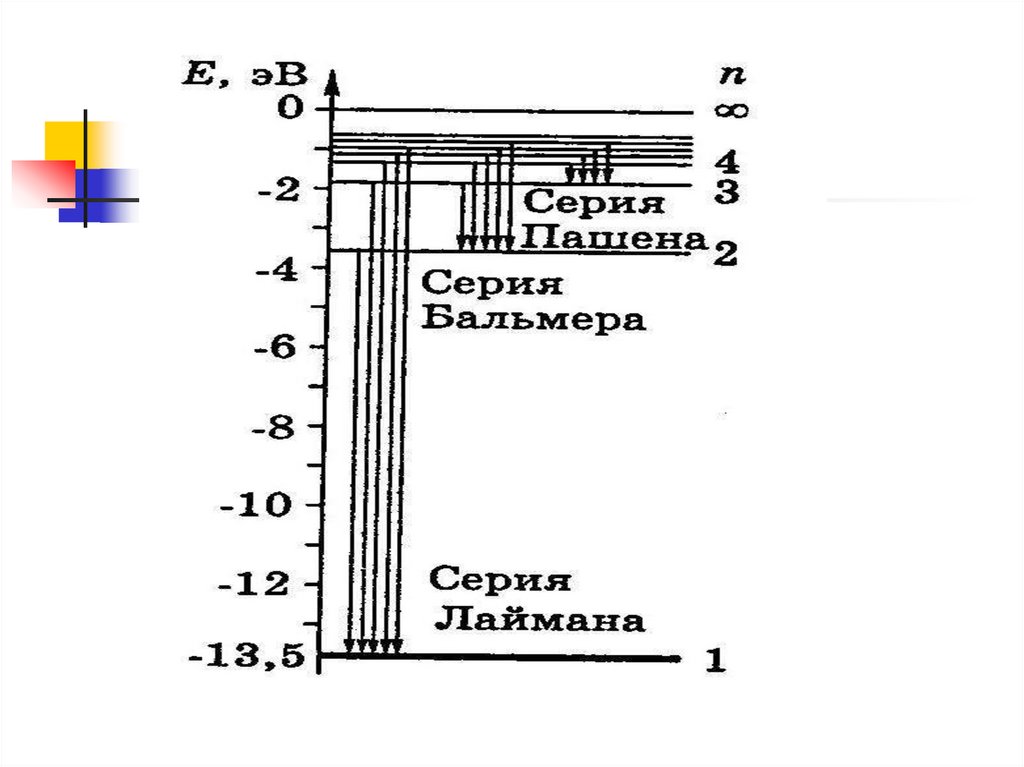
Спектральныезакономерности
Спектр отдельного атома – линейчатый
Спектральные линии образуют серии
Для атомарного водорода
1 1
R 2 2
2 n
, n 3,4...
Формула Бальмера (видимая часть спектра)
14.
частота, соответствующаякаждой спектральной линии
R 3,29 10
15
Постоянная Ридберга
c
-1
15.
1 1R 2 2
1 n
, n 2,3...
Серия Лаймана (ультрафиолетовая
часть спектра)
1 1
R 2 2
3 n
, n 4,5...
Серия Пашена (инфракрасная часть
спектра)
16.
1 1R 2 2
4 n
, n 5,6...
Серия Брекета
1 1
R 2 2
5 n
Серия Пфунда
, n 6,7...
17.
Постулаты БораВ атоме существуют стационарные
состояния, в которых он не излучает
энергии.
Эти состояния характеризуются
дискретными значениями энергии
При этом электроны двигаются по
стационарным орбитам
18.
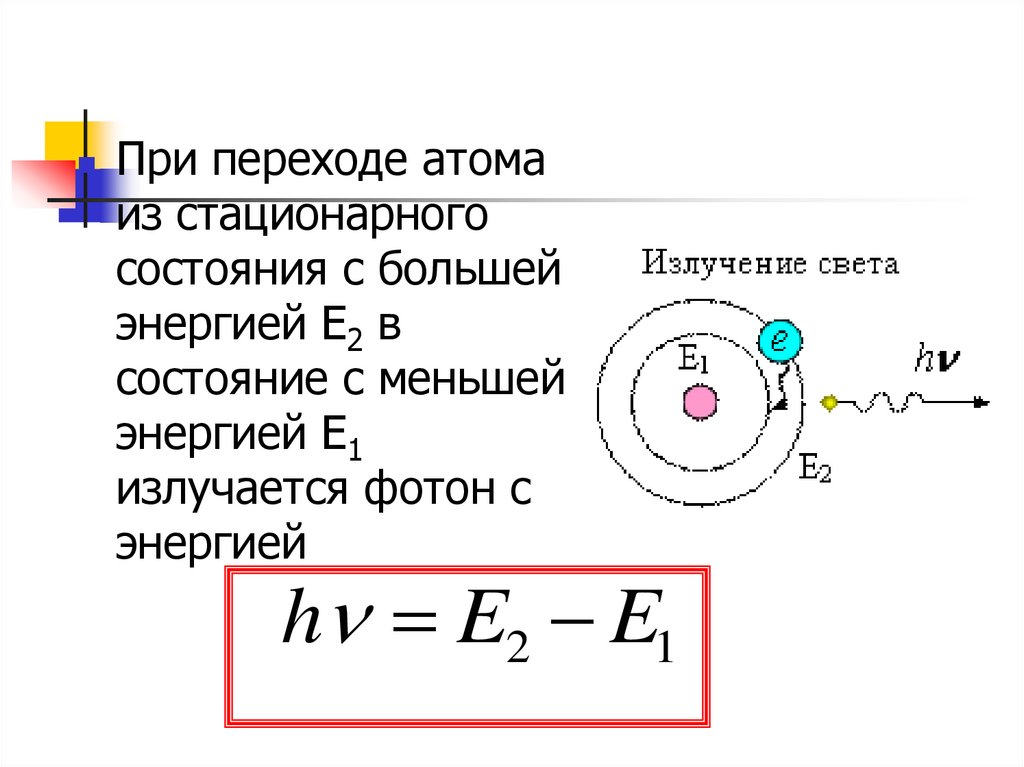
При переходе атомаиз стационарного
состояния с большей
энергией Е2 в
состояние с меньшей
энергией Е1
излучается фотон с
энергией
h E2 E1
19.
Боровская модель атомаводорода
,
,
На длине орбиты должно
укладываться целое число длин волн
электрона
2πrn nλ
h
meVrn n
n
2π
h
2πrn n
meV
20.
Электрон в атоме движется поорбитам , для которых момент
импульса может принимать значения
L n
(n 1,2,3...)
n - квантовые числа
34
1,054 10
Дж с
21.
Рассмотрим водородноподобные системы (Н, ион Не,
ион Li )
Заряд ядра (Z·e)
e – заряд электрона
2
2
V
Ze
me
2
r 4 0r
L meVr n
n
V
me r
22.
2n
Ze
me
rme 4 0 r
4 0
rn n
2
me Ze
n Ze
rme
4 0
2
2
2
2
2
4 0
r1 1
2
me Ze
2
2
528 10
10
м
23.
Энергия электрона настационарной орбите
E T U
meV
T
2
2
2
Ze
2r 4 0
2
Ze
U
4 0 r
2
E
Ze
8 0 r
24.
EnZe
2
8 0 rn
2
1 Z mee
En 2 2 2
n 8h 0
4
25.
n =1 – основное состояниеE1 13,53
эВ
-энергия связи электрона –
необходимо сообщить электрону,
чтобы удалить его из атома
26.
При переходе атома из одногосостояния в другое излучается
энергия
En Em h
1 Z mee
1 Z mee
2
2
2 2
2 2
n 8h 0
m 8h 0
2
2
4
4
1 Z mee
1
1
1
2 2
2 2 Rh 2
2
m
n
n m 8h 0
2
4
27.
11
R 2 2
n
m
- частота излучения при переходе с
орбиты с номером n на орбиту с
номером m
4
15 1
e
3
0
- постоянная Ридберга
me
R
3,29 10 c
8h
28.
29.
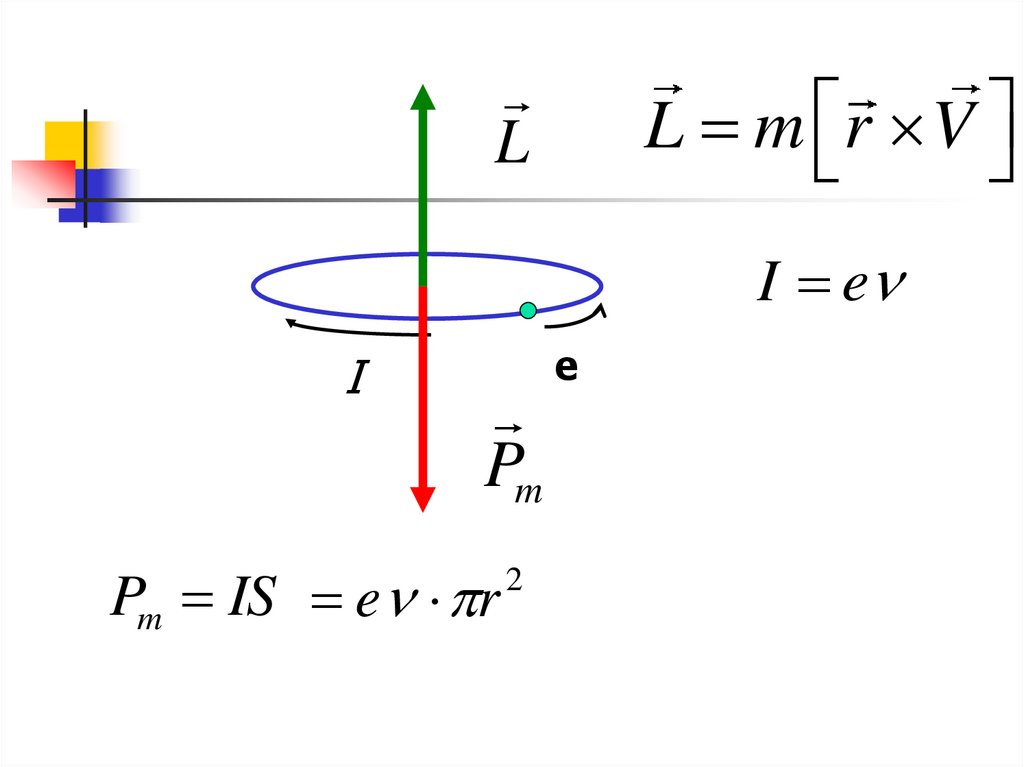
Магнитный момент атомаводорода
Пусть электрон движется со
скоростью V по орбите радиуса r
Образуется круговой ток
I e
30.
LL m r V
I e
I
Pm
Pm IS e r
2
e
31.
1V
T 2 r
V
2
Pm e
r
2 r
Pm eVr 1
L
2 mVr
L mVr
e
B
2m
магнетон Бора
32.
ЭЛЕМЕНТЫ КВАНТОВОЙМЕХАНИКИ
33.
Корпускулярно-волновойдуализм
С каждым объектом связаны
корпускулярные характеристики(E ,P)
и волновые (λ,ω)
E h
h
P k
34.
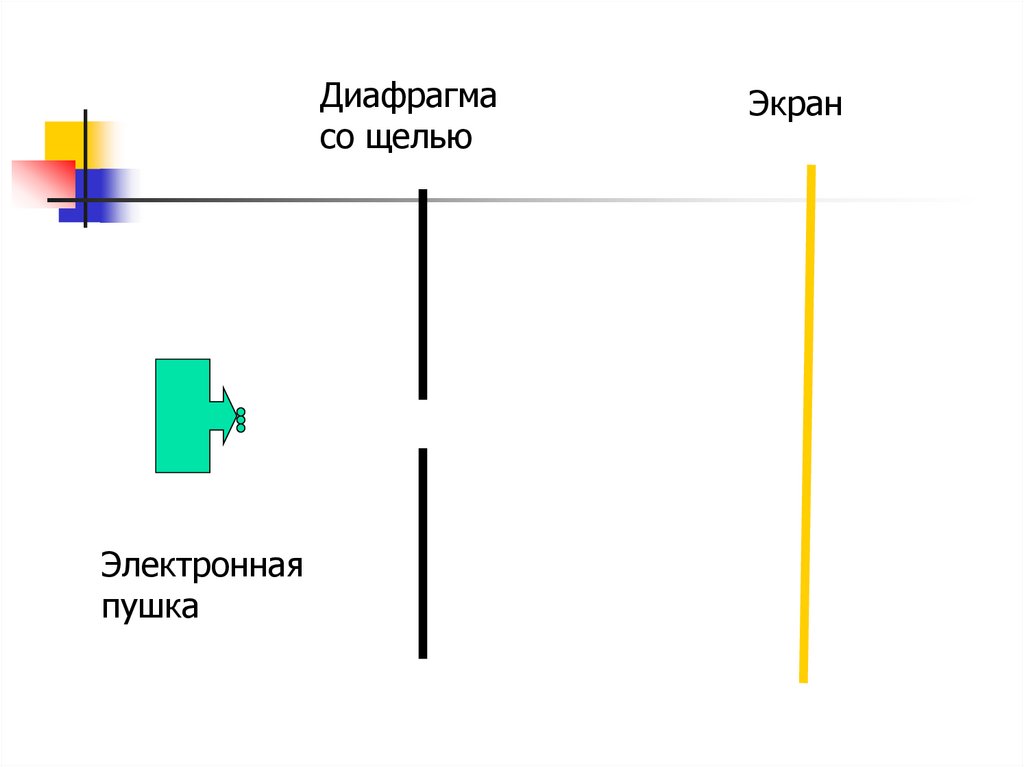
Опыт ФабрикантаЭлектронная пушка стреляет по
одному электрону, а на экране
наблюдается дифракционная картина
35.
Диафрагмасо щелью
Электронная
пушка
Экран
36.
Дифракционная картина37.
ПримерДлина волны человека
m 60кг
V 1 м / с
34
h
6,63 10
33
1,1 10 м
P
60 1




























 physics
physics








