Similar presentations:
Молекулярная физика и термодинамика
1.
Молекулярная физика итермодинамика
2.
Основные понятия3.
Моль• Количество вещества, в
котором содержится число
Авогадро молекул
4.
Молярная масса• Масса одного моля вещества
(в таблице Менделеева
указана в граммах )
5.
Количество вещества (число молей)6.
Плотность вещества7.
Концентрация молекул8.
Основные формулы9.
• Число независимых друг отдруга движений тела
(независимых координат),
называется числом его
степеней свободы
10.
Число степеней свободы молекул• У одноатомного газа i = 3
• У двухатомного газа при не
слишком высокой температуре i = 5
• У двухатомного газа при высокой
температуре i = 7
11.
• Энергия равномернораспределяется между всеми
степенями свободы
12.
• Среднюю энергию любоймолекулы можно записать в виде
где i – число степеней свободы
молекулы.
13.
Физический смысл температуры• абсолютная температура Т –
это мера средней
кинетической энергии молекул
14.
Средняя кинетическая энергияпоступательного движения одной
молекулы одноатомного газа
15.
Основное уравнение МКТ16.
Уравнение Менделеева Клапейрона17.
Постоянная Больцмана18.
Изопроцессы19.
Изопроцессы• Процессы могут протекать так, что
изменяются все три параметра
состояния, но могут протекать и так,
что изменяются только два
параметра, а третий остается
постоянным. Такие процессы
называются ИЗОПРОЦЕССАМИ.
20.
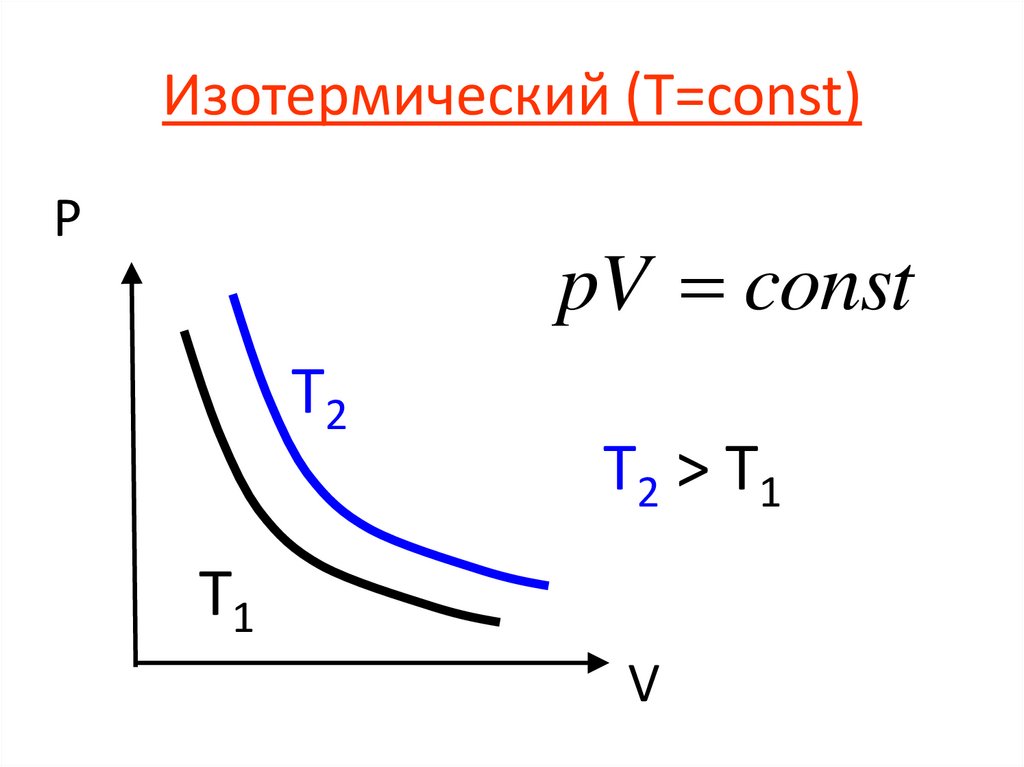
Изотермический (Т=const)P
pV const
T2
T2 > T1
T1
V
21.
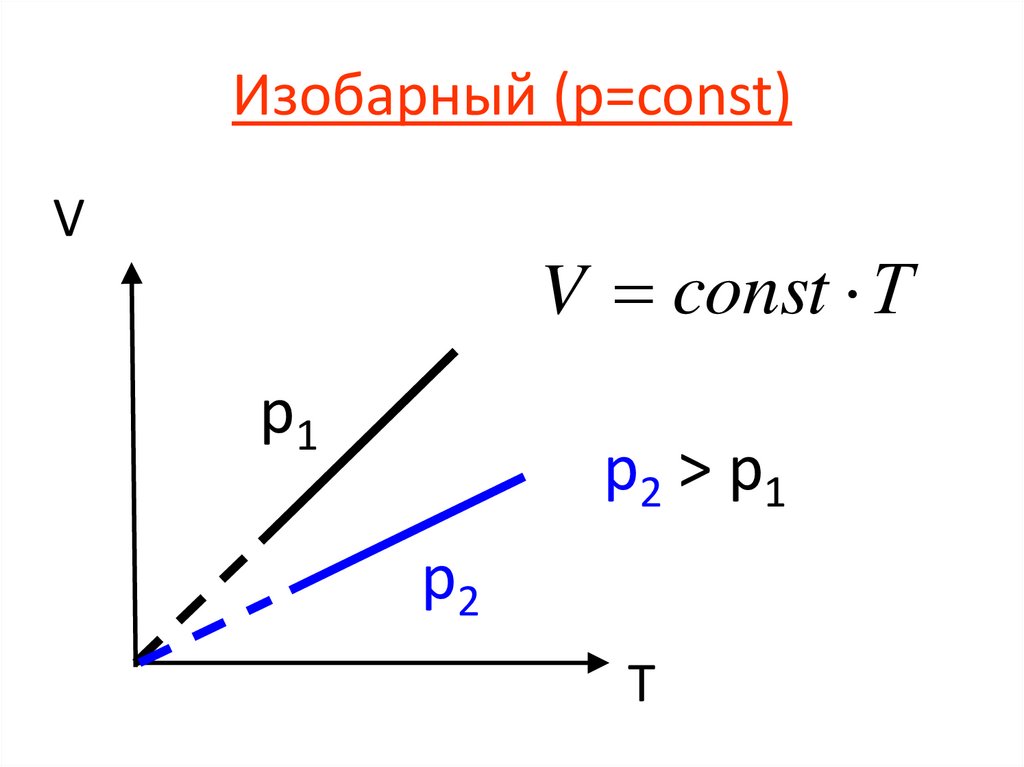
Изобарный (р=const)V
V const Т
p1
p2 > p 1
p2
T
22.
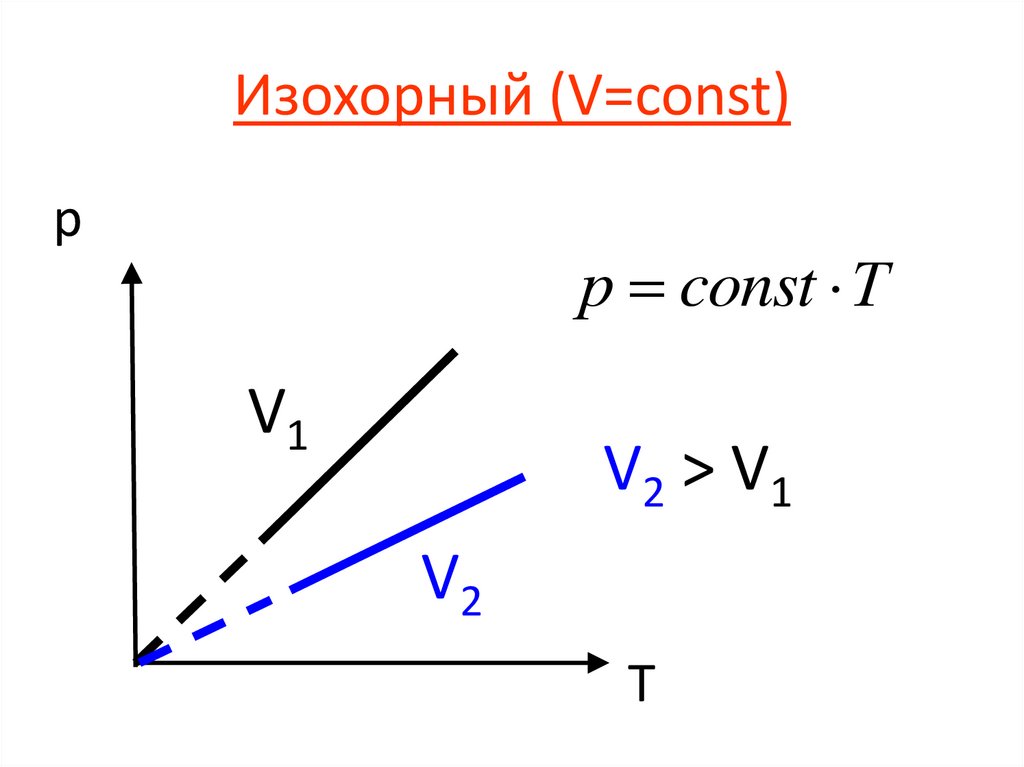
Изохорный (V=const)p
р const Т
V1
V2 > V 1
V2
T
23.
РаспределениеБольцмана
24.
Людвиг Больцман25.
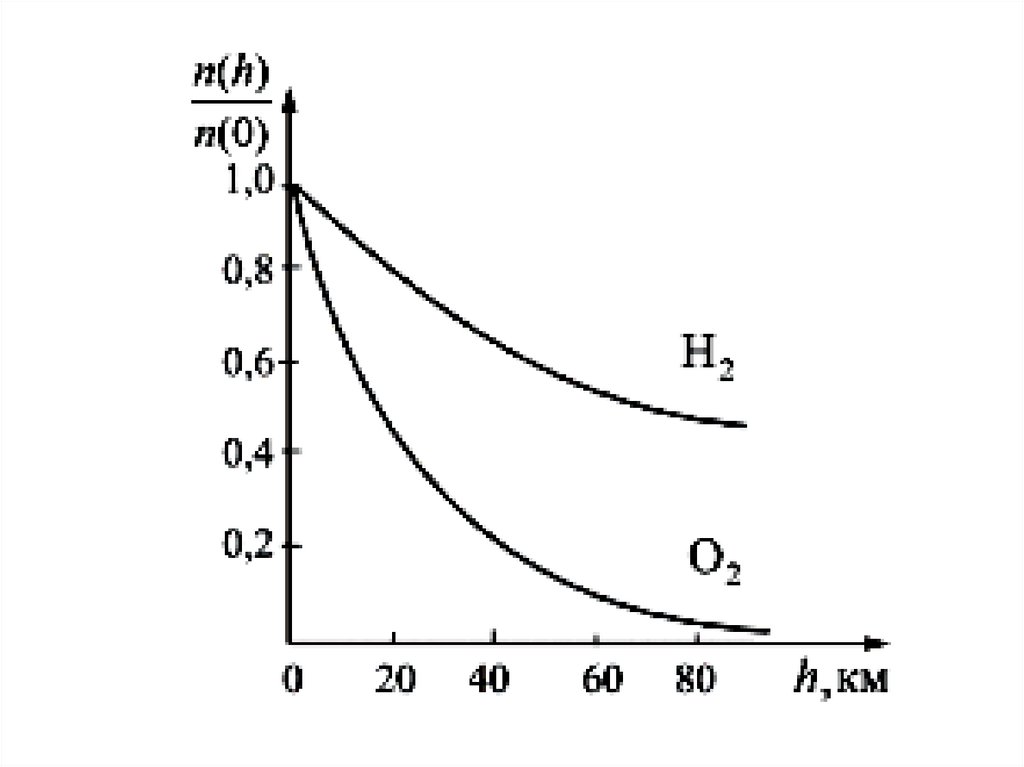
Распределение концентрациимолекул в зависимости от высоты
Концентрация молекул газа уменьшается с увеличением
высоты над поверхностью Земли. Например, в горах
концентрация кислорода меньше, чем на равнине
26.
27.
Барометрическая формулаЗависимость давления газа от высоты над
поверхностью земли. Например, давление
воздуха в горах меньше, чем на равнине.
28.
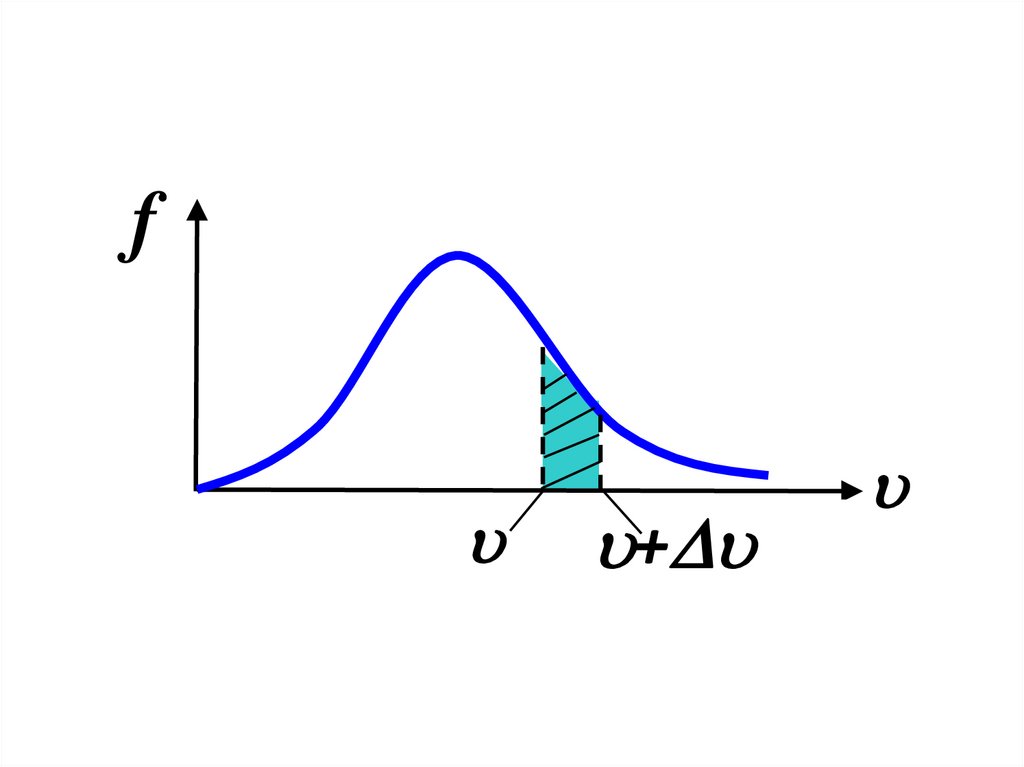
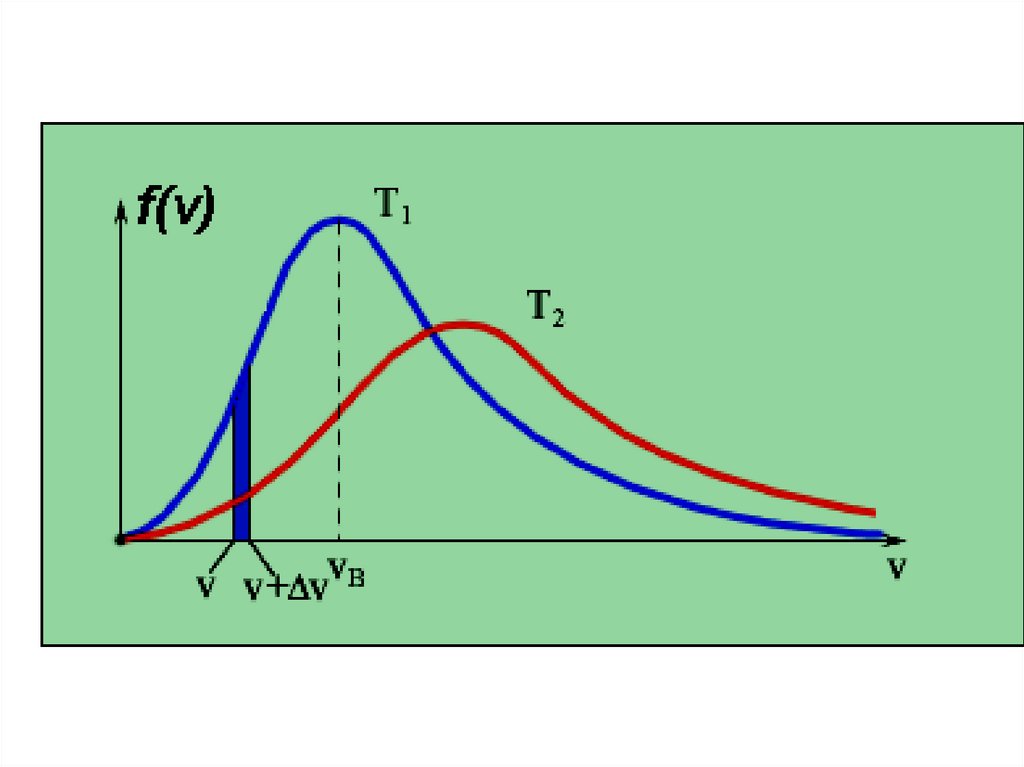
РаспределениеМаксвелла
29.
f+
30.
Доля молекул, имеющих скорости вданном интервале
31.
Распределение Максвелла32.
33.
Наиболее вероятная скорость34.
Средняя скорость35.
Средняя квадратичная скорость36.
Принцип детального равновесия.• Максвелловское распределение
стационарно, несмотря на то, что в
результате столкновений молекулы все
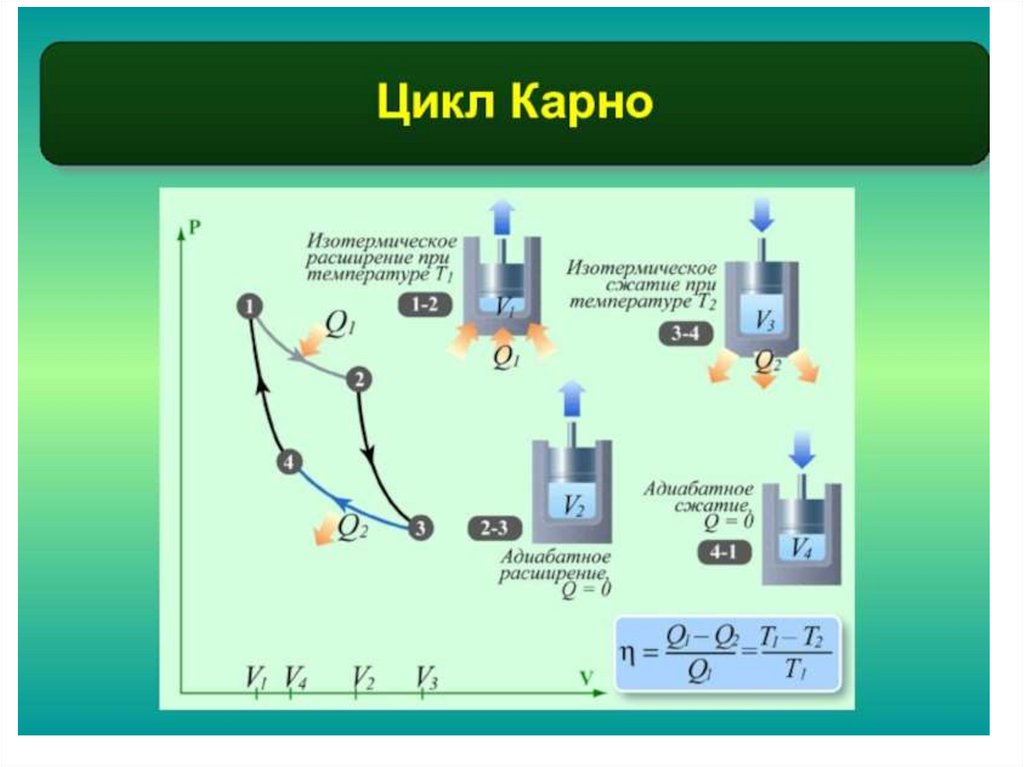
время меняют скорость. Но при этом
между любыми двумя интервалами
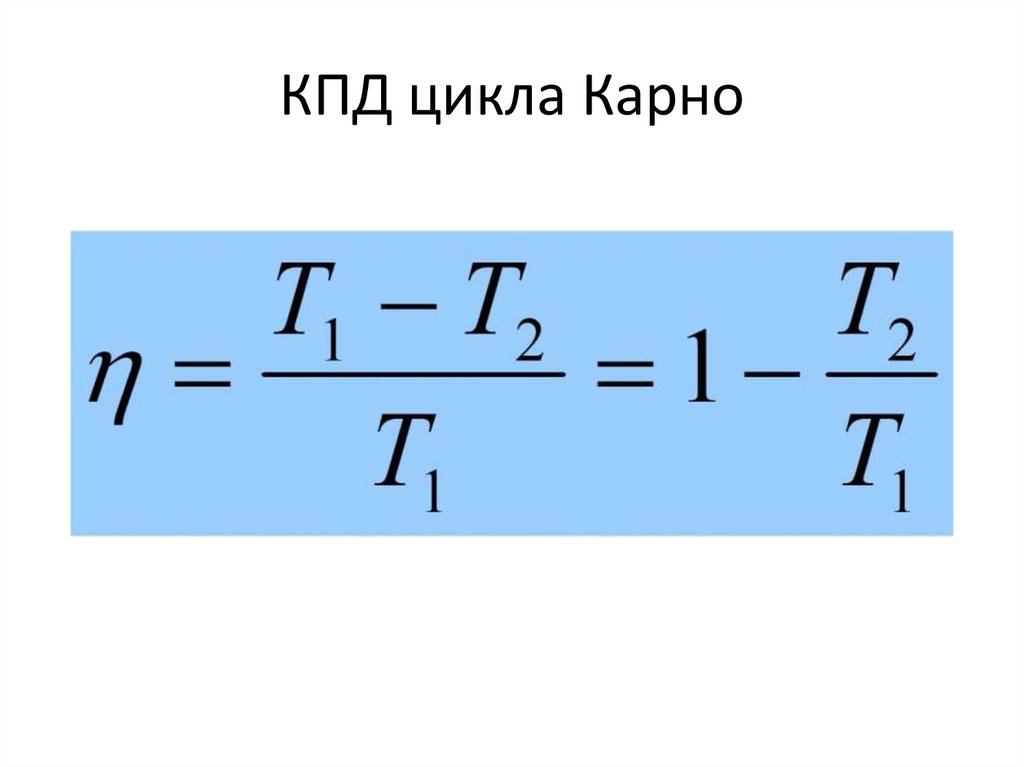
скоростей устанавливается равновесие,
в результате которого число убывающих
и приходящих молекул одинаково.
37.
Термодинамический истатистический методы.
Термодинамические и
статистические закономерности
38.
Динамические закономерности• Движение каждой отдельной
молекулы описывается
законами классической
механики
39.
Статистический метод• Изучает поведение большого
числа частиц при помощи
теории вероятностей и
определенных моделей
изучаемых систем
40.
Термодинамический метод• изучает систему как целое, не
рассматривая внутреннее
строение тел и характер
движения отдельных молекул
41.
Термодинамическая система и еепараметры
42.
Термодинамическая система• Мысленно выделенная
макроскопическая система,
которую рассматривают
методами термодинамики,
называется
ТЕРМОДИНАМИЧЕСКОЙ
системой
43.
Внешняя средаВсе тела, которые не включены
в состав рассматриваемой
системы, называются
ВНЕШНИМИ телами или
ВНЕШНЕЙ СРЕДОЙ.
44.
Система открытая• Если может обмениваться
веществом с внешней средой. У
нее может меняться
химический состав и масса.
45.
Закрытая система• Система ЗАКРЫТАЯ, если не
может обмениваться
веществом с внешней средой.
Ее масса и химический состав
остаются постоянными
46.
Термодинамические параметры• Физические величины,
служащие для характеристики
состояния термодинамической
системы
47.
Равновесное состояние• Состояние термодинамической
системы РАВНОВЕСНОЕ, если при
постоянных внешних условиях
параметры термодинамической
системы не изменяются со
временем и в системе отсутствуют
потоки (вещества, энергии)
48.
Нулевое начало термодинамики• Замкнутая термодинамическая
система с течением времени
приходит в равновесное
состояние, при котором
температура всех частей
системы одинакова
49.
Термодинамический процесс• ТЕРМОДИНАМИЧЕСКИЙ
ПРОЦЕСС – переход системы из
одного состояния в другое.
50.
Равновесные процессы51.
• Если процесс идет достаточномедленно, то значения параметров
состояния во всем объеме можно
считать одинаковыми. Эти процессы
называют РАВНОВЕСНЫМИ или
ОБРАТИМЫМИ
52.
Внутренняя энергия. Теплота.Работа в термодинамике.
53.
Внутренняя энергия• ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕЛА –
сумма кинетической энергии
движения молекул и
потенциальной энергии их
взаимодействия.
54.
Работа• Количество энергии, переданной
телу механическим путем,
измеряется величиной
произведенной над телом работы.
При совершении работы
происходит изменение
макроскопических параметров
системы (в частности, объема).
55.
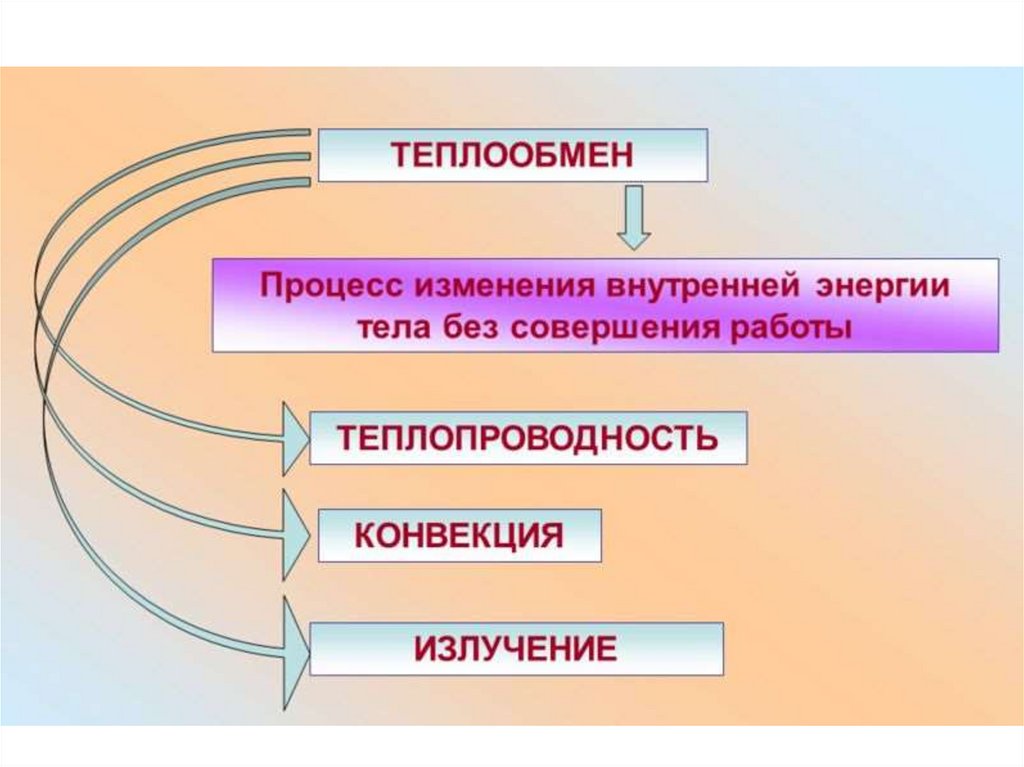
Теплообмен• Энергия может передаваться со
стороны среды путем случайных
импульсов, передаваемых то одной,
то другой молекуле. Это теплообмен.
Теплообмен совершается путем
изменения энергии движения
отдельных молекул, т.е.,
микроскопических параметров тела.
56.
Теплота• Количество энергии, переданной
при теплообмене, измеряется
количеством ТЕПЛОТЫ.
57.
58.
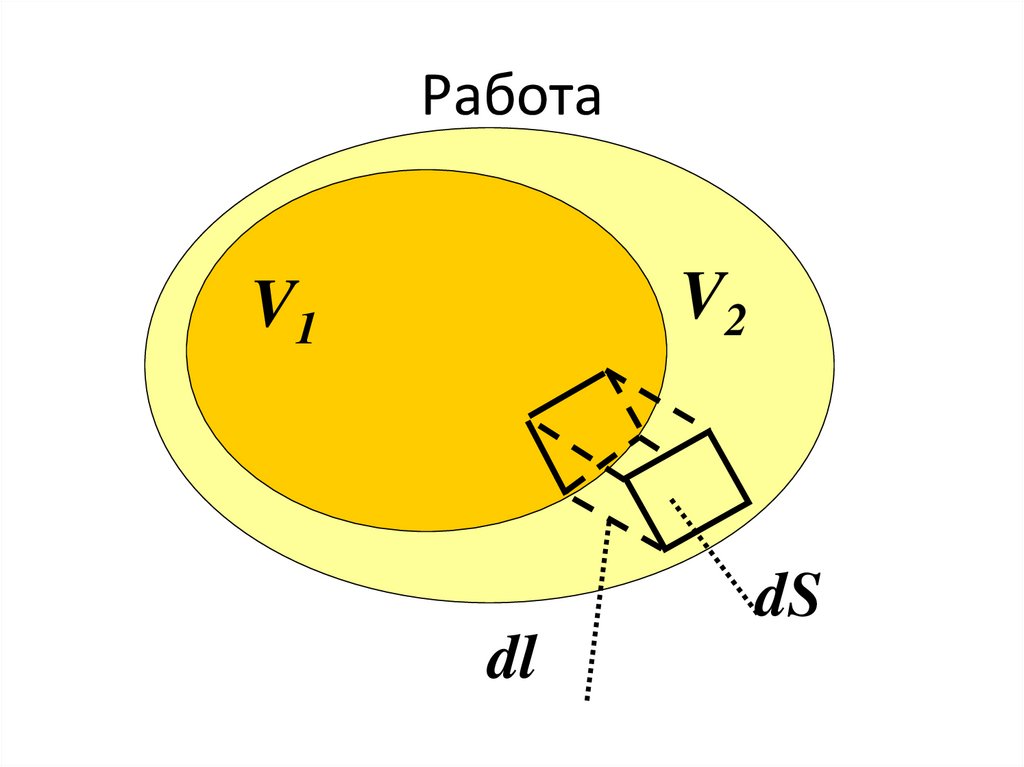
РаботаV2
V1
dS
dl
59.
Работа60.
Работа при постоянном давлении61.
Внутренняя энергия• ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕЛА –
сумма кинетической энергии
движения молекул и
потенциальной энергии их
взаимодействия.
62.
Внутренняя энергия газа63.
Внутренняя энергия64.
Первое началотермодинамики
65.
• Подведенное телу теплоидет на изменение
внутренней энергии тела и
на совершение телом
работы
66.
Внутренняя энергия67.
Теплоемкость вещества.Применение первого начала
термодинамики к
изопроцессам
68.
Теплоемкость тела• физическая величина, численно равная
отношению теплоты Q, сообщаемой
телу, к изменению температуры dТ в
данном термодинамическом процессе
69.
Удельная теплоемкость• теплоемкость одного
килограмма вещества.
70.
Молярная теплоемкость• теплоемкость одного моля
вещества.
71.
Первое начало термодинамики72.
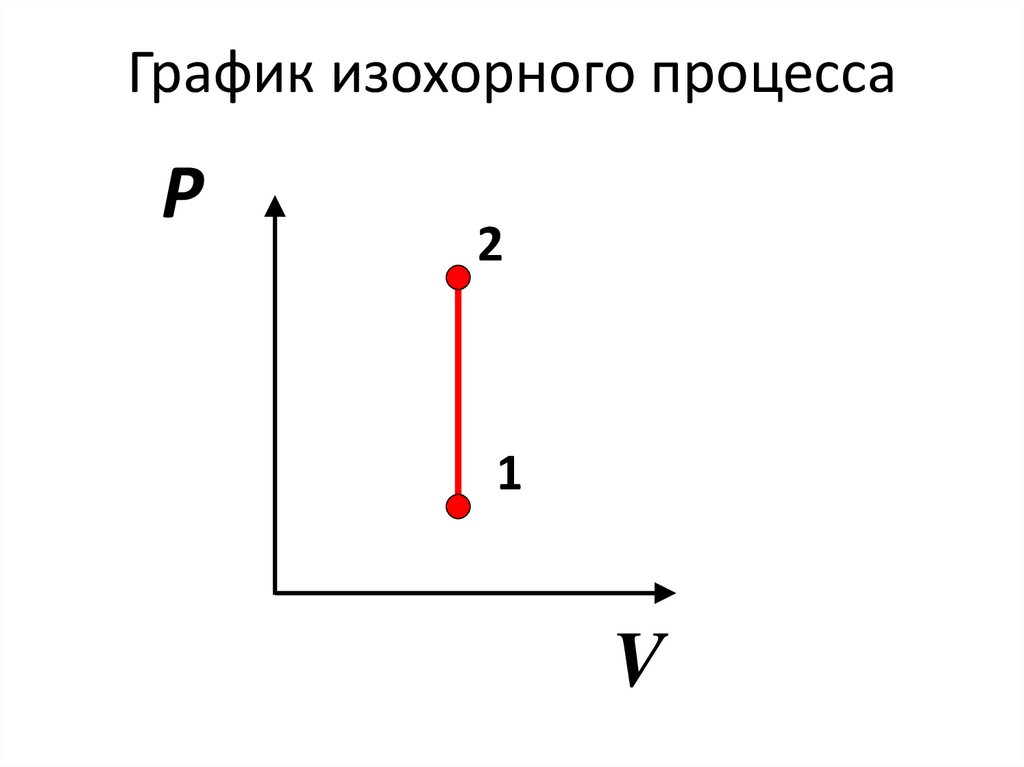
Изохорный процесс• процесс, происходящий при
неизменном объеме тела.
V=const.
73.
График изохорного процессаP
2
1
V
74.
Первое начало термодинамикидля изохорного процесса
Q=dU
75.
Первое начало термодинамикидля изохорного процесса
76.
Молярная теплоемкость приизохорном процессе
77.
Изменение внутренней энергии78.
Теплота79.
Изобарный процесс• Процесс, происходящий при
постоянном давлении
80.
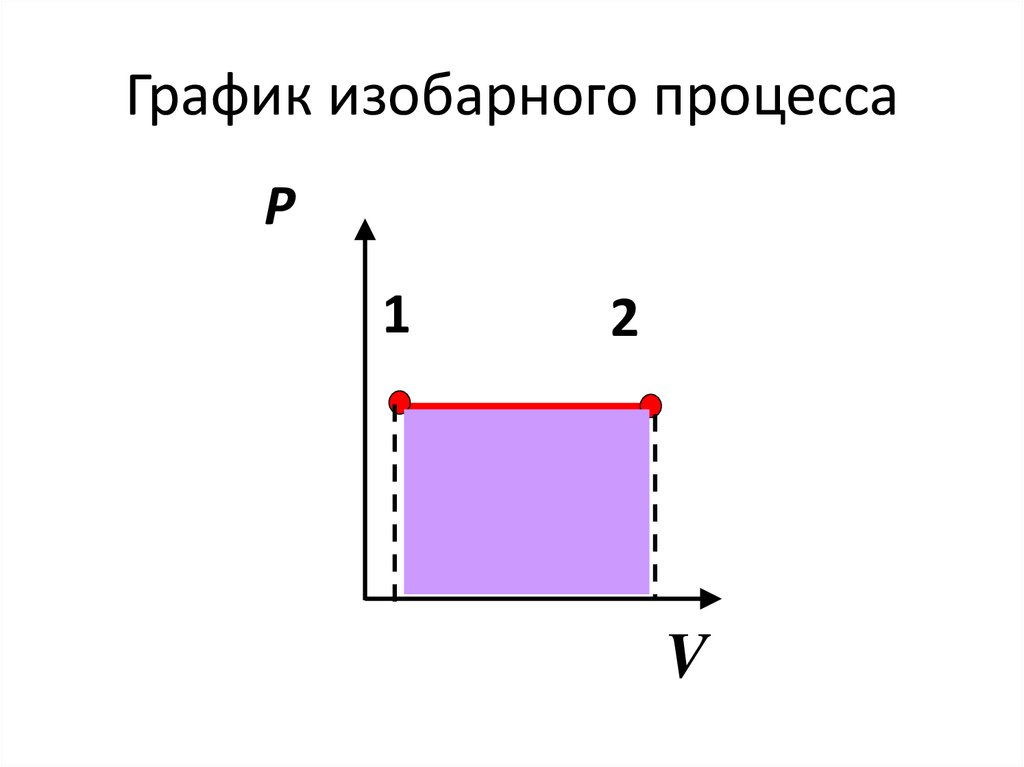
График изобарного процессаP
1
2
V
81.
Первое начало термодинамики• Отличны от нуля все три
слагаемых
82.
83.
84.
Молярная теплоемкость приизобарном процессе
85.
Уравнение Майера86.
Изотермический процесс• Теплообмен происходит при
постоянной температуре.
87.
Изотермический процесс88.
89.
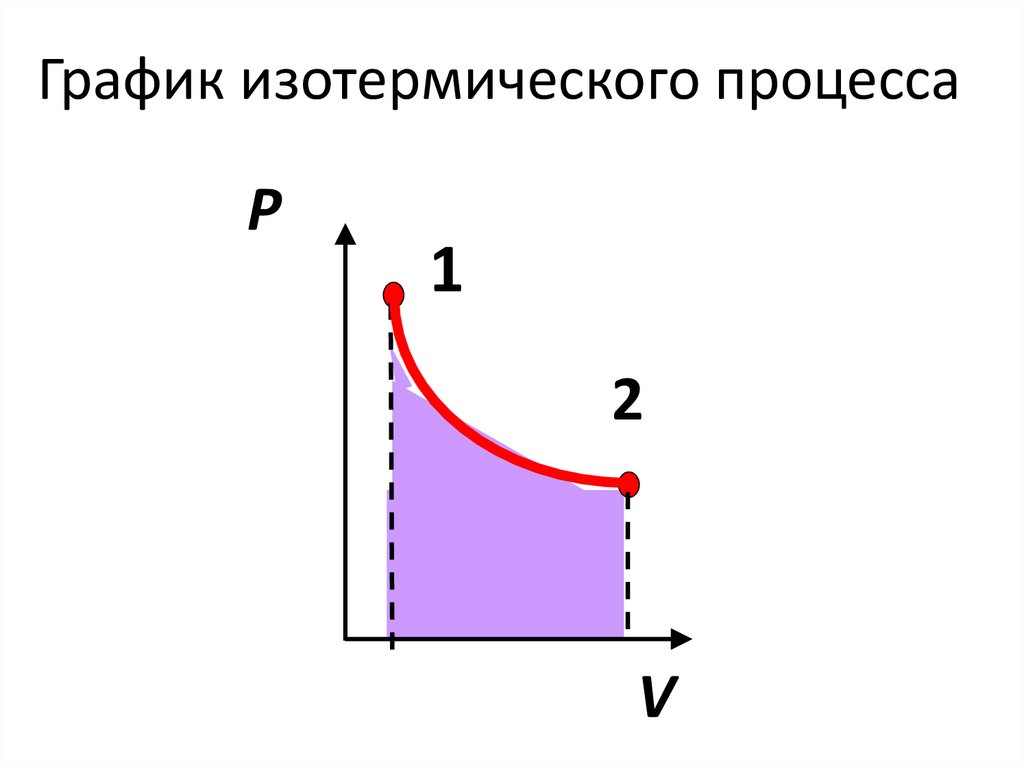
График изотермического процессаP
1
2
V
90.
Адиабатный процесс91.
Из первого начала термодинамики92.
Адиабатное расширение• При адиабатном расширении
температура уменьшается
93.
Джинн из кувшина94.
Теплоемкость при адиабатном процессе95.
Уравнение адиабаты (Пуассона)96.
Показатель адиабаты, коэффициентПуассона
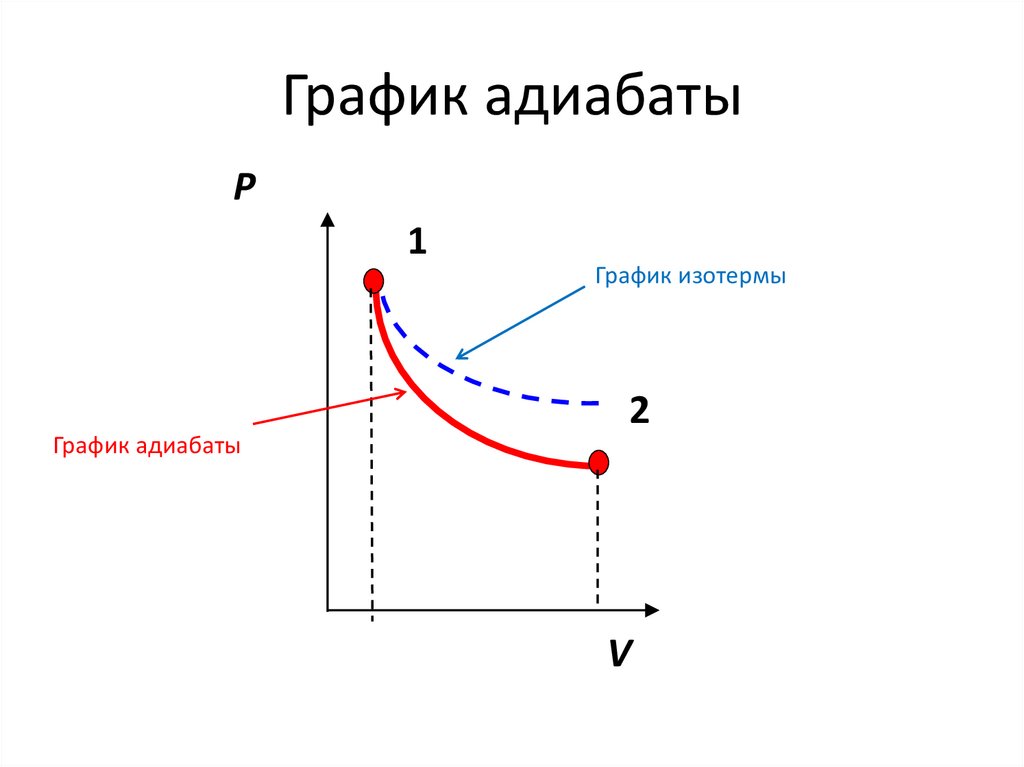
97.
График адиабатыP
1
График изотермы
2
График адиабаты
V
98.
Энтропия99.
ЭнтропияЭнтропия S – это отношение
полученной или отданной теплоты к
температуре, при которой происходил
этот процесс.
100.
Изменение энтропии в процессахидеального газа
101.
Изменение энтропии в изопроцессах:Изохорический
процесс:
т.к.
Изобарический
процесс:
т.к.
Изотермический
процесс:
т.к. Т1 = Т2
Адиабатический
процесс:
то
изоэнтропийный процесс
P1 = P2
102.
Круговые процессы(циклы)
103.
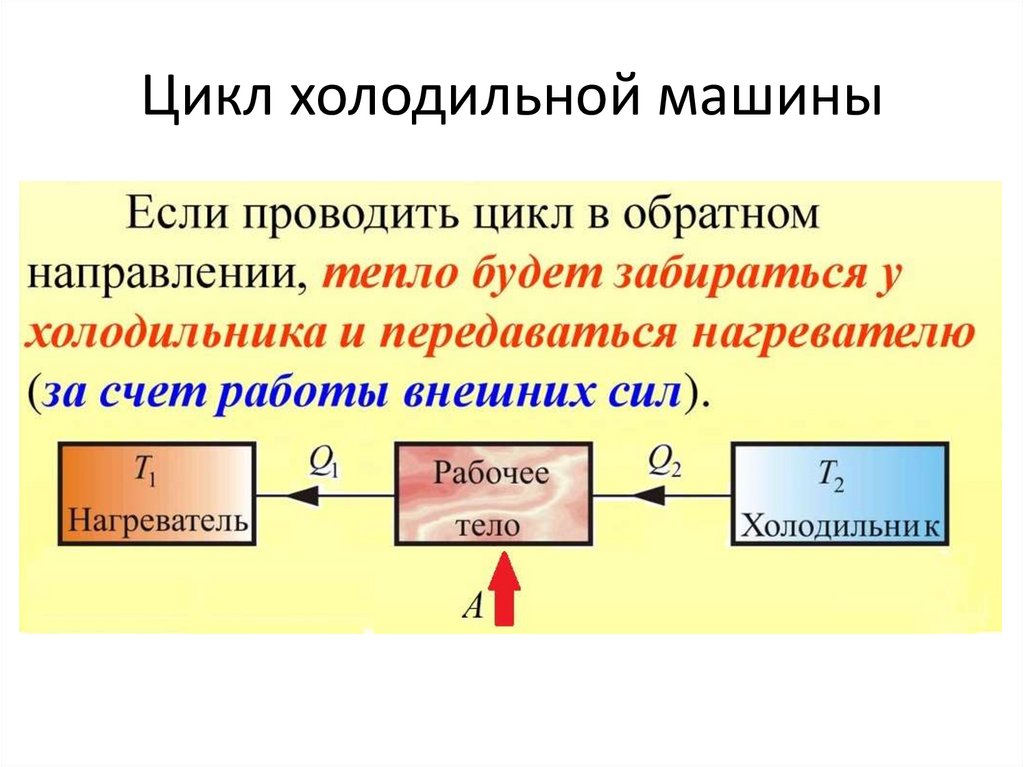
Цикл• Процесс в тепловой машине, при
котором совпадают начальные и
конечные параметры состояния
системы, называется ЦИКЛОМ
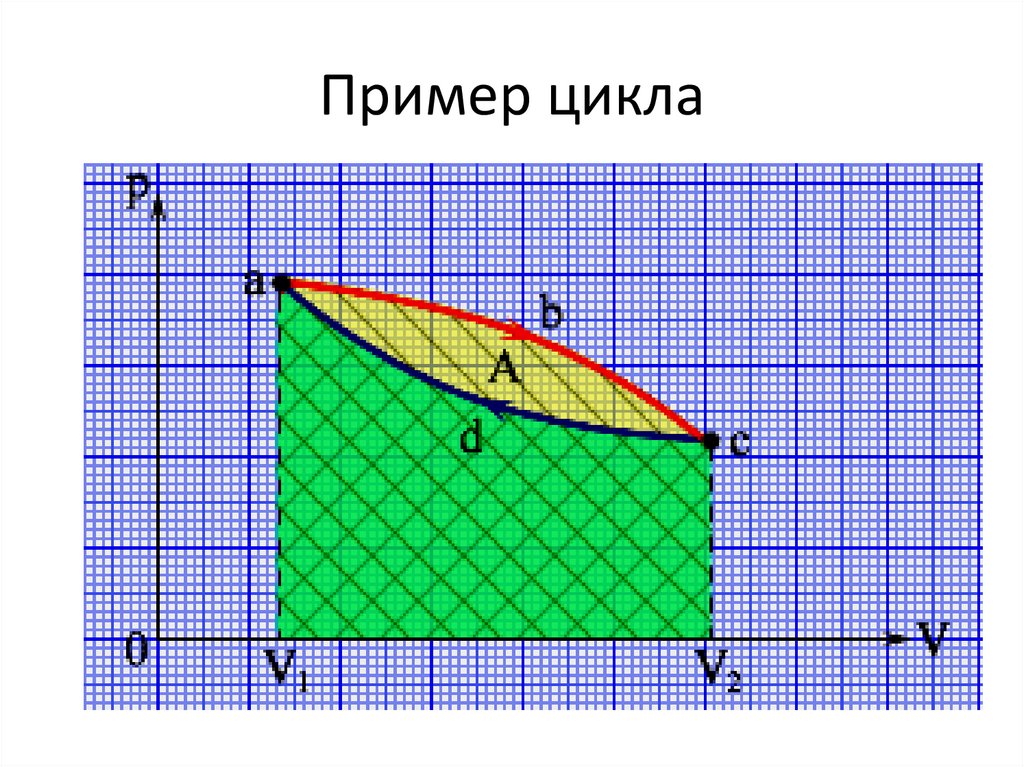
104.
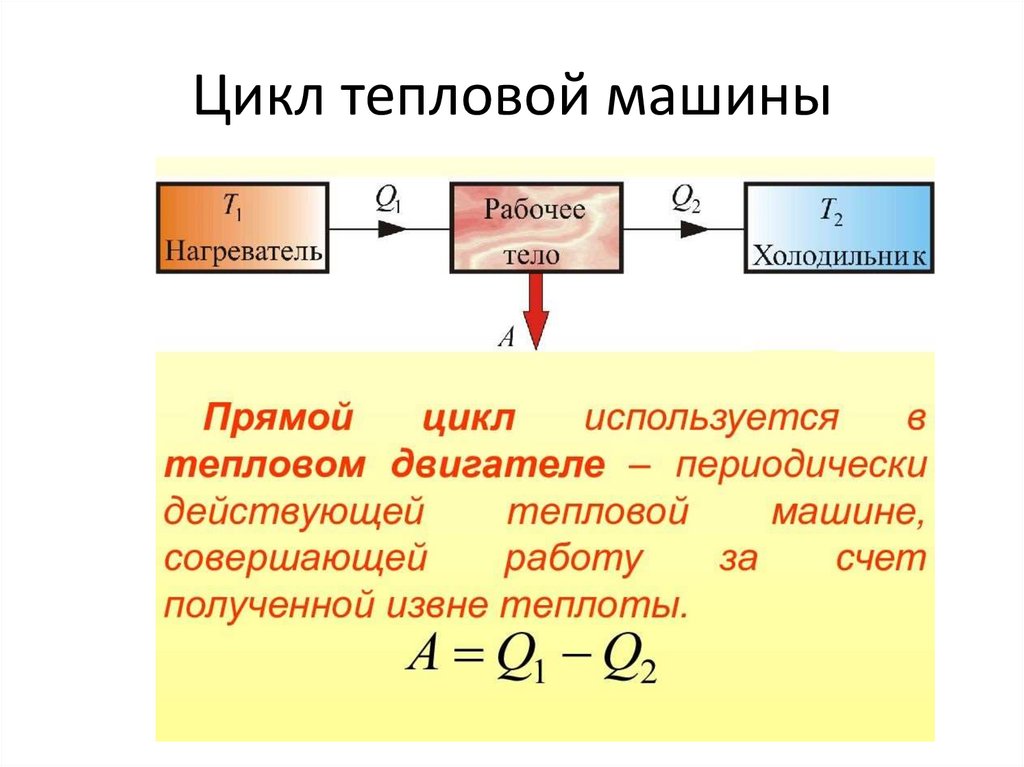
Пример цикла105.
Цикл тепловой машины106.
Цикл холодильной машины107.
КПД цикла108.
Второе начало термодинамики• Невозможна такая тепловая машина,
которая превращала бы в работу всю
полученную теплоту.
Невозможен периодический процесс,
единственным результатом которого было
бы превращение теплоты в работу.





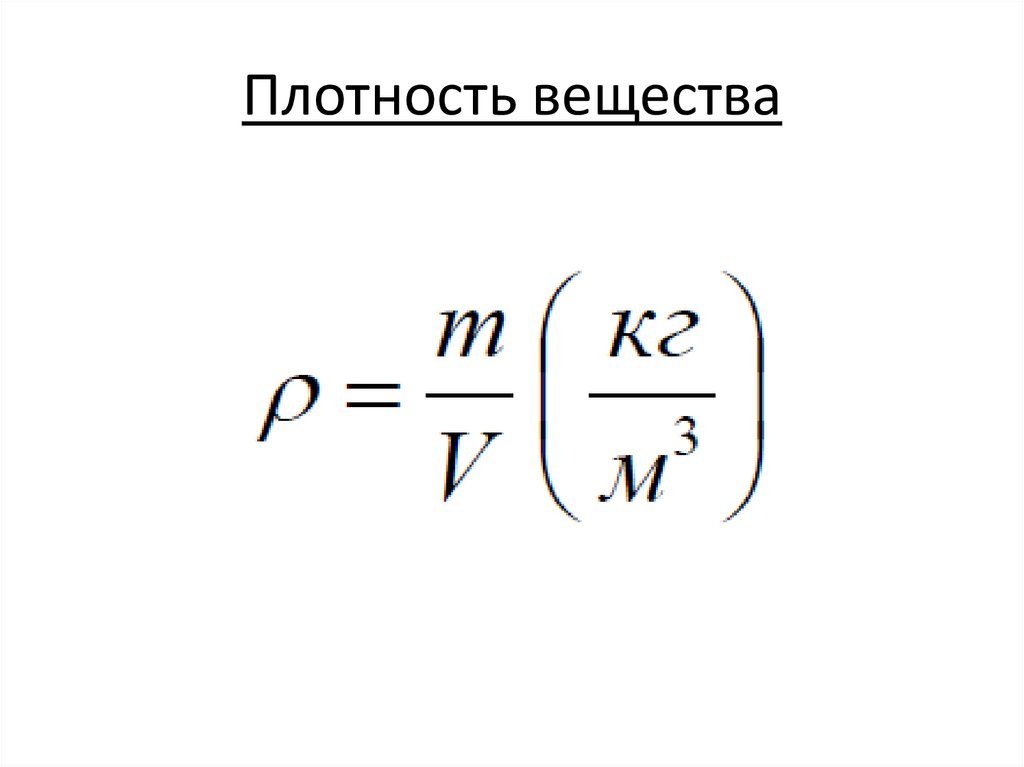








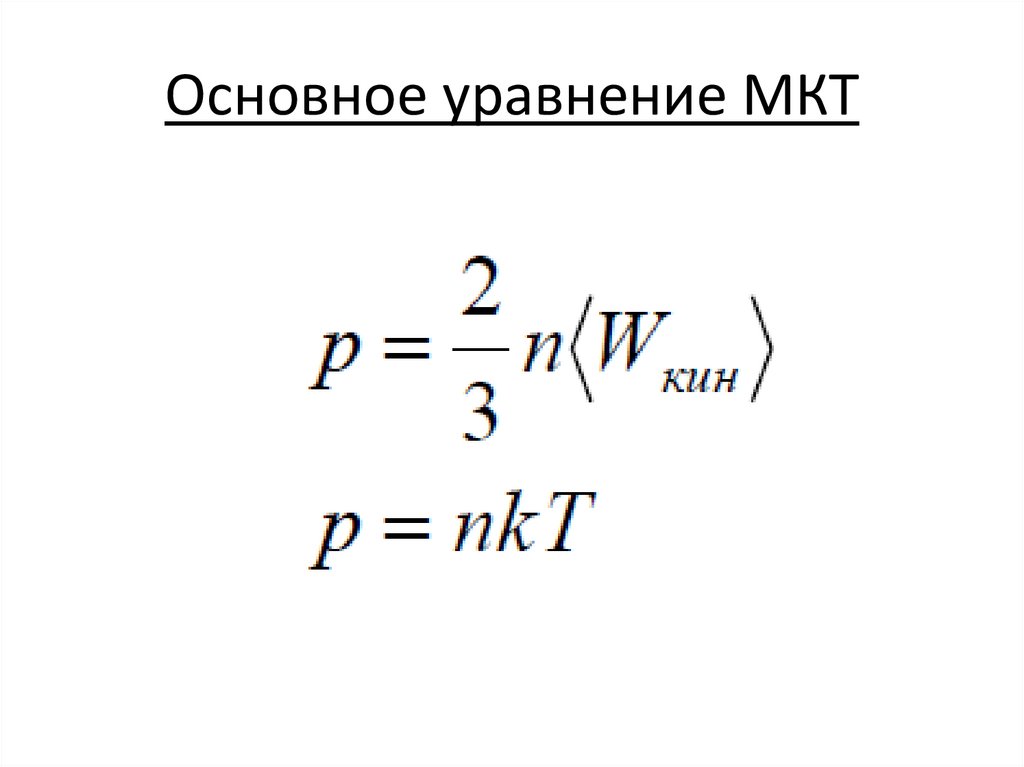









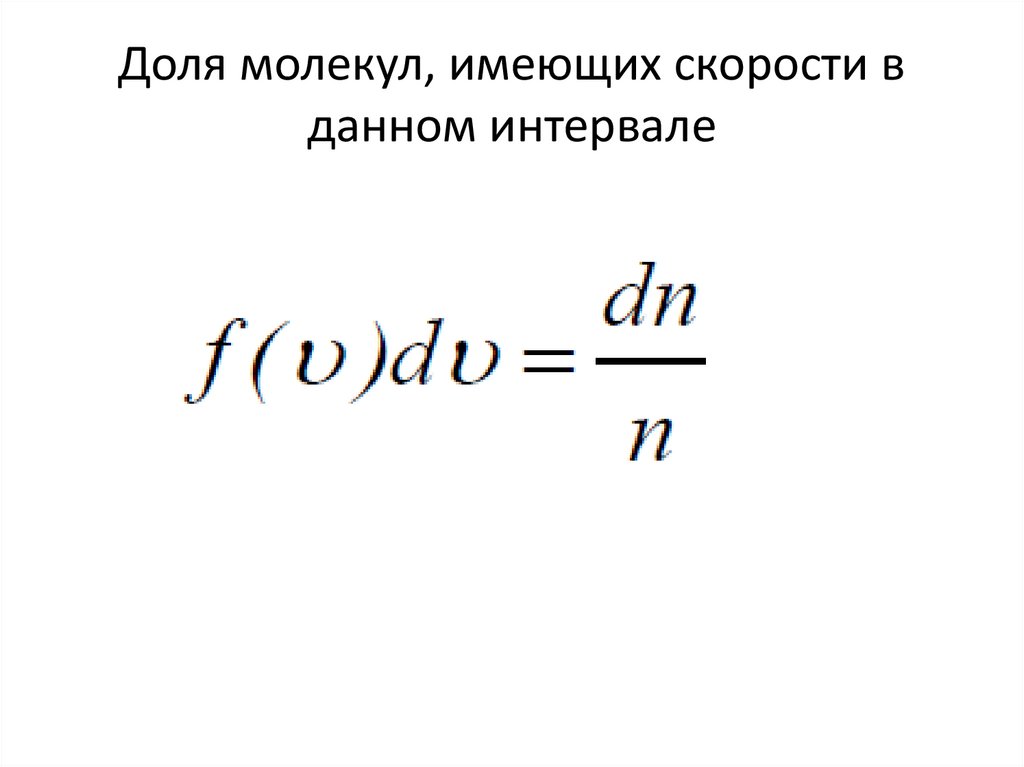








































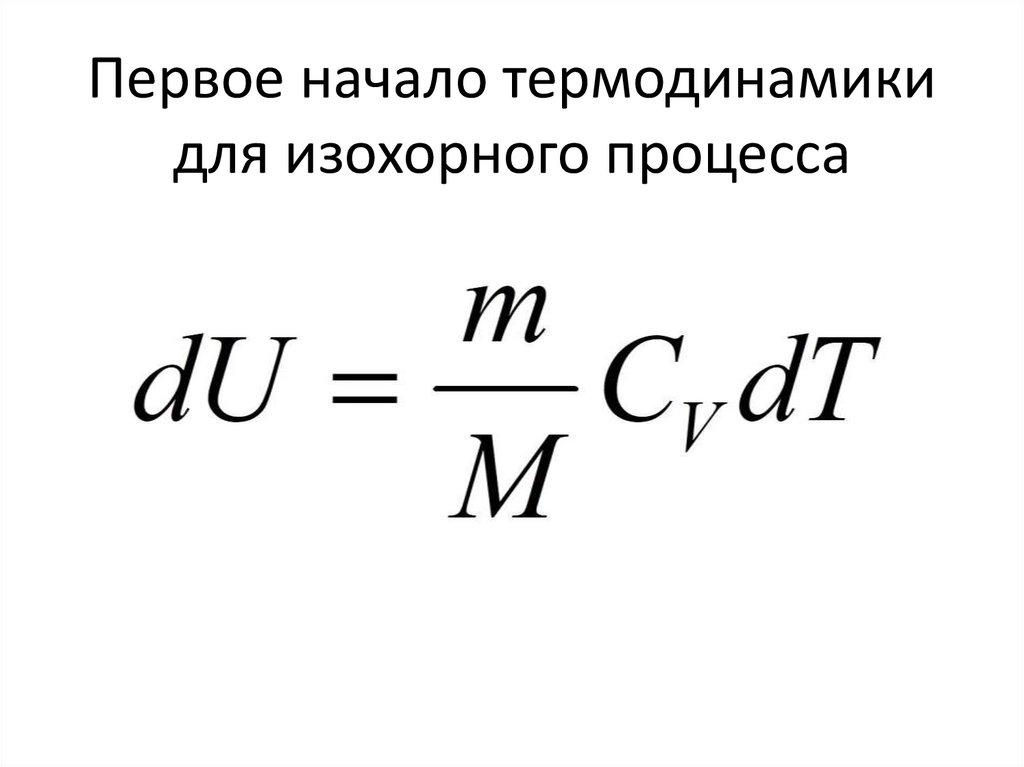

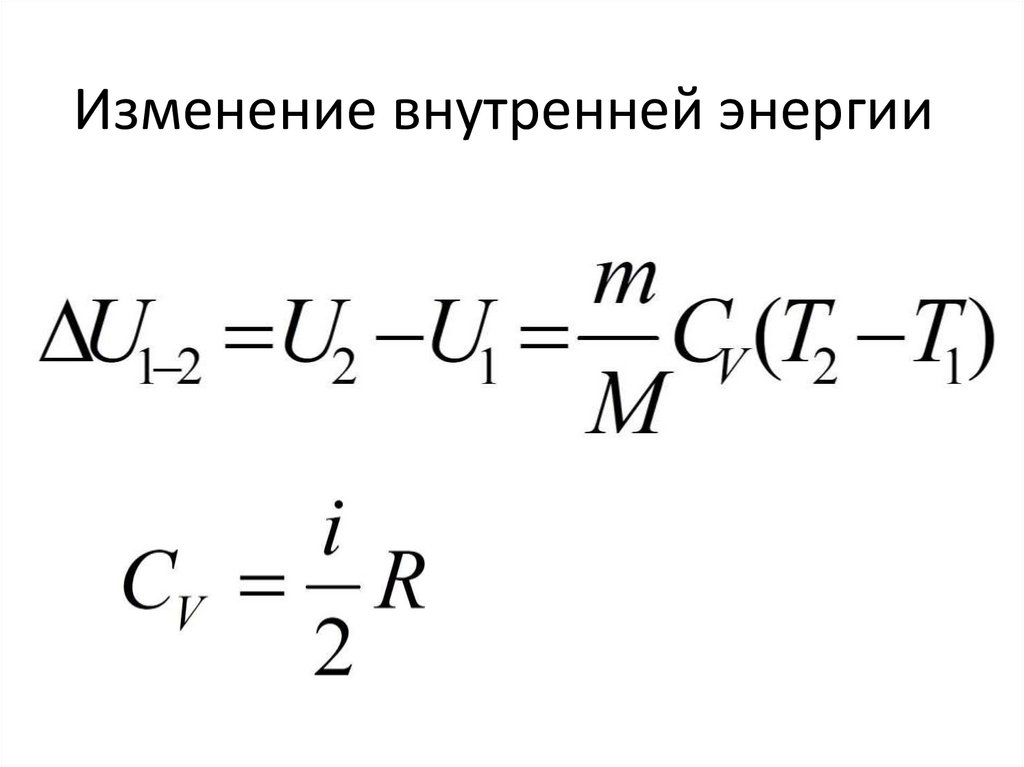



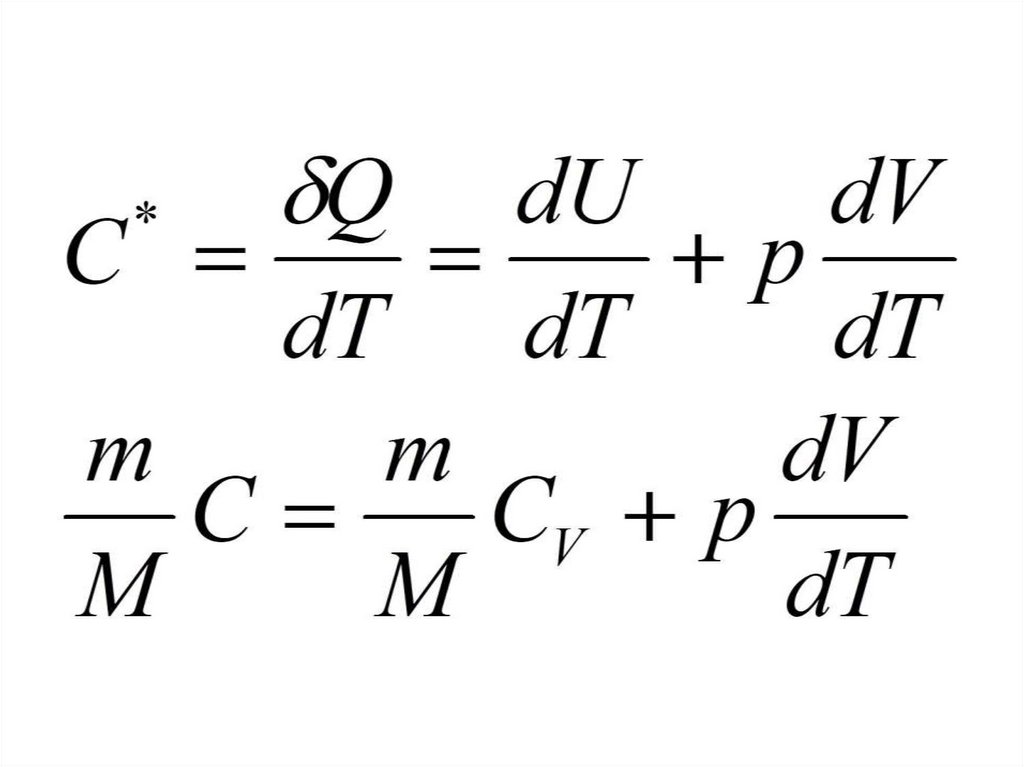
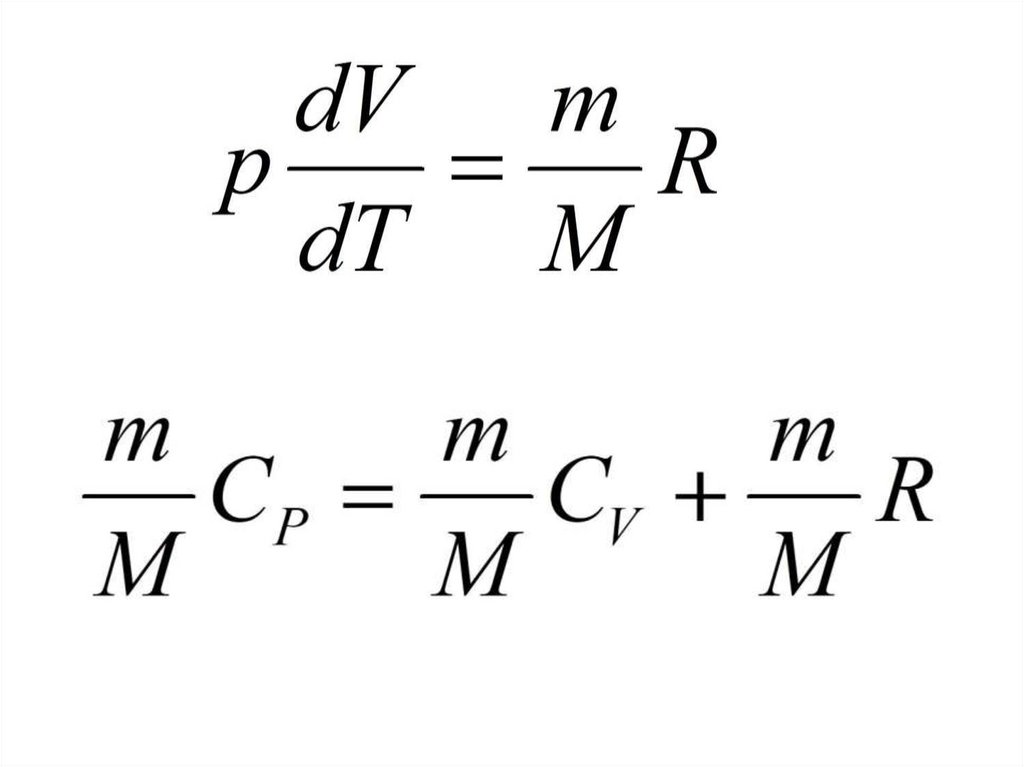



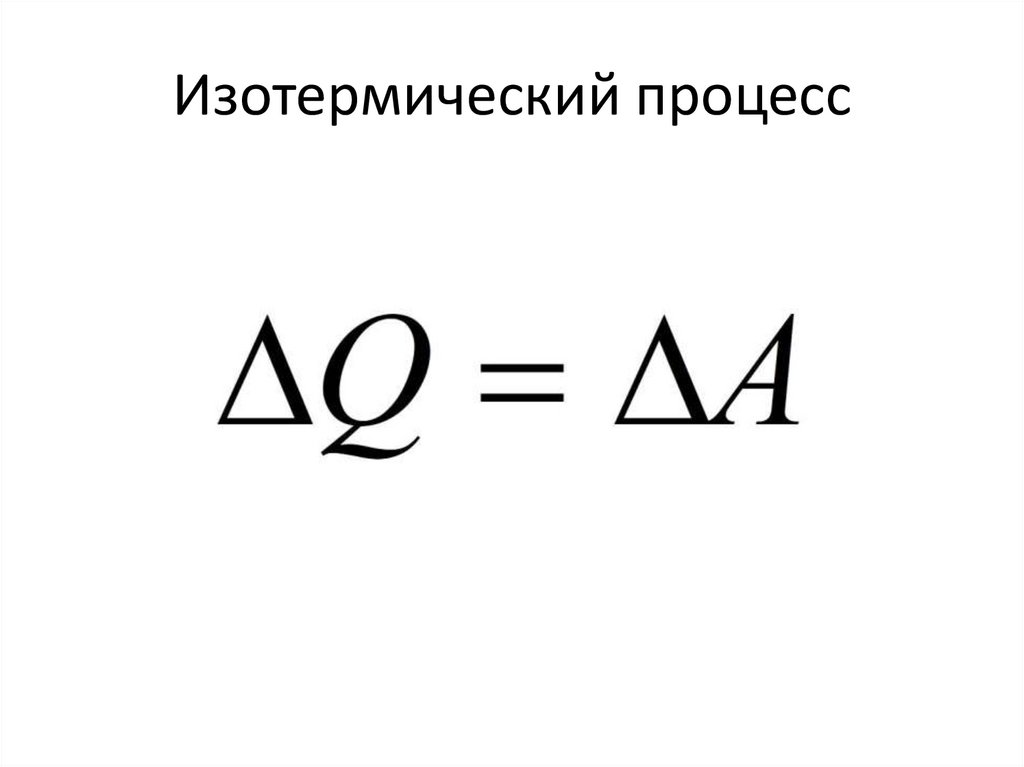
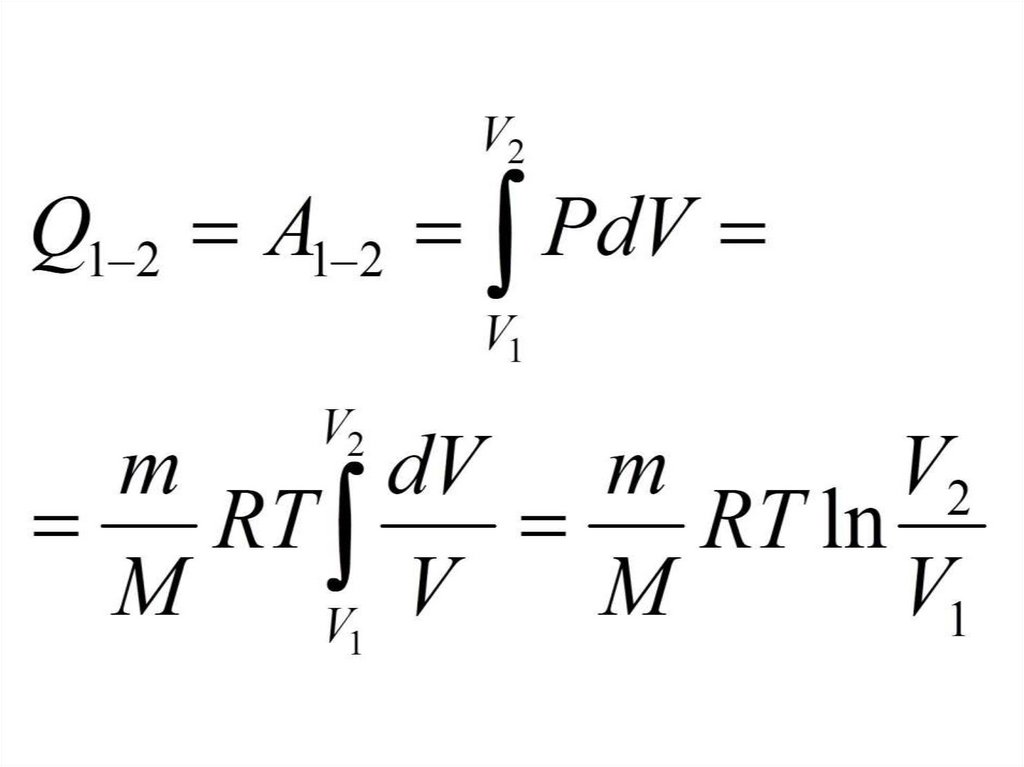
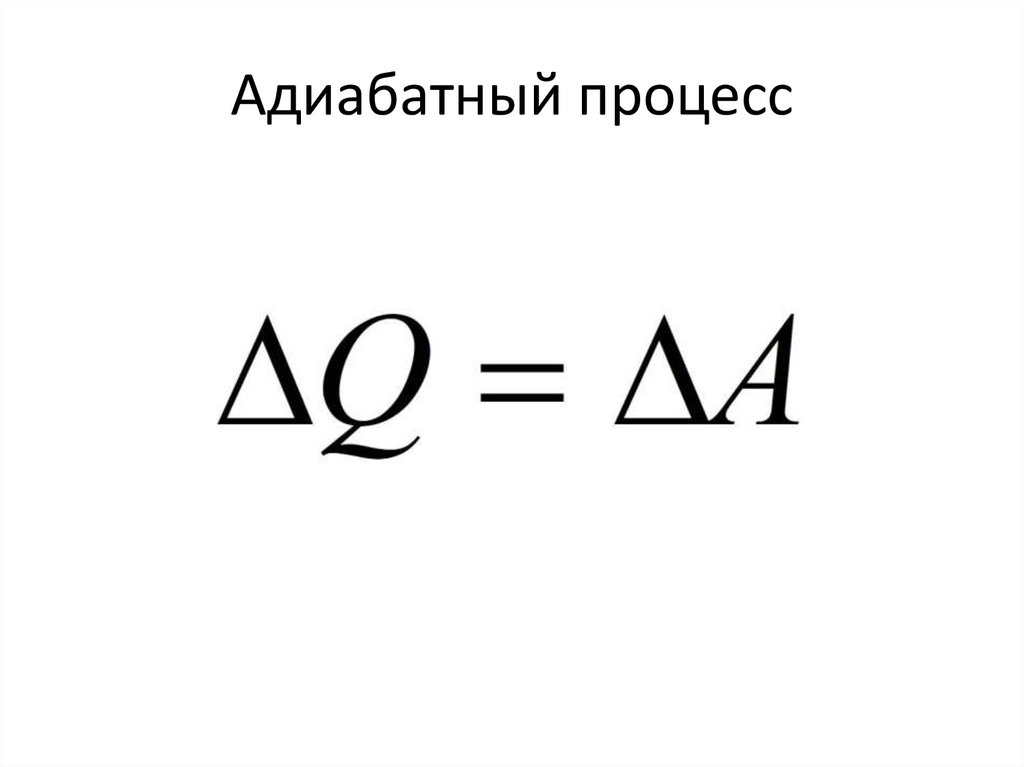












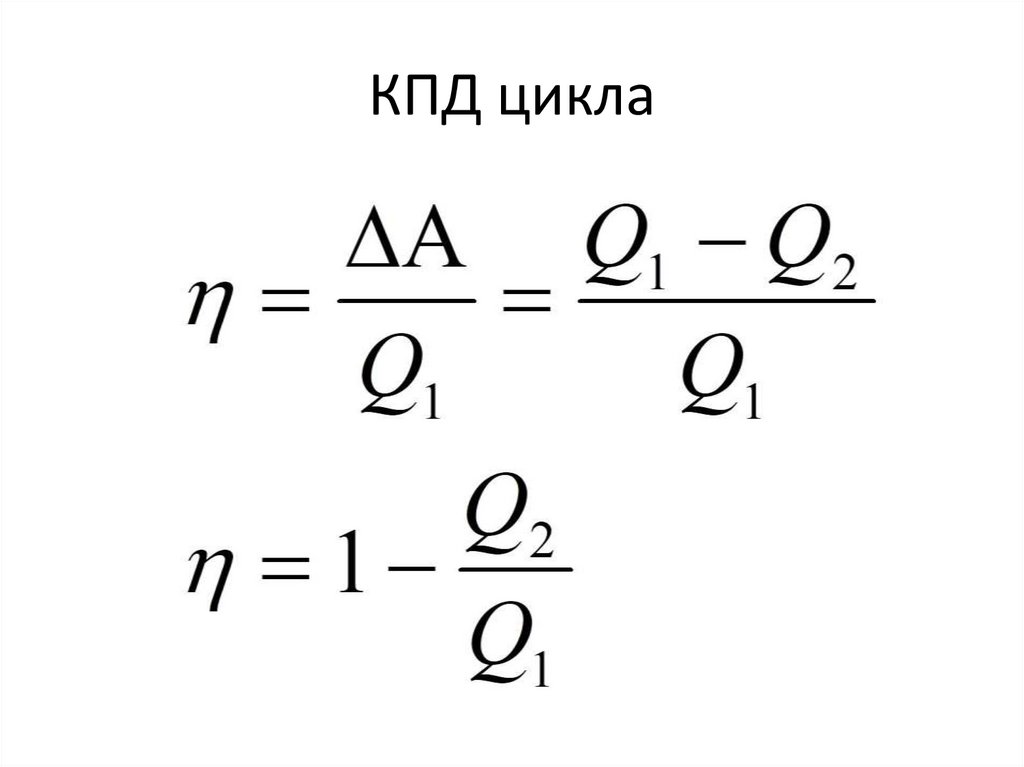

 physics
physics








