Similar presentations:
Биохимические механизмы детоксикации чужеродных веществ и эндогенных метоболитов
1.
СЗГМУ им. И.И.МЕЧНИКОВАКАФЕДРА КЛИННИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ ИМ. В.В. СОКОЛОВСКОГО
БИОЛОГИЧЕСКАЯ ХИМИЯ - БИОХИМИЯ ПОЛОСТИ РТА
Раздел X/ Тканевая биохимия
ЛЕКЦИЯ
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ДЕТОКСИКАЦИИ
ЧУЖЕРОДНЫХ ВЕЩЕСТВ И ЭНДОГЕННЫХ МЕТОБОЛИТОВ
Доцент АНТОНОВА Ж.В.
2024/2025
2.
План лекции1. Ксенобиотики, определение понятия, токсичность
2.Механизмы обезвреживания ксенобиотиков, фазы детоксикации
3. Возможные модификации ксенобиотиков в 1-й фазе детоксикации
4. 1-я фаза детоксикации, состав МОС
5. Локализация в мембране гладкого ЭПР ферментов МОС, пути переноса электронов
6. Строение ферментов МОС.
7. Цитохром Р 450, генные семейства, номенклатура генов.
8. Строение активного центра цитохрома Р450
9. Механизм монооксигеназной реакции (схема Эстабрука)
10. Роль цитохрома Р450 в эндогенном метаболизме
11. Свойства системы микросомального окисления. Индукция и индукторы цитохрома Р450
12. Ингибиторы цитохрома цит Р450
13. Феномен токсификации, примеры.
14. Образованием АФК, в ходе 1-й фазы детоксикации, значение работы АОС
15. 2-я фаза детоксикации - конъюгация. Виды реакций конъюгации, субстраты, ферменты, КоЕ,
биологическая роль. 16. Рекомендуемая литература
Список сокращений
МОС –монооксигеназная система ; АОС – антиоксидантная система
ПАУ – полиароматичекие углеводороды; ПАСК- пара-Аминосалициловая кислота
2.Ж.В
3.
1. Ксенобиотики/определение понятия/токсичностьКсенобиотики – чужеродные вещества, поступающие в организм из
окружающей среды и не используемые им в качестве пластических или в
энергетических субстратов.
К ксенобиотикам можно отнести продукты хозяйственной деятельности
человека, вещества бытовой химии, инсектициды, большинство
лекарственных средств, токсины, яды и т.д.
Ксенобиотики попадают в организм с пищей и водой, через кожу и с
вдыхаемым воздухом через легкие.
Гидрофильные ксенобиотики выводятся с мочой.
Гидрофобные (липофильные) ксенобиотики могут задерживаться в тканях,
связываясь с белками или образуя комплексы с липидами мембран. Они могут
проникать в клетки, нарушая их функционирование. В этом проявляется их
токсичность.
Для удаления гидрофобных ксенобиотиков из организма существуют
специальные механизмы их детоксикации и выведения.
3.Ж.В
4.
2. Механизмы обезвреживания ксенобиотиков/фазы детоксикацииОбезвреживание большинства ксенобиотиков происходит путем
химической модификации и протекает в 2 фазы
1-я фаза – функционализация, идет за счет МОС: в молекуле
гидрофобного ксенобиотика образуются полярные функциональные
группы (-ОН, -NH2, -SH, -COOH и др.), повышающие гидрофильность и
реакционную способность веществ, что дает им возможность
вступать в реакции 2-й фазы
2-я фаза – реакции конъюгации: в ходе которых к функциональным
группам, образованным в 1-фазе, присоединяются молекулы или
группы эндогенного происхождения, что еще больше увеличивает
гидрофильность, снижает токсичность и способствует выведению
веществ (ксенобиотика). Конъюгат удаляется из организма.
4.Ж.В
5.
2. Механизмы обезвреживания ксенобиотиков/фазы детоксикации3-я фаза системы детоксикации не связана с химической
модификацией ксенобиотиков, а необходима для обезвреживания
активных форм кислорода, образованных в 1-й фазе
монооксигеназных реакций
Работа АОС
В метаболизме ксенобиотиков могут принимать участие ферменты
почек, легких, кожи, ЖКТ, но наиболее активны они в печени.
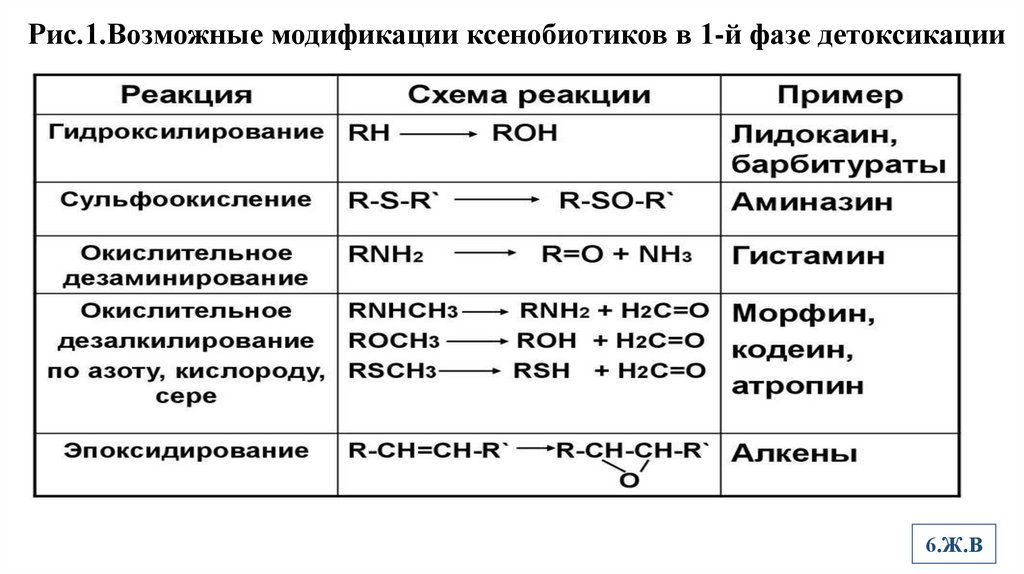
• Микросомальные ферменты 1-й фазы детоксикации катализируют
реакции С-гидроксилирования, N-гидроксилирования, сульфоокисления,
окислительного дезаминирования, O-,N-,S-дезалкилирования,
окислительного дезаминирования и эпоксидирования (Рис.1).
5.Ж.В
6.
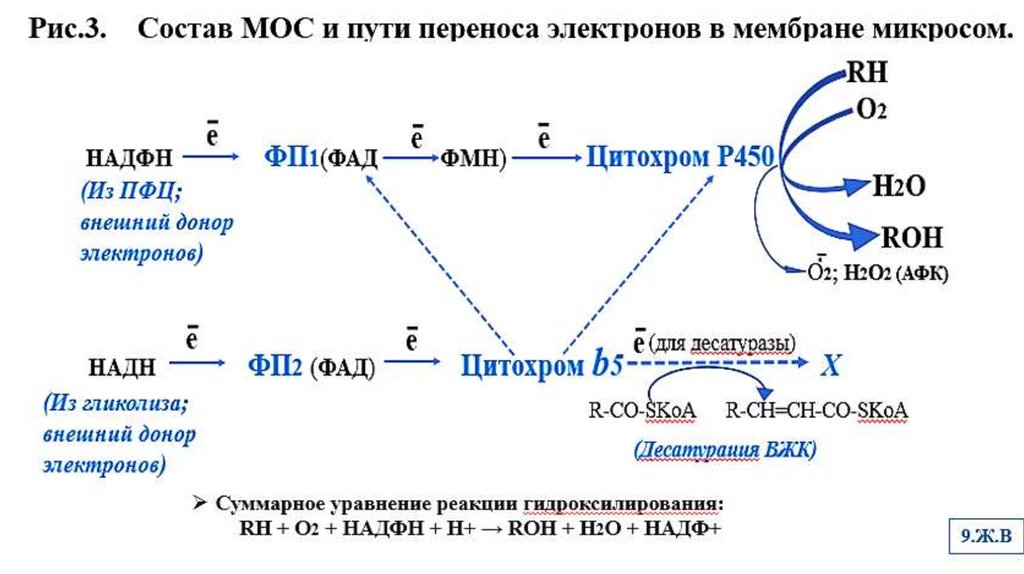
Рис.1.Возможные модификации ксенобиотиков в 1-й фазе детоксикации6.Ж.В
7.
2. 1-я фаза детоксикации1-фаза детоксикации
Идет под действием ферментов МОС (микросомальных монооксигеназ)
МОС –это полиферментный комплекс, локализованный в мембранах гладкого ЭПР,
представленный 2-мя функционально связанными электронотранспортными цепями, в
состав которых входят ферменты (Рис.2,3)
ФП1 – это НАДФН-зависимая-цитохром Р 450- редуктаза (ФАД, ФМН)
Цитохром Р 450
ФП2 – это НАДН-зависимая-цитохром b5- редуктаза (ФАД)
Цитохром b5
Цитохромы Р450 и b5 функционально связаны и могут образовывать сложные
комплексы, в результате чего происходит стабилизация цитохрома Р450 в
каталитически активном конформационном состоянии.
Большое значение в детоксикации ксенобиотиков играет НАДФН (из ПФЦ). Он
является донором внешних электронов (80-90%). НАДН поставляет только 10-20 %
всех электронов для МОС.
Для работы МОС важна связь с липидным окружением в мембранах ЭПР.
7.Ж.В
8.
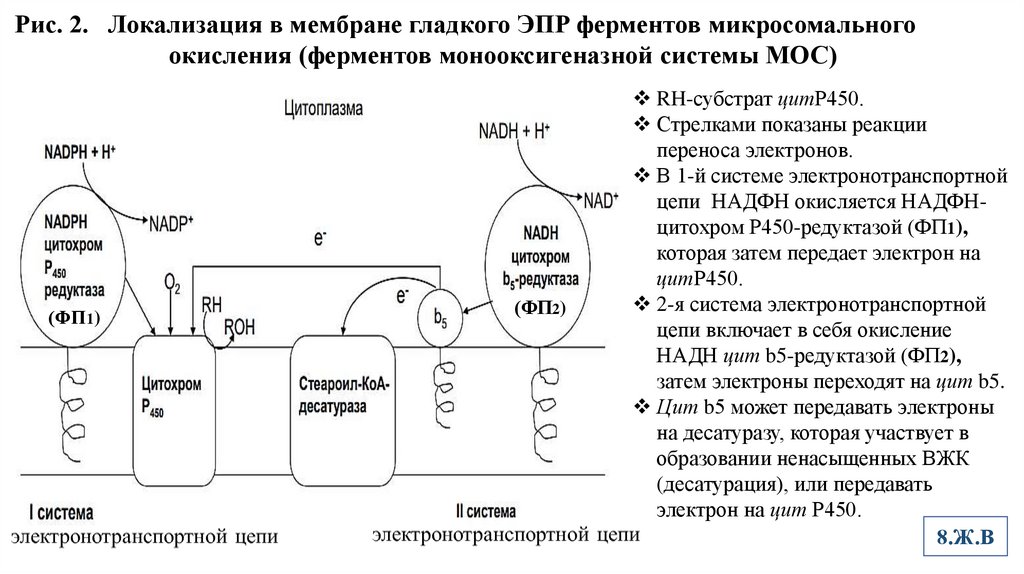
Рис. 2. Локализация в мембране гладкого ЭПР ферментов микросомальногоокисления (ферментов монооксигеназной системы МОС)
(ФП1)
(ФП2)
RH-субстрат цитР450.
Стрелками показаны реакции
переноса электронов.
В 1-й системе электронотранспортной
цепи НАДФН окисляется НАДФНцитохром Р450-редуктазой (ФП1),
которая затем передает электрон на
цитР450.
2-я система электронотранспортной
цепи включает в себя окисление
НАДН цит b5-редуктазой (ФП2),
затем электроны переходят на цит b5.
Цит b5 может передавать электроны
на десатуразу, которая участвует в
образовании ненасыщенных ВЖК
(десатурация), или передавать
электрон на цит Р450.
8.Ж.В
9.
10.
2. 1-я фаза детоксикации/строение ферментов МОССтроение ферментов МОС
НАДH-цитохром b5 редуктаза - двухдоменный белок. Глобулярный цитозольный
домен связывает простетическую группу - кофермент ФАД, а единственный
гидрофобный «хвост» закрепляет белок в мембране.
Цитохром b5 - гемсодержащий белок, который имеет домен, локализованный на
поверхности мембраны ЭПР, и короткий «заякоренный» в липидном бислое
спирализованный домен.
НАДH-цитохром b5 редуктаза и цитохром b5 не зафиксированы в мембране ЭПР и
могут менять свою локализацию.
НАДФН-зависимая-цитохром Р 450- редуктаза содержит две простетические
группы: ФАД и ФМН
Цитохром P450 (цитохром P450-зависимая монооксигеназа, от англ. cytochrome
P450, CYP) — общее название ферментов семейства P450. Р –от Phylodelphia, где
открыта эта форма; λ max -450 нм (комплекс восстановленного цитохрома Р450 с СО
имеет максимум поглощения 450 нм ), что лежит в основе его определения..
10.Ж.В
11.
2.1-я фаза детоксикации/цитохром Р 450Показано, что цит. Р-450 кодируется семейством «супергенов», которое
составляет у человека по крайней мере 57 генов, организованных в несколько (не
менее 18) мультигенных семейств и более 43 подсемейства. Эти семейства
содержат от одного до нескольких генных сегментов, кодирующих родственные
белки (или по крайней мере их мРНК). Номенклатура генов осуществляется
следующим образом:
общее название гена — СYР;
имя - арабские или римские цифры от 1;
под имя — латинские буквы (А — Z);
индивидуальный номер — арабские цифры,
Например: СYР27В1(1-альфа-гидроксилаза вит. D3, активир. вит. D3),CYP27A1 (б/с желчных кислот)
Гены СYР1 несут информацию о ферментах, участвующих в обезвреживании ароматических
углеводородов. Высокая активность СYР1А2 в организме появляется в ответ на курение и связана с
увеличенным риском заболевания раком толстого кишечника. СYР2 участвуют в метаболизме
11.Ж.В
некоторых лекарственных соединений и стероидов, СYР3— в метаболизме стероидов, включая
тестостерон.
12.
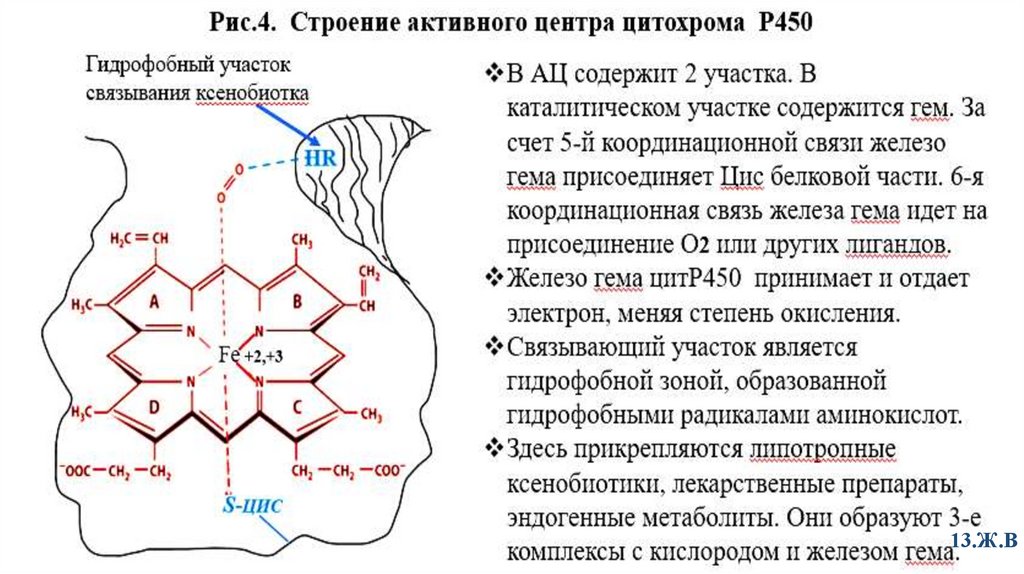
2.1-я фаза детоксикации/цитохром Р 450Цитохром Р 450 – это хромопротеин, гемопротеин. Гем погружен в гидрофобный
«карман»
ЦтоиP450 могут хромы проявлять как монооксигеназную, так и оксигеназную
активность, поэтому иногда относятся к оксидазам со смешанной функцией.
Цитохром Р 450 является монооксигеназой внешнего типа, т. к. требует для своей
работы внешних доноров электронов для передачи на молекулярный кислород.
Цитохром Р450 участвует в окислении как эндогенных метаболитов, так и
ксенобиотиков
Окисление с участием монооксигеназ изучают с использованием препаратов микросом
(микросомальные монооксигеназы).
Цитохром Р450 относится к числу индуцибельных ферментов
Строение активного центра цитохрома Р450 предсталено на рис.4.
12.Ж.В
13.
13.Ж.В14.
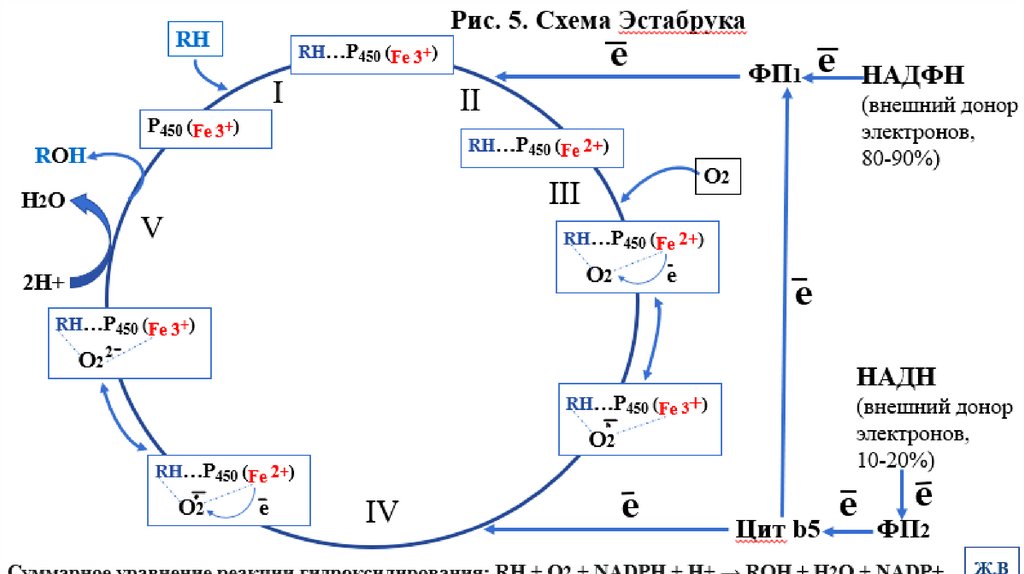
2.1-я фаза детоксикации/механизм монооксигеназной реакцииИзвестно, что молекулярный кислород в триплетном состоянии инертен и не способен
взаимодействовать с органическими соединениями. Чтобы сделать кислород
реакционно-способным, необходимо его превратить в синглетный, используя
ферментные системы его восстановления. К числу таковых принадлежит МОС,
содержащая цитохром Р450.
Связывание АЦ цит Р450 липофильного вещества RH и молекулы О2 повышает
окислительную активность фермента. Один атом из молекулы кислорода
принимает два электрона и переходит в форму О2- Донором электронов служит
NADРH, О2- взаимодействует с протонами: О2- + 2Н+ → Н2О.
Второй атом молекулы кислорода включается в субстрат RH, образуя
гидроксильную группу у гидрофобного вещества: R-OH, поэтому система
называется монооксигеназной
Суммарное уравнение реакции гидроксилирования:
RH + O2 + NADPH + H+ → ROH + H2O + NADP+.
Механизм монооксигеназной реакции (схема Эстабрука) смотри на рис.5
14.Ж.В
15.
16.
3. Роль цит Р450 в эндогенном метаболизмеРоль цитохрома Р450 в эндогенном метаболизме
Цитохром Р450 участвует в синтезе ряда эндогенных
метаболитов
Синтез холестерола
Синтез желчных кислот
Синтез адреналина и норадреналина
Синтез стероидных гормонов
Синтез серотонина
Синтез эйкозаноидов
Образование активной формы вит.Д
16.Ж.В
17.
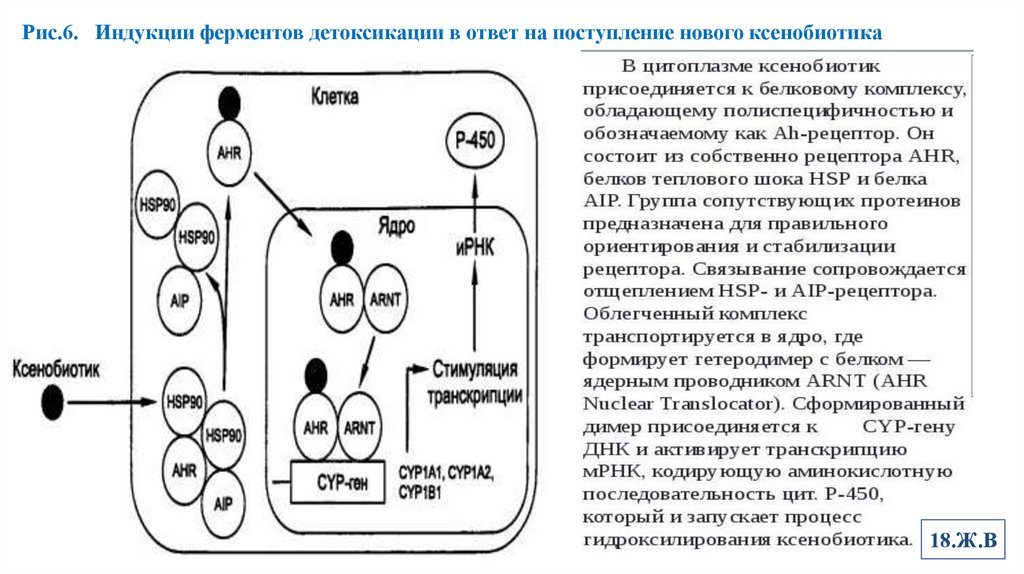
4. Свойства системы МОССвойства системы микросомального окисления
Широкая субстратная специфичность, которая позволяет обезвреживать самые
разнообразные по строению вещества и регуляция активности по механизму
индукции.
Описано более 250 химических соединений, являющихся индукторами
микросомальных ферментов, например, барбитураты, ПАУ, спирты, кетоны,
некоторые стероиды и т. д. (Рис.6)
Индукция синтеза увеличивает количество ферментов в ответ на поступление или
образование в организме веществ, которые должны метаболизироваться на МОС.
Широкая субстратная специфичность обусловлена множественными
формами Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих
различные формы фермента.
В отличии от изоферментов множественные формы – генетически разные белки,
катализирующие один тип реакции, но с разными субстратами.
17.Ж.В
18.
Рис.6. Индукции ферментов детоксикации в ответ на поступление нового ксенобиотика18.Ж.В
19.
4. Индукторы цит Р450Индукторы цитохрома Р450
Система цитохрома Р450 обладает индуцибельностью – т.е. при поступлении в организм
ксенобиотика происходит индукция синтеза соответствующей формы цит. Р450. Синтез Р450
может индуцироваться лекарствами, гормонами, инсектицидами, пестицидами и др.
Индукторы имеют общие свойства: липофильность, способность связываться с цитР450.,
относительно большое время полуэлиминации.
Индукторы цит. Р450 делятся на индукторы широкого и узкого спектра действия.
К индукторам широкого спектра действия относится
фенобарбитал, который индуцирует
а) цит. Р450 редуктазу
б) цитохром Р450
в) глюкуронилтрансферазу
Антибиотик рифампицин
К индукторам узкого спектра действия относятся
Полициклические ароматические углеводороды (ПАУ): метилхолантрен, бензпирен,
бензантрацен и др. которые индуцируют синтез только цит. Р448, и не индуцирует синтез
цит. Р450 редуктазы и глюкуронилтрансферазы, тем самым превращая ряд проканцерогенов
в канцерогены.
19.Ж.В
20.
4. Индукторы цит Р450Лекарственные вещества не только метаболизируются на МОС, но и оказывают на нее свое влияние,
изменяя ее активность. Этот факт объясняет положение о «привыкании» к лекарствам.
Например, при длительном применении барбитуратов скорость их метаболизма возрастает, вследствие
индукции цит Р450. Поэтому продолжительность «барбитурового» сна со временем уменьшается.
При комплексном применении лекарств учитывают возможность ферментативной индукции. Индукция
одной формы цит Р450 одним из препаратов может резко изменить скорость метаболизма и
фармакологический эффект других.
Например, барбитураты ускоряют метаболизм и изменяют фармакологический эффект кумариновых
антикоагулянтов, салициловой кислоты, аминопирина,кортизола,эстрадиола, тестостерона и др. Не
сочетается прием барбитуратов и оральных контрацептивов.
Рифампицин усиливает метаболизм антипирина, гексобарбитала, ряда стероидных анаболиков и др.
Индукторы микросомального окисления могут ускорять метаболизм не только ксенобиотиков, но и
эндогенных субстратов.
Например, фенобарбитал ускоряет элиминацию билирубина, что позволяет применять его при
некоторых формах гипербилирубинемий (синдроме Жильберта).
Растительные индолы (сем. Крестоцветных – капусты брокколи и брюссельской) индуцируют синтез
цит Р450 1А1 и стимулируют нормальный метаболизм эстрадиола, предотвращая образование
канцерогенных метаболитов 4-гидрокси- и 16-гидроксиэстрадиола.
20.Ж.В
21.
5. Ингибиторы цитохрома Р450Ингибиторы цитохрома цит Р450 делятся на группы
Эти группы ингибиторов снижают активность всех форм цит Р 450, т.к. действуют на
белковую или небелковую часть фермента
Ингибиторы небелковой части цит Р450–, связывающиеся с Fe+3 гема - CN-, CO, H2S
Промежуточные продукты метаболизма цитохрома Р450, которые образуют с ним прочные
комплексы: лекарственные препараты ПАСК, прогестерон, стероидные контрацептивы, тетурам,
аминозин, фторурацил, циклосерин, гидразины. и др.
Ингибиторы, разрушающие цит Р450 (СCl4) и др.
Ингибиторы, тормозящие синтез или ускоряющие распад цит Р450 (тяжелые металлы и др.)
Специфические ингибиторы изоформ цит Р 450 – лекарственные препараты
Тетурам – ингибитор цитохрома 2Е1;
Противогрибковый препарат клотримазол ингибирует цит Р450 (формы 3А4, 3А5, 3А7)
Тамоксифен, летразол и др. ингибируют ароматазу и применяются для лечения рака молочной
железы и эндометрия и т.д.
Дефицит минеральных компонентов (кальция, магния, железа, меди, цинка, селена и др.
снижает активность монооксигеназ и нарушает метаболизм ксенобиотиков.
21.Ж.В
22.
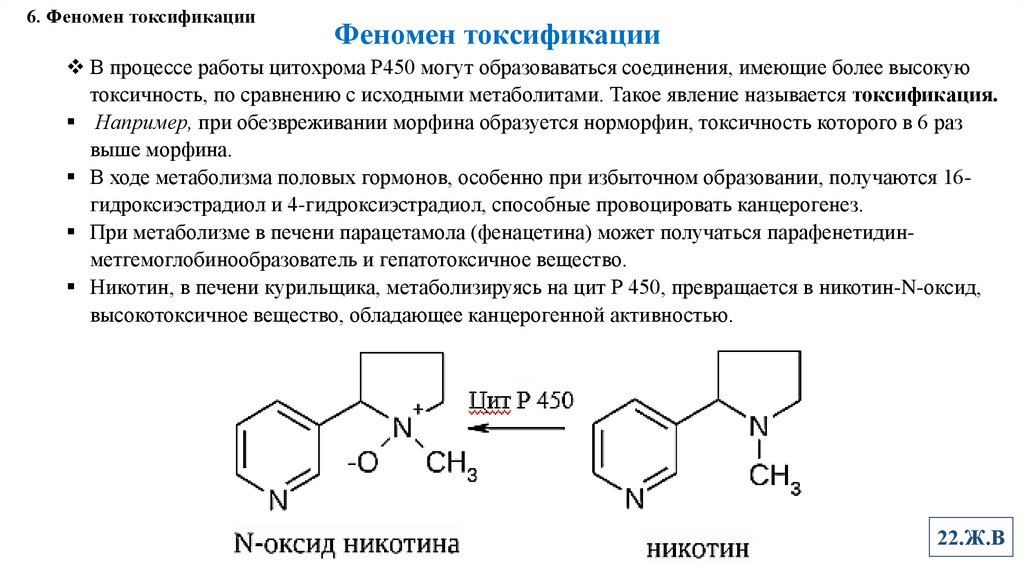
6. Феномен токсификацииФеномен токсификации
В процессе работы цитохрома Р450 могут образоваваться соединения, имеющие более высокую
токсичность, по сравнению с исходными метаболитами. Такое явление называется токсификация.
Например, при обезвреживании морфина образуется норморфин, токсичность которого в 6 раз
выше морфина.
В ходе метаболизма половых гормонов, особенно при избыточном образовании, получаются 16гидроксиэстрадиол и 4-гидроксиэстрадиол, способные провоцировать канцерогенез.
При метаболизме в печени парацетамола (фенацетина) может получаться парафенетидинметгемоглобинообразователь и гепатотоксичное вещество.
Никотин, в печени курильщика, метаболизируясь на цит Р 450, превращается в никотин-N-оксид,
высокотоксичное вещество, обладающее канцерогенной активностью.
22.Ж.В
23.
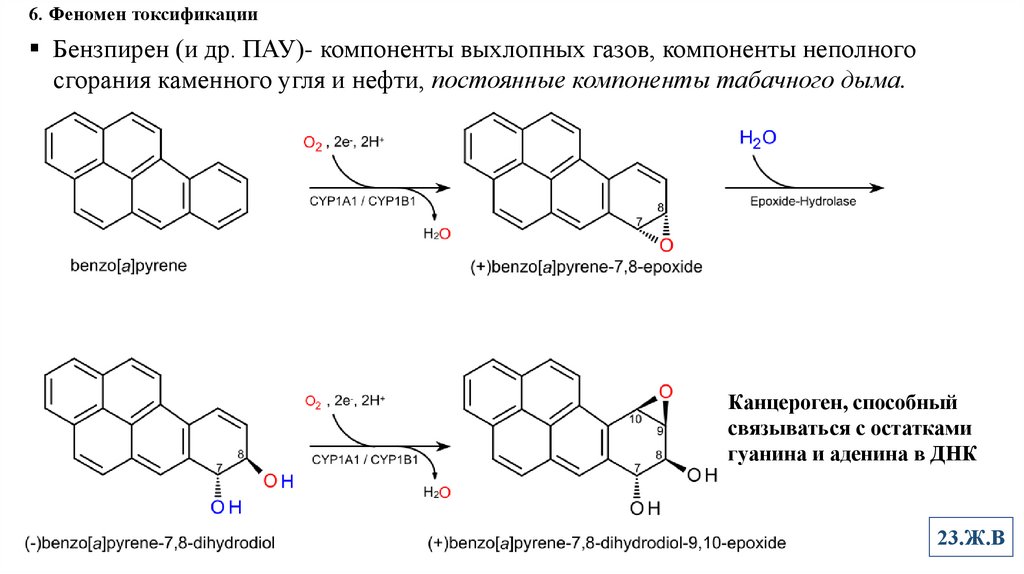
6. Феномен токсификацииБензпирен (и др. ПАУ)- компоненты выхлопных газов, компоненты неполного
сгорания каменного угля и нефти, постоянные компоненты табачного дыма.
Канцероген, способный
связываться с остатками
гуанина и аденина в ДНК
23.Ж.В
24.
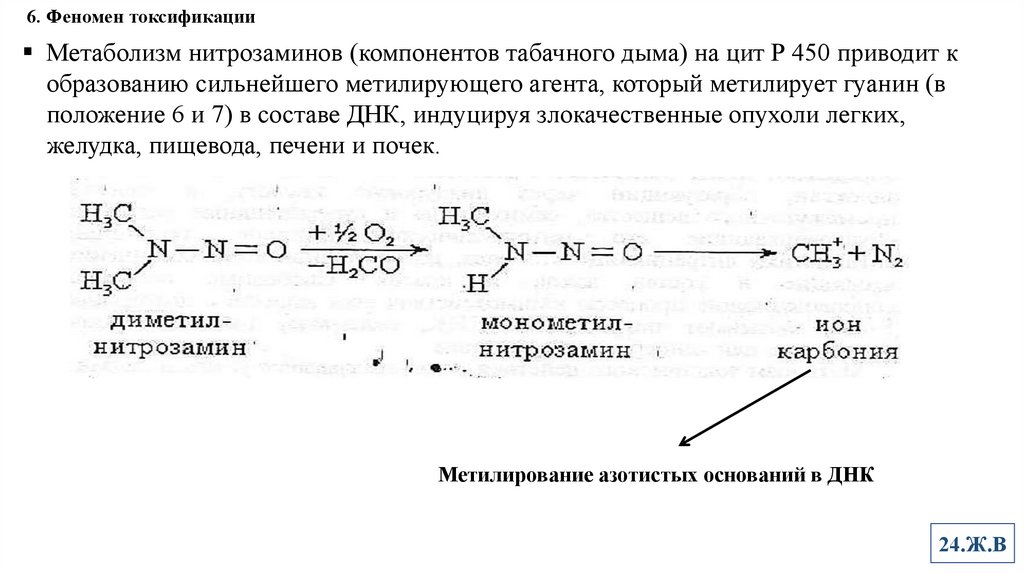
6. Феномен токсификацииМетаболизм нитрозаминов (компонентов табачного дыма) на цит Р 450 приводит к
образованию сильнейшего метилирующего агента, который метилирует гуанин (в
положение 6 и 7) в составе ДНК, индуцируя злокачественные опухоли легких,
желудка, пищевода, печени и почек.
Метилирование азотистых оснований в ДНК
24.Ж.В
25.
Работа цитохрома Р450 связана с образованием активных формкислорода (АФК), главным образом супероксид-анион-радикала и
пероксида водорода. Необходима работа АОС (самост. см. литературу).
АФК при избыточном образовании могут вызывать повреждение
мембран, в том числе эндоплазматических, в которые встроены
цитохром Р-450-зависимые ферменты и частично ферменты
конъюгации.
При усиленной работе ферментов детоксикации, либо при их индукции,
продукция АФК возрастает, что может привести к деструкции мембран
(Рис.7).
Субстраты, вызывающие образование большого количества АФК,
приводящих к гибели клетки называются суицидальными субстратами,
например ССl4. При лечении интоксикации такими соединениями
индукторы не используются, а применяются антиоксиданты.
25.Ж.В
26.
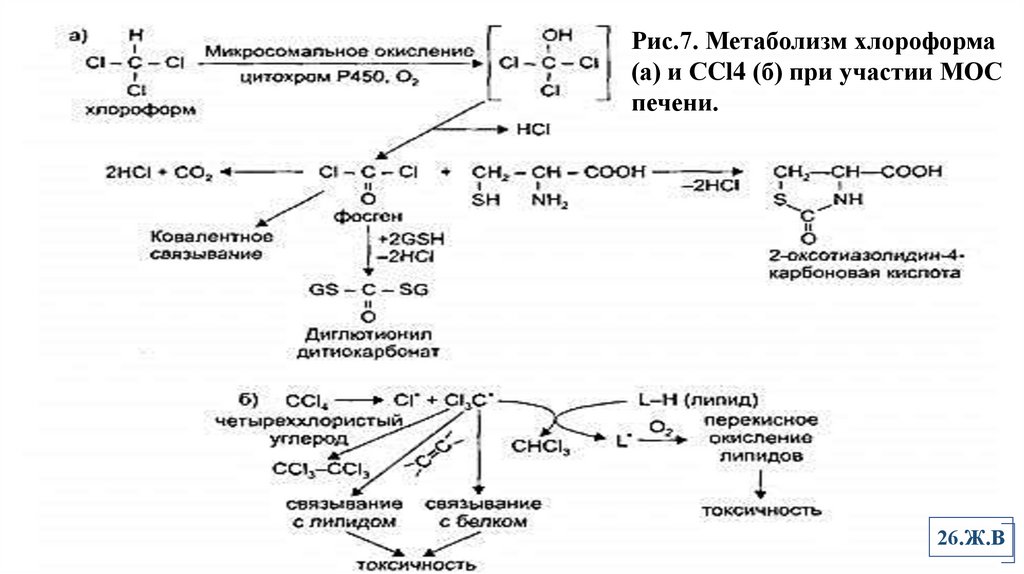
Рис.7. Метаболизм хлороформа(а) и СCl4 (б) при участии МОС
печени.
26.Ж.В
2.Ж.В
27.
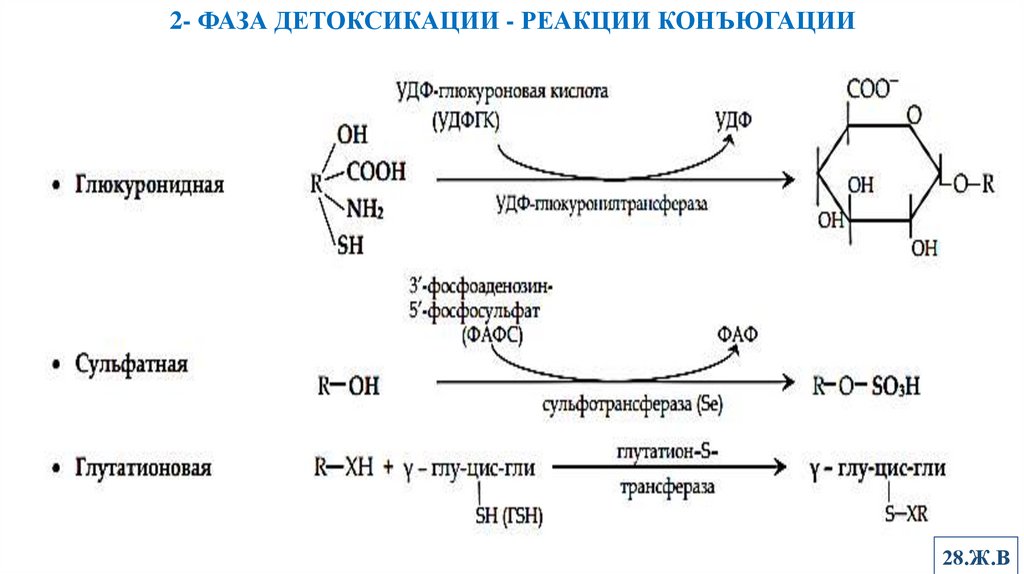
7. Конъюгация.2- ФАЗА ДЕТОКСИКАЦИИ - РЕАКЦИИ КОНЪЮГАЦИИ
Продуктами реакций 2-й фазы являются конъюгаты. Они образуются при участии
трансфераз.
Конъюгаты быстро экскретируются, их метаболическая активность ослаблена или
отсутствует.
Глюкуронидная конъюгация- наиболее важная реакция 2-фазы
Субстраты для нее – спирты, фенолы, карбоновые кислоты, тиолы, амины
Уридиндифосфоглюкуронилтрансфераза находится гл. образом в ЭПР гепатоцитов.
Сульфатная конъюгация
Субстраты –фенолы, спирты, реже аминосоединения.
Образованные конъюгаты обладают свойствами сложных эфиров.
Лекарственное соединение полностью теряет фармакологическую активность.
Глутатионовая конъюгация
Глутатионтрансферазы обладают широкой специфичностью к субстратам их более
3000.
Субстраты – вещества, имеющие электрофильный центр и гидрофобные зоны.
27.Ж.В
28.
2- ФАЗА ДЕТОКСИКАЦИИ - РЕАКЦИИ КОНЪЮГАЦИИ28.Ж.В
29.
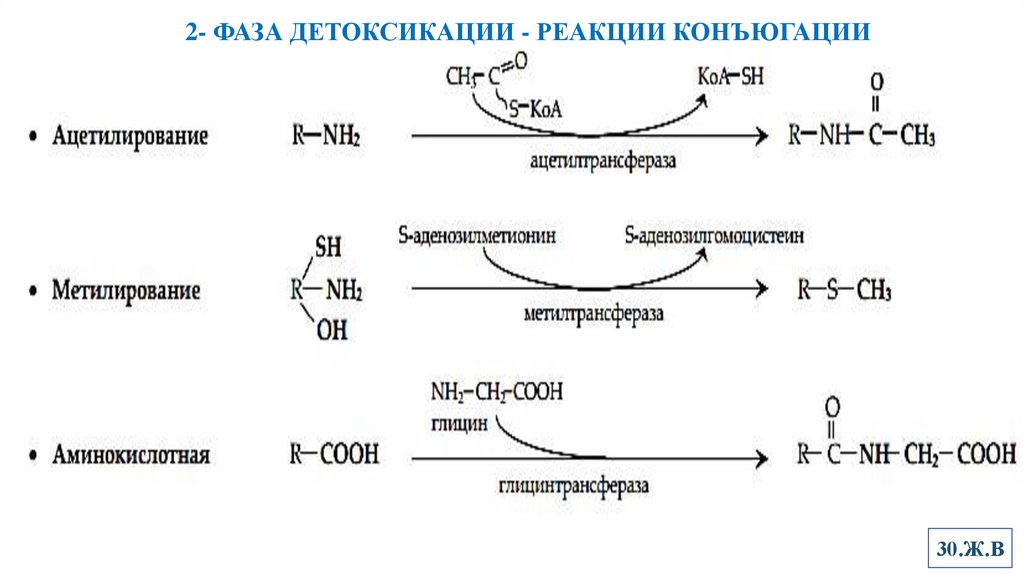
7. Конъюгации2- ФАЗА ДЕТОКСИКАЦИИ - РЕАКЦИИ КОНЪЮГАЦИИ
Ацетилирование
Субстраты – соединения с аминогруппой в составе (N-ацетилирование)
Все сульфаниламиды подвергаются ацетильной конъюгации
Ацетилированные продукты ряда сульфаниламидов плохо растворимы и
кристаллизуются в мочевыводящих путях.
Метилирование
Субстраты- фенолы, тиолы, амины (дофамин, унитиол, морфин)
Аминокислотная конъюгация
Субстраты – ароматические, карбоновые и ряд других органических кислот
Реакция представляет собой амидирование карбоксила субстрата
Во 2-фазе обезвреживания принимают участие и некоторые другие ферменты,
например, эпоксидгидролаза, присоединяющая воду к эпоксидам бензола,
бензпирена и др. ПАУ (см. феномен токсифекации), превращающая их в диолы.
29.Ж.В
30.
2- ФАЗА ДЕТОКСИКАЦИИ - РЕАКЦИИ КОНЪЮГАЦИИ30.Ж.В
31.
Рекомендованная литератураБиохимия : учебник / под ред. Е.С. Северина. – М. : ГЭОТАР-Медиа, 2011. – Раздел 12
Биохимия [Электронный ресурс] : учебник / под ред. Е. С. Северина. – 5-е изд., испр. и
доп. – М. : ГЭОТАР-Медиа, 2015. – http://www.studmedlib.ru / book /
ISBN9785970433126.html (разд. 12).
Биологическая химия. Биохимия полости рта : учебник / Т.П. Вавилова, А.Е. Медведев. –
М. : ГЭОТАР-Медиа, 2014. – С. 227–238.
Биологическая химия. Биохимия полости рта [Электронный ресурс]: учебник / Т.П.
Вавилова, А.Е. Медведев. – М. : ГЭОТАР-Медиа, 2014. – http://www.studmedlib.ru / book /
ISBN9785970430392.html (ч. IV, гл. 12; с. 227–238).
Сборник тестовых заданий по разделам биологической химии и биохимии полости рта :
учебно-методическое пособие для студентов стоматологического факультета / под ред.
В.А. Дадали, Ж.В. Антоновой, Р.Н. Павловой. – СПб. : Изд-во СЗГМУ им. И.И.
Мечникова, 2017. – С. 116–121.
Метаболические нарушения и зубочелюстная система : учебно-методическое пособие. –
СПб. : Изд-во СЗГМУ им. И.И. Мечникова, 2017. – С. 117–118 (АОС).
31.Ж.В
32.
Благодарю за внимание !32.Ж.В




















 medicine
medicine