Similar presentations:
Общая характеристика серы
1.
125.11.2024
Губарева В.А.
2.
21
• Историческая справка.
2
• Нахождение в природе.
3
• Положение в ПСХЭ. Строение атома.
4
• Строение и физические свойства.
5
• Химические свойства.
6
• Получение.
7
• Применение.
8
• Проверь свои знания!
25.11.2024
Губарева В.А.
3.
332
p+ = 16
n0 = 16
e- = 16
0
+16
Электронное строение
Валентные возможности
2 8 6
Валентные возможности -
II,IV,VI
Возможные степени окисления -2, +4, +6
25.11.2024
Губарева В.А.
4.
4Цинковая
обманка - ZnS
В земной коре в
свободном и связанном
состоянии серы
находится 0,03% от
Самородная
общего количества
сера -атомов,
S
по массе –
0,05%.
Глауберова соль –
Na2SO4∙10H2O
Сера в
природе
Киноварь HgS
Свинцовый
блеск - PbS
Гипс –
CaSO4∙2H2O
Железный
колчедан – FeS2
Медный
колчедан – Cu2S
25.11.2024
Губарева В.А.
5.
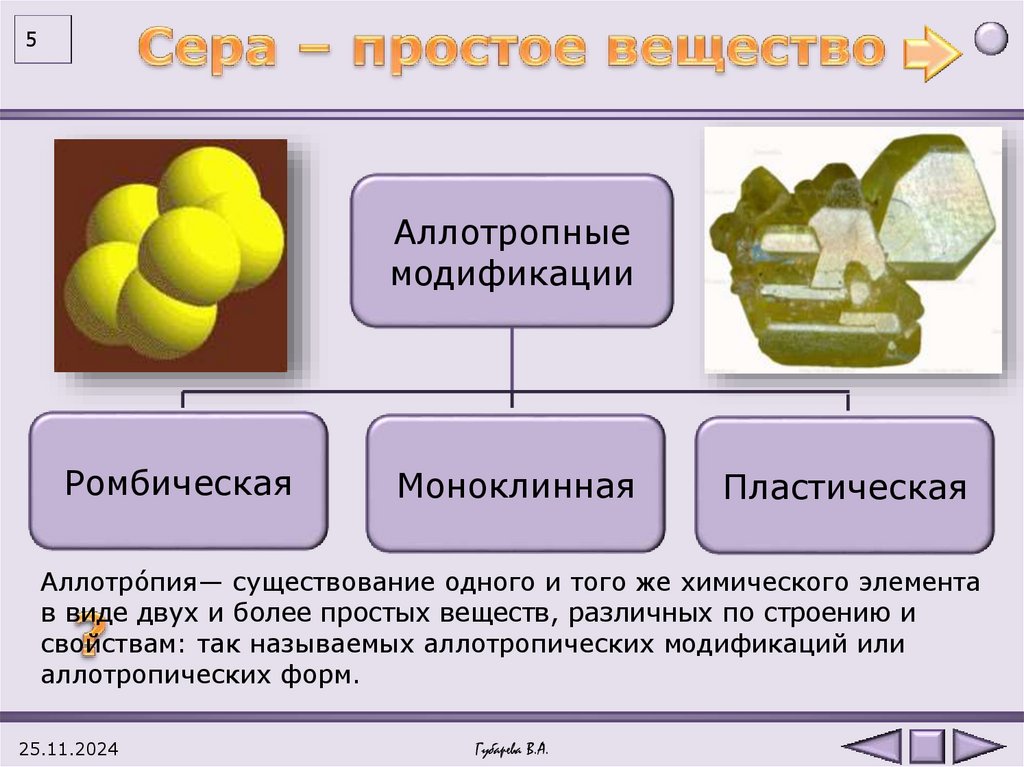
5Аллотропные
модификации
Ромбическая
Моноклинная
Пластическая
Аллотро́пия— существование одного и того же химического элемента
в виде двух и более простых веществ, различных по строению и
свойствам: так называемых аллотропических модификаций или
аллотропических форм.
25.11.2024
Губарева В.А.
6.
61080C
25.11.2024
S8
Твердая хрупкая
Цвет лимонно – желтый
Без вкуса и запаха
t пл.= 112,80С
tкип. = 4440С
Плотность - 2,07 г/см
В воде не растворяется,
не смачивается
Растворяется в
сероуглероде
Губарева В.А.
7.
7Мягкая, похожая на
резину коричневая масса,
растягивающаяся в нити;
Плотность - 2,046 г/см
Не растворяется в
сероуглероде
При хранении становится
хрупкой, желтеет,
превращается в
ромбическую
25.11.2024
Губарева В.А.
8.
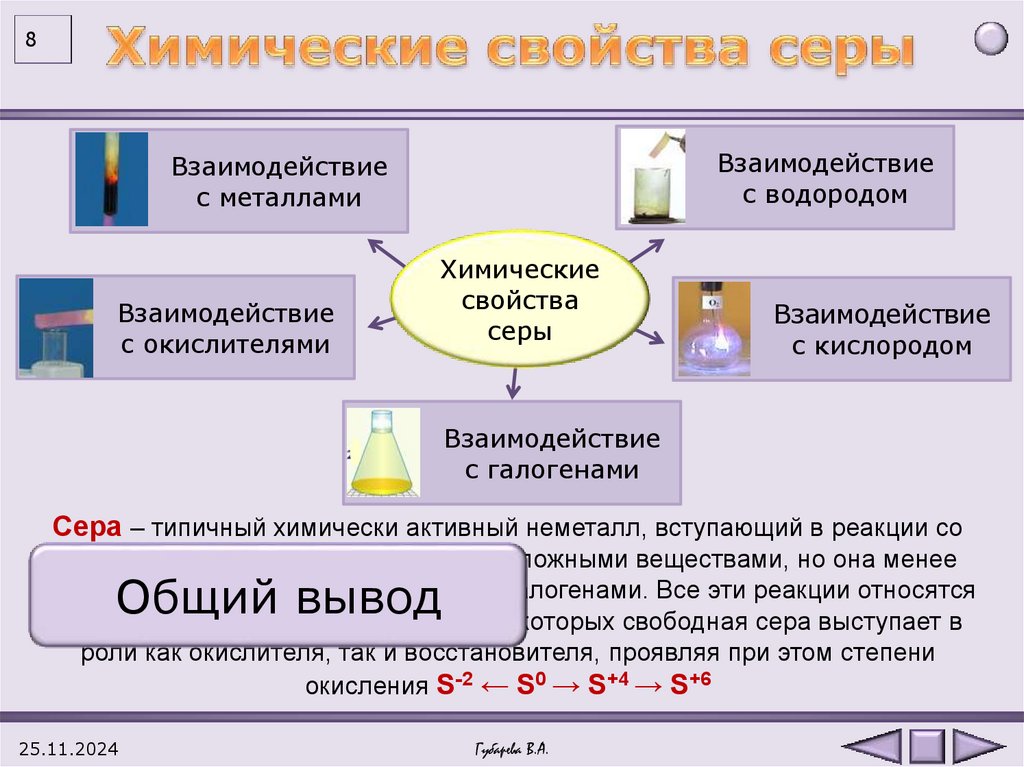
8Взаимодействие
с водородом
Взаимодействие
с металлами
Взаимодействие
c окислителями
Химические
свойства
серы
Взаимодействие
с кислородом
Взаимодействие
с галогенами
Сера – типичный химически активный неметалл, вступающий в реакции со
многими металлами, неметаллами и сложными веществами, но она менее
активна по сравнению с кислородом и галогенами. Все эти реакции относятся
к окислительно-восстановительным, в которых свободная сера выступает в
роли как окислителя, так и восстановителя, проявляя при этом степени
окисления S-2 ← S0 → S+4 → S+6
Общий вывод
25.11.2024
Губарева В.А.
9.
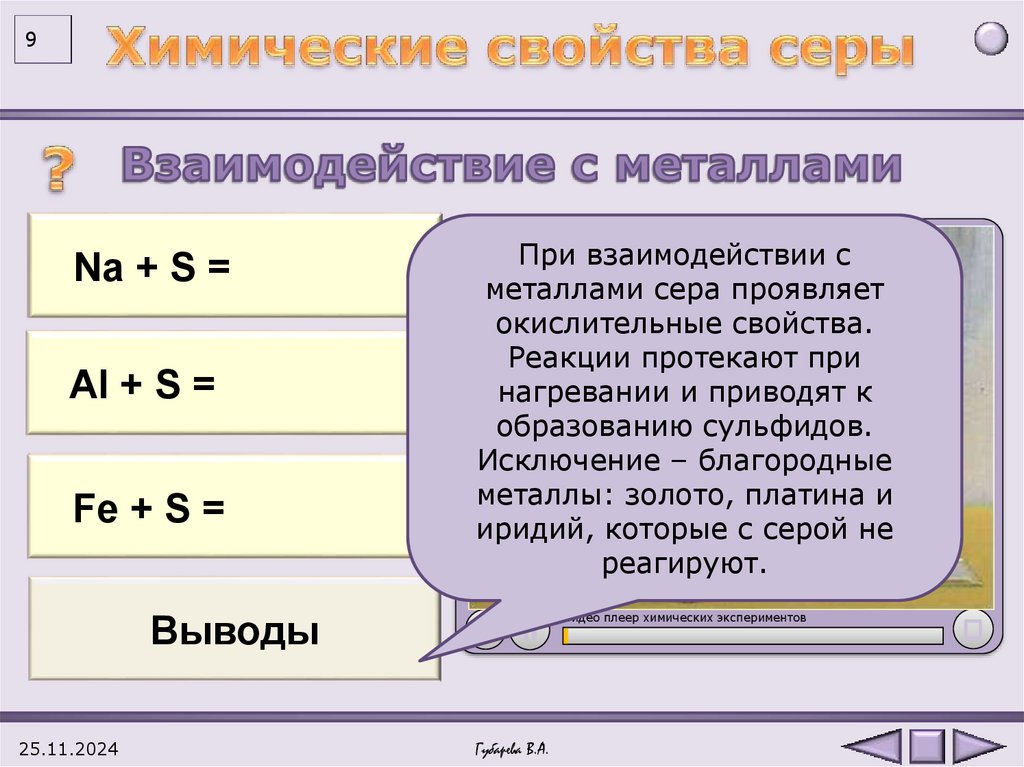
92 Na
Na0++SS=0 = Na+12S-2
Al0++S3S
=0 = Al+32S-23
2Al
Fe 0++SS=0 = Fe+2S-2
При взаимодействии с
металлами сера проявляет
окислительные свойства.
Реакции протекают при
нагревании и приводят к
образованию сульфидов.
Исключение – благородные
металлы: золото, платина и
иридий, которые с серой не
реагируют.
Выводы
25.11.2024
Видео плеер химических экспериментов
Губарева В.А.
10.
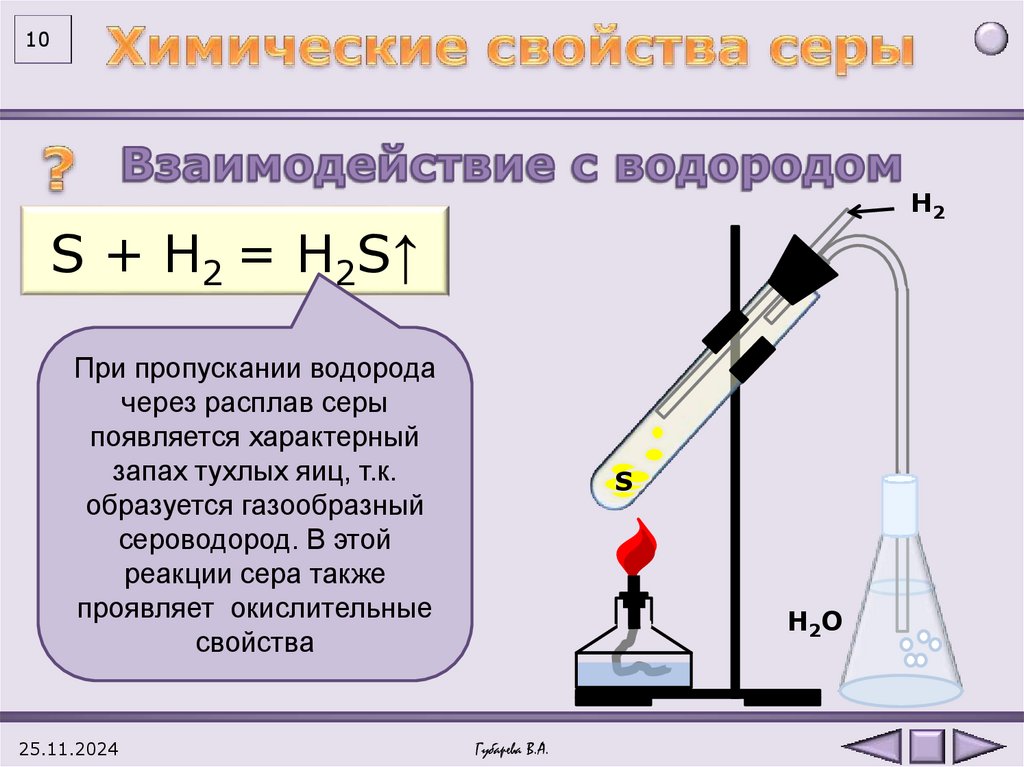
10Н2
S + H2 = H2S↑
При пропускании водорода
через расплав серы
появляется характерный
запах тухлых яиц, т.к.
образуется газообразный
сероводород. В этой
реакции сера также
проявляет окислительные
свойства
25.11.2024
S
Н2О
Губарева В.А.
11.
11S + О2 = SO2
При нагревании сера
вступает в реакцию с
кислородом с
образованием оксида
серы(IV) SO2 (сернистого
газа). В этой реакции сера
выступает в роли
восстновителя.
25.11.2024
Видео плеер химических экспериментов
Губарева В.А.
12.
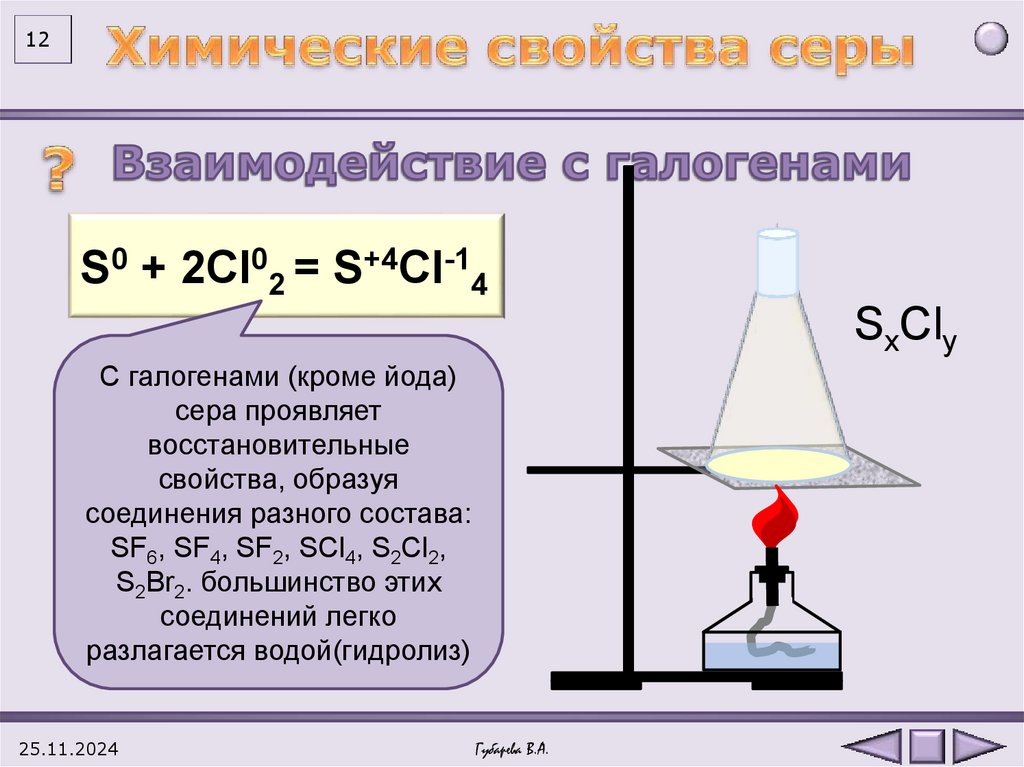
12S0 + 2Cl02 = S+4Cl-14
SxCly
С галогенами (кроме йода)
сера проявляет
восстановительные
свойства, образуя
соединения разного состава:
SF6, SF4, SF2, SCl4, S2Cl2,
S2Br2. большинство этих
соединений легко
разлагается водой(гидролиз)
25.11.2024
Губарева В.А.
13.
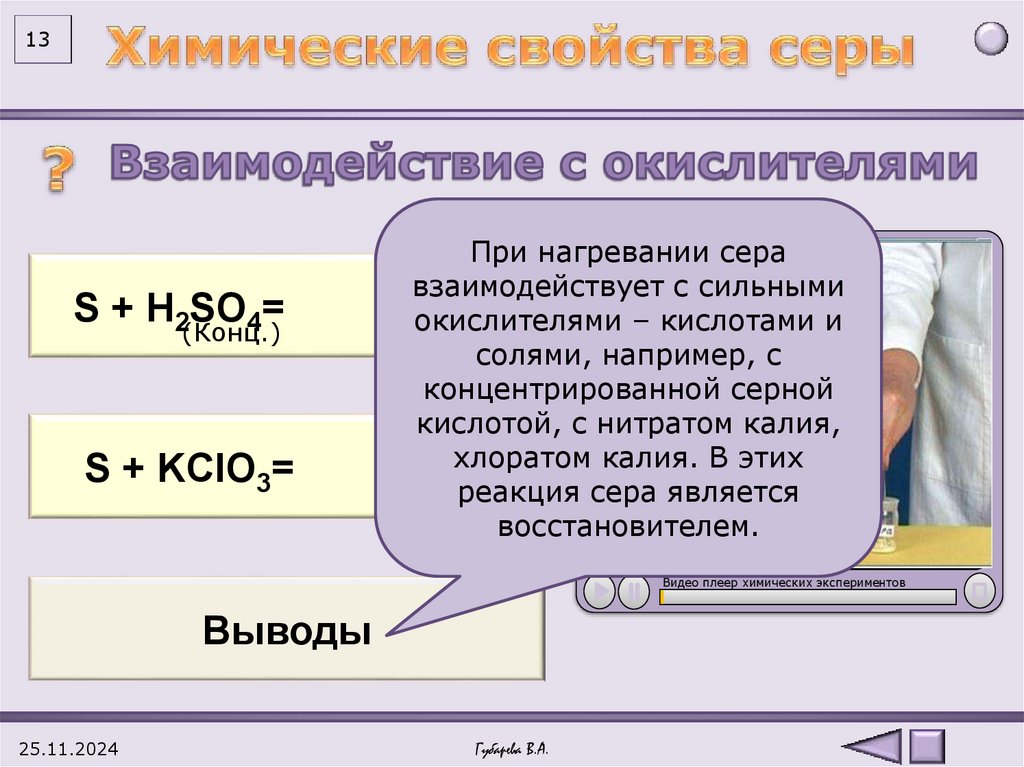
13При нагревании сера
взаимодействует с сильными
0
+4
SS+2H
+ H22SO
SO44== 3S O2окислителями
+2H2O
– кислотами и
(Конц.)
солями, например, с
концентрированной серной
кислотой, с нитратом калия,
хлоратом калия. В этих
3SS++KClO
KClO
=
=
2KCl
+
3SO
33
2
реакция
сера является
восстановителем.
Видео плеер химических экспериментов
Выводы
25.11.2024
Губарева В.А.
14.
14В промышленных условиях
серу получают без подъема
руды на поверхность:
• путем выплавления из руды
водяным паром
•окислением сероводорода
•восстановлением
сернистого газа:
2 H2S + O2 = 2 S + 2H2O
SO2 + C = S + CO2
SO2 + 2 CО = S + 2 CO2
25.11.2024
Губарева В.А.
15.
15Круго
ворот
Другое
25.11.2024
Производство
красителей
и
пигментов, взрывчатых веществ
(входит
в
состав
пороха),
искусственных
волокон,
люминофоров,
производство
спичек.
Серу до сих пор
содержат
некоторые
мази,
которыми лечат заболевания
кожи. В металлургии.
Губарева В.А.









 chemistry
chemistry








