Similar presentations:
Термодинамика химических процессов
1.
2.
1. Энергетика химических и фазовых превращений1.1 Основные понятия термодинамики: система (виды
систем), энергия (внутренняя, тепловая,
механическая), параметры и функции состояния
системы, компоненты системы, фаза, процесс. Первый
закон (начало) термодинамики.
1.2 Тепловые эффекты реакций и термохимические
уравнения. Закон Гесса. Понятие энтальпии. Молярная
энтальпия (теплота) образования вещества.
1.3 Энтропия и второе начало (закон) термодинамики
1.4 Энергия Гиббса (изобарно-изотермический
потенциал). Критерии самопроизвольного протекания
процессов.
2. Вычисления по термохимическим уравнениям
3.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Термодинамика (от греч. θέρμη – «теплота», δύναμις –
«сила») – наука о закономерностях превращения
энергии из одной формы в другую при физических
или химических процессах; – базируется не на
постулатах,
а
на
экспериментально
подтвержденных объективных закономерностях,
сформулированных в основных началах (или
законах)
Химическая термодинамика – раздел химии,
изучающий энергетику химических и фазовых
превращений,
направление
и
протекание
процессов
в
физико-химических
системах,
химические и фазовые равновесия
4.
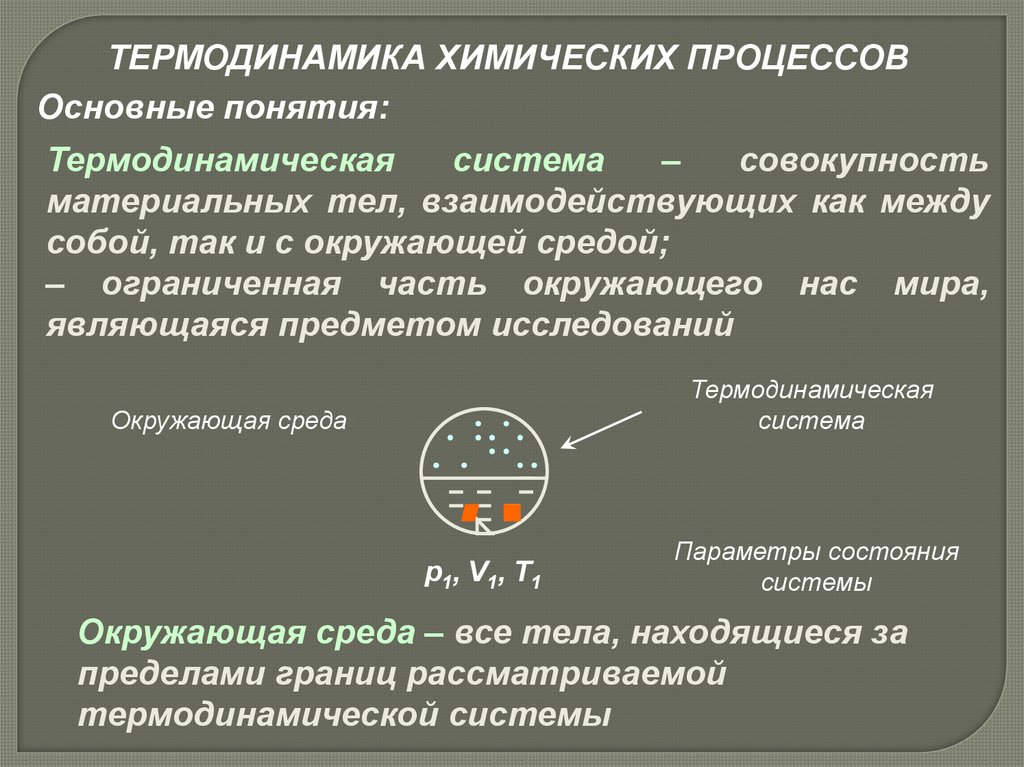
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Термодинамическая
система
–
совокупность
материальных тел, взаимодействующих как между
собой, так и с окружающей средой;
– ограниченная часть окружающего нас мира,
являющаяся предметом исследований
Термодинамическая
система
Окружающая среда
р1, V1, T1
Параметры состояния
системы
Окружающая среда – все тела, находящиеся за
пределами границ рассматриваемой
термодинамической системы
5.
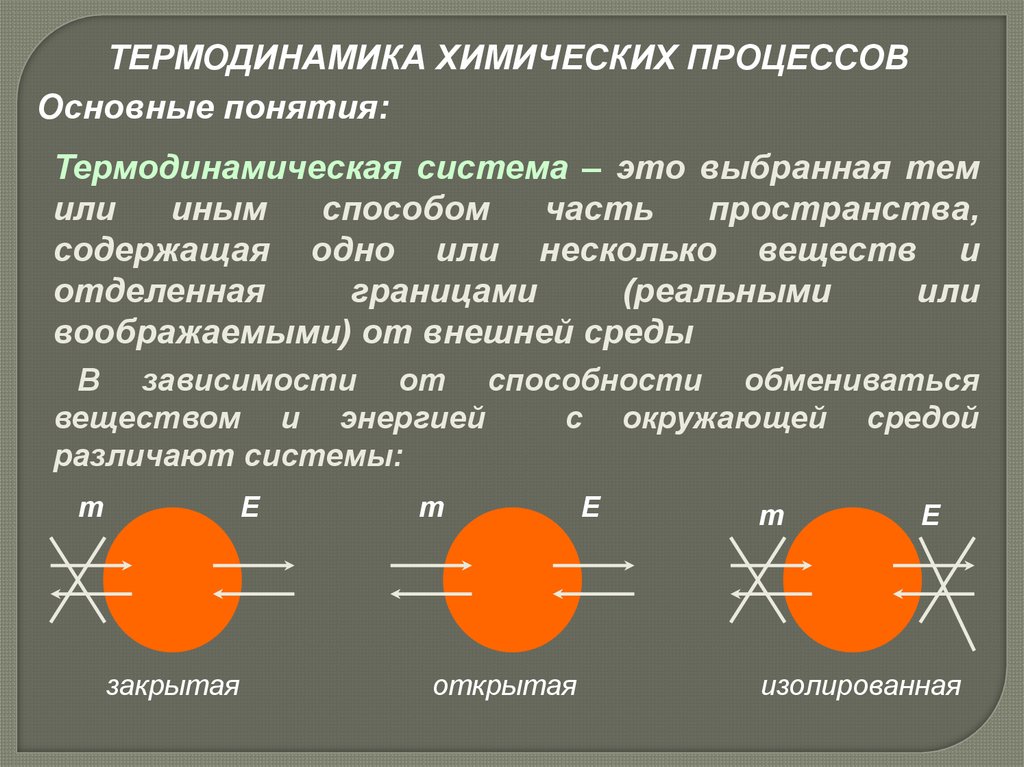
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Термодинамическая система – это выбранная тем
или
иным
способом
часть
пространства,
содержащая одно или несколько веществ и
отделенная
границами
(реальными
или
воображаемыми) от внешней среды
В зависимости от способности обмениваться
веществом и энергией
с окружающей средой
различают системы:
m
E
закрытая
m
открытая
E
m
E
изолированная
6.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Фаза – часть системы, отделенная от других ее частей
поверхностью раздела
По числу фаз различают системы:
Гомогенные
Гетерогенные
– однофазные системы (в
зависимости от агрегатного
состояния: твердые; жидкие;
газообразные).
– многофазные системы, в
которых фазы отделены друг от
друга поверхностями раздела
(жидкость-твердое вещество; газ-
Особенность: реакции
начинаются и протекают
сразу во всем объеме
системы
твердое вещество; жидкость(1)жидкость(2); твердое вещество(1)
-твердое вещество(2); др.)
Особенность: реакции начинаются
и протекают на границе раздела
фаз
7.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Термодинамические параметры – это величины,
характеризующие термодинамическую систему
Интенсивные параметры (их величина не зависит
от количества вещества):
- температура (T);
- давление (р);
- молярная концентрация (См);
- плотность.
Экстенсивные параметры (их величина зависит от
количества вещества):
- масса (m);
- объем (V).
8.
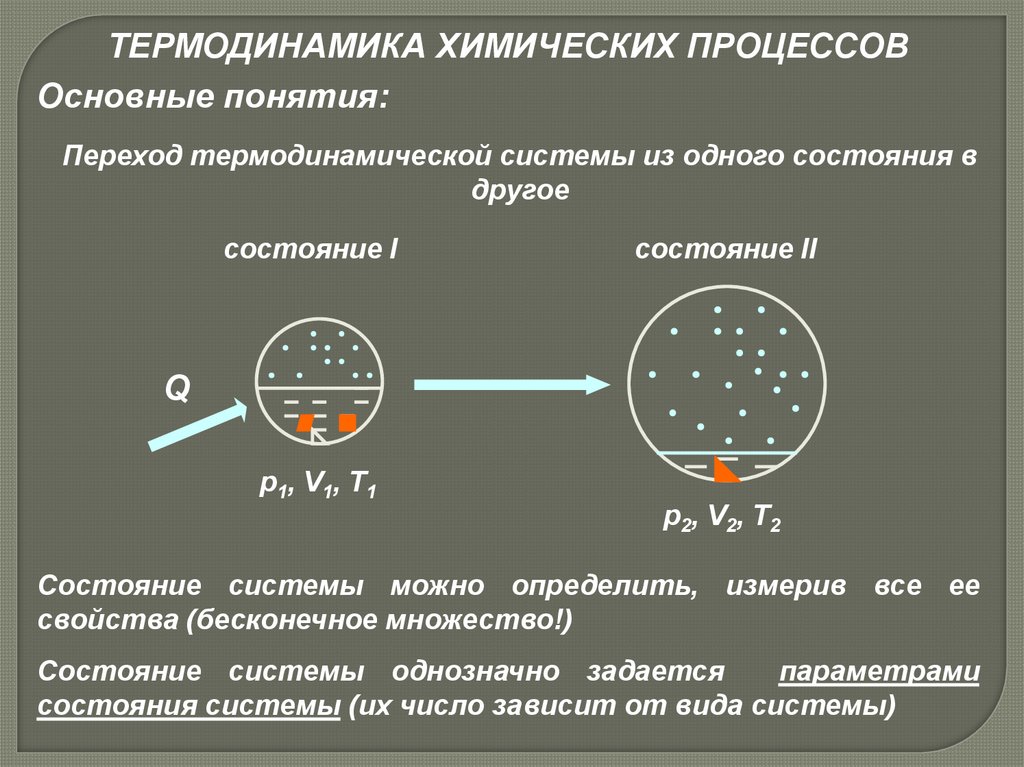
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Переход термодинамической системы из одного состояния в
другое
состояние I
состояние II
Q
р1, V1, T1
р2, V2, T2
Состояние системы можно определить, измерив все ее
свойства (бесконечное множество!)
Состояние системы однозначно задается
параметрами
состояния системы (их число зависит от вида системы)
9.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Функция состояния термодинамической системы –
это функция нескольких независимых параметров,
которые
однозначно
определяют
состояние
термодинамической системы; – зависит только от
состояния термодинамической системы и не зависит
от пути перехода системы в это состояние
Внутренняя энергия системы (U) определяется
суммарным запасом энергии составляющих систему
молекул, атомов, электронов, ядер и т.д. и
складывается, в основном, из кинетической энергии
этих частиц и энергии взаимодействия между ними
U = U2 – U1
Внутренняя энергия изолированной системы ( Q = 0; A = 0;
U = 0) есть величина постоянная
10.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИТеплота (Q), сообщаемая системе извне, расходуется
на увеличение внутренней энергии закрытой системы
( U) и на совершаемую системой работу (A):
Q = U + A + W + E
– подведенная к системе
теплота
сумма всех работ,
совершаемых системой
A = p V
Q = U + A
– совершаемая системой работа при
постоянном давлении
(1)
* вытекает из закона сохранения и движения (превращения)
материи (вещества) и энергии М.В. Ломоносова (1748 г.).
11.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИДля процессов, протекающих при постоянном
давлении, тепловой эффект (Qр) равен сумме
изменения внутренней энергии и работы расширения
(других видов работы не совершается):
Qр = U + p V
При переходе такой системы из начального
состояния 1 в конечное состояние 2 можно записать:
Qр = (U2 – U1) + p(V2 – V1) = (U2 + pV2) – (U1 + pV1) =
= H2 – H1 = Hr
12.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВОсновные понятия:
Энтальпия, Н (от греч. enthalpo «внутрь» и «нагреваю»),
(кДж∙моль-1,
ккал∙моль-1)
–
функция
состояния
системы, равная сумме:
H = U + pV
Для изобарного процесса:
H = U + p V
При р = const и при отсутствии других видов
работ, кроме работы расширения, теплота равна
изменению энтальпии с противоположным знаком:
Qр = U + p V = – H
Для изохорного процесса (V = const ) и в отсутствии
других видов работ:
QV = U
13.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙОсновные понятия:
Термохимия
– раздел химической термодинамики, в котором
изучают тепловые эффекты химических реакций
и их зависимость от различных физикохимических параметров.
Тепловой эффект (±Q)
– количество теплоты, выделившейся
поглощенной в данной химической реакции
или
Термохимическое уравнение реакции
– уравнение реакции, в котором наряду с ее
участниками указывается тепловой эффект (±Q)
реакции как один из продуктов взаимодействия
* В термохимическом уравнении реакции
указывается агрегатное состояние веществ
обязательно
14.
ТЕПЛОВЫЕ ЭФФЕКТЫ РЕАКЦИЙИ ТЕРМОХИМИЧЕСКИЕ УРАВНЕНИЯ
Примеры:
1)
реакция
взаимодействия
паров
воды
с
монооксидом углерода выражается термохимическим
уравнением:
H2О (г) + СO (г) = H2 (г) + СO2 (г) + 242 кДж
При экзотермическом процессе Qр-ции > 0, Нр-ции < 0
2)
реакция
разложения
карбоната
кальция
выражается термохимическим уравнением:
СаСО3 (т) = СаО (т) + СО2 (г) – 177 кДж
При эндотермическом процессе Qр-ции < 0, Нр-ции > 0.
15.
ЗАКОН ГЕССА– установлен экспериментально (1836 г.) русским химиком Г. И.
Гессом
Тепловой эффект реакции (ΔQр-ции) или изменение
энтальпии реакции ( Нр-ции) не зависит от
промежуточных стадий реакции (пути протекания
процесса), а определяется только видом и состоянием
исходных веществ и продуктов реакции
αА (г) + βВ (ж) = γC (г) + δD (т);
Реагенты,
состояние исходное
ΔНр-ции – ?
Продукты,
состояние конечное
** В термодинамическом уравнении реакции
указывается агрегатное состояние веществ
обязательно
16.
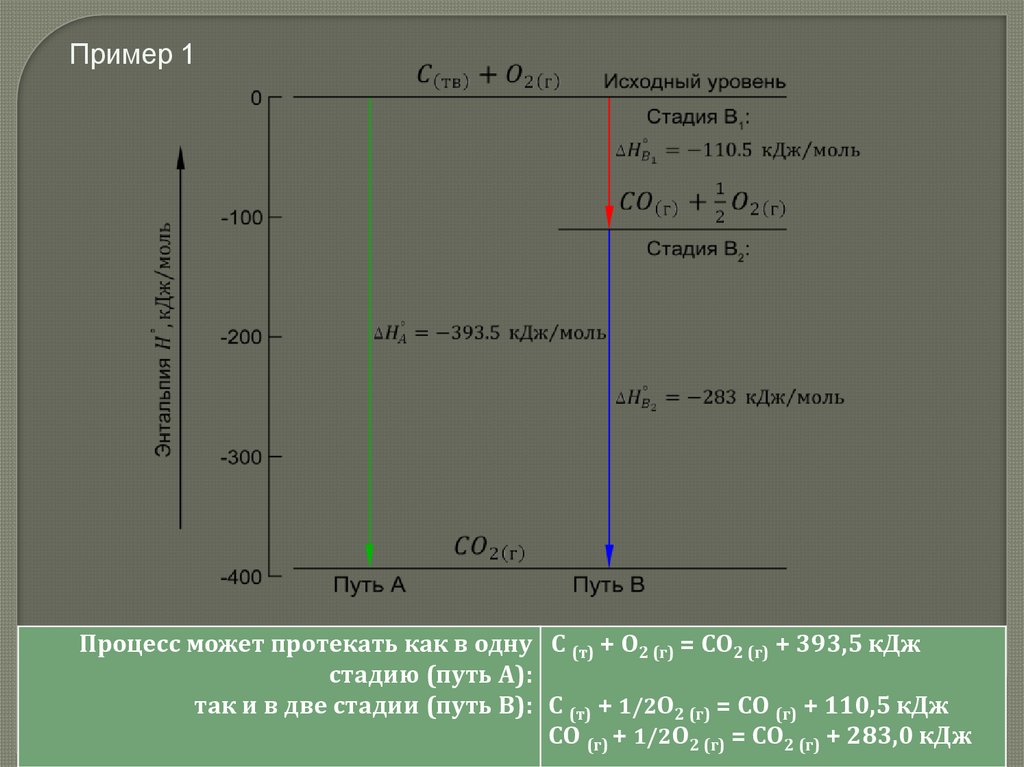
Пример 1Процесс может протекать как в одну С (т) + О2 (г) = СО2 (г) + 393,5 кДж
стадию (путь А):
так и в две стадии (путь В): С (т) + 1/2О2 (г) = СО (г) + 110,5 кДж
СО (г) + 1/2О2 (г) = СО2 (г) + 283,0 кДж
17.
Пример 218.
19.
ЗАКОН ГЕССАПример: Определите изменение энтальпии Hх в реакции
взаимодействия газообразного аммиака с раствором
хлороводородной кислоты с образованием хлорида аммония:
NH3 (г) + HCl (р) = NH4Cl (р);
Hх
(ӿ)
если известны величины Hi следующих реакций:
1) образование твердого хлорида аммония из газообразного аммиака и
хлороводорода ( H1):
NH3 (г) + HCl (г) = NH4Cl (тв) ,
H1
(1)
2) образование раствора хлорида аммония (aq – означает растворение
в воде с образованием бесконечно разбавленного раствора) ( H2):
NH4Cl (тв) + aq = NH4Cl (р),
H2
(2)
3) образование раствора хлороводородной кислоты ( H3):
HCl (г) + aq = HCl (р)
H3
(3)
Комбинируя реакции 1, 2 и 3, получаем интересующую нас реакцию (ӿ),
для которой:
Hх = H1 + H2 + H3
20.
ЗАКОН ГЕССА,следствие, математическое выражение:
ΔНºр-ции = Σ ni ∙ΔНºf (прод.) – Σ nj ∙ΔНºf (исх. в-в),
где ni и nj – стехиометрические коэффициенты в уравнении
реакции; i – для продуктов реакции; j – для исходных веществ;
ΔНºf – стандартная энтальпия образования вещества, кДж/моль
Стандартная энтальпия образования вещества (ΔНºf, кДж/моль)
– изменение энтальпии в реакции образования 1 моль вещества
из простых веществ в стандартных условиях (при температуре
25 С (298,15 К) и давлении 1 атм = 760 мм рт. ст. = 101,3 кПа)
Пример: для реакции
Al2O3 (тв) + 3SO3 (г) = Al2(SO4)3 (тв)
ΔНºр-ции = ΔНºf [Al2(SO4)3 (тв)] – {ΔНºf [Al2O3 (тв)] + 3ΔНºf [SO3 (г)]}
= -3444,1 кДж – {-1676,8 кДж + 3(-376,2 кДж)} = -638,7 кДж
Al2O3 (тв) + 3SO3 (г) = Al2(SO4)3 (тв) + 638,7 кДж
21.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙОсновные понятия:
Энтропия (S), (Дж∙моль-1∙К-1, кал∙моль-1∙К-1) – функция
состояния системы, такая же фундаментальная и
универсальная, как энергия (понятие введено Р.
Клаузиусом)
В классической термодинамике энтропия – такое свойство
системы, изменение которого в обратимом процессе численно
равно
отношению
теплоты
процесса
к
абсолютной
температуре протекания процесса:
dS = dQ/Т
S = k ∙ lnWU, V
где WU,V – термодинамическая вероятность данного состояния
системы при определенном запасе внутренней энергии U и объеме V;
k – постоянная Больцмана, равная 1,38 10ˉ23 Дж/К.
22.
ВТОРОЕ НАЧАЛО (ЗАКОН) ТЕРМОДИНАМИКИР. Клаузиус, 1850 г.; У. Томсон (лорд Кельвин), 1851 г.
Предпосылки:
исследования французского военного инженера С. Карно
(1824 г.) принципов действия тепловых двигателей с
целью повышения их коэффициента полезного действия
(КПД).
Формулировки второго начала термодинамики:
1. Невозможен самопроизвольный переход тепла от тела
менее нагретого к телу более нагретому (Р. Клаузиус).
2. Невозможно превратить теплоту в работу, не
производя никакого другого действия, кроме охлаждения
источника тепла (У. Томсон, М. Планк).
3. Вечный двигатель второго рода невозможен
(В. Оствальд).
23.
ВТОРОЕ НАЧАЛО (ЗАКОН) ТЕРМОДИНАМИКИВ изолированных системах самопроизвольно идут те
процессы, при которых происходит увеличение энтропии
( Sизолир > 0)
– Все системы самопроизвольно стремятся
достигнуть состояния с наибольшей
разупорядоченностью (с бóльшим беспорядком).
Энтропия (S) – мера неупорядоченности в системе,
или вероятности ее состояния.
При протекании необратимых процессов энтропия
увеличивается и стремится к максимальному
значению: ΔS > 0.
* Энтропия идеального кристалла индивидуального
вещества при температуре абсолютного нуля (0 К) равна
нулю
24.
ИЗМЕНЕНИЕ ЭНТРОПИИ, ΔSS i S j S
0
0
i
0
j
Энтропия всегда увеличивается (ΔS > 0) в процессах:
при переходе из конденсированного состояния
(твердого) в жидкое, из жидкого в газообразное;
при растворении твердого или жидкого вещества;
при диссоциации электролита; чем больше степень
диссоциации, тем заметней увеличивается энтропия;
в химических реакциях, идущих с образованием
газообразных веществ.
* Чем сложнее состав вещества, тем больше его
энтропия S°.
25.
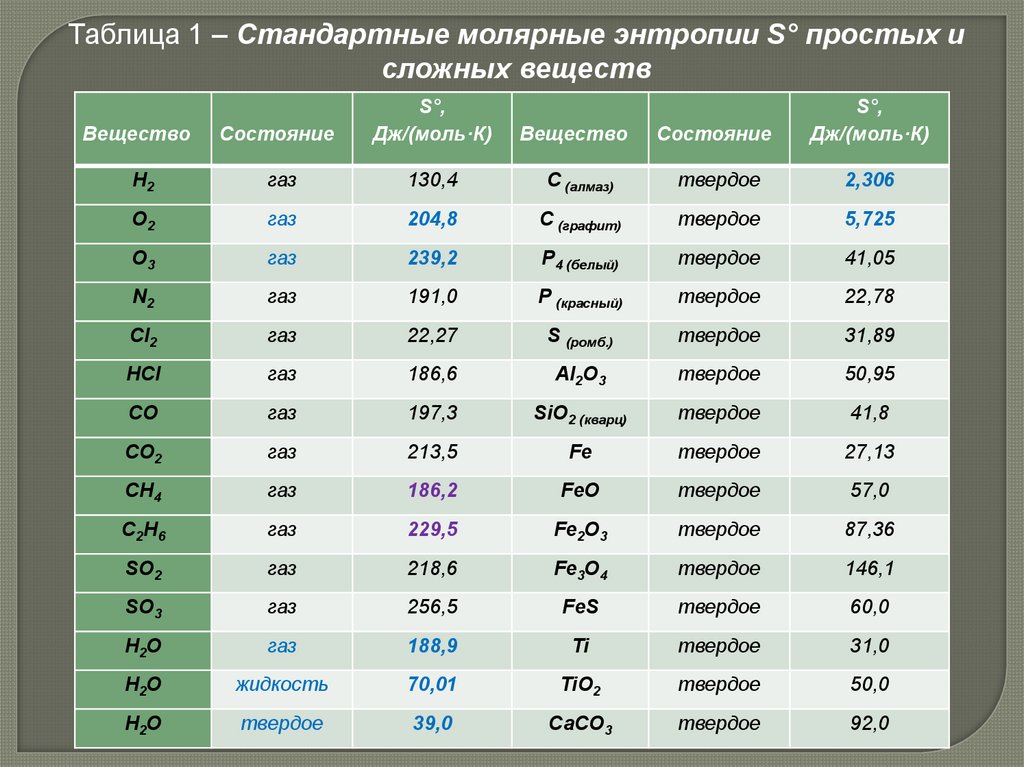
Таблица 1 – Стандартные молярные энтропии S° простых исложных веществ
Вещество
Состояние
S°,
Дж/(моль·К)
Вещество
Состояние
S°,
Дж/(моль·К)
Н2
газ
130,4
С (алмаз)
твердое
2,306
О2
газ
204,8
С (графит)
твердое
5,725
О3
газ
239,2
P4 (белый)
твердое
41,05
N2
газ
191,0
P (красный)
твердое
22,78
Cl2
газ
22,27
S (ромб.)
твердое
31,89
HCl
газ
186,6
Al2O3
твердое
50,95
СО
газ
197,3
SiO2 (кварц)
твердое
41,8
CО2
газ
213,5
Fe
твердое
27,13
CH4
газ
186,2
FeO
твердое
57,0
C2H6
газ
229,5
Fe2O3
твердое
87,36
SО2
газ
218,6
Fe3O4
твердое
146,1
SО3
газ
256,5
FeS
твердое
60,0
Н2O
газ
188,9
Ti
твердое
31,0
Н2O
жидкость
70,01
TiO2
твердое
50,0
Н2O
твердое
39,0
СаСО3
твердое
92,0
26.
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙОсновные понятия:
Энергия
Гиббса
(G)
(изобарно-изотермический
потенциал, свободная энергия; кДж/моль, ккал/моль) –
функция состояния термодинамической системы;
если давление и температура – независимые
параметры (р = const, Т = const), то:
G = H – TS.
Изменение энергии Гиббса:
ΔGо = ΔHо – TΔSо
ΔG – критерий возможности самопроизвольного
протекания процессов.
Для самопроизвольно протекающих процессов:
ΔGо < 0
Gо = ( Hо – T Sо) < 0
27.
Таблица 2 – Критерии возможности самопроизвольногопротекания процессов
Ограничения,
накладываемые на
систему
Изолированная
система
Неизолированная
система,
T, p = const
Функция состояния
S
G
Определение
изменения функции
состояния
Критерий
самопроизвольного
протекания
процесса
Условие равновесия
G = H – T S
S
Qобр
T
S > 0
G < 0
S = 0; максимум S G = 0, минимум G
28.
ИЗМЕНЕНИЕ ЭНЕРГИИ ГИББСА0
0
0
G298
i G298
j G298
i
j
0
0
0
G298 H 298 298 S 298
Стандартные значения
справочных таблицах.
ΔНºf
ΔНºf,
Sº,
ΔGºf
приведены
в
и ΔGºf – характеристики термодинамической
стабильности веществ: чем более отрицательное значение
они имеют, тем устойчивее вещество, то есть тем легче
оно образуется из исходных простых веществ и тем
труднее разлагается на исходные вещества.
29.
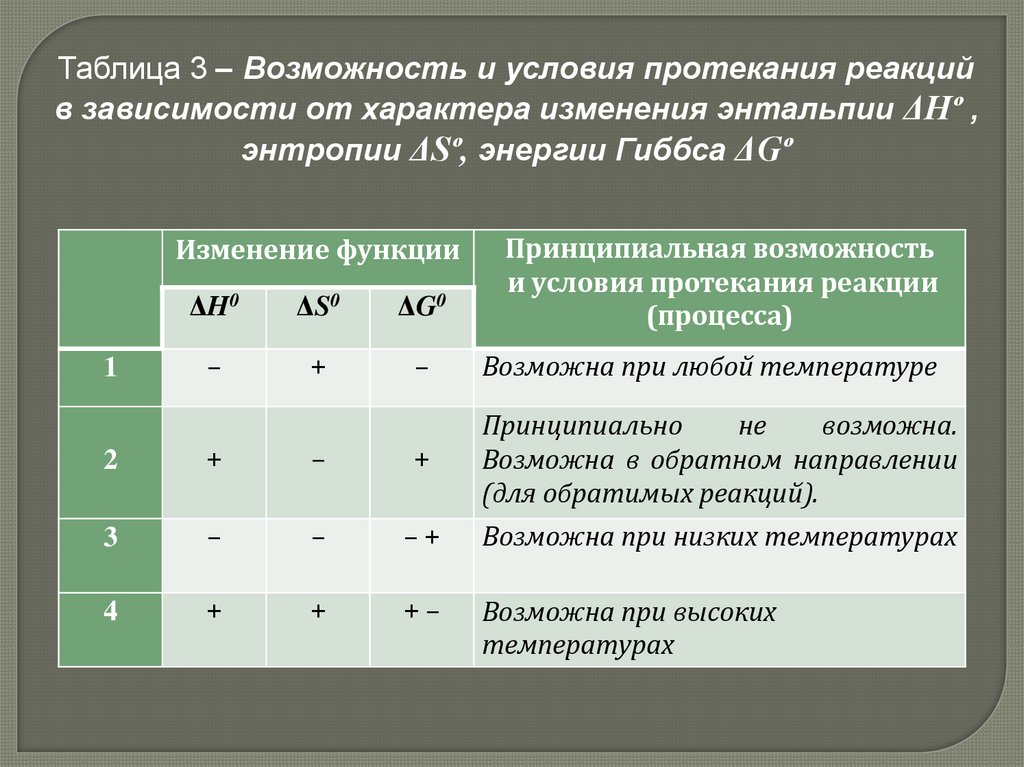
Таблица 3 – Возможность и условия протекания реакцийв зависимости от характера изменения энтальпии ΔНº ,
энтропии ΔSº, энергии Гиббса ΔGº
ΔH0
ΔS0
ΔG0
Принципиальная возможность
и условия протекания реакции
(процесса)
–
+
–
Возможна при любой температуре
Изменение функции
1
2
+
–
+
Принципиально
не
возможна.
Возможна в обратном направлении
(для обратимых реакций).
3
–
–
–+
Возможна при низких температурах
4
+
+
+–
Возможна при высоких
температурах
























 chemistry
chemistry








