Similar presentations:
Белки - активаторы и белки - ингибиторы
1.
Биология 10 класс06.11.2024
Белкиактиваторы и
белкиингибиторы
2.
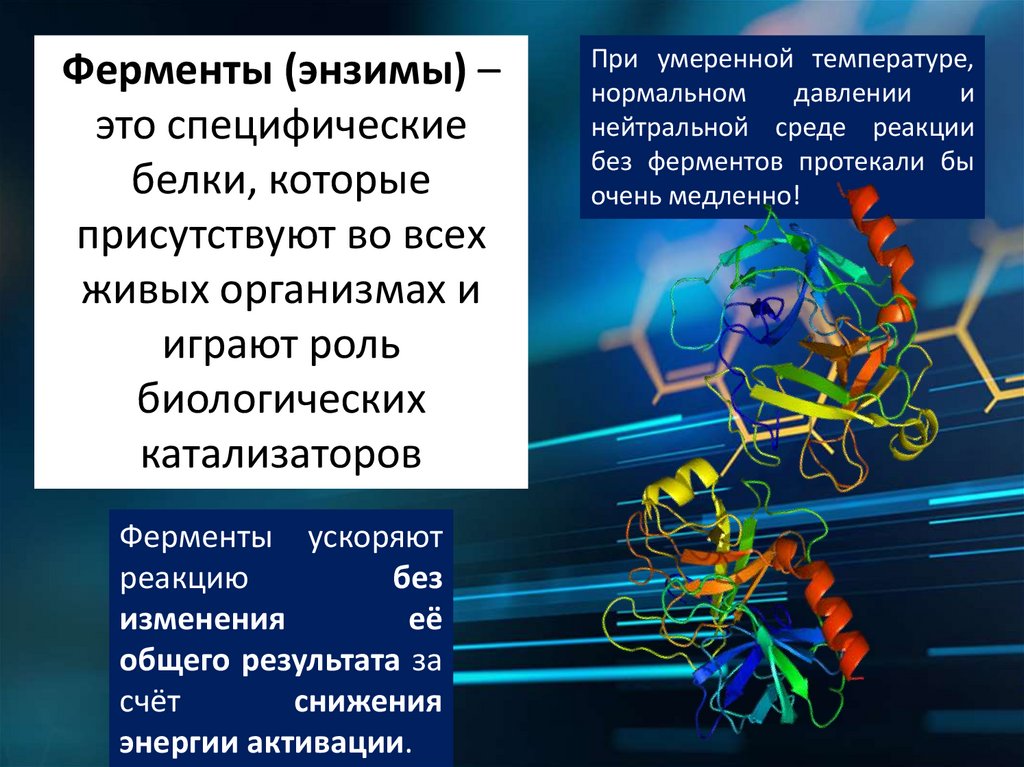
Ферменты (энзимы) –это специфические
белки, которые
присутствуют во всех
живых организмах и
играют роль
биологических
катализаторов
Ферменты ускоряют
реакцию
без
изменения
её
общего результата за
счёт
снижения
энергии активации.
При умеренной температуре,
нормальном
давлении
и
нейтральной среде реакции
без ферментов протекали бы
очень медленно!
3.
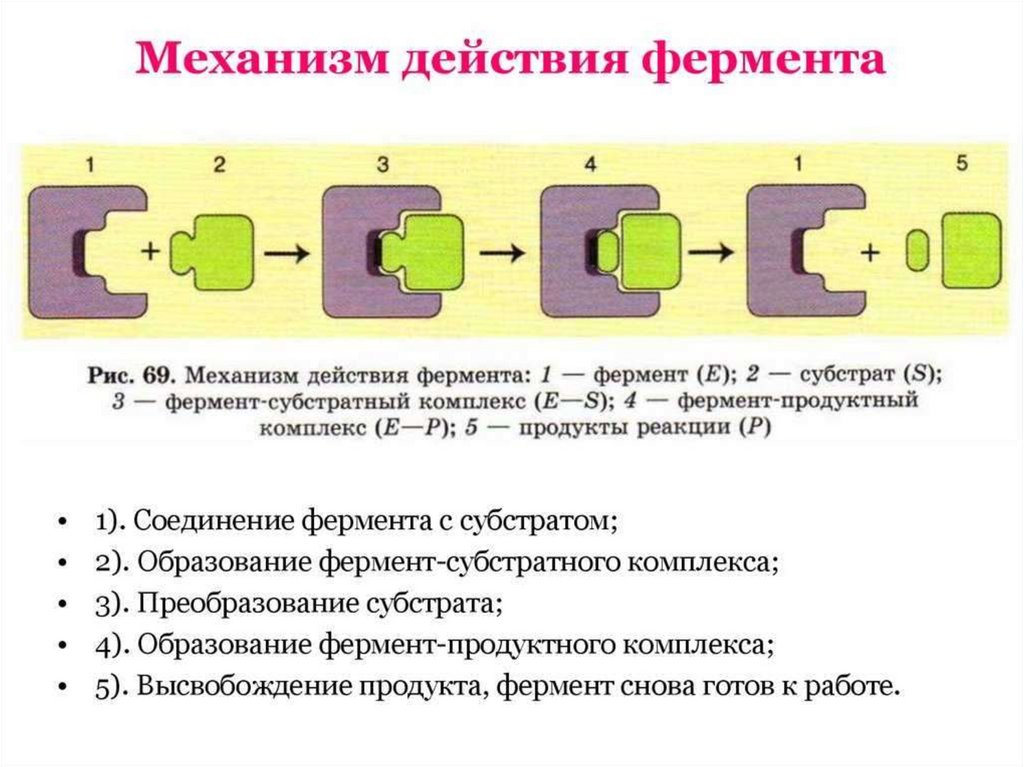
Ферменты обладают высокойспецифичностью – фермент
катализирует только 1 реакцию
или действует только на один тип
связи.
Скорость ферментативных реакций зависит от :
1. Природы и концентрации фермента и субстрата.
2. Температуры.
3. Давления.
4. Кислотности среды.
5. Наличия ингибиторов и т.д.
4.
5.
Классификация ферментовОксидоредуктазы - катализируют
окислительно-восстановительные
реакции, осуществляя перенос
атомов Н и О или электронов от
одного вещества к другому,
окисляя при этом первый и
восстанавливая второй.
Лиазы
–
катализируют
негидралитическое присоединение
к субстрату или отщепление от него
группы атомов.
Изомеразы
–
осуществляют
внутримолекулярные перестройки,
т.е. катализируют превращение
одного изомера в другой
Трансферазы
–
катализируют
перенос группы атомов от одного
вещества к другому.
Гидролазы
–
ускоряют
реакции
расщепления
сложных
органических
соединений на более простые
путём
присоединения
молекул воды в месте
разрыва химической связи.
Лигазы (синтетазы) катализируют реакции
соединения двух молекул с
образованием новых связей,
используя энергию АТФ.
6.
Регуляция активности ферментов может осуществляться путёмвзаимодействия ферментов с различными биологическими
компонентами или чужеродными соединениями, которые
называются регуляторами ферментов. Они могут либо ускорять,
либо замедлять ферментативную реакцию.
Активаторы – это
вещества, увеличивающие
скорость ферментативной
реакции.
Ингибиторы ферментов это вещества,
замедляющие
ферментативные реакции.
7.
Виды активаторов:1. Вещества, влияющие на область активного центра. К ним относятся ионы
металлов (Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ и др.). В ряде случаев
ионы металлов выполняют функцию кофактора фермента. В других случаях они
способствуют присоединению субстрата к активному центру фермента. Ионы
металлов оказываются активаторами только в условиях дефицита их в организме.
2. Аллостерические эффекторы, которые связываются с аллостерическим
(регуляторным) участком апофермента. Это связывание вызывает
конформационные изменения в молекуле белка, приводящие к изменению
структуры активного центра, что сказывается на связывании и превращении
субстрата в активном центре. При этом активность фермента либо увеличивается
(это аллостерические активаторы), либо уменьшается (это аллостерические
ингибиторы). Аллостерическими эффекторами ферментов наиболее часто
выступают различные метаболиты, а также гормоны, ионы металлов,
нуклеозиды - АТФ, АДФ, АМФ.
3. Вещества, вызывающие модификации, не затрагивающие активный центр
фермента.
• - активация путём присоединения специфической модифицирующей группы к
молекуле фермента.
• - активация путём перехода неактивного предшественника - профермента в
активный фермент за счёт частичного протеолиза.
• - активатор вызывает диссоциацию субъединиц фермента, имеющего
четвертичную структуру.
8.
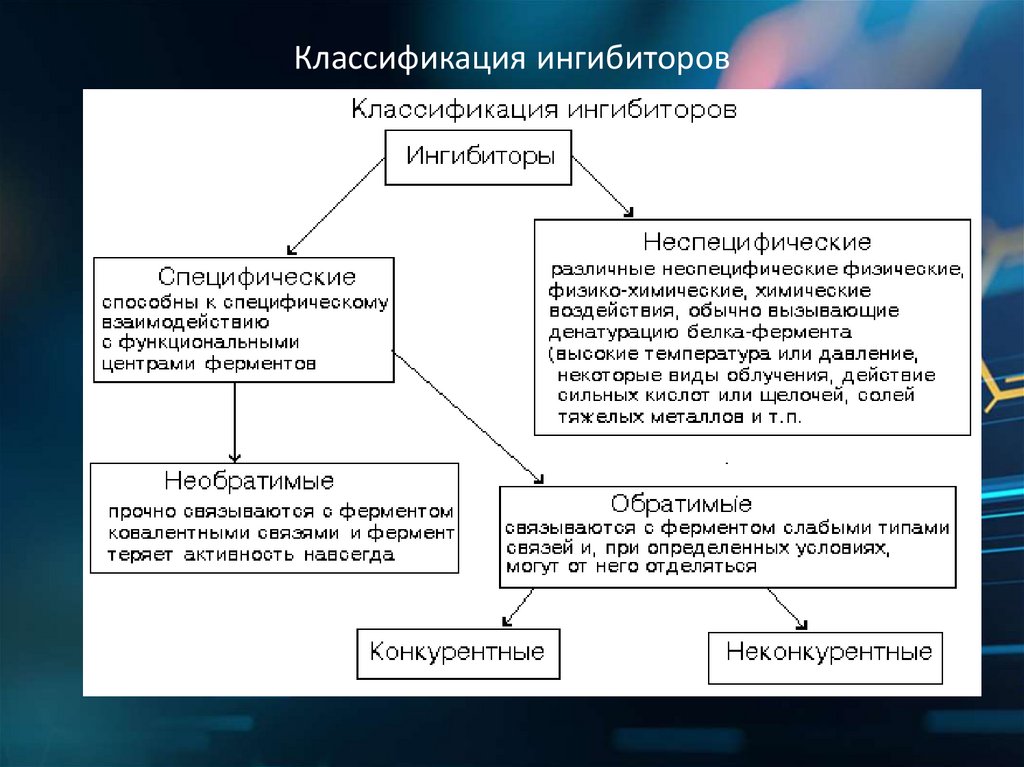
Классификация ингибиторов9.
Конкурентное ингибирование. Ингибитор похож насубстрат фермента по своей структуре и соперничает с
субстратом за активный центр (садится на активный центр
фермента), что приводит к уменьшению связывания
субстрата с ферментом и нарушению катализа. В этом
состоит особенность конкурентного ингибирования –
возможность усилить или ослабить ингибирование через
изменение концентрации субстрата.
Неконкурентное ингибирование. Ингибитор не
имеет структурного сходства с субстратом и
присоединяется не в активном центре, а в другом месте
молекулы, одновременно с субстратом. Образуется
тройной комплекс: субстрат - фермент - ингибитор. Это
ведет к деформации активного центра и каталитической
активности. Например, синильная кислота (цианиды)
связывается с гемовым железом ферментов дыхательной
цепи и блокирует клеточное дыхание.
10.
11.
Домашнее заданиеПроработать материал презентации;
Повторить § 11 (учебник)
Выполнить задание из ЕГЭ по ферментам (см.
слайд 12)
12.
Задания из ЕГЭ по ферментам1. При какой температуре и реакции среды фермент желудочного сока
наиболее активно действуют на белки
1) выше температуры тела, в щелочной среде
2) выше температуры тела, в нейтральной среде
3) при нормальной температуре тела, в кислой среде
4) при нормальной температуре тела, в щелочной среде
2. Найдите три ошибки в приведенном тексте.
Укажите номера предложений, в которых они допущены, и объясните их.
(1)Быстрое протекание химических реакций в организме обеспечивают
ферменты. (2)Один фермент катализирует несколько разных реакций. (3)Так,
например, фермент, расщепляющий белки, может расщеплять и жиры. (4)По
химической природе ферменты — это только белковые молекулы. (5)Они
(ферменты) не изменяются по своему химическому составу в результате
реакции. (6)Каждая молекула фермента может осуществлять несколько тысяч
операций в минуту. (7)Активность ферментов зависит от его количества,
температуры, и рН-среды.






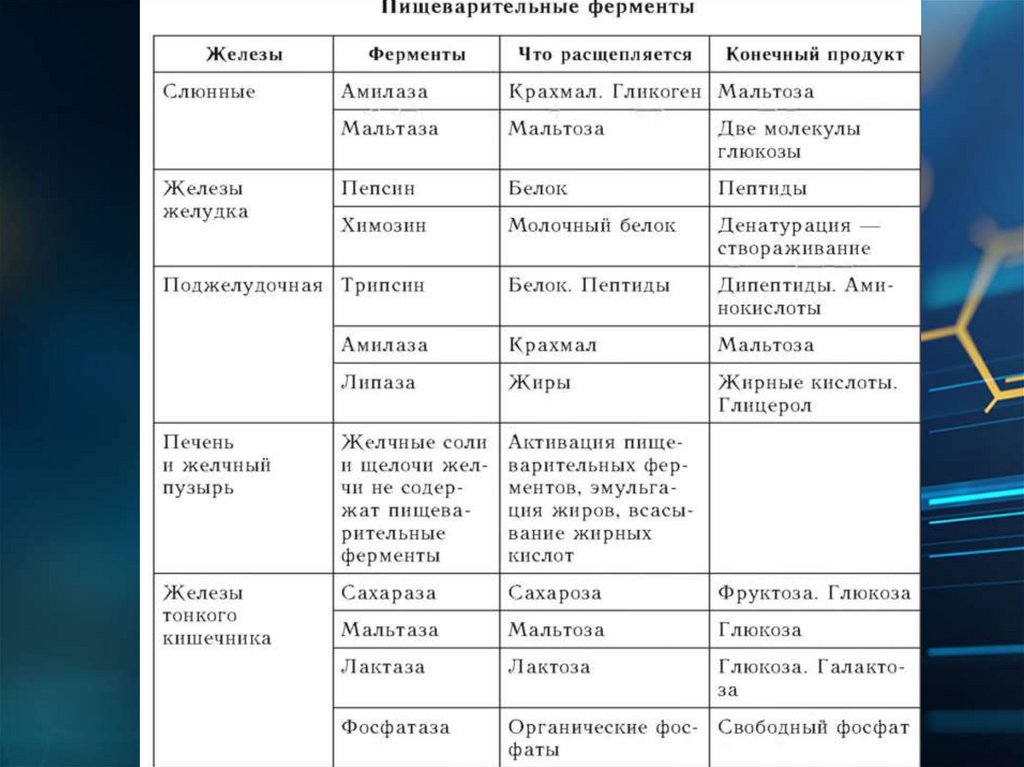


 biology
biology