Similar presentations:
Механизм действия ферментов. Номенклатура и классификация ферментов. Лекция №4
1.
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ филиал федерального государственного бюджетного образовательного учреждения высшего образования«ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
Министерства здравоохранения Российской Федерации
Кафедра биологической химии
Специальность: «Фармация»
Семестр 5, курс 3
Лекция №4
Механизм действия ферментов.
Номенклатура и классификация
ферментов
Пятигорск, 2024
2.
Ферменты - это биокатализаторы белковой природы,изменяющие скорость химических реакций в живых клетках
Три группы свойств ферментов:
1.
Свойства ферментов как белков
Имеют высокую молекулярную массу
Образуют коллоидные растворы, обладают высокой вязкостью, оптическими свойствами
Термолабильны
Могут обратимо и необратимо осаждаться и т.д.
2. Свойства ферментов как катализаторов
Катализируют только термодинамически возможные реакции
Не потребляются в ходе реакции и не входят в состав конечных продуктов
В случае обратимости реакции ускоряют и прямую и обратную реакции
Ведут реакцию «в обход энергетического барьера»
Чувствительны к изменению параметров проведения реакции (температуре, рН,
концентрации катализатора и реагирующих веществ)
Чувствительны к действию эффекторов – активаторов и ингибиторов
3. Собственные свойства ферментов
Высокая биологическая активность
Ферментная специфичность (действия, субстратная)
Иная зависимость от факторов, влияющих на скоростьреакции
Наличие механизмов регуляции активности
3.
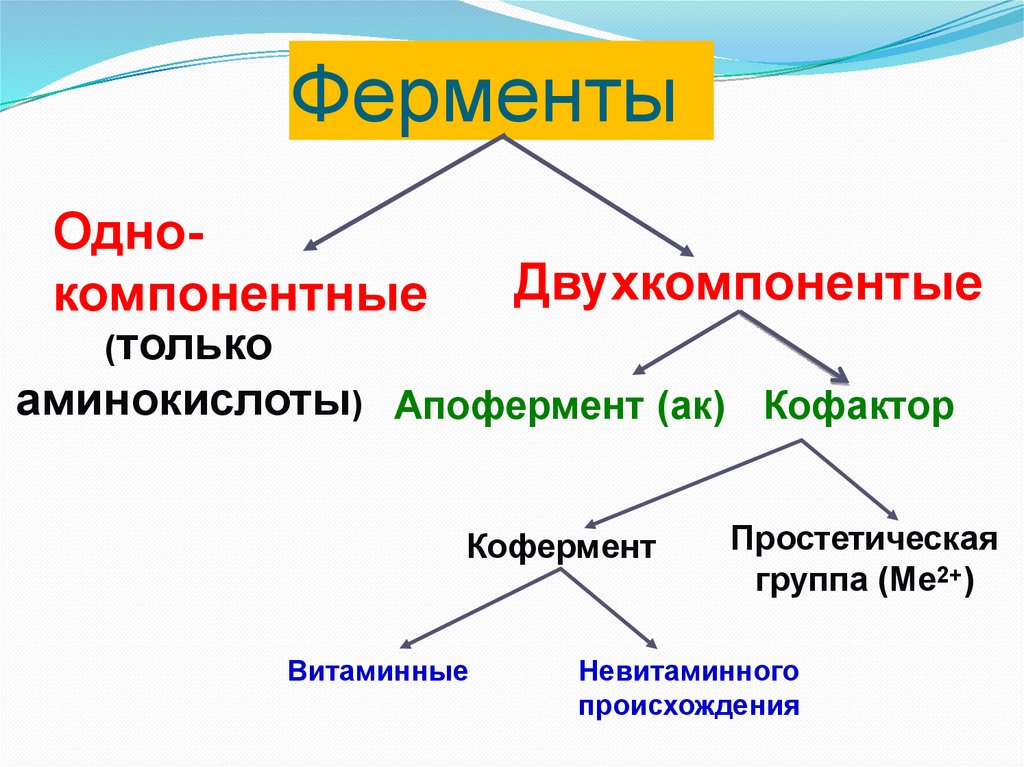
ФерментыОднокомпонентные
Двухкомпонентые
(только
аминокислоты) Апофермент (ак) Кофактор
Кофермент
Витаминные
Простетическая
группа (Ме2+)
Невитаминного
происхождения
4.
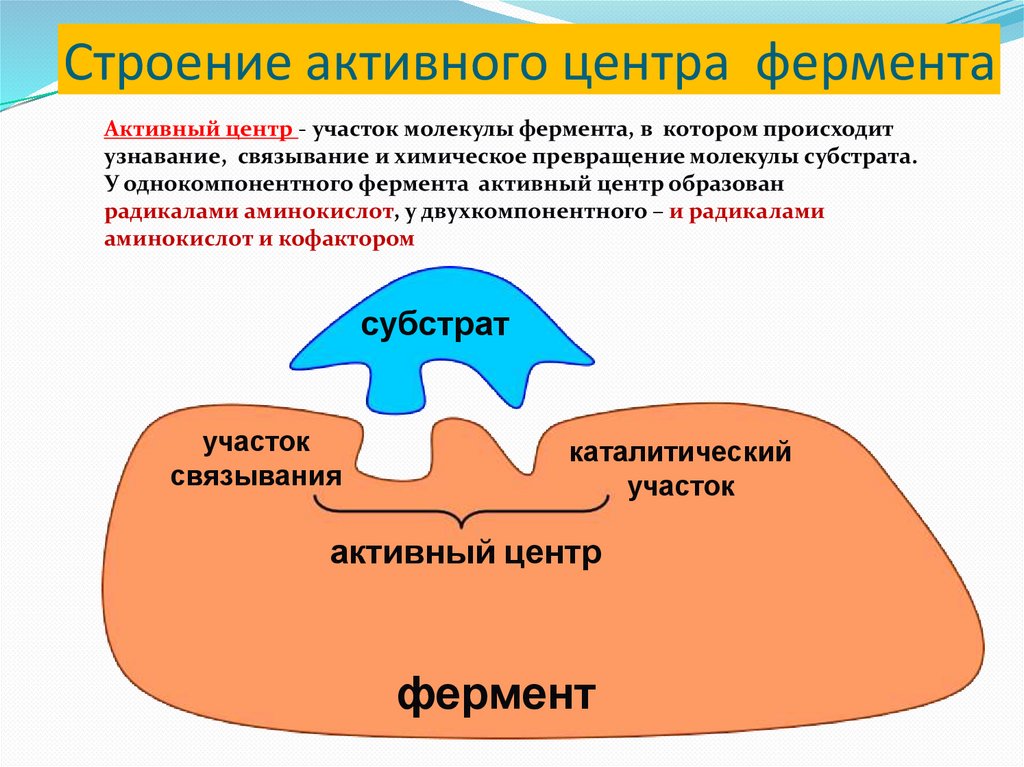
Строение активного центра ферментаАктивный центр - участок молекулы фермента, в котором происходит
узнавание, связывание и химическое превращение молекулы субстрата.
У однокомпонентного фермента активный центр образован
радикалами аминокислот, у двухкомпонентного – и радикалами
аминокислот и кофактором
субстрат
участок
связывания
каталитический
участок
активный центр
фермент
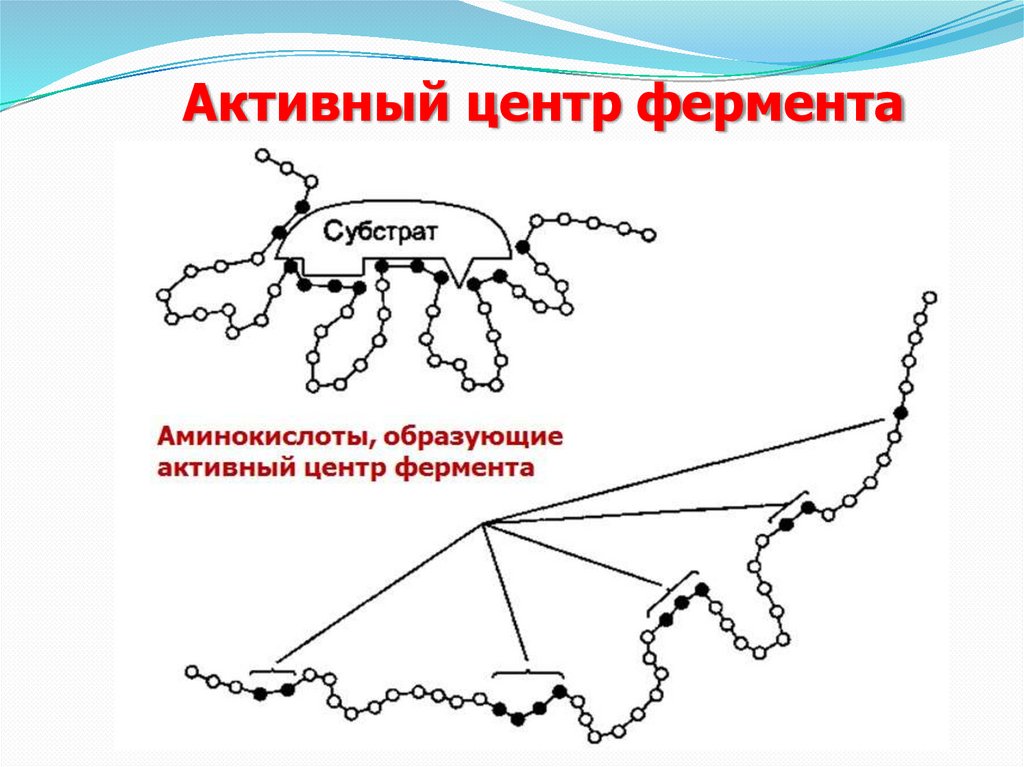
5.
Активный центр фермента6.
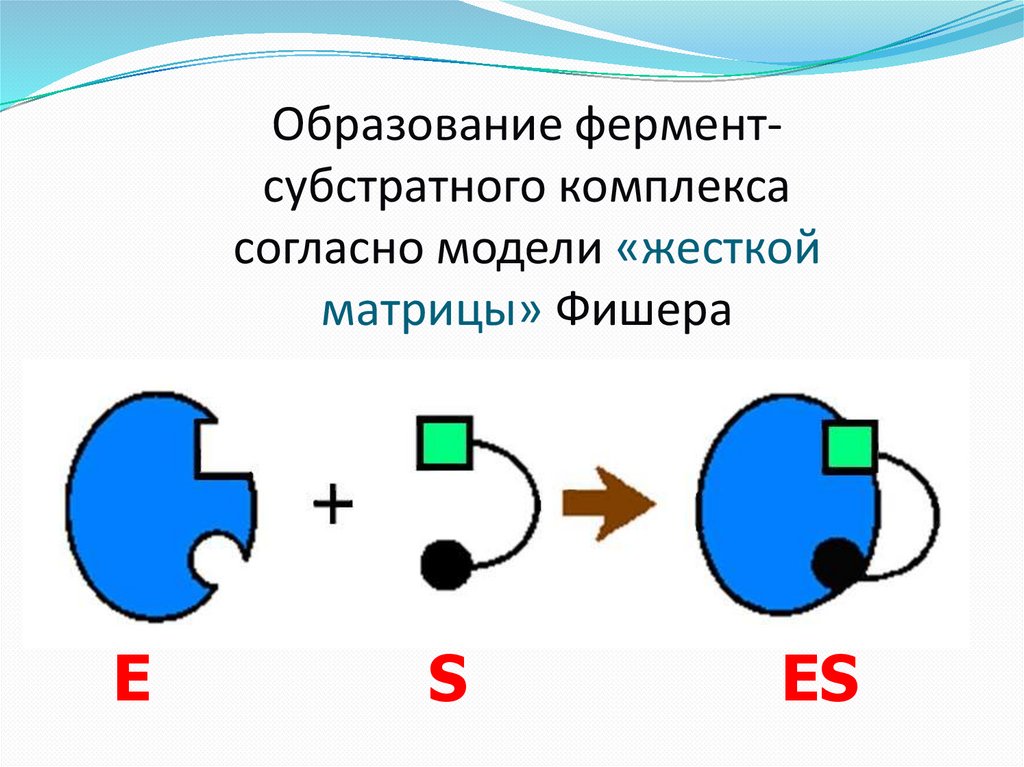
Образование ферментсубстратного комплексасогласно модели «жесткой
матрицы» Фишера
E
S
ES
7.
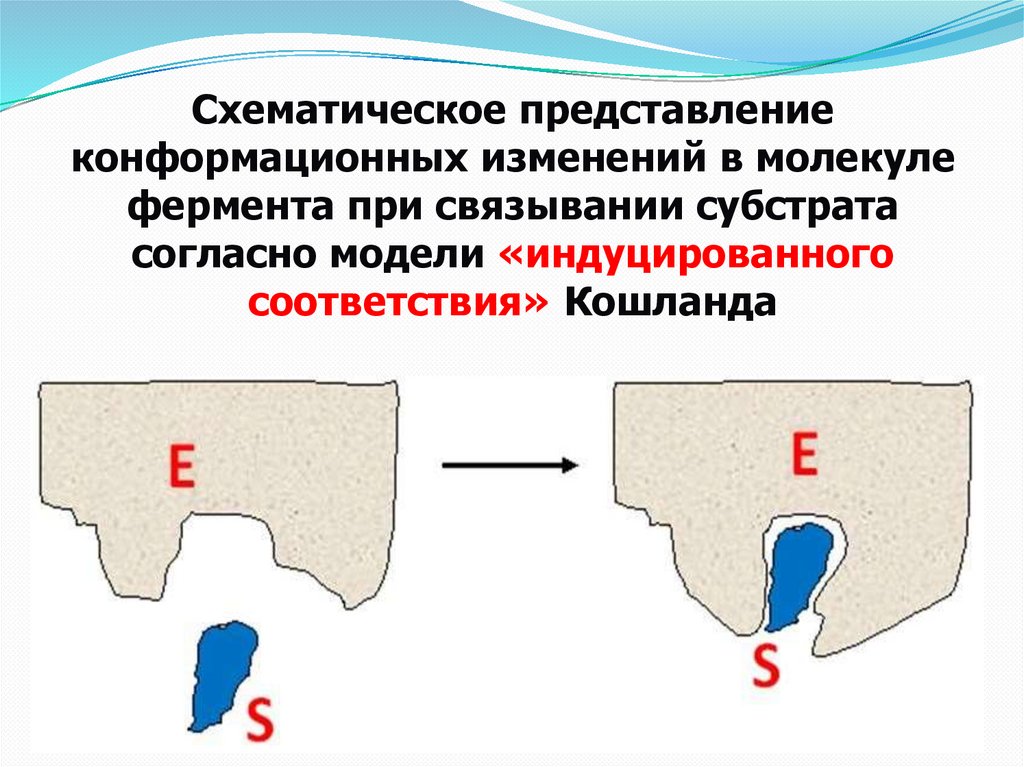
Схематическое представлениеконформационных изменений в молекуле
фермента при связывании субстрата
согласно модели «индуцированного
соответствия» Кошланда
8.
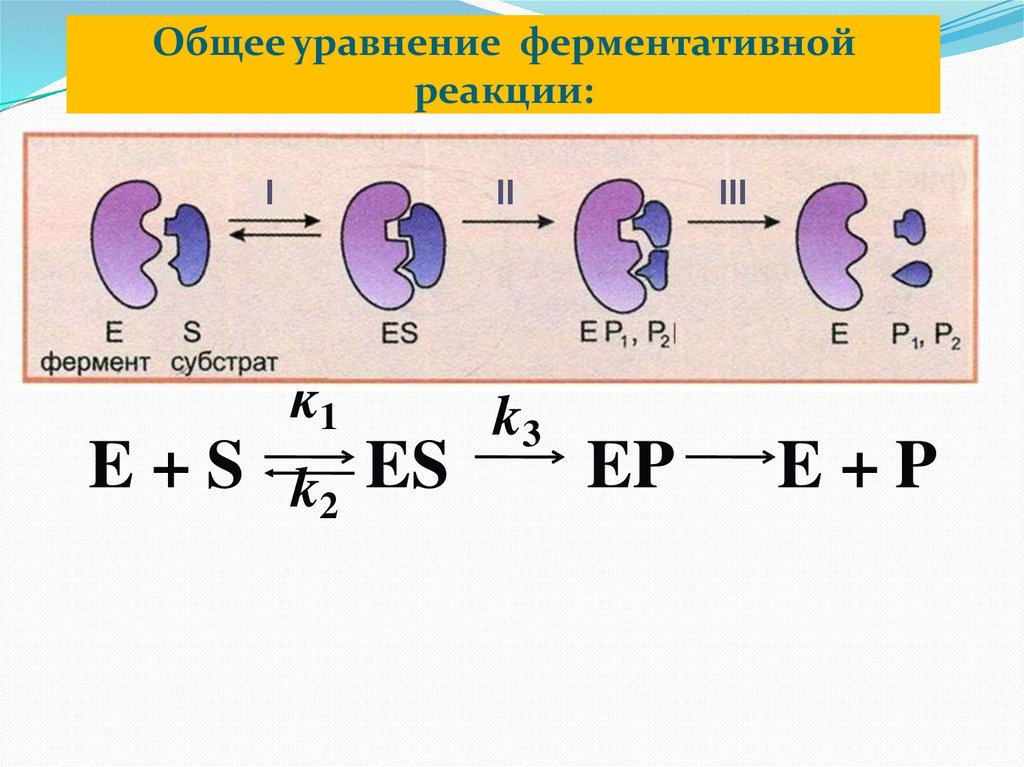
Общее уравнение ферментативнойреакции:
I
II
k1
E + S k2 ES
k3
III
EP
E+P
9.
Типы кофакторовКофактором называется небелковая часть
двухкомпонентных ферментов, которая может быть:
• простетической группой, в том случае, когда она
прочно связана с белковой частью (ионы металлов,
гем и т.д.), и еѐ невозможно отделить от
апофермента, не разрушив при этом фермент;
• коферментом, если связи с апоферментом
непрочные, соединение белковой и небелковой
частей происходит только на время биокатализа, и
затем образованный комплекс легко разрушается.
(Деление кофакторов на простетические группы и
коферменты довольно условно).
10.
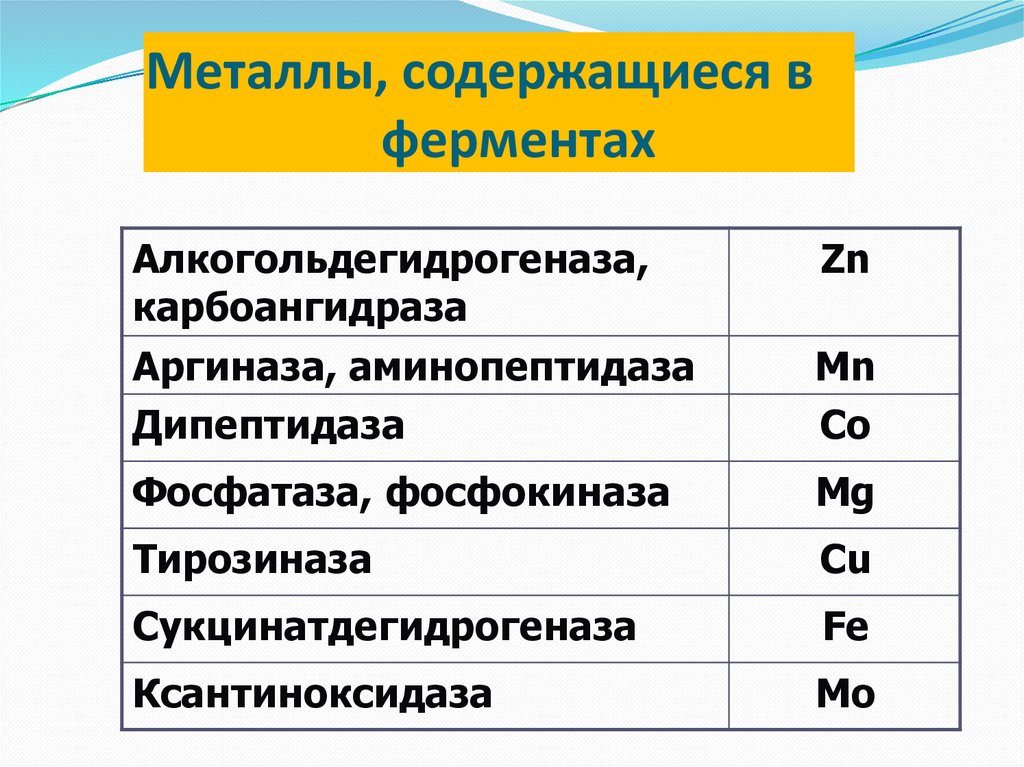
Металлы, содержащиеся вферментах
Алкогольдегидрогеназа,
карбоангидраза
Zn
Аргиназа, аминопептидаза
Дипептидаза
Mn
Co
Фосфатаза, фосфокиназа
Mg
Тирозиназа
Cu
Сукцинатдегидрогеназа
Fe
Ксантиноксидаза
Mo
11.
Классификация коферментовПо химическому строению
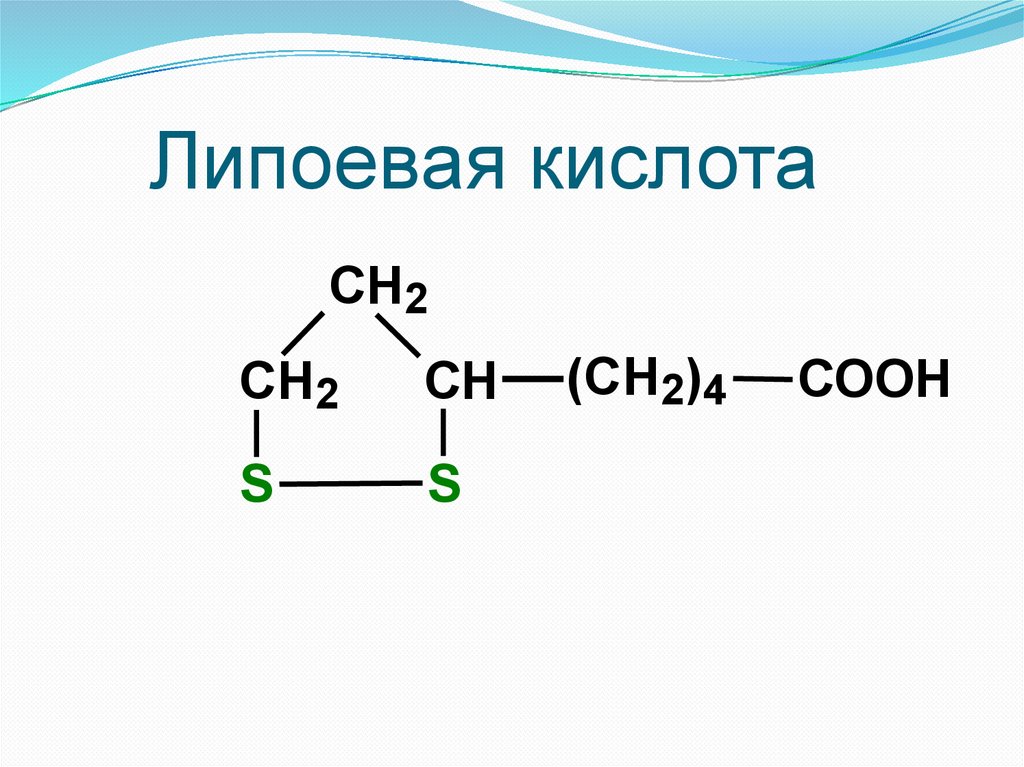
1.
Алифатические (липоевая
кислота);
2. Ароматические (коэнзим Q);
3. Гетероциклические (ТПФ, ПФ);
4. Нуклеотиды (НАД, НАДФ, ФАД,
ФМН)
12.
Липоевая кислотаCH2
СН2
СН
S
S
(СН2)4
COOH
13.
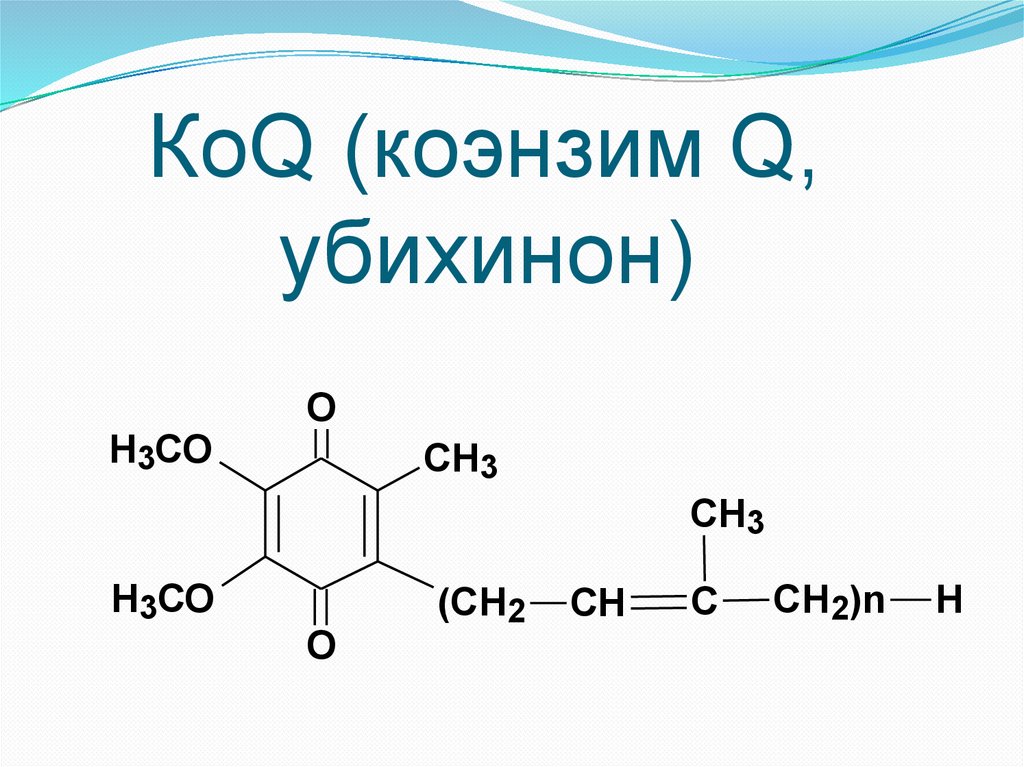
КоQ (коэнзим Q,убихинон)
Н3СО
O
CH3
CH3
Н3СО
(СН2
O
СН
С
СН2)n
Н
14.
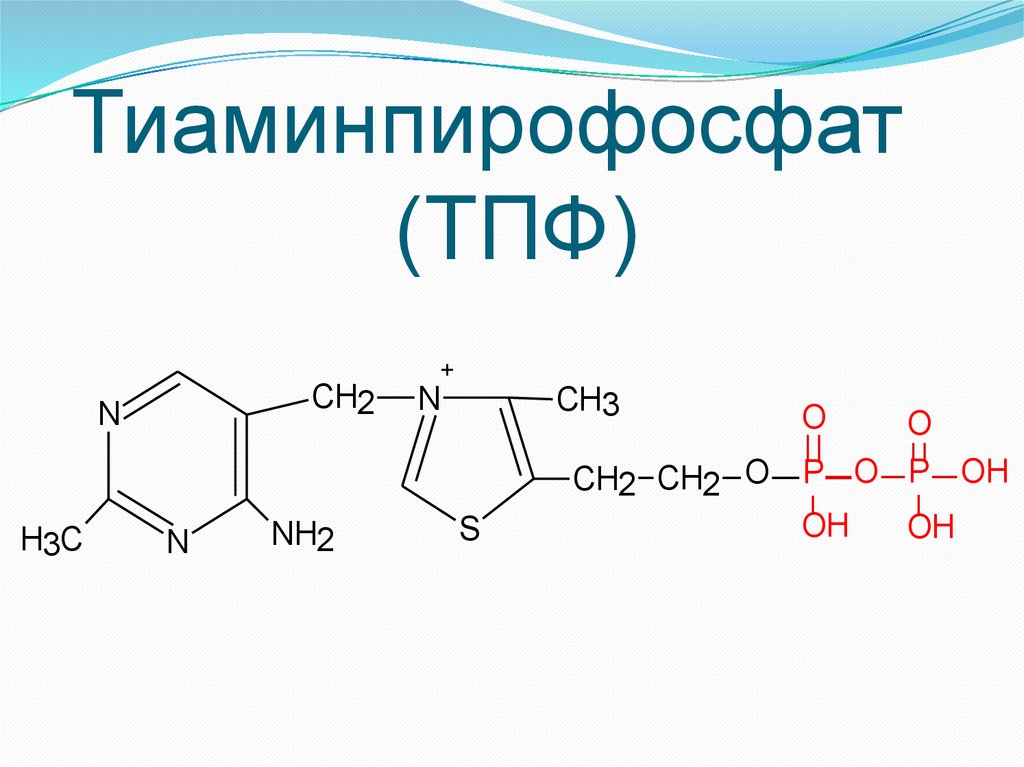
Тиаминпирофосфат(ТПФ)
CH2
N
H3C
N
NH2
+
N
CH3
S
O
O
CH2 CH2 O P O P OH
OH
OH
15.
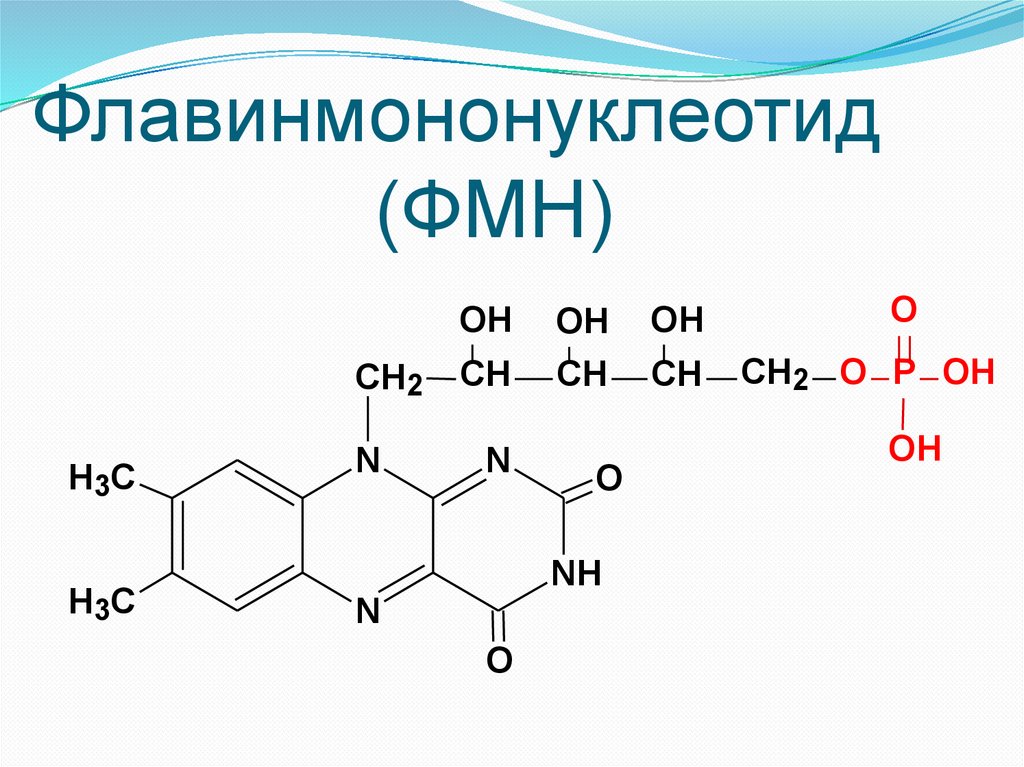
Флавинмононуклеотид(ФМН)
OH
H3C
H3C
CH2
CH
N
N
OH
CH
O
NH
N
O
OH
CH
O
CH2 O P OH
OH
16.
По выполняемым функциям1.
Переносчики протонов и
электронов (НАД, ФАД, Ко Q);
Переносчики групп (ТПФ,
ПФ, КоА);
3.
Коферменты синтеза и
изомеризации
2.
17.
По механизму действияКоферменты с высоким
потенциалом переноса энергии
(переносчики энергии);
2. Коферменты, участвующие в
окислительно-восстановительных
реакциях;
3.
Коферменты, формирующие
активный центр фермента.
1.
18.
Классификацияферментов
В 1961 г. в Москве V Международный
биохимический союз принял современную
классификацию. В основу классификации положен
тип химической реакции, катализируемой
ферментом. В соответствии с этой
классификацией все ферменты делятся:
• на классы – по типу катализируемой реакции;
• каждый класс подразделяется на подклассы – по
природе атакуемой химической группы;
• подклассы делятся на подподклассы – по характеру
атакуемой связи или по природе акцептора.
19.
Классификация ферментов1.
Оксидоредуктазы
– ферменты, катализирующие
окислительно-восстановительные реакции, лежащие в основе
биологического окисления. К оксидоредуктазам относятся
дегидрогеназы, оксидазы, моно- и диоксигеназы, пероксидазы.
Этот класс насчитывает 22 подкласса.
А Н2 + В
А + В Н2
2. Трансферазы – ферменты, катализирующие
межмолекулярный перенос атомов или функциональных групп
(т.е. от донора к акцептору):
В классе трансфераз девять подклассов в зависимости от типа
переносимой группы (аминотрансферазы, ацилтрансферазы,
метилтрансферазы и т.д.)
20.
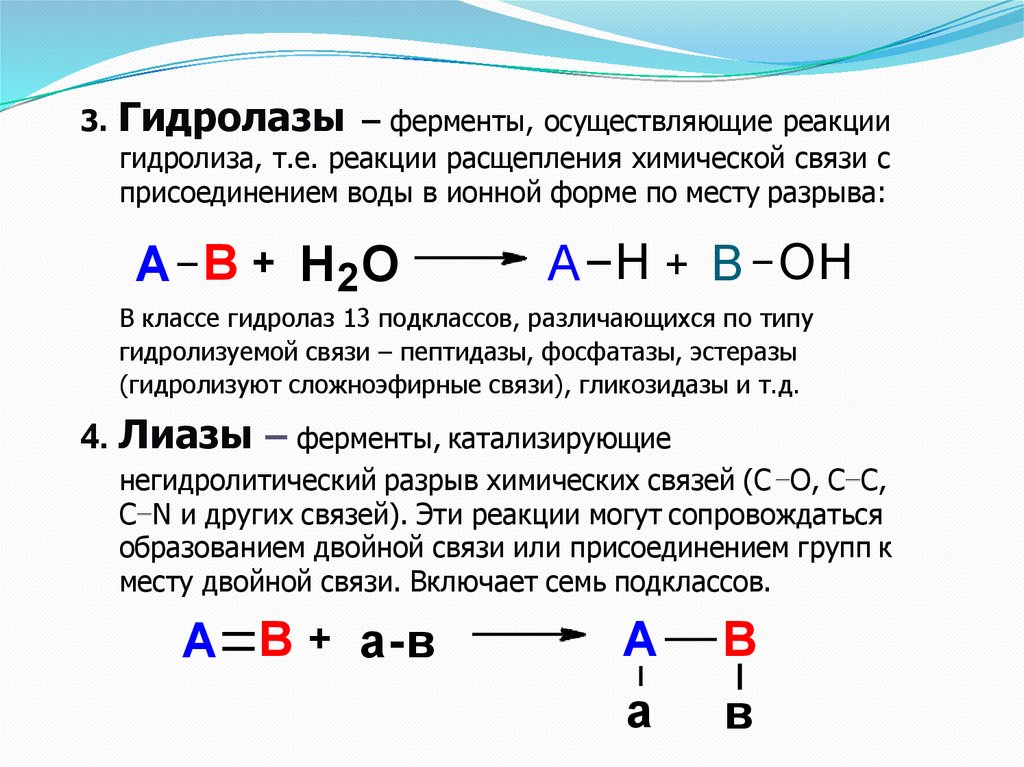
3. Гидролазы – ферменты, осуществляющие реакциигидролиза, т.е. реакции расщепления химической связи с
присоединением воды в ионной форме по месту разрыва:
А В + Н2О
А Н + В ОН
В классе гидролаз 13 подклассов, различающихся по типу
гидролизуемой связи – пептидазы, фосфатазы, эстеразы
(гидролизуют сложноэфирные связи), гликозидазы и т.д.
4. Лиазы – ферменты, катализирующие
негидролитический разрыв химических связей (С О, С С,
C N и других связей). Эти реакции могут сопровождаться
образованием двойной связи или присоединением групп к
месту двойной связи. Включает семь подклассов.
А В + а-в
А
а
В
в
21.
5. Изомеразы катализируют реакции изомеризации,взаимопревращения оптических и геометрических изомеров, а
также внутримолекулярный перенос групп (в этом случае они
называются также «мутазы»). Существует пять подклассов
изомераз.
цис
транс, D
L
6. Лигазы (синтетазы) – ферменты, катализирующие
присоединение друг к другу двух молекул с использованием
энергии высокоэнергетических связей АТФ (или других
нуклеозидтрифосфатов):
А + В + АТФ
А В + НР + АДФ
22.
В 2018 году было предложено ввести новый,седьмой класс ферментов – транслоказы.
Причиной стало то, что ни один из принятых
классов не может описать группу ферментов,
катализирующих движение ионов или молекул
через мембраны, или их разделение внутри
мембран. Некоторые из этих ферментов связаны с
гидролизом АТФ и ранее классифицировались как
АТФазы (ЕС 3.6.3.х), хотя гидролитическая
реакция не является их основной функцией.
23.
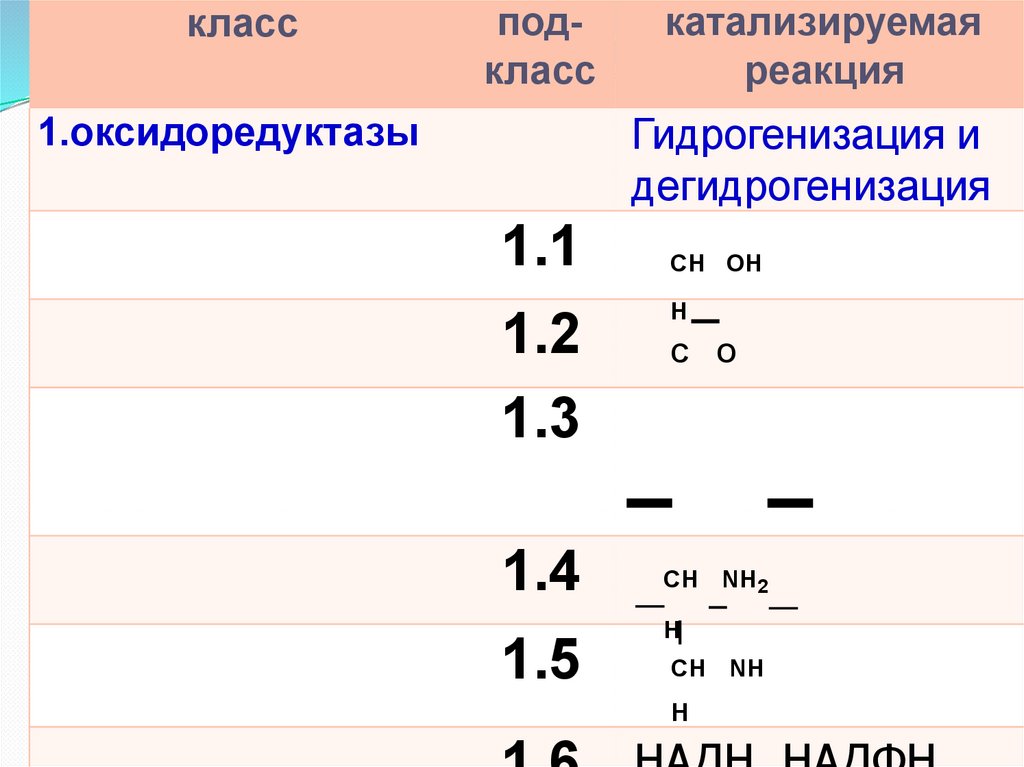
классподкласс
1.оксидоредуктазы
катализируемая
реакция
Гидрогенизация и
дегидрогенизация
1.1
1.2
1.3
1.4
1.5
СН OH
H
С O
СН
СН
СН NH2
H
СН NН
H
24.
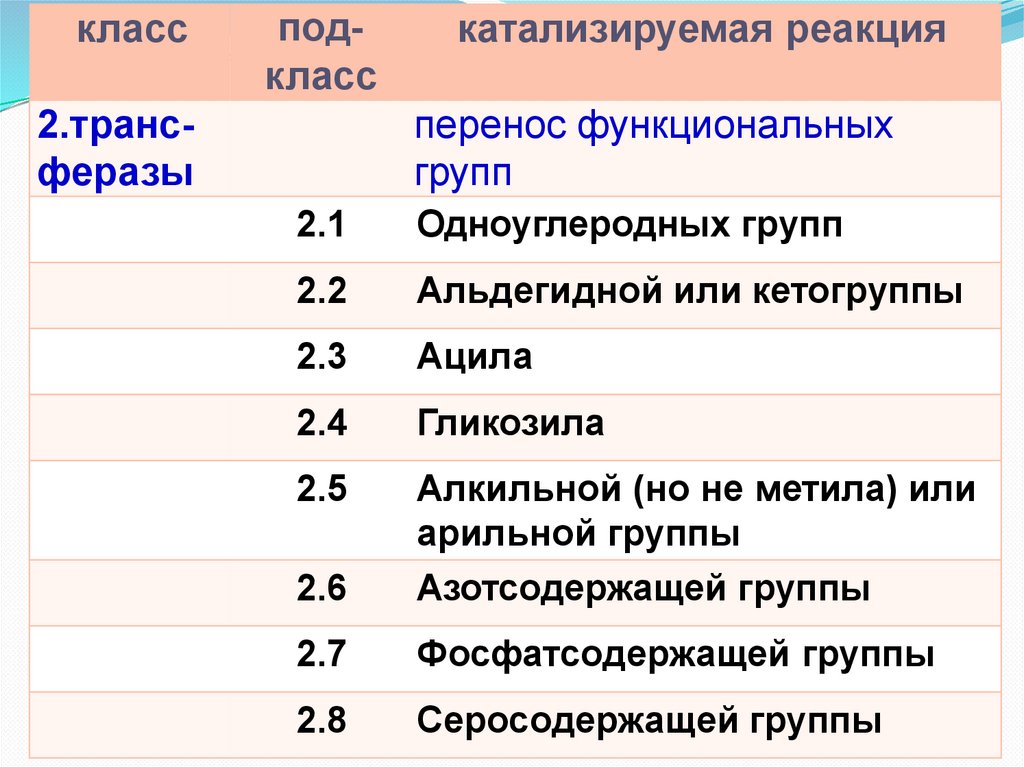
классподкласс
2.трансферазы
катализируемая реакция
перенос функциональных
групп
2.1
Одноуглеродных групп
2.2
Альдегидной или кетогруппы
2.3
Ацила
2.4
Гликозила
2.5
2.6
Алкильной (но не метила) или
арильной группы
Азотсодержащей группы
2.7
Фосфатсодержащей группы
2.8
Серосодержащей группы
25.
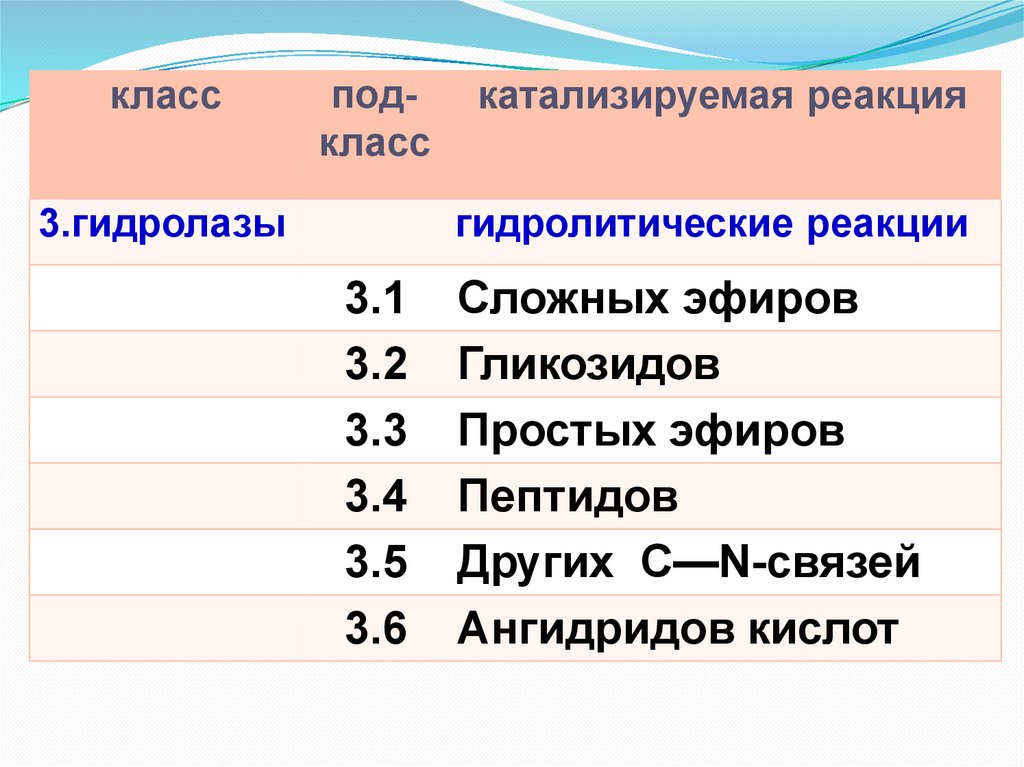
классподкласс
3.гидролазы
катализируемая реакция
гидролитические реакции
3.1
3.2
3.3
3.4
3.5
3.6
Сложных эфиров
Гликозидов
Простых эфиров
Пептидов
Других С—N-связей
Ангидридов кислот
26.
Номенклатура ферментовДля ферментов принято несколько типов названий –
систематическое (в соответствии с международной
классификацией), рабочее (более простое и удобное),
тривиальное.
• Так систематическое название фермента, катализирующего
дегидрирование глутаминовой кислоты – L-глутамат: NADоксидоредуктаза (рабочее – глутаматдегидрогеназа).
• Рабочее название фермента в большинстве случаев содержит
суффикс «аза», присоединѐнный к названию субстрата (амилаза,
уреаза, липаза) или к названию субстрата и типу реакции,
катализируемой ферментом (аденилатциклаза,
глутаматдегидрогеназа, гликогенфосфорилаза).
• Наряду с этими основными названиями используются также и
тривиальные, исторически устоявшиеся названия, не дающие
представления ни о субстрате, ни о типе катализируемой реакции
– пепсин, трипсин, тромбин, плазмин и т.д.
27.
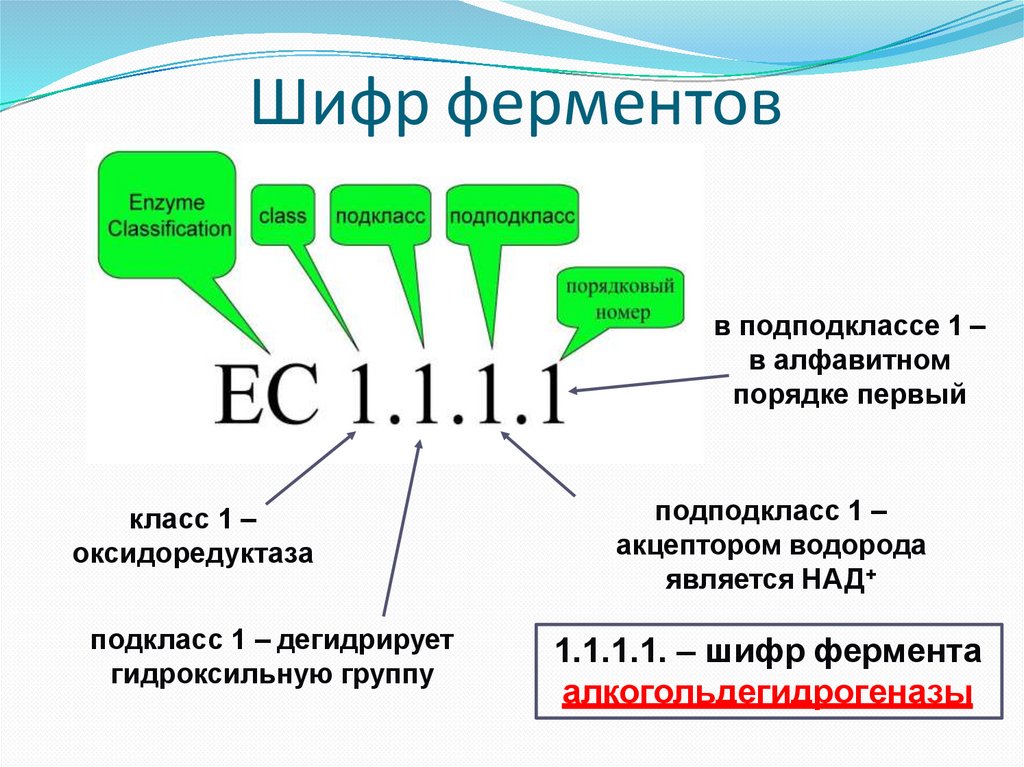
Шифр (индекс) ферментовВ соответствии с международной классификацией и
принятыми в 1972 г. «Правилами номенклатуры
ферментов» каждому ферменту присвоен четырехзначный
классификационный номер, включающий класс, подкласс,
подподкласс и порядковый номер в подподклассе. Перед
четырѐхзначным шифром ставятся буквы КФ
(классификатор ферментов) или ЕС (Enzyme classification)
28.
Шифр ферментовв подподклассе 1 –
в алфавитном
порядке первый
класс 1 –
оксидоредуктаза
подкласс 1 – дегидрирует
гидроксильную группу
подподкласс 1 –
акцептором водорода
является НАД+
1.1.1.1. – шифр фермента
алкогольдегидрогеназы
29.
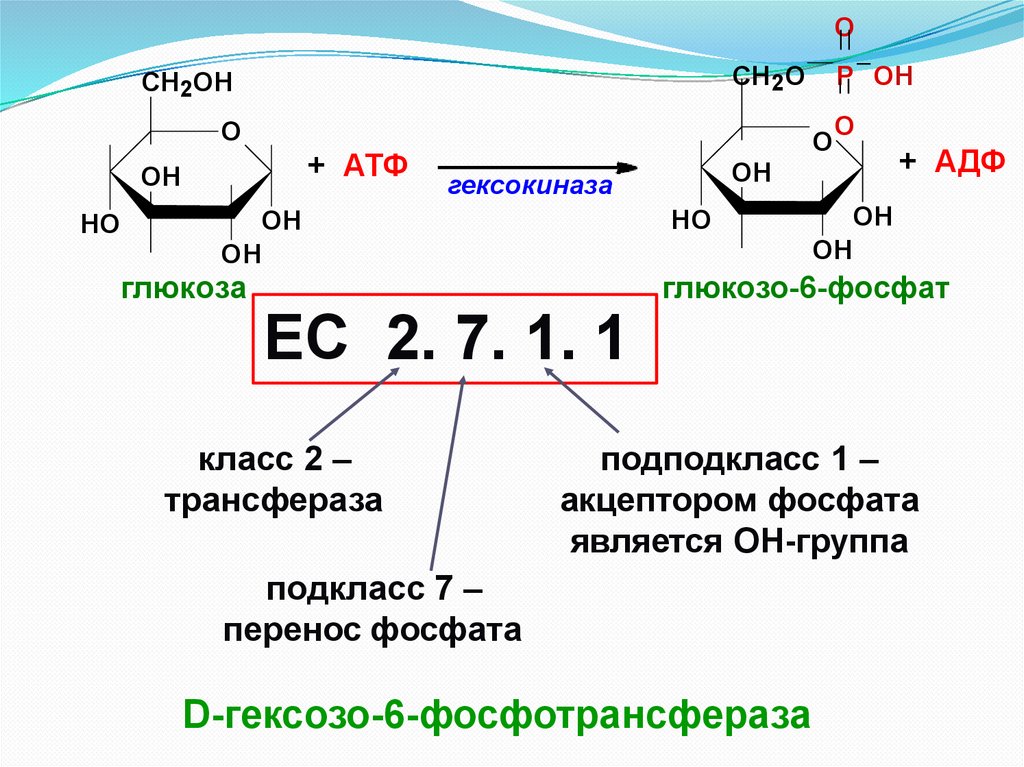
OСН 2О
СН2ОН
O
+ АТФ
OH
HO
O
HO
ЕС 2. 7. 1. 1
класс 2 –
трансфераза
O
OH
гексокиназа
OH
OH
глюкоза
P OH
+ АДФ
OH
OH
глюкозо-6-фосфат
подподкласс 1 –
акцептором фосфата
является ОН-группа
подкласс 7 –
перенос фосфата
D-гексозо-6-фосфотрансфераза
30.
Регуляция скоростиферментативных реакций
1. Количеством ферментов
2.
Доступностью фермента и
субстрата
3.
Регуляцией активности самого
фермента:
компонентами самой клетки
аллостерическая
химическая модификация
частичный протеолиз
31.
Регуляция скоростиферментативных реакций
компонентами самой клетки –
температурой, рН, количеством
субстрата, компартментализацией
(расположением в определѐнных
«компартментах» – отделах клетки
– цитозоле, митоходриях и т.д.)
ферментов, наличием эффекторов
32.
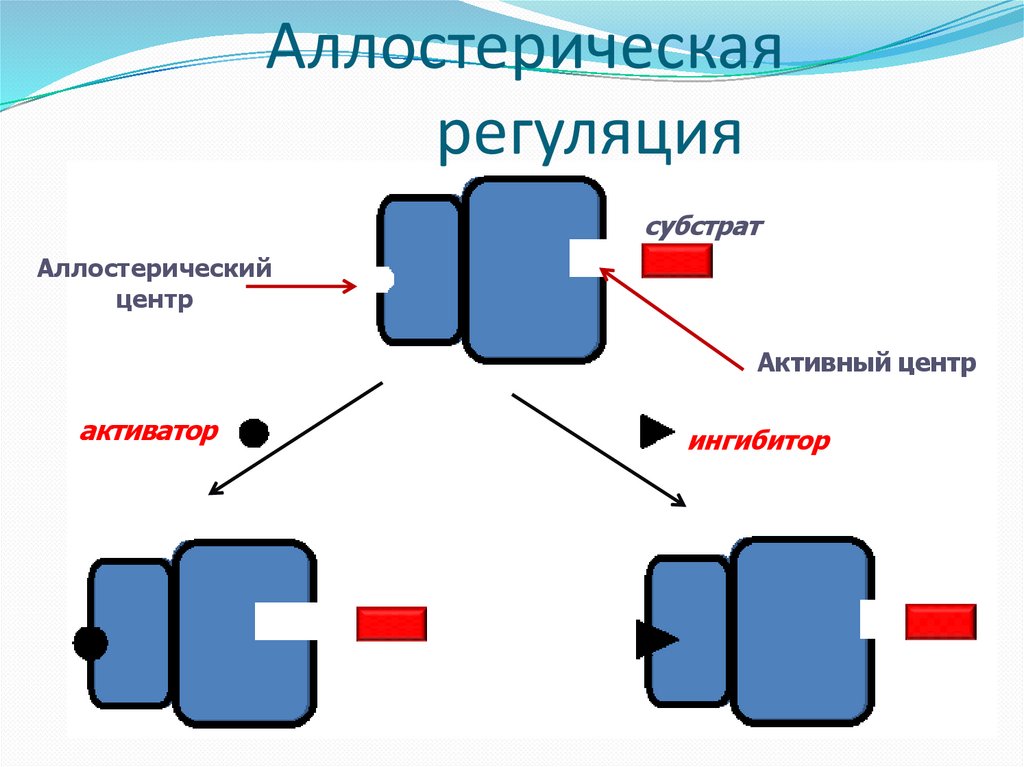
Аллостерическаярегуляция
Аллостерическая регуляция. Многие ферменты наряду
с активным имеют дополнительный аллостерический центр
(греч. άλλες – иной, другой), к которому присоединяется не
субстрат, а эффектор – активатор или ингибитор. Этот
центр называют также регуляторным, а ферменты,
обладающие таким центром – аллостерическими, или
регуляторными ферментами. Обычно аллостерические
ферменты построены из двух и более субъединиц: одни
субъединицы содержат каталитический центр, другие
имеют аллостерический центр и являются регуляторными.
Присоединение эффектора к аллостерическому центру
регуляторной субъединицы изменяет конформацию белка
и, соответственно, активность каталитической
субъединицы
33.
Аллостерическаярегуляция
субстрат
Аллостерический
центр
Активный центр
активатор
ингибитор
34.
Аллостерическаярегуляция
+
А
Е1
В
Е2
С
Е3
D
Е4
F
Е5
ПР
В качестве аллостерических эффекторов часто выступают компоненты
биохимических процессов – исходные вещества и продукты реакций
(поэтому аллостерическую регуляцию часто называют
«саморегуляцией»). Аллостерические ферменты обычно катализирует
одну из начальных стадий, например, в процессе окисления глюкозы –
гликолизе, протекающем в зависимости от условий в 10 или 11 стадий,
регуляторным ферментом является фосфофруктокиназа,
катализирующая третью реакцию.
35.
Регуляция активности фермента путемфосфорилирования/
дефосфорилирования
Фосфорилирование и дефосфорилирование (ковалентная
модификация) – один из наиболее распространѐнных способов регуляции
активности ферментов. Такая модификация заключается в обратимом
присоединении или отщеплении фосфорной кислоты. Фосфорилирование
фермента происходит по остаткам серина и тирозина. Присоединение
фосфорной кислоты к белку осуществляют ферменты протеинкиназы,
отщепление – протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в
дефосфорилированном состоянии. Например, при фосфорилировании
ферментов, участвующих в обмене гликогена, фермент распада гликогена
(гликогенфосфорилаза) находится в активном состоянии, а фермент синтеза
гликогена (гликогенсинтаза) – в неактивном. В дефосфорилированном
состоянии, наоборот, гликогенфосфорилаза неактивна, а гликогенсинтаза
активна.
36.
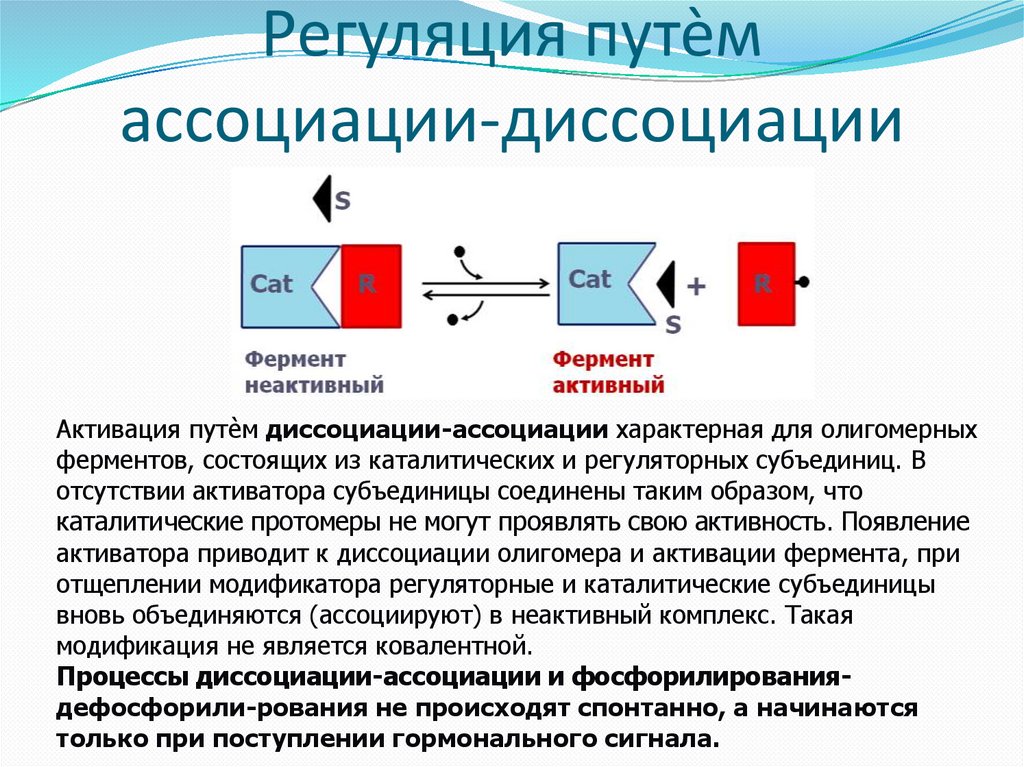
Регуляция путѐмассоциации-диссоциации
Активация путѐм диссоциации-ассоциации характерная для олигомерных
ферментов, состоящих из каталитических и регуляторных субъединиц. В
отсутствии активатора субъединицы соединены таким образом, что
каталитические протомеры не могут проявлять свою активность. Появление
активатора приводит к диссоциации олигомера и активации фермента, при
отщеплении модификатора регуляторные и каталитические субъединицы
вновь объединяются (ассоциируют) в неактивный комплекс. Такая
модификация не является ковалентной.
Процессы диссоциации-ассоциации и фосфорилированиядефосфорили-рования не происходят спонтанно, а начинаются
только при поступлении гормонального сигнала.
37.
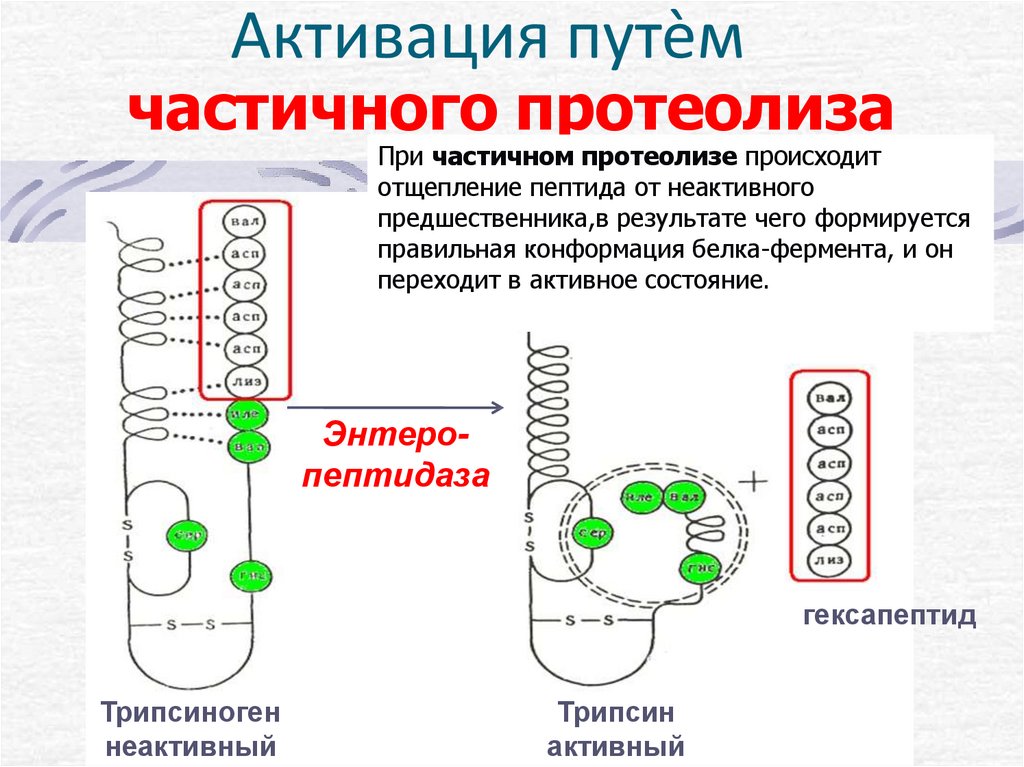
Активация путѐмчастичного протеолиза
При частичном протеолизе происходит
отщепление пептида от неактивного
предшественника,в результате чего формируется
правильная конформация белка-фермента, и он
переходит в активное состояние.
Энтеропептидаза
гексапептид
Трипсиноген
неактивный
Трипсин
активный
38.
Механизмы ингибирования•Конкурентное
•Неконкурентное
•Бесконкурентное
•Субстратное
•Аллостерическое
39.
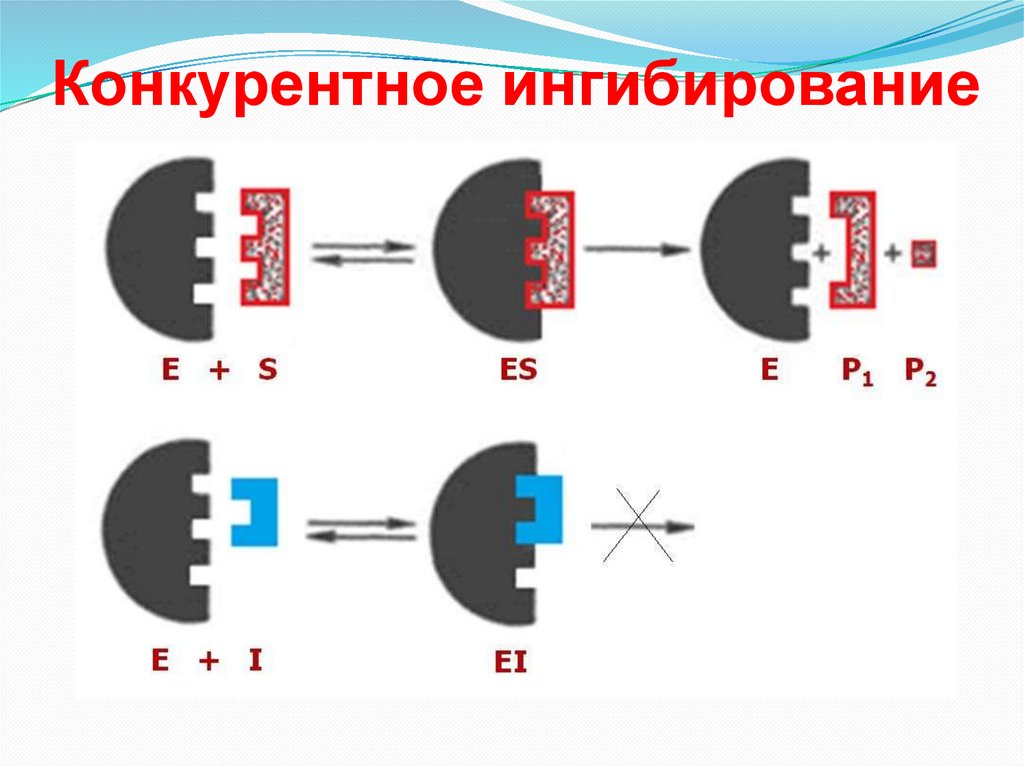
Конкурентное ингибирование40.
Конкурентное ингибированиеКонкурентное ингибирование имеет место в том случае,
когда ингибитор похож по структуре с субстратом. В
этом случае происходит конкуренция между субстратом
и ингибитором за место в активном центре фермента.
Снижение скорости зависит от концентрации
ингибитора (чем больше ингибитора, тем больше
активных центров ферментов занято ингибитором и
наоборот). Конкурентное ингибирование обратимо.
Конкурентные ингибиторы часто используются в
качестве лекарственных средств (антивитамины К и В9
и др.)
41.
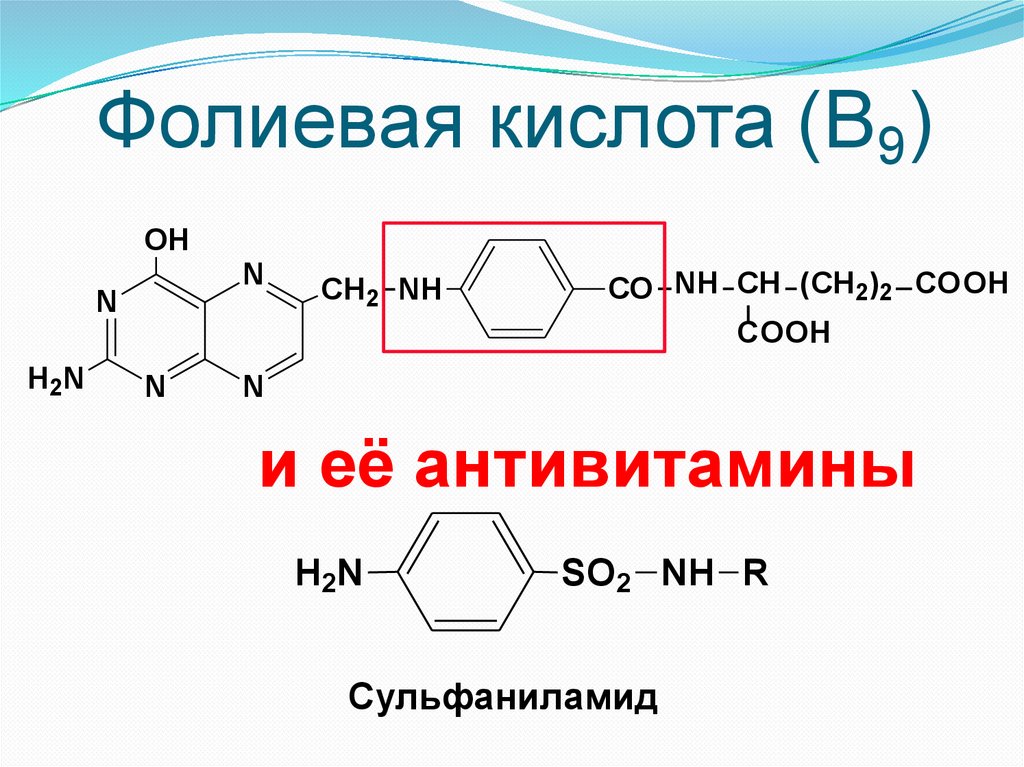
Фолиевая кислота (В9)OH
N
N
H2 N
N
СН2 NH
СО NH СН (СН2)2 COOH
COOH
N
и её антивитамины
H 2N
SО2 NH R
Сульфаниламид
42.
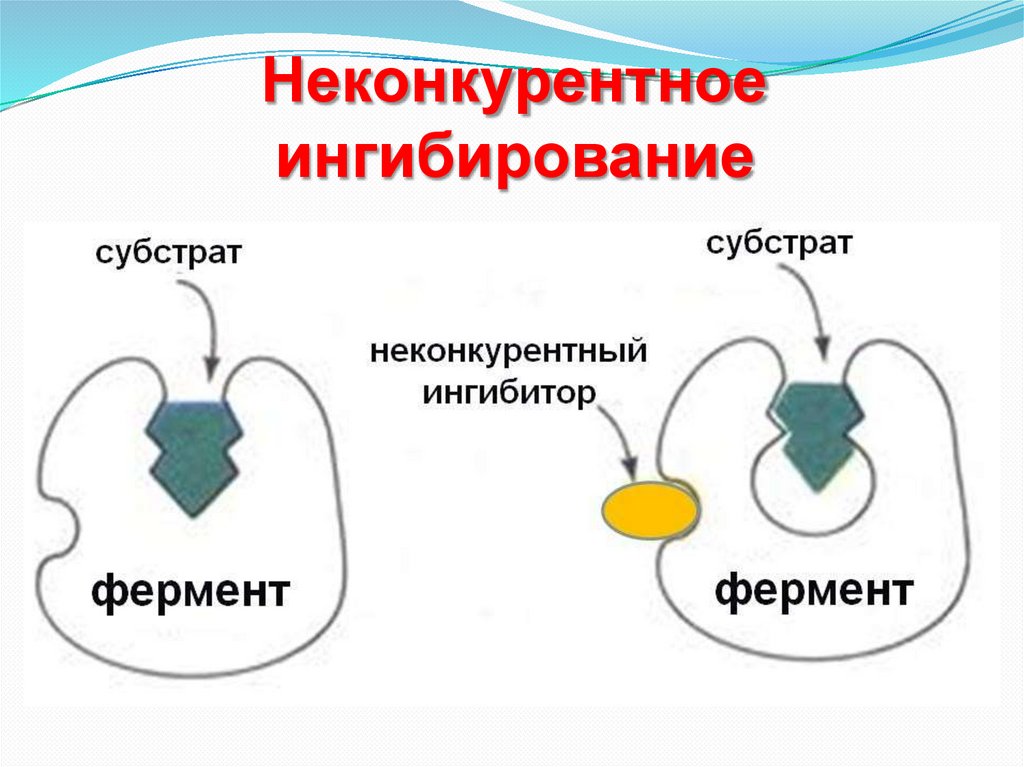
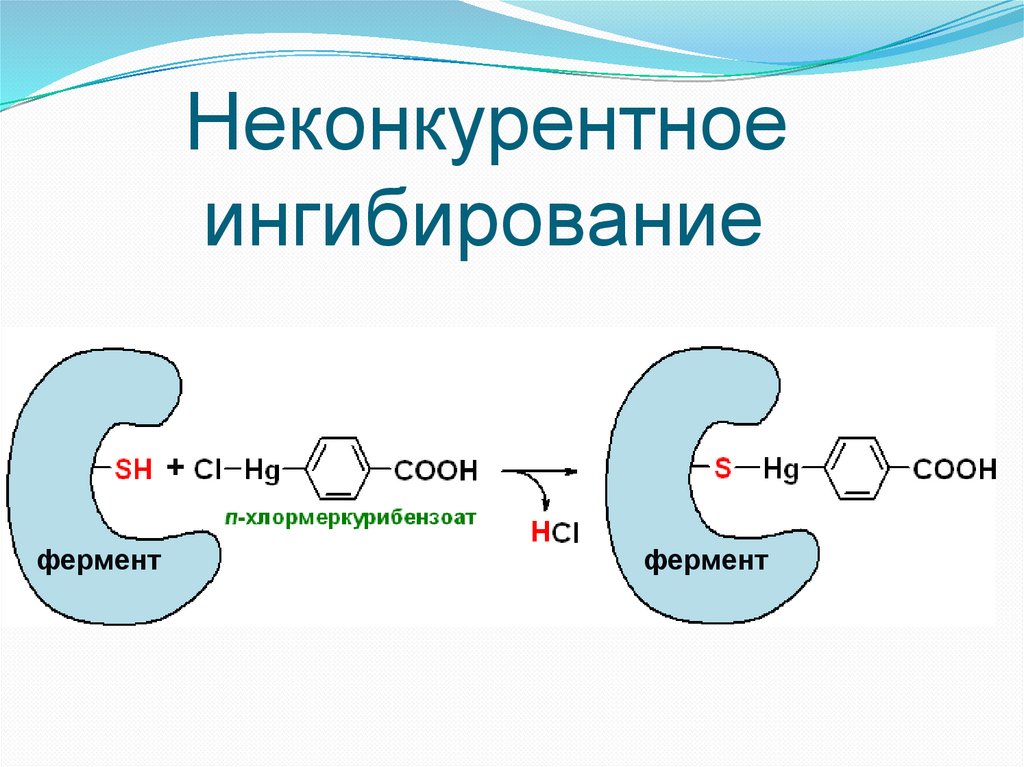
Неконкурентноеингибирование
43.
Неконкурентноеингибирование
+
фермент
фермент
44.
Неконкурентное ингибированиеНеконкурентное ингибирование имеет место в том случае, когда
ингибитор не похож по структуре с субстратом. В этом случае конкуренции
между субстратом и ингибитором за место в активном центре фермента не
происходит.
Ингибитор взаимодействует с функциональными группами белкафермента или в активном центре, или вне активного центра, изменяя его
конформацию.
Неконкурентное ингибирование чаще всего необратимо.
Неконкурентными ингибиторами часто бывают яды, боевые
отравляющие вещества, инсектициды и т.п.
45.
Бесконкурентноеингибирование
При бесконкурнетном ингибировании ингибитор присоединяется не к
самому ферменту, а к фермент-субстратному комплексу, образуя
тройной комплекс. При этом скорость реакции снижается, но такое
ингибирование обратимо.
46.
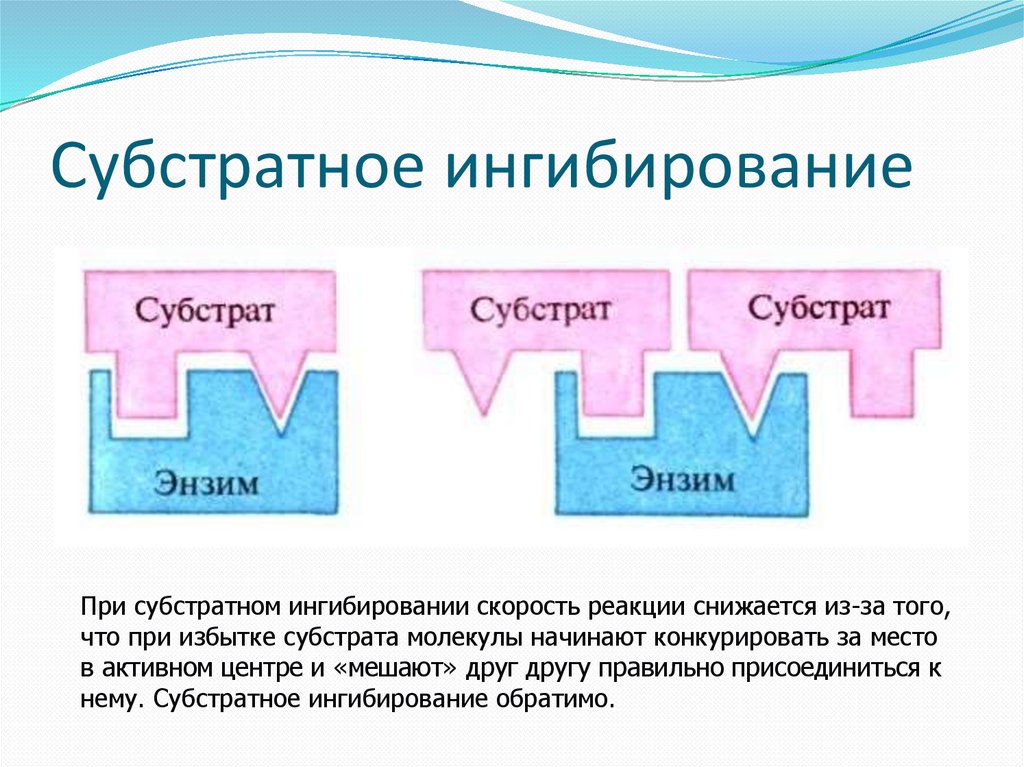
Субстратное ингибированиеПри субстратном ингибировании скорость реакции снижается из-за того,
что при избытке субстрата молекулы начинают конкурировать за место
в активном центре и «мешают» друг другу правильно присоединиться к
нему. Субстратное ингибирование обратимо.
47.
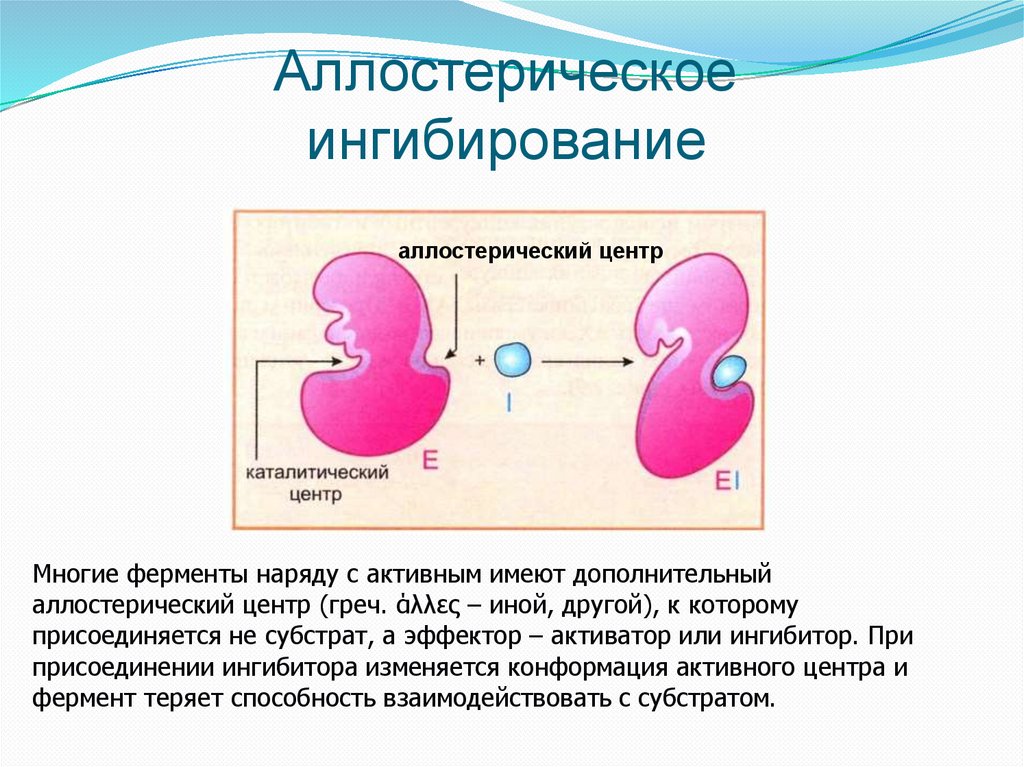
Аллостерическоеингибирование
аллостерический центр
Многие ферменты наряду с активным имеют дополнительный
аллостерический центр (греч. άλλες – иной, другой), к которому
присоединяется не субстрат, а эффектор – активатор или ингибитор. При
присоединении ингибитора изменяется конформация активного центра и
фермент теряет способность взаимодействовать с субстратом.
48.
Энзимология –раздел биохимии, изучающий
строение, механизм действия и
молекулярную структуру
ферментов, а также выделение,
процессы биосинтеза ферментов и
их практическое применение, в т.ч.
для энзимодиагностики и
энзимотерапии.
49.
Энзимодиагностика – это определение активностиферментов с диагностической целью
2 группы ферментов
Ферменты жизнеобеспечения (одинаковые во всех
клетках)
Органоспецифические ферменты (специфичные для органа)
Ферментный состав клеток изменяется в онтогенезе и при
болезнях
Происхождение ферментов крови
Собственные ферменты крови;
Ферменты секретов и экскретов;
Тканевые ферменты.
50.
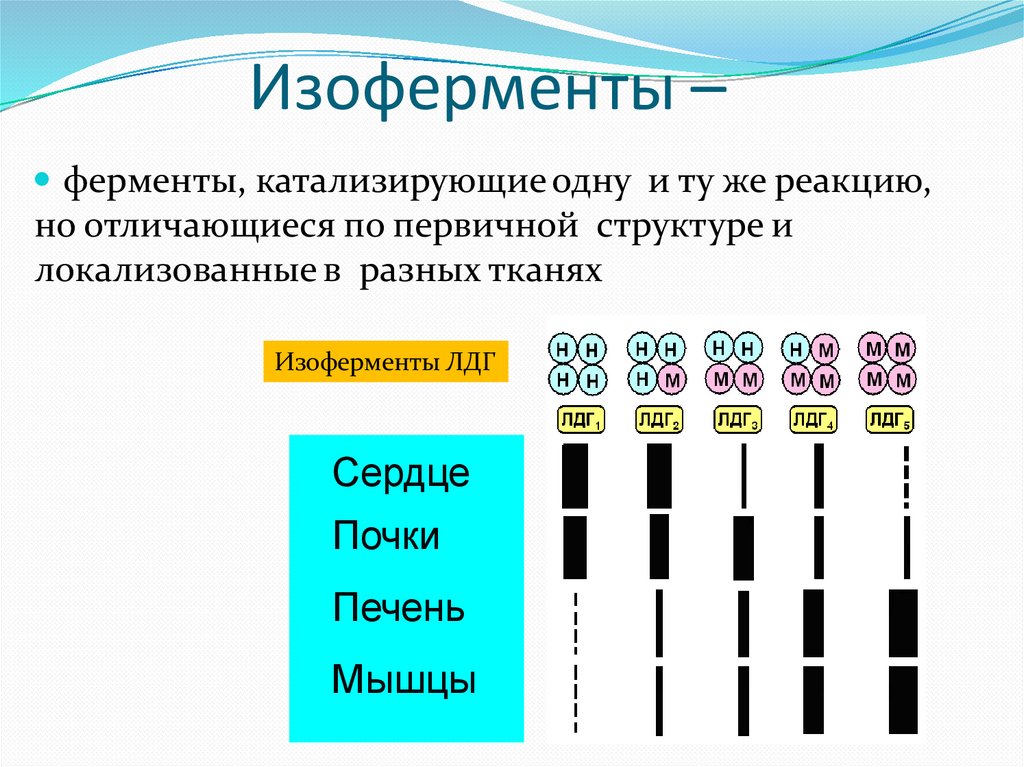
Изоферменты –ферменты, катализирующие одну и ту же реакцию,
но отличающиеся по первичной структуре и
локализованные в разных тканях
Изоферменты ЛДГ
Сердце
Почки
Печень
Мышцы
51.
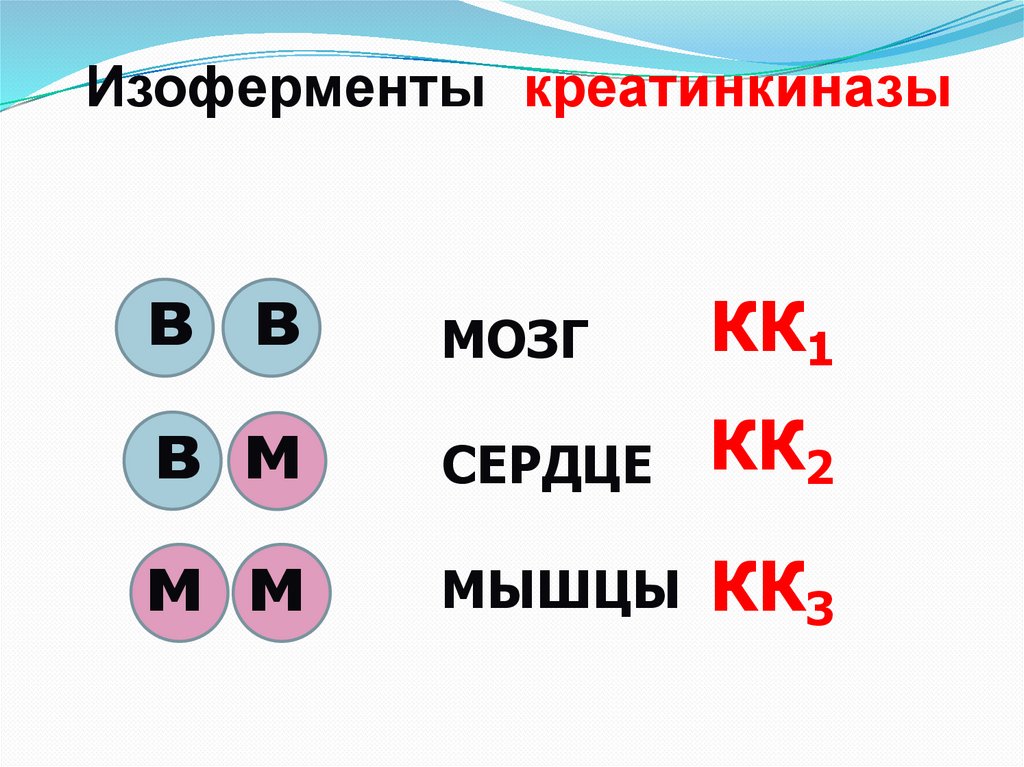
Изоферменты креатинкиназыв в
МОЗГ
КК1
в м
СЕРДЦЕ
КК2
м м
МЫШЦЫ КК3
52.
ферментпримеры
использования
Лактатдегидрогеназа (изофермент
ЛДГ1)
Инфаркт миокарда
Аспартатаминотрансфераза (АСТ)
Инфаркт миокарда
Аланинаминотрансфераза (АЛТ)
Заболевания печени,
инфаркт миокарда
Креатинкиназа (КК)
(изофермент ММ – мышечный тип,
изофермент МВ – сердечный тип)
Прогрессирующая дистрофия
Кислая фосфатаза
Рак предстательной железы
Инфаркт миокарда
53.
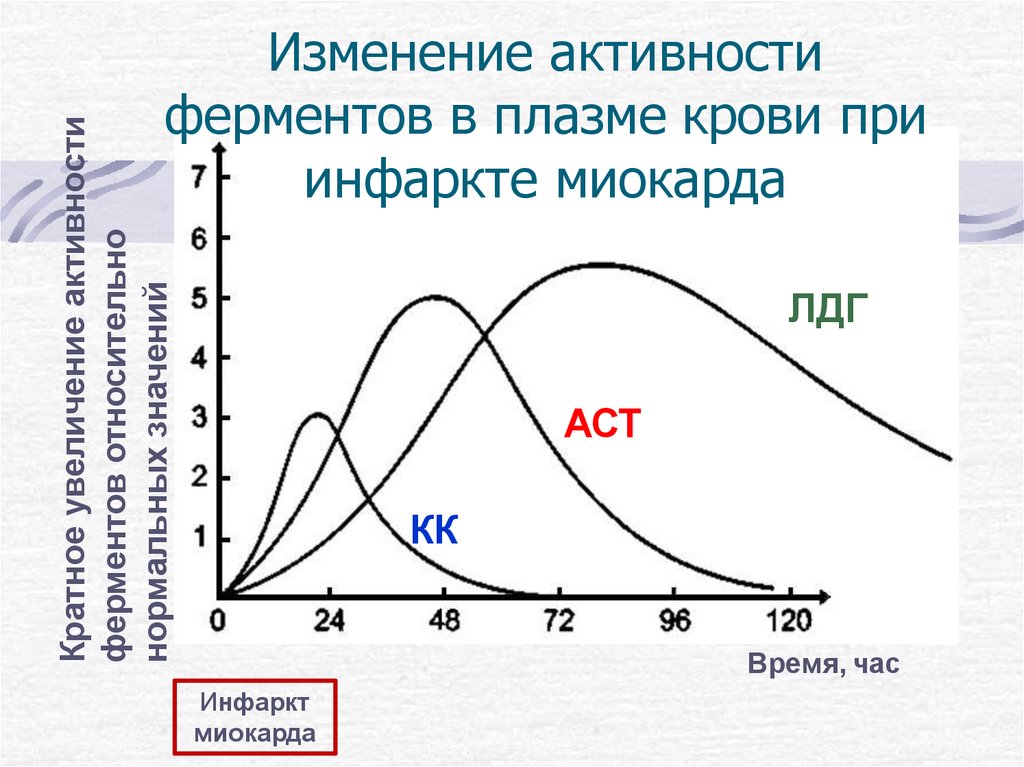
Кратное увеличение активностиферментов относительно
нормальных значений
Изменение активности
ферментов в плазме крови при
инфаркте миокарда
ЛДГ
АСТ
КК
Время, час
Инфаркт
миокарда
54.
nМЕ – количествоединиц активности
nМЕ =
Кол-во превращенного S (мкмоль)
Время (мин)
55.
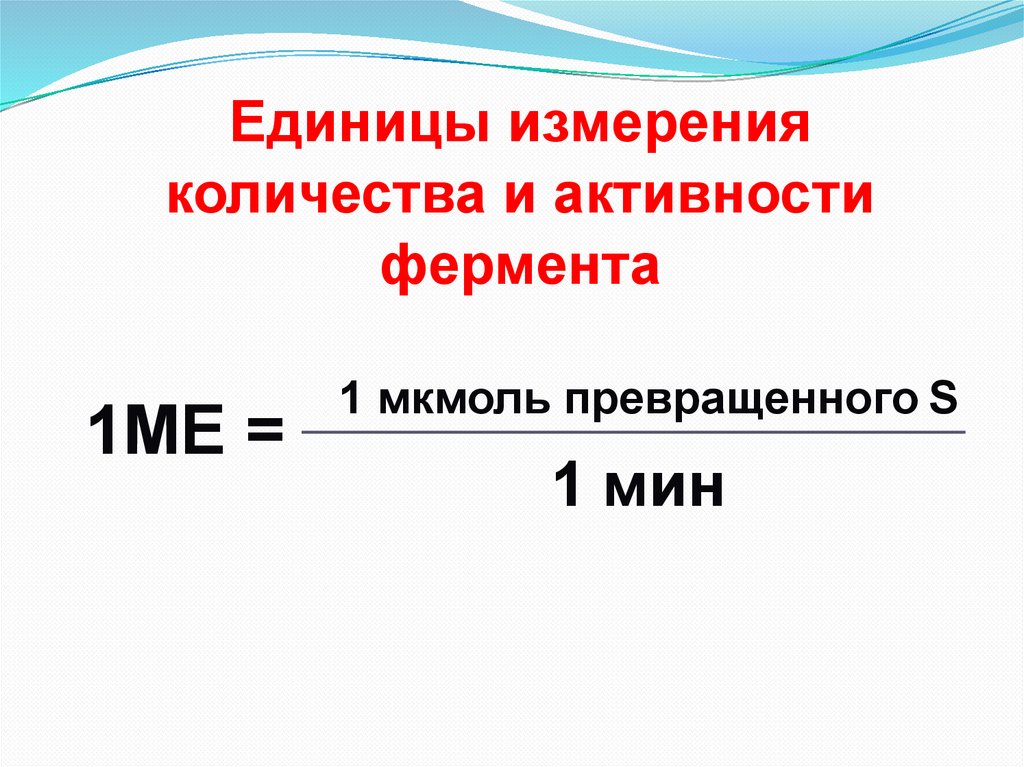
Единицы измеренияколичества и активности
фермента
1МЕ =
1 мкмоль превращенного S
1 мин
56.
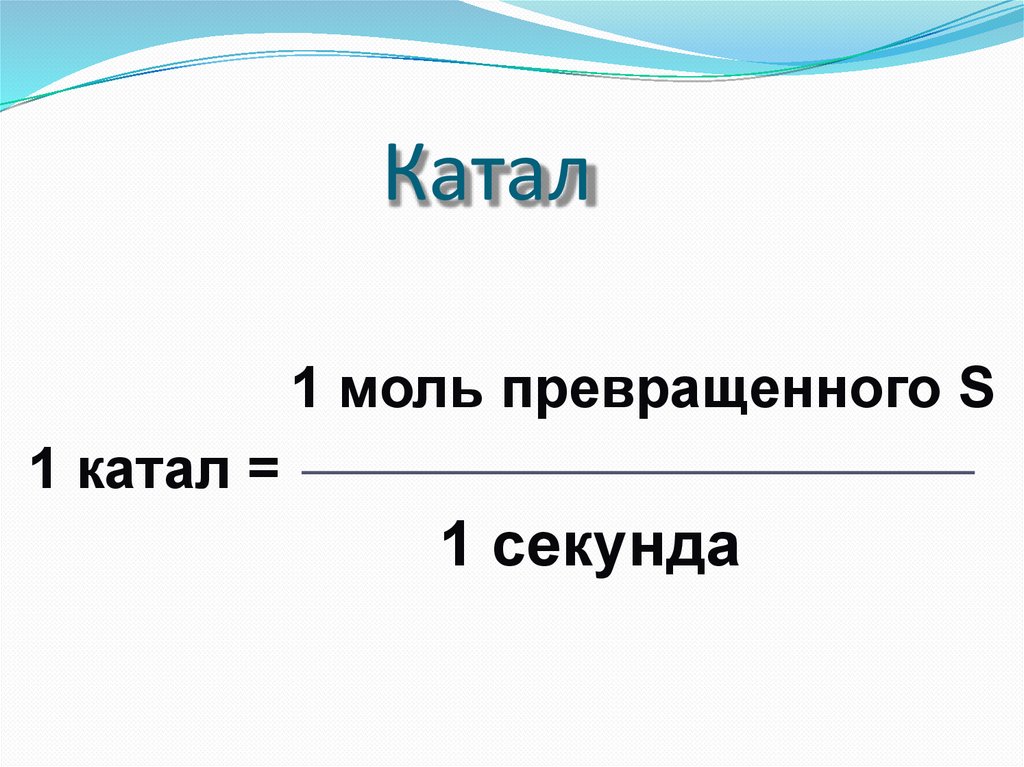
Катал1 моль превращенного S
1 катал =
1 секунда
57.
Связь международной единицыферментативной активности с
каталом
7
1 кат = 6х10 МЕ
1 МЕ = 16,67 нкат
58.
Энзимотерапия - использование ферментов с лечебной цельюФерментозаместительная терап
Противовоспалительная терапия;
Фибринолитическая терапия;
Литическая терапия
фермент
примеры использования
Пепсин
Нарушение переваривания белков в
желудке,
нарушение синтеза или секреции
пепсина
Лечение гнойных ран
Трипсин,
химотрипсин
(Девитас)
Гиалуронидаза
Стрептокиназа,
урокиназа
Нуклеазы
(ДНКаза)
Рассасывание рубцов
Рассасывание тромбов
Вирусный конъюнктивит, ринит,
гнойный бронхит
59.
Иммобилизованные ферменты—препараты ферментов, молекулы которых связаны с
матрицей, или носителем (например, целлюлозой),
сохраняя при этом свои каталитические свойства.
Преимущества иммобилизованных ферментов:
• более высокая стабильность ферментных препаратов,
• возможность их удаления из реакционной среды и их
повторного использования,
• длительность хранения,
• возможность создания непрерывных процессов на
ферментных колонках,
• получение продукта реакции, не загрязнѐнного
ферментом.
60.
ЭнзимопатииНаследственные
Вторичные
(связаны с
• токсические;
отсутствием
• алиментарные;
или
• регуляторные;
нарушением
нарушение
синтеза
локализации
ферментов)
фермента в
клетке.
61.
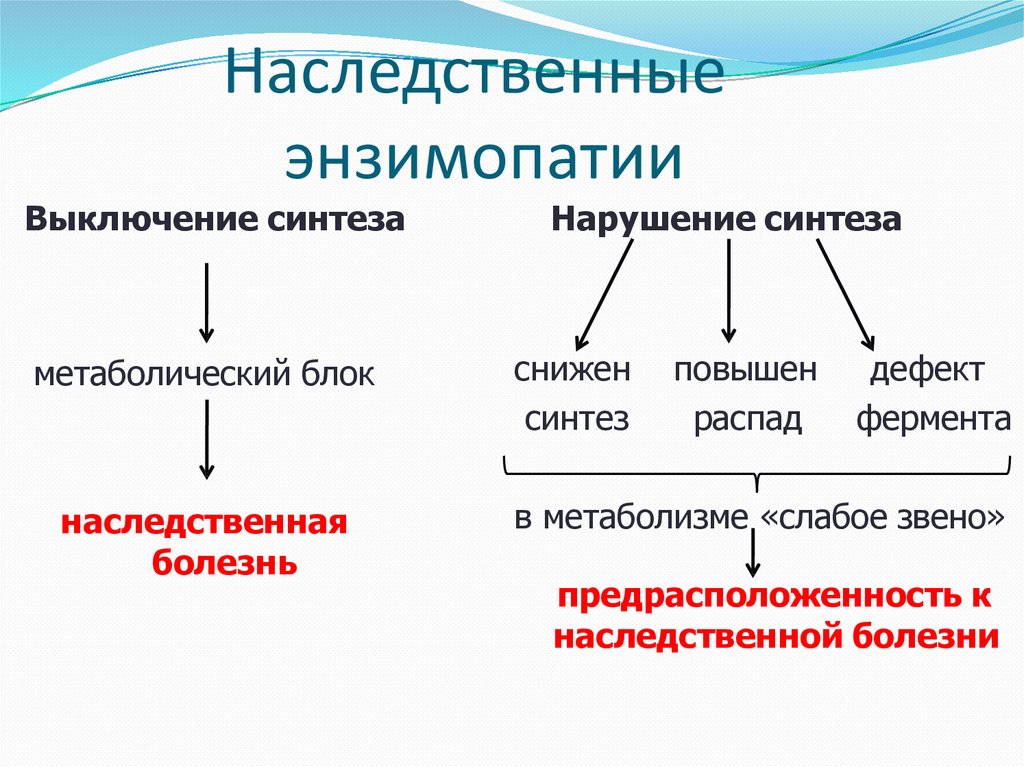
Наследственныеэнзимопатии
Выключение синтеза
метаболический блок
наследственная
болезнь
Нарушение синтеза
снижен
синтез
повышен
распад
дефект
фермента
в метаболизме «слабое звено»
предрасположенность к
наследственной болезни





























 biology
biology








