Similar presentations:
Спирты
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
Тема: «Спирты»
Преподаватель химии: Агафонова Н.В.
1
2.
План лекции:1. Общая формула, классификация и номенклатура
спиртов.
2. Физические и химические свойства одноатомных
спиртов.
3. Получение.
4. Многоатомные спирты.
5. Химические свойства спиртов.
6. Применение.
2
3.
Спирты и фенолы относятся ккислородосодержащим соединениям.
В составе этих соединений имеются
гидроксильные группы, связанные с
углеводородным радикалом R – OH.
Если в состав спирта или фенола
входит одна гидроксильная группа, то
их называют одноатомными, при
наличии двух гидроксильных групп –
двухатомными и т.д.
3
4.
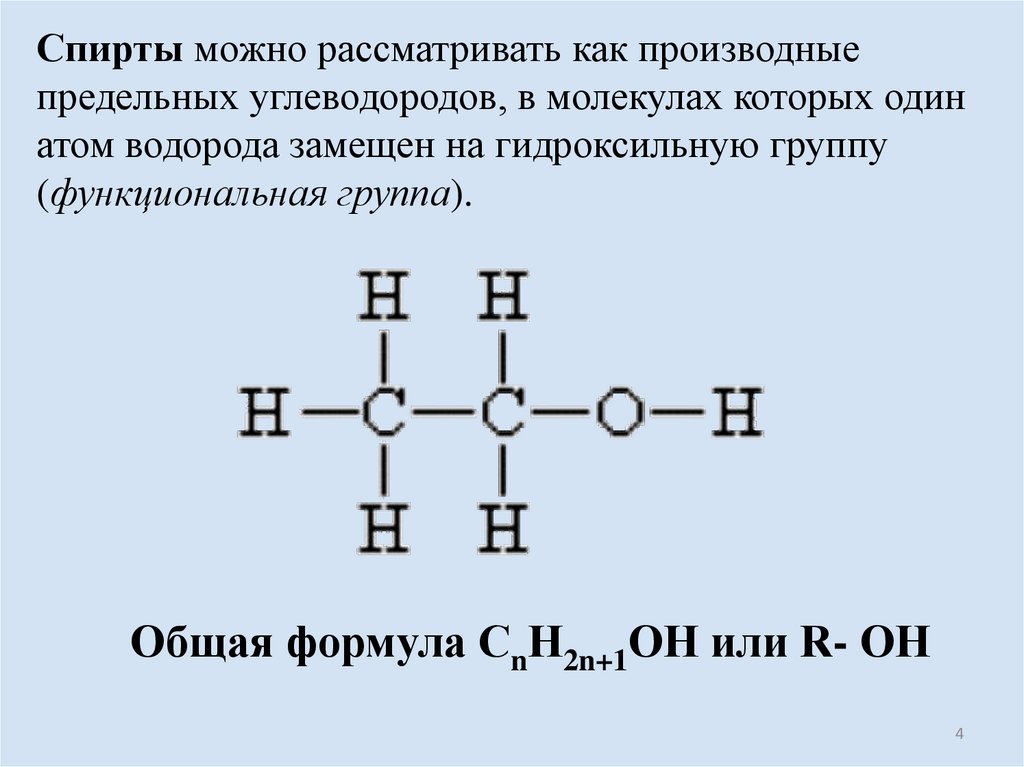
Спирты можно рассматривать как производныепредельных углеводородов, в молекулах которых один
атом водорода замещен на гидроксильную группу
(функциональная группа).
Общая формула СnН2n+1ОН или R- ОН
4
5.
56.
67.
78.
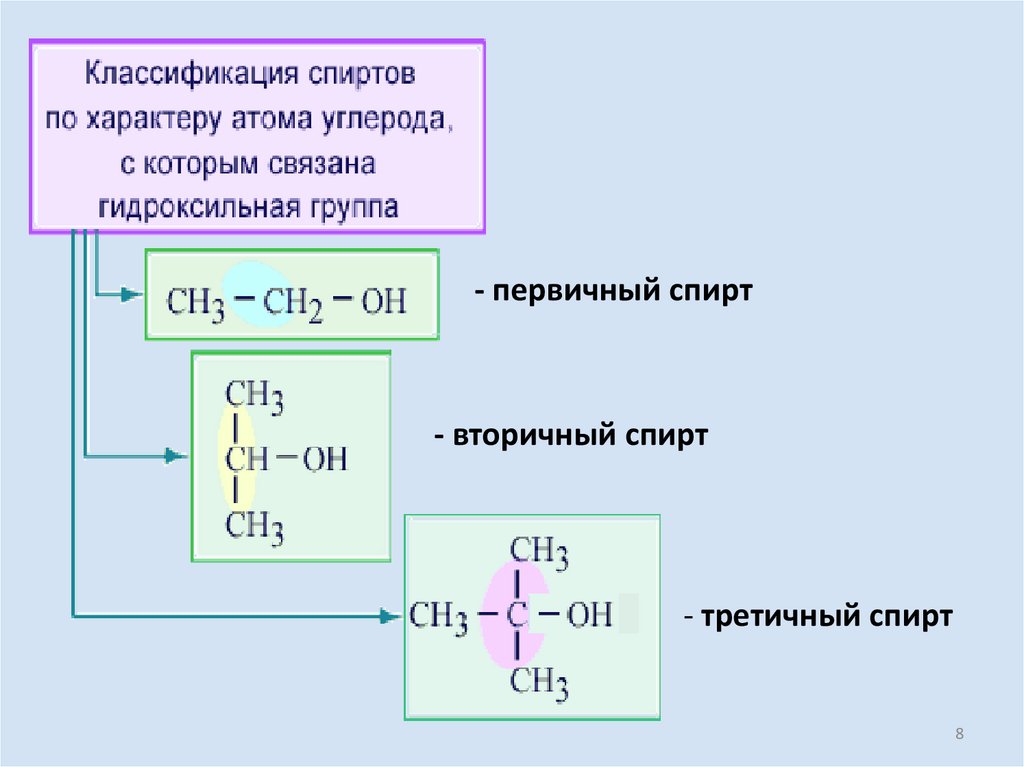
- первичный спирт- вторичный спирт
- третичный спирт
8
9.
Номенклатура предельныходноатомных спиртов
1. Выбрать главную цепь, содержащую –ОН
группу
2. Пронумеровать цепь с той стороны, к которой
ближе –ОН группа
3. Указать положение и название радикалов, число
атомов углерода в главной цепи с суффиксом –
ан.
4. Затем добавляют суффикс –ол, обозначающий
гидроксильную группу, и номер атома углерода,
у которого эта группа находится.
9
10.
Назовите следующие спирты10
11.
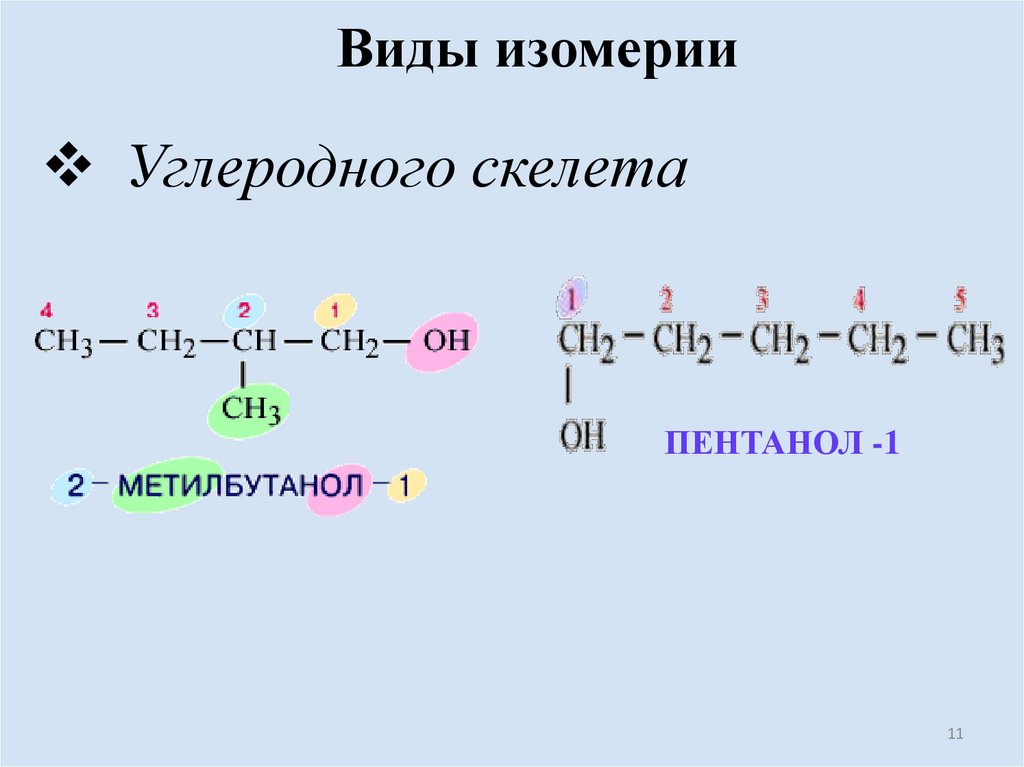
Виды изомерииУглеродного скелета
ПЕНТАНОЛ -1
11
12.
Положения функциональнойгруппы
Пентанол - 1
Пентанол - 2
12
13.
Межклассовая изомерияИзомерны с простыми эфирами
C3H8O
СН3–СН2–СН2–ОН
Пропанол
СН3–СН2–О–СН3
Метилэтиловый эфир
13
14.
Физические свойства одноатомных спиртовПредельные одноатомные спирты с числом атомов
углерода С1-С12 – бесцветные жидкости, С13-С20 –
мазеобразные вещества, С21 и выше – твердые вещества.
Метиловый и этиловый спирты имеют специфический
алкогольный запах, другие жидкие спирты обладают
удушливым не приятным запахом.
14
15.
Метанол или метиловый спирт – сильнейший нервныйи сосудистый яд. При принятие внутрь нескольких
граммов вызывает тяжелое отравление, повреждает
сетчатку глаза и дегенерацию зрительного нерва и
может привести к слепоте, возможен смертельный
исход.
15
16.
Этанол или этиловый спирт – входит в составалкогольных напитков. Попадая в организм, спирт
действует сначала возбуждающе, а затем угнетающе на
нервную
систему,
притупляя
чувствительность,
ослабляя функцию мозга и мышечной системы,
ухудшает реакцию.
16
17.
Способы получения спиртов1. Спиртовое брожение
17
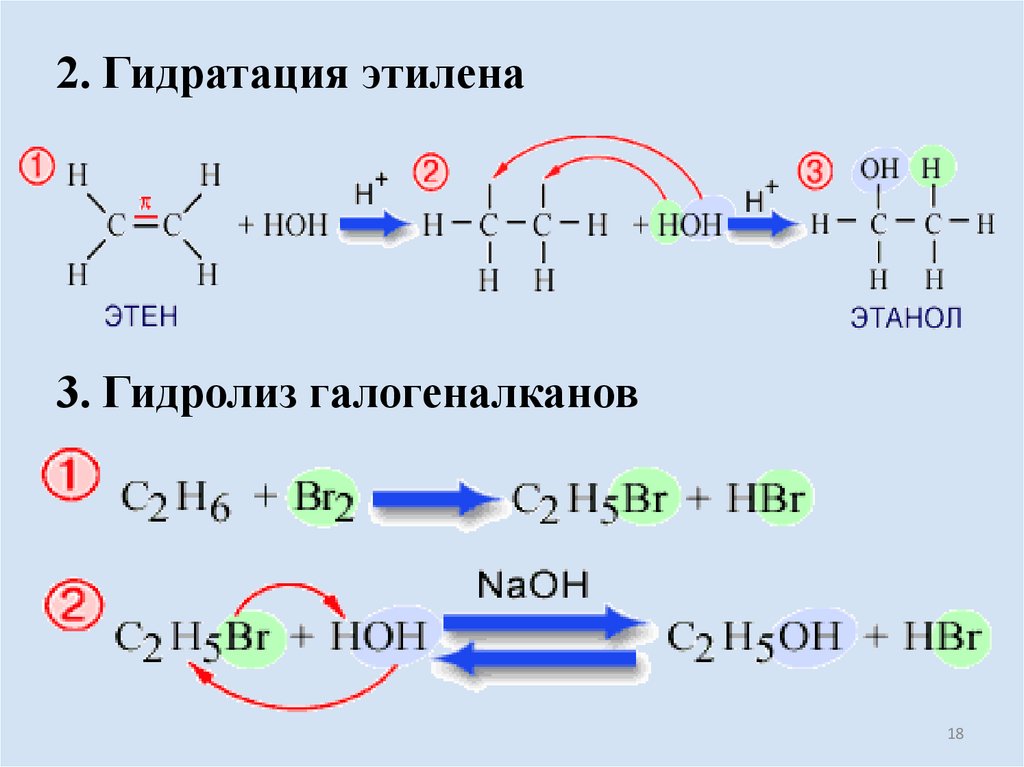
18.
2. Гидратация этилена3. Гидролиз галогеналканов
18
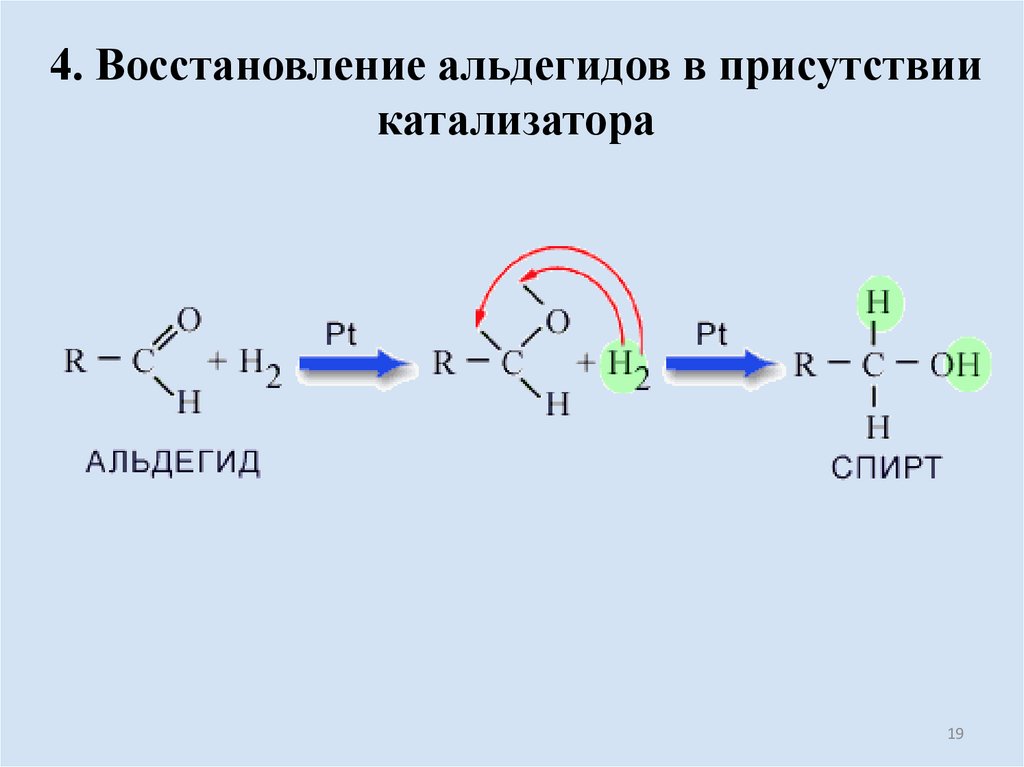
19.
4. Восстановление альдегидов в присутствиикатализатора
19
20.
Многоатомные спиртыЭтандиол-1,2
Пропантриол-1,2,3
20
21.
Химические свойства одноатомных спиртовДействие индикаторов на этиловый спирт
21
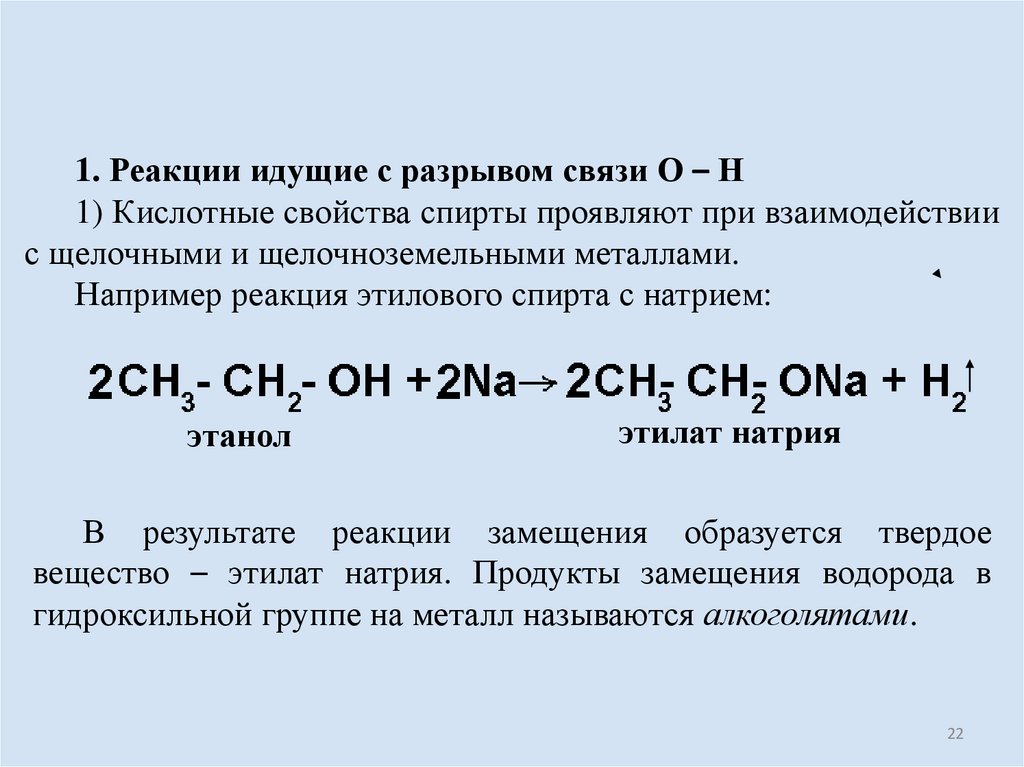
22.
1. Реакции идущие с разрывом связи О – Н1) Кислотные свойства спирты проявляют при взаимодействии
с щелочными и щелочноземельными металлами.
Например реакция этилового спирта с натрием:
этанол
этилат натрия
В результате реакции замещения образуется твердое
вещество – этилат натрия. Продукты замещения водорода в
гидроксильной группе на металл называются алкоголятами.
22
23.
2. Реакции идущие с разрывом связи С – ОНЗа счет разрыва этой связи в реакцию может вступить
вся гидроксильная группа. Таким образом проявляются
основные свойства спиртов.
Например
при
нагревании
галогеноводородами гидроксогруппа
галоген:
спиртов
замещается
с
на
C2H5OH + HBr C2H5Br + H2O
23
24.
3. Реакция этерификации – это реакциявзаимодействия карбоновых кислот со спиртами.
24
25.
Реакция этерификации25
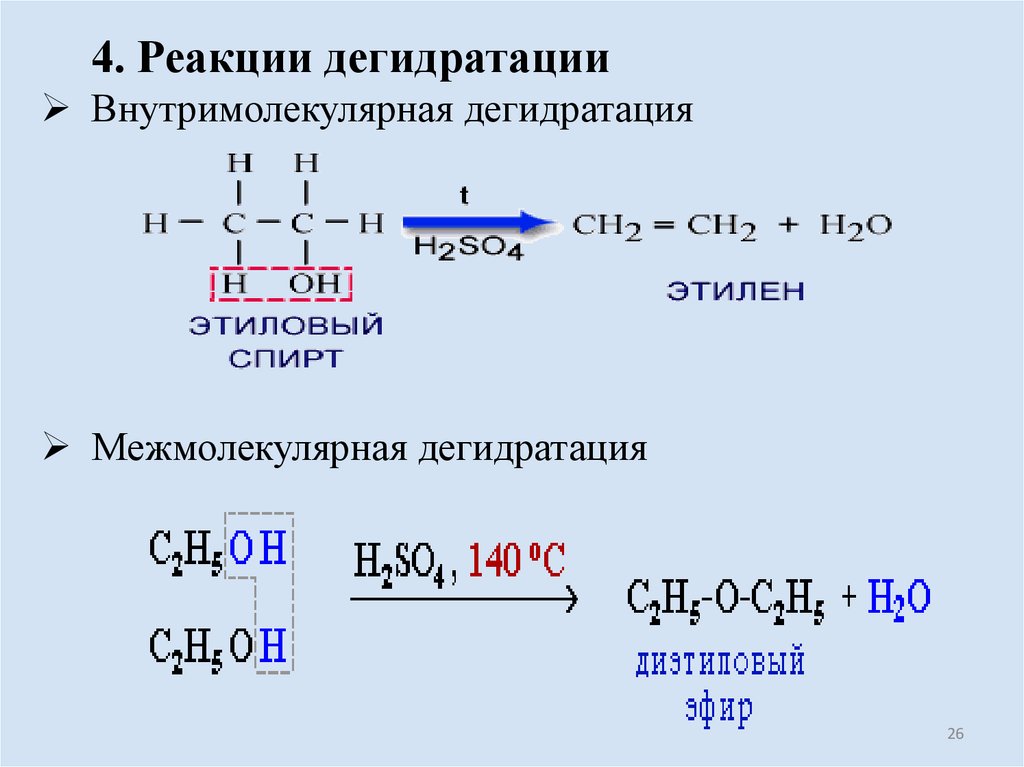
26.
4. Реакции дегидратацииВнутримолекулярная дегидратация
Межмолекулярная дегидратация
26
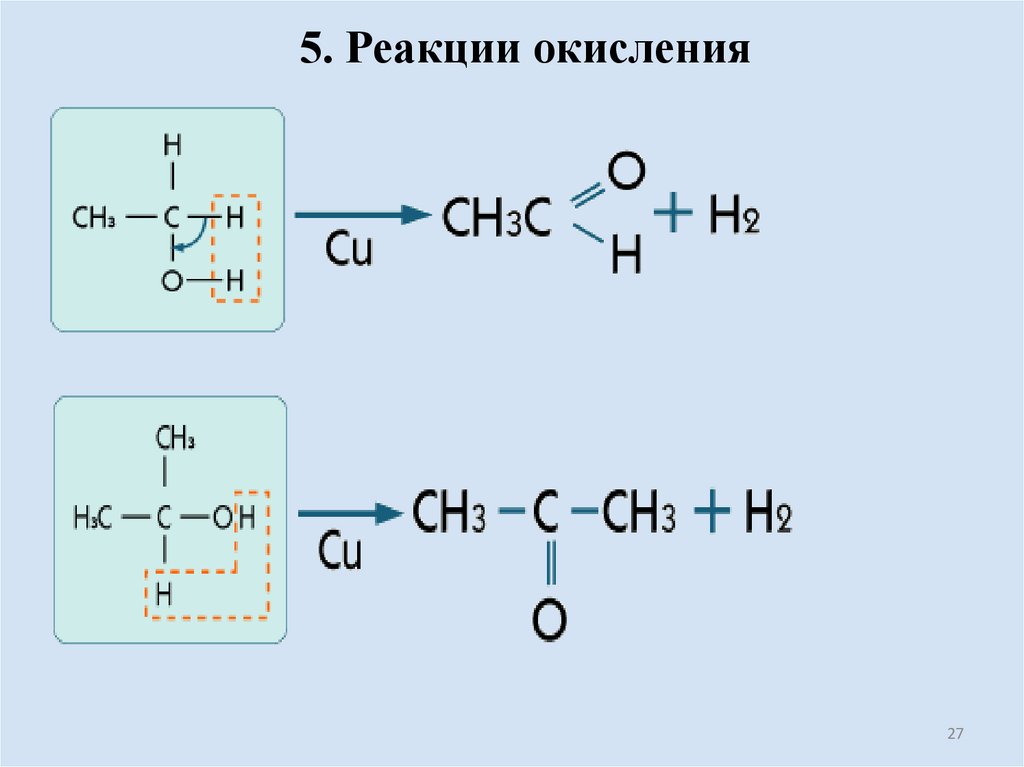
27.
5. Реакции окисления27
28.
6. Горение спиртов28
29.
Химические свойства многоатомных спиртов1. Реакции замещения
Взаимодействие с металлами
29
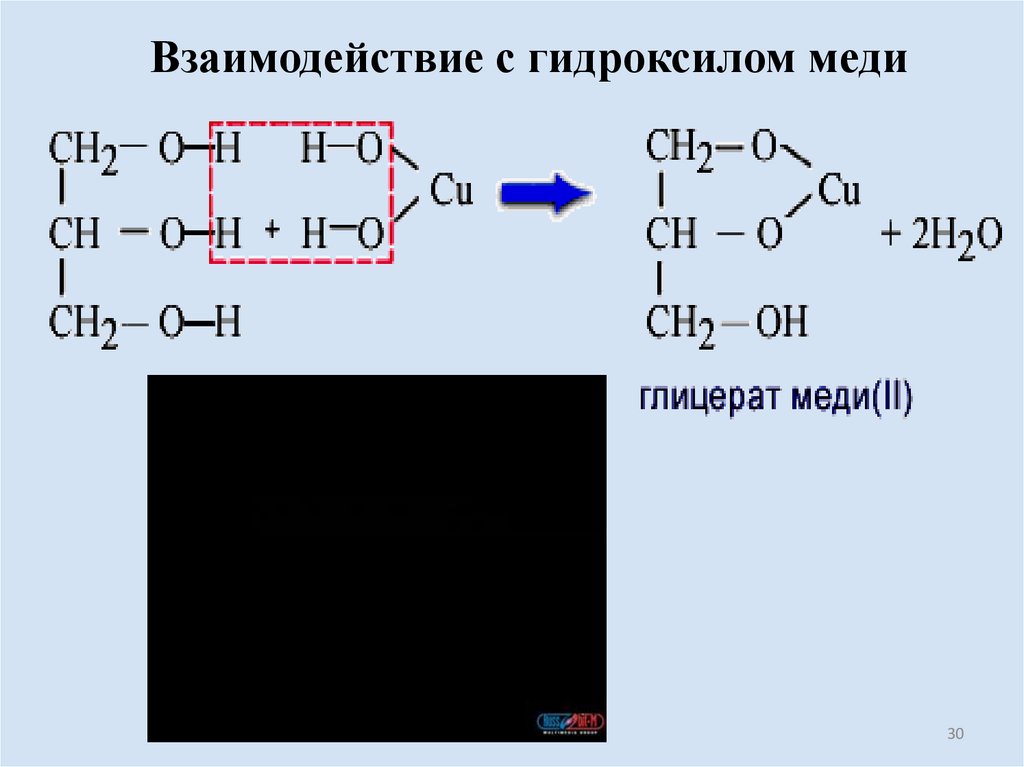
30.
Взаимодействие с гидроксилом меди30
31.
Взаимодействие с кислотами31
32.
Применение32
33.
Закрепление1. Общая формула одноатомных предельных спиртов:
a. CnH2n-1OH;
b. CnH2nOH;
c. CnH2n+1OH;
d. CnH2n-2OH.
33
34.
2. В ряду веществ, формулы которых C4H9OH,C3H7OH, C2H5OH, растворимость в воде:
a. увеличивается;
b. уменьшается;
c. не изменяется;
d. сначала увеличивается, затем уменьшается.
34
35.
3. При дегидратации метанола можно получить:a. метан;
b. этан;
c. диметиловый эфир;
d. этен.
35
36.
4. Характерной реакцией для глицерина является еговзаимодействие с:
a. гидроксидом калия;
b. раствором хлорида железа (III);
c. бромной водой;
d. гидроксидом меди (II).
36
37.
5. Этиленгликоль и глицерин являются:a. изомерами;
b. гомологами;
c. многоатомными спиртами;
d. вторичным и третичным спиртом соответственно.
37
38.
6. Изомером 2-метилпропанола-1 является:a. пропанол-1;
b. 2-метилбутанол-1;
c. метилизопропиловый эфир;
d. пропандиол-1,2.
38
39.
7. Этиленгликоль-это жидкость:a. неядовитая;
b. ограничено растворима в воде;
c. летучая;
d. ядовитая.
39
40.
Спасибо за внимание40






























 chemistry
chemistry