Similar presentations:
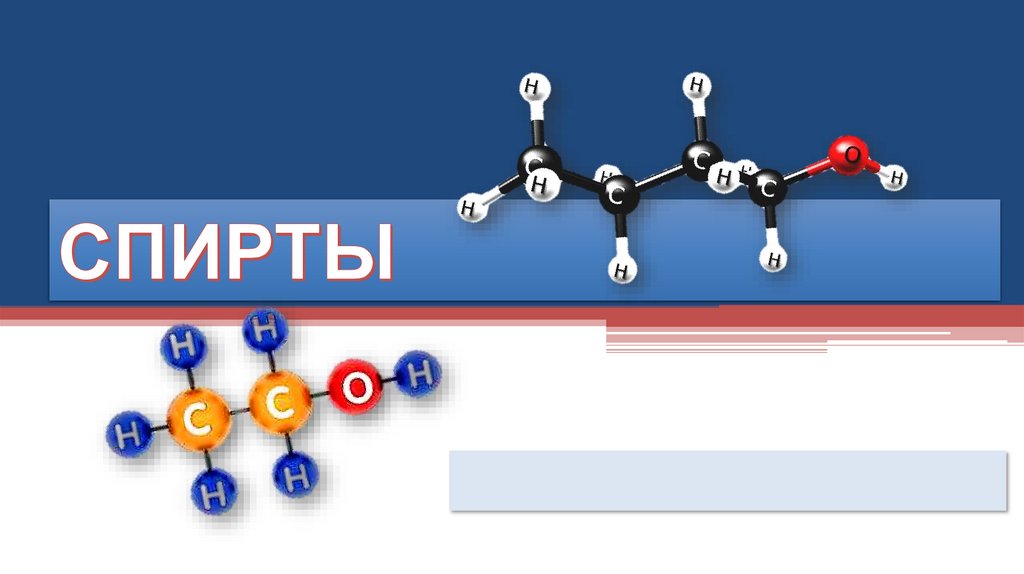
Спирты
1.
2.
2Мы изучим:
• Понятие «функциональная группа»
• Какие вещества относятся к «спиртам»
• Классификация спиртов
• Предельные одноатомные спирты:
строение;
гомологический ряд;
изомерия и номенклатура;
физические свойства;
водородная связь;
химические свойства;
способы получения;
области применения.
3.
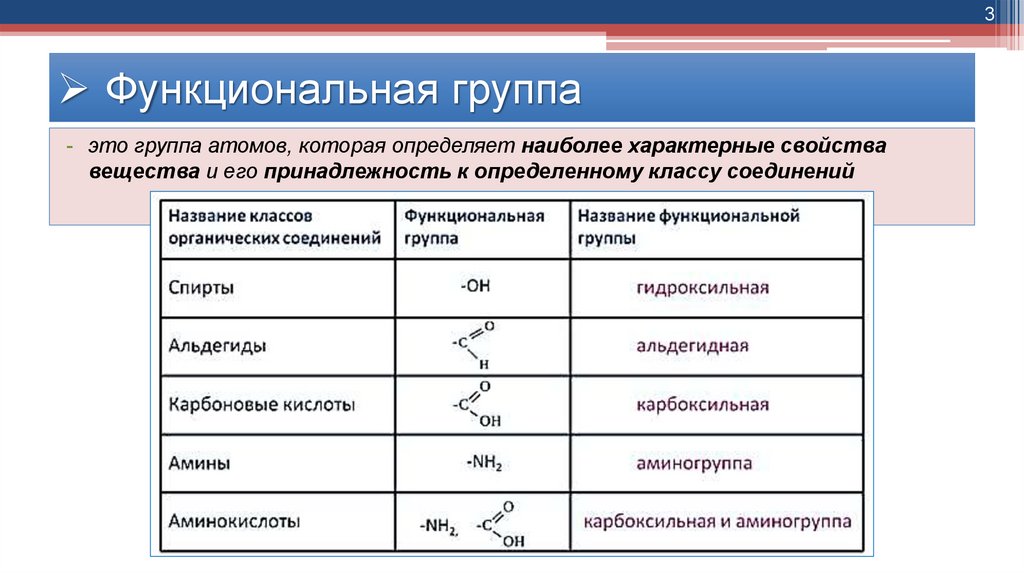
3Функциональная группа
- это группа атомов, которая определяет наиболее характерные свойства
вещества и его принадлежность к определенному классу соединений
4.
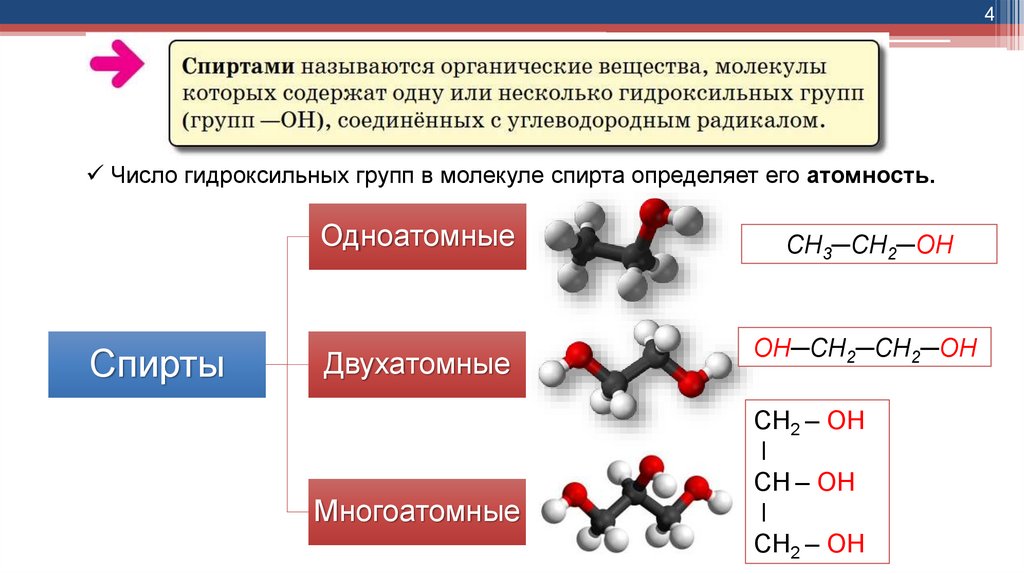
4Число гидроксильных групп в молекуле спирта определяет его атомность.
Одноатомные
Спирты
Двухатомные
Многоатомные
СН3─СН2─ОН
ОН─СН2─СН2─ОН
СН2 – ОН
ǀ
СН – ОН
ǀ
СН2 – ОН
5.
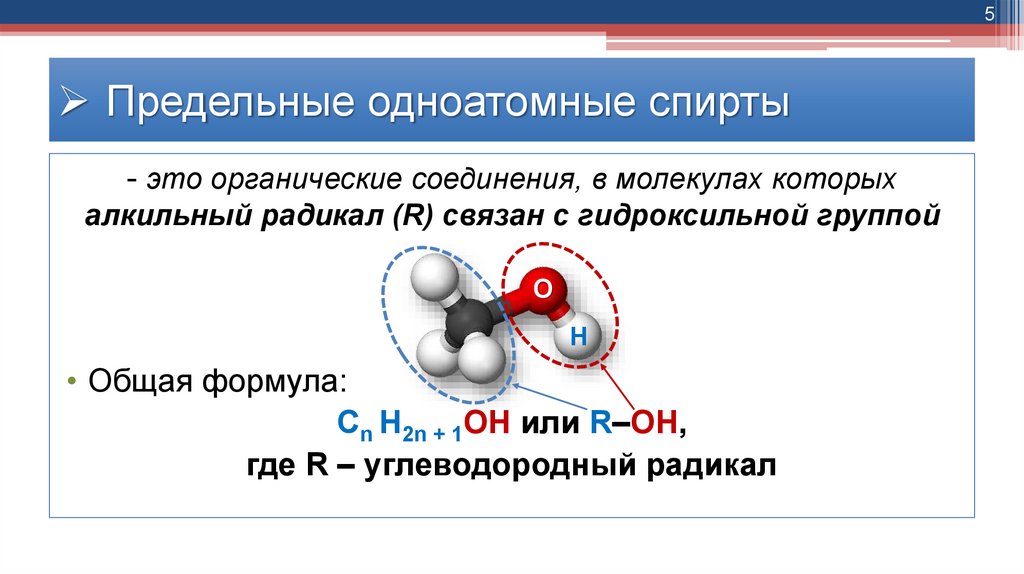
5Предельные одноатомные спирты
- это органические соединения, в молекулах которых
алкильный радикал (R) связан с гидроксильной группой
O
H
• Общая формула:
Cn H2n + 1OH или R–OH,
где R – углеводородный радикал
6.
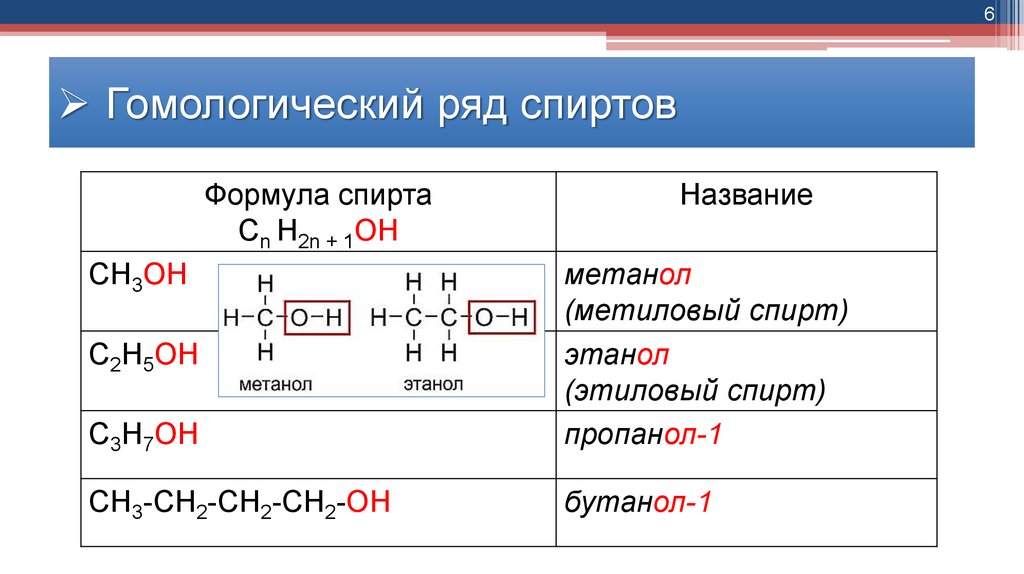
6Гомологический ряд спиртов
Формула спирта
Cn H2n + 1OH
СН3ОН
Название
С3Н7ОН
метанол
(метиловый спирт)
этанол
(этиловый спирт)
пропанол-1
СН3-СН2-СН2-СН2-ОН
бутанол-1
С2Н5ОН
7.
7Номенклатура
• При образовании названий спиртов к названию углеводорода,
соответствующего спирту, добавляют суффикс -ол.
• Цифрами после суффикса указывают положение
гидроксильной группы в главной цепи, а префиксами (ди-,
три-, тетра- и т. д.) - их число.
8.
8Изомерия предельных одноатомных спиртов
I. Изомерия углеродного скелета:
4
3
2
1
3
СН3–СН2–СН2–CH2–ОН
бутанол-1
2
1
СН3–СН–СН2–ОН
ǀ
2-метилпропанол-1
СН3
II. Изомерия положения функциональной группы
4
3
2
1
• СН3–СН2–СН2–СН2–ОН бутанол-1
ОН
1
2
3
4
• СН3–СН–СН2–СН3
ǀ
ОН
бутанол-2
9.
9Изомерия предельных одноатомных спиртов
III. Межклассовая изомерия
• СН3–СН2–ОН этанол
• СН3–О–СН3 диметиловый эфир
Сколько изомеров возможны у пропанола-1?
10.
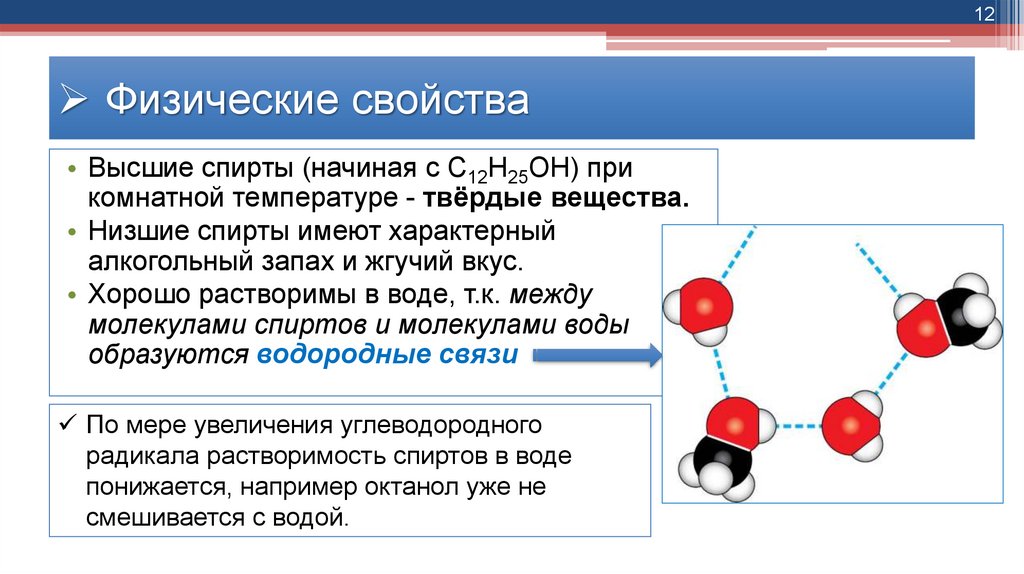
10Физические свойства
• Низшие и средние члены ряда предельных
одноатомных спиртов, содержащие от одного до
одиннадцати атомов углерода, - жидкости.
• Это объясняется наличием водородных связей между
молекулами спиртов:
Водородные связи возникают при
взаимодействии частично
положительно заряженного атома
водорода одной молекулы спирта и
частично отрицательно заряженного
атома кислорода другой молекулы.
11.
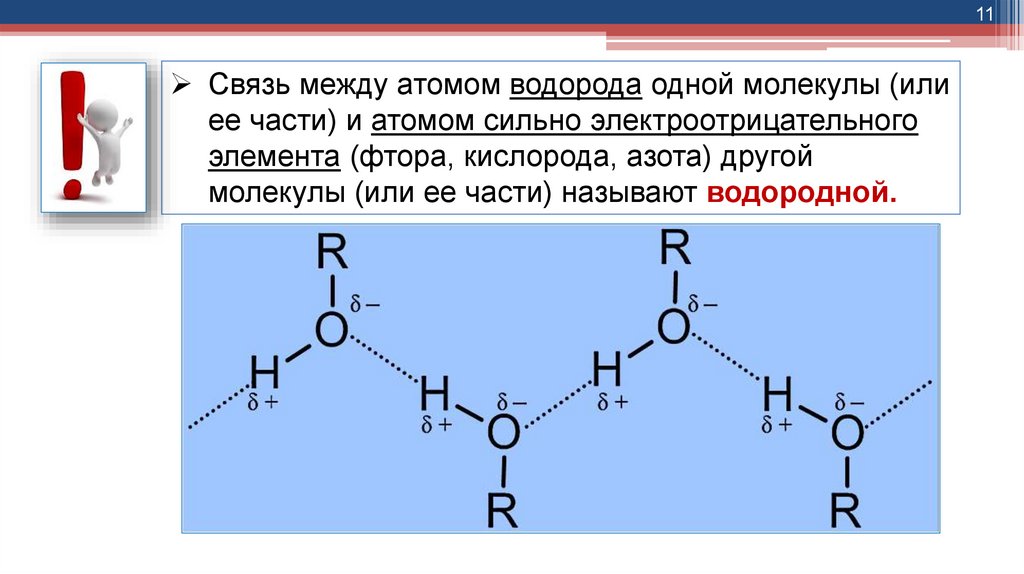
11Связь между атомом водорода одной молекулы (или
ее части) и атомом сильно электроотрицательного
элемента (фтора, кислорода, азота) другой
молекулы (или ее части) называют водородной.
12.
12Физические свойства
• Высшие спирты (начиная с C12H25OH) при
комнатной температуре - твёрдые вещества.
• Низшие спирты имеют характерный
алкогольный запах и жгучий вкус.
• Хорошо растворимы в воде, т.к. между
молекулами спиртов и молекулами воды
образуются водородные связи
По мере увеличения углеводородного
радикала растворимость спиртов в воде
понижается, например октанол уже не
смешивается с водой.
13.
13Химические свойства
• Характерные для данного класса соединений свойства обусловлены
наличием гидроксильной группы.
1. Взаимодействие спиртов с щелочными и щёлочно-земельными
металлами.
Образуются алкоголяты (соли):
этилат натрия
2. Взаимодействие спиртов с галогеноводородами.
Замещение гидроксильной группы на галоген приводит к образованию
галогеналканов.
Например:
14.
14Химические свойства
3. Межмолекулярная дегидратация спиртов.
Отщепление молекулы воды от двух молекул спирта при нагревании
происходит в присутствии водоотнимающих средств:
Так, при нагревании этилового спирта с серной кислотой в диапазоне
температур от 100 до 140 °С образуется диэтиловый (серный) эфир.
15.
15Химические свойства
4. Внутримолекулярная дегидратация спиртов.
При нагревании спиртов в присутствии водоотнимающих средств до более
высокой температуры, чем температура межмолекулярной дегидратации,
образуются алкены.
Внутримолекулярная дегидратация спиртов протекает в соответствии с
правилом Зайцева: при отщеплении воды от вторичного или третичного
спирта атом водорода отрывается от наименее гидрированного атома
углерода.
16.
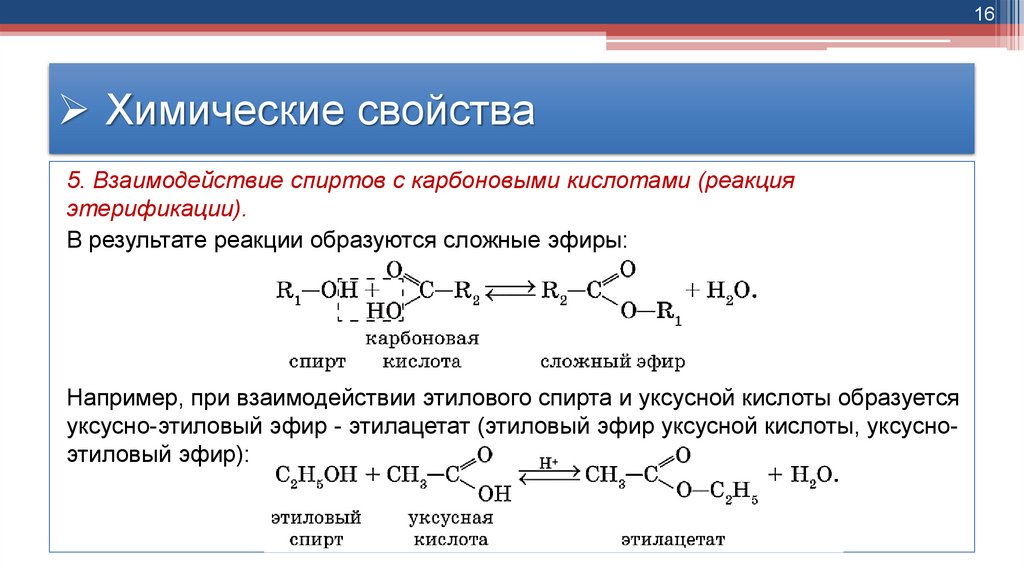
16Химические свойства
5. Взаимодействие спиртов с карбоновыми кислотами (реакция
этерификации).
В результате реакции образуются сложные эфиры:
Например, при взаимодействии этилового спирта и уксусной кислоты образуется
уксусно-этиловый эфир - этилацетат (этиловый эфир уксусной кислоты, уксусноэтиловый эфир):
17.
17Химические свойства
6. Окисление спиртов.
Обычно окисление спиртов проводят сильными окислителями, например дихроматом калия или
перманганатом калия, в кислой среде. При этом действие окислителя направляется на атом
углерода, связанный с гидроксильной группой.
Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению.
Качественная реакция на спирты – чёрный
налёт оксида меди со спирали исчезает,
восстанавливается характерная красноватая
окраска металла.
18.
18Химические свойства
7. Дегидрирование спиртов.
При пропускании паров спирта над металлическим катализатором,
например медью, серебром или платиной, нагретым до температуры
200-300°С, первичные спирты превращаются в альдегиды,
а вторичные - в кетоны:
19.
19Химические свойства
• Свойства спиртов, обусловленные углеводородным
радикалом различны и зависят от характера последних:
все спирты горят;
непредельные спирты, содержащие в молекуле двойную
С=С связь вступают в реакции присоединения, подвергаются
гидрированию, реагируют с галогенами, например
обесцвечивают бромную воду, и т. д.
20.
20Способы получения
• Гидролиз галогеналканов – реакция с водой:
• Гидратация алкенов.
Присоединение воды по π-связи молекулы алкена:
Гидратация пропена приводит в соответствии с правилом Марковникова к
образованию вторичного спирта - пропанола-2:
21.
21Способы получения
• Окисление алкенов.
Гликоли могут быть получены при окислении алкенов водным раствором
перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется
при окислении этилена (этена) на холоду:
• Брожение глюкозы.
Этот способ получения этилового (винного) спирта известен человеку с
древнейших времён:
22.
22Применение этанола
В промышленности и
медицине:
1 - производство уксусной
кислоты;
2 - косметика и парфюмерия;
3 - медицинские препараты;
4 - лекарственные средства;
5 - производство сложных
эфиров;
6 - лаки;
7, 8 - синтетические каучуки.
23.
23Источники















 chemistry
chemistry








