Similar presentations:
Молекулярно – кинетическая теория
1.
МОЛЕКУЛЯРНО – КИНЕТИЧЕСКАЯТЕОРИЯ
Примечание:
ВНИМАНИЕ!!!
В ДАННОЙ ПРЕЗЕНТАЦИИ МНОГО
НАСЛОЕНИЙ НА СЛАЙДЫ. БУДЬ
ВНИМАТЕЛЬНЕЕ!!!
в конспекте должно быть все, что записано красным, бордовым цветом
или выделено красным.
Формулы, схемы должны быть представлены все.
Материал представленный черным цветом дополнительный.
Материал представленный курсивом для прочтения.
2.
МКТ - учение о свойствах и строение вещества.- объясняет свойства материального мира, через
движение и взаимодействие частиц.
Основные положения МКТ.
Вещество состоит из частиц.
Эти частицы хаотически движутся.
Частицы взаимодействуют друг с другом.
3.
Основоположники теории:М.В.
Ломоносов;
Больцман,
Максвелл,
Авогадро.
Издавна человека интересовали такие
вопросы как: каково внутреннее строение
любого предмета, вещества; является ли
вещество сплошным или дискретным (т.е.
непрерывным или подобным горке песка).
Еще др. гр. ученый Демокрит учил, что все
тела возникают в результате соединения
атомов, находящихся в непрерывном движении.
У истоков создания теории строения
вещества стоял М.В. Ломоносов. Он доказал,
что
все
cсоответствующие
явления
(нагревание, остывание, упругость газов,
смешивание веществ и т.д.) объясняются
взаимодействием
и движением частиц
вещества.
Идеи Ломоносова продолжал развивать
английский ученый Дальтон. Он объяснял
некоторые химические закономерности исходя
из представлений о частицах.
К началу 20 века была создана теория, которая
получила название молекулярно-кинетическая
теория строения вещества.
4.
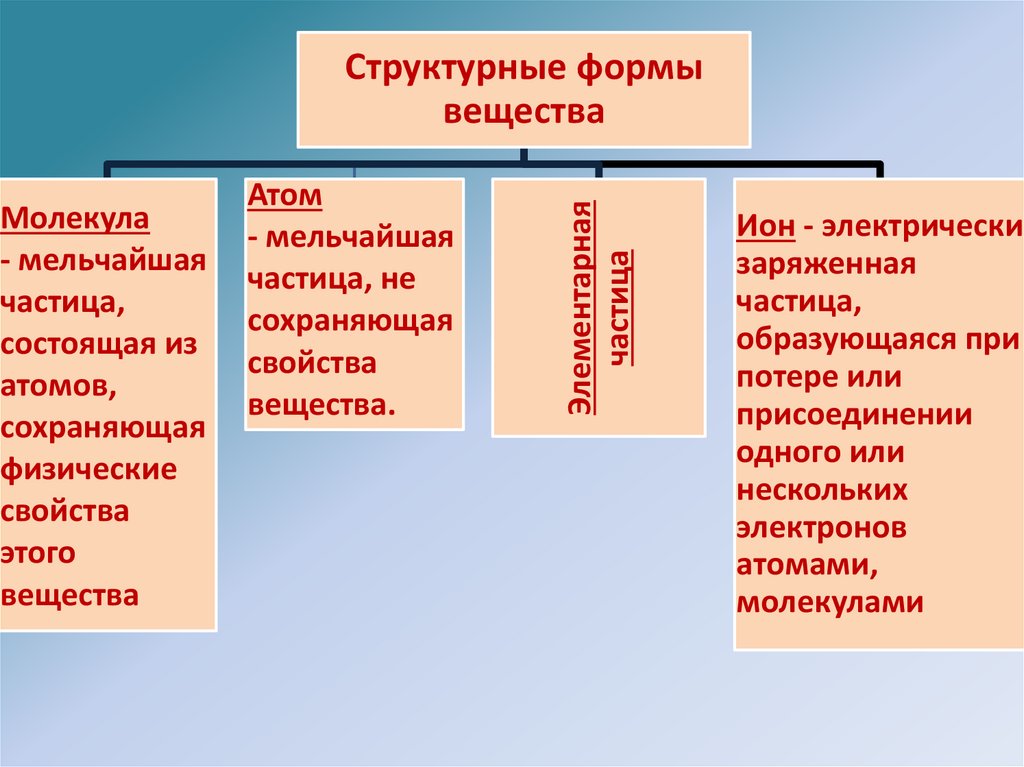
Молекула- мельчайшая
частица,
состоящая из
атомов,
сохраняющая
физические
свойства
этого
вещества
Атом
- мельчайшая
частица, не
сохраняющая
свойства
вещества.
Элементарная
частица
Структурные формы
вещества
Ион - электрически
заряженная
частица,
образующаяся при
потере или
присоединении
одного или
нескольких
электронов
атомами,
молекулами
5.
Косвенные подтверждения хаотическогодвижения частиц вещества.
1.Диффузия - самопроизвольное проникновение соприкасающихся
веществ одного в другое.
Особенности явления:
- с повышением температуры диффузия ускоряется;
- в газах происходит быстрее, чем в жидкостях и твердых телах.
Пример: - засолка овощей, питание растений.
2.Броуновское движение - это хаотичное движение мелких
частиц под действием молекул окружающей среды.
Характер этого движения зависит:
- от вида жидкости, размера, массы и формы частиц;
- не зависит от вещества частицы;
- чем больше температура, тем больше скорость броуновского движения.
Причина этого движения – нескомпенсированность импульсов, которые получает частица со стороны
молекул окружающей среды (рассеяние дыма).
Явление открыто английским ботаником Робертом Броуном в 1827г. Он рассматривал в
микроскоп движение цветочной пыльцы взвешенной в воде.
Француз Жан Перрен (1870-1943г.) выполнил этот же опыт более тщательно, исключил все
возможные сотрясения чаши с жидкостью и конвекционные потоки, так же выделил особенности
явления. Но теорию броуновского движения в 1905 г. смог построить Эйнштейн.
3.Теплопроводность - обусловлена передачей кинетической
энергии отдельными атомами или молекулами вещества в
результате их взаимодействия.
6.
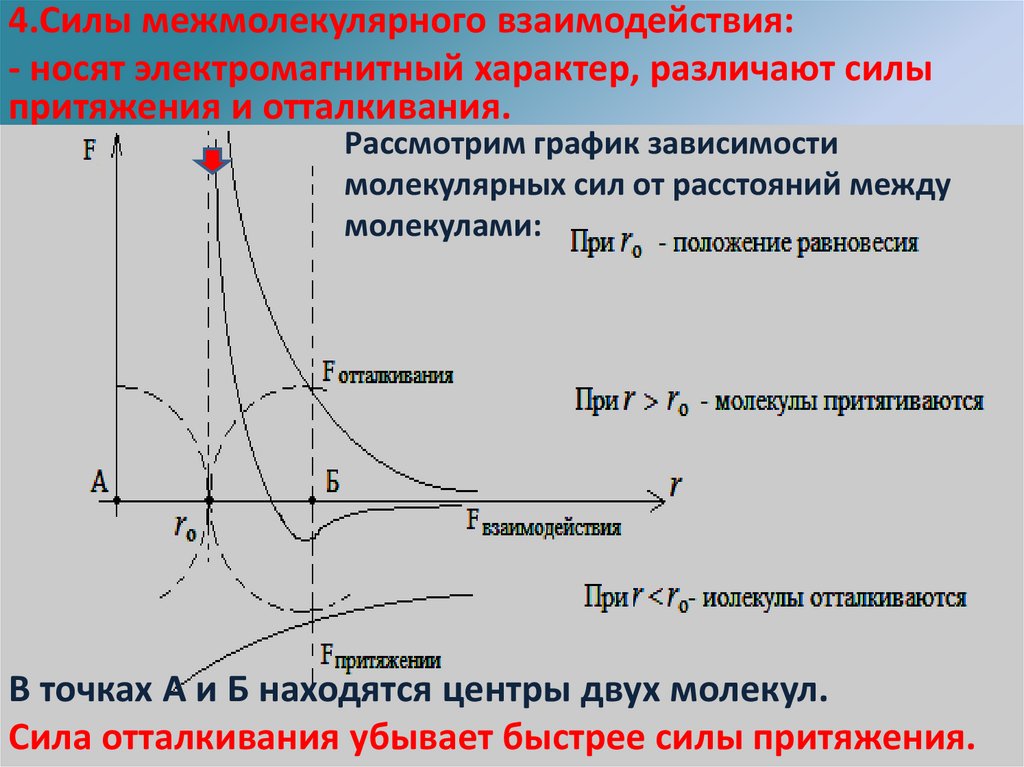
4.Силы межмолекулярного взаимодействия:- носят электромагнитный характер, различают силы
притяжения и отталкивания.
зависимости
Это обусловлено наличием в Рассмотрим
составе молекулграфик
и положительных
и отрицательных
частей (зарядов).
молекулярных сил от расстояний между
Примеры: Изучая межмолекулярное взаимодействие, получают различной силы клей
молекулами:
для склеивания бумаги, резины,
фарфора или строительных балок.
Проявление сил упругости при деформации тел, есть следствие межмолекулярного
взаимодействия.
В точках А и Б находятся центры двух молекул.
Сила отталкивания убывает быстрее силы притяжения.
7.
Силы короткодействующие заметны лишь нарасстоянии порядка размеров молекул.
a
F
=;
r
прит
7
Fотталк =
b
r
9
.
8.
.9.
ИДЕАЛЬНЫЙ ГАЗ.Любая физическая теория использует Модель идеального газа.
1. Объемом всех молекул газа
модели, изучаемого объекта.
можно пренебречь по
Пример: модель атома.
Модель - материальная точка; сравнению с объемом сосуда,
содержащим газ.
равномерное движение.
2.Время столкновения
Основная модель МКТ
молекул пренебрежимо мало
- идеальный газ.
по сравнению со временем
В физической модели принимают во
между двумя
внимание лишь те свойства
столкновениями.
реальной системы, учет которых
3.Молекулы взаимодействуют
совершенно необходим, для
между собой только при
объяснения исследуем
непосредственном
закономерностей поведения этой
системы. Ни одна модель не может соприкосновении, и при этом
они отталкиваются.
передать, се свойства системы.
Например, модель идеального газа
4.Сила притяжения между
вполне удовлетворительна для
молекулами пренебрежимо
расчета давления разряженного газа малы.
на стенки сосуда.
10.
Для описания процессов в газах и других телах,макроскопического характера используют
физические величины, относящиеся ко всему телу в
целом или же к частицам тела.
Микроскопические параметры - индивидуальные
физические величины, относящиеся к 1 частице
(то, uо, V о и т. д.)
Макроскопические параметры - физические
величины, характеризующие состояние всего
физического тела, без учета его молекулярного
строения (V, P, T, m и т.д.).
11.
Вакуум - разряженное состояние газа, при котором средняядлина свободного пробега молекул газа определяется только
размерами сосуда.
концентрация молекул меньше постоянной
Лошмидта - nл = 2,7 1025 м - 3
Пространство не может быть пустым, если в нем нет вещества, то
всегда существуют поля: гравитационное или электромагнитное.
В межзвездном пространстве вещество находится в
крайне разряженном состоянии (это частицы пыли, атомы,
молекулы...). Газ и пыль распределены не равномерно, т.е. они
образуют облака - газопылевые туманности. Концентрация
частиц в туманностях в 10 тысяч раз меньше, чем в самом
высоком вакууме достижимом на Земле. Столкновения молекул
там редки, длина свободного пробега в 10 раз больше расстояния
от Земли до Солнца. Радиоастрономия позволяет обнаружить
невидимый газ по радиоволнам, которые он излучает.
12.
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ МКТ1) Атомная единица массы 1а.е.м = 1,66 10 -27 кг
Дальтон предлагал измерять массу молекул, атомов и т.д. в массах атома
водорода Н, но это было не удобно и поэтому взяли атом изотопа углерода С.
1/2массы атома изотопа углерода С
2) Количество вещества - характеризует число частиц в теле.
[ν] = моль,
1 моль - равен количеству вещества, в котором содержится
столько же частиц, сколько атомов содержится в углероде массой
0,012кг (12 грамм)
В 1 моле число частиц равно постоянной Авогадро:
Na = 6,022 1023 моль -1
ν = N/Na
N- число частиц
[N] = штук
13.
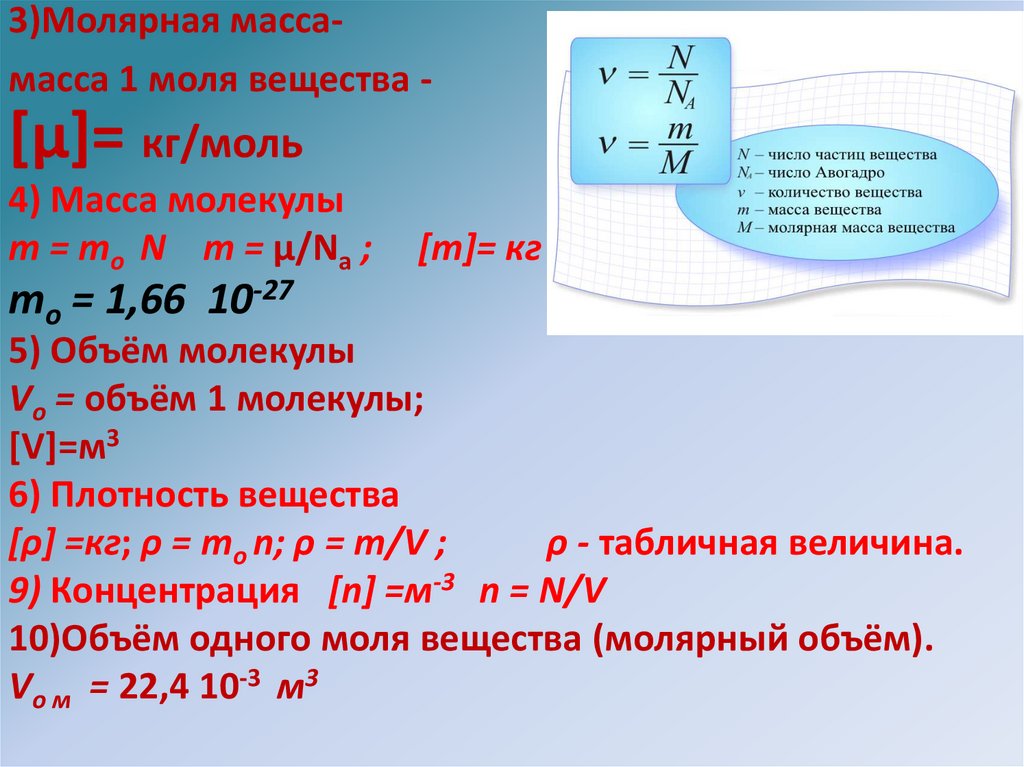
3)Молярная массамасса 1 моля вещества -[μ]= кг/моль
4) Масса молекулы
т = то N m = μ/Na ;
[m]= кг
то = 1,66 10-27
5) Объём молекулы
Vо = объём 1 молекулы;
[V]=м3
6) Плотность вещества
[ρ] =кг; ρ = то n; ρ = m/V ;
ρ - табличная величина.
9) Концентрация [n] =м-3 n = N/V
10)Объём одного моля вещества (молярный объём).
Vо м = 22,4 10-3 м3
14.
Давление газа на стенки сосуда обусловленосовокупностью ударов молекул о стенки сосуда
(передачей импульса частиц).
Вывод основного уравнения:
Вычислим давление газа на стенку СД сосуда АВСД, ее площадь S.
Каждая молекула массой mо, подлетая к стенке сосуда со скоростью uо, передает ей
импульс при ударе mоuоx ( в проекции на ось X).
Отскакивая от стенки с той же по модулю скоростью, молекула опять передает импульс
mоuоx .В результате столкновения молекула передала стенке импульс - 2muх.
ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
ГАЗОВ.
n – концентрация; м-3
m -масса одной молекулы, кг
- средняя квадратичная
скорость; м/с Р = 2/3 n Е
к
15.
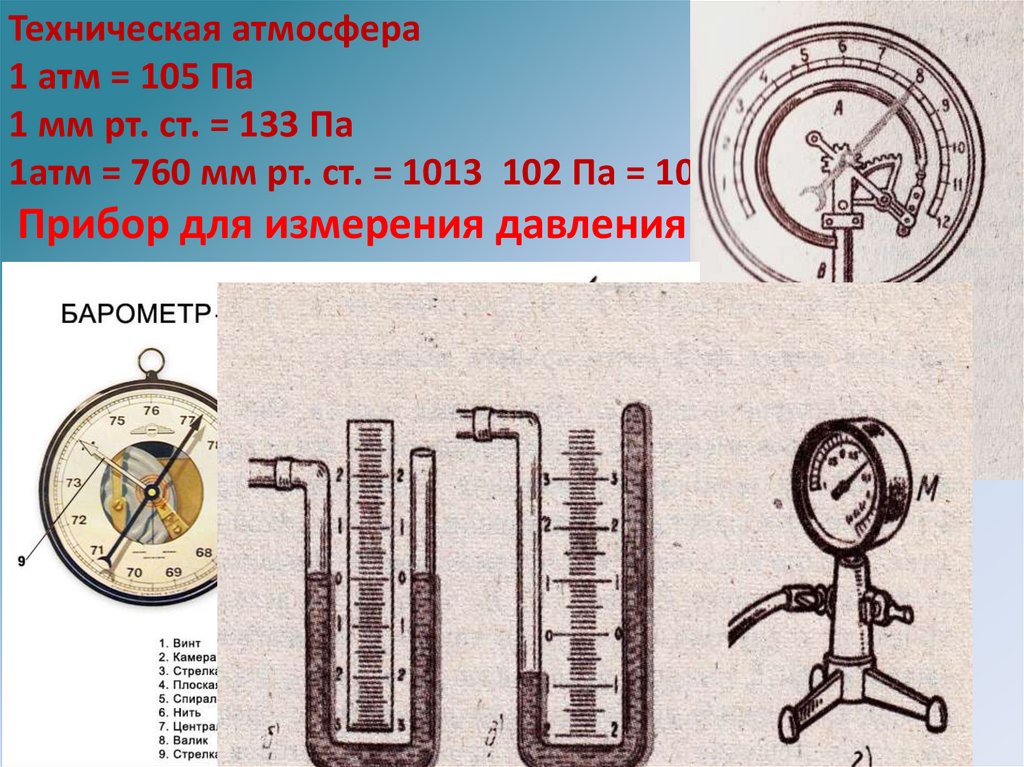
Техническая атмосфера1 атм = 105 Па
1 мм рт. ст. = 133 Па
1атм = 760 мм рт. ст. = 1013 102 Па = 105 Па
Прибор для измерения давления - манометр.
16.
Температура - величина,характеризующая степень нагретости тел.
Измеряют термометром, его приводят в соприкосновение с
изучаемым телом.
Термометр никогда не покажет температуру сразу необходимо
дождаться - теплового равновесия. Тепловое равновесие - состояние,
при котором все макроскопические параметры сколько угодно долго
остаются неизменными.
Экспериментально было установлено, что: в состоянии
теплового равновесия при котором отсутствует теплообмен, но
движение частиц не прекращается, для газов выполняется условие:
PV
PV
Q(const ) ...T
N
N
1
1
1
2
2
2
Тела, находящиеся в тепловом равновесии имеют
одинаковую температуру.
17.
Так получим температурную шкалу – теоретическуюВ левой части все величины "+" => температура может быть только "+", предельное
значение "0"
Такую шкалу построил англ. физик лорд Кельвин
( 1824-1907) - Шкала Кельвина
Абсолютная температурная шкала - не зависит ни
от каких свойств ни какого вещества.
- перейти к единицам измерения температуры в градусы позволяет коэффициент
пропорциональности k - постоянная Больцмана.
Коэффициент пропорциональности вычислил авст. физик Больцман (1844-1906)
самый ярый сторонник МКТ.
PV
kT
N
Т=[К]
18.
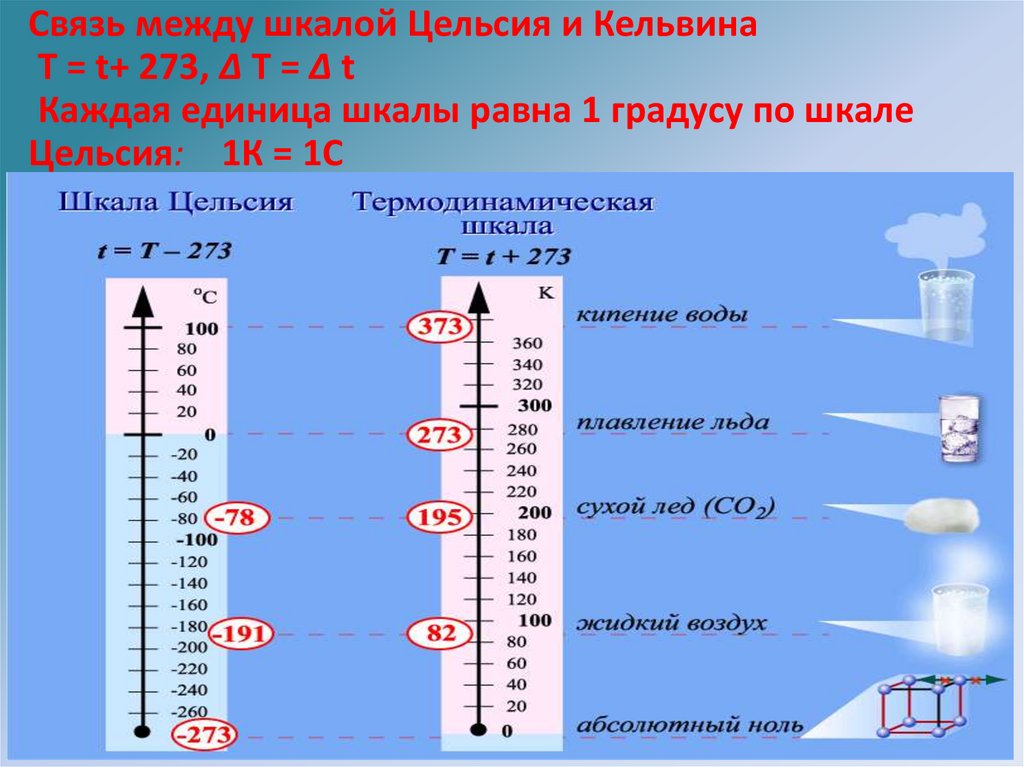
Связь между шкалой Цельсия и КельвинаТ = t+ 273, ∆ T = ∆ t
Каждая единица шкалы равна 1 градусу по шкале
Цельсия: 1К = 1С
19.
Существует предельная температура - абсолютный нуль.Абсолютный нуль температуры - предельная
температура, при которой давление в фиксированном
объеме равно нулю; и должно было бы, прекратится
поступательное движение частиц.
По законам термодинамики - он недостижим!
Температура мера средней кинетической энергии
молекул.
Воспользуемся основным
к
уравнением МКТ:
Р = 2/3 n< Ек > ;
Е
3
kT
2
-уравнение Больцмана - устанавливает связь между кинетической
энергией молекул и температурой.
Зависимость давления от концентрации и температуры.
P = nkT
20.
уравнение состояния идеального газаУРАВНЕНИЕ КЛАПЕЙРОНА - МЕНДЕЛЕЕВА
• Установим связь между основными
макропараметрами газа: m, V, Р, Т
• Концентрация частиц: n=N/V, где N = νNa
• Связь температуры и давления Р = n Kт
[Р]= Па, [V]= м3 , [m]= кг, [μ]=кг/моль
[R]=Дж/К моль, [T]= К
PV = (m/ μ )RT
21.
Различные газы подчиняются уравнениюсостояния идеального газа при малых
давлениях т.е при нормальных условиях.
Нормальные условия:
Vо = 22,4 10-3 м3/моль
Ро = 105 Па
То = 2730 К
22.
ГАЗОВЫЕ ЗАКОНЫСмотреть отдельную
презентацию!!!
23.
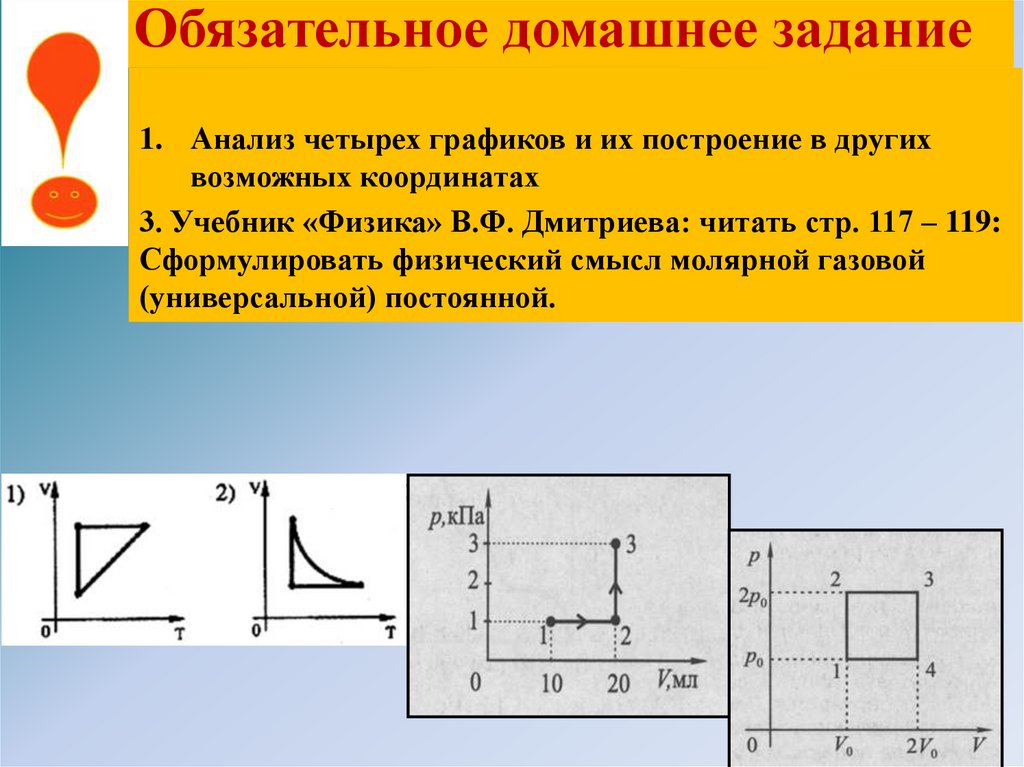
Обязательное домашнее задание1. Анализ четырех графиков и их построение в других
возможных координатах
3. Учебник «Физика» В.Ф. Дмитриева: читать стр. 117 – 119:
Сформулировать физический смысл молярной газовой
(универсальной) постоянной.
















 physics
physics








