Similar presentations:
Химические уравнения реакций
1.
Практикум по теме:«Химические уравнения
реакций»
2.
Химические уравненияХимическое уравнение - это условная запись химической реакции
посредством химических знаков и формул.
Основой при составлении химических уравнений служит Закон
сохранения массы веществ: «Масса веществ, вступивших в
химическую реакцию. Равна массе образовавшихся
веществ».М.В.Ломоносов (1748 год),
то есть число атомов каждого элемента в левой и правой частях
уравнения должно быть одинаково!
При составлении уравнений химических реакций необходимо
знать, что молекулы простых веществ: водорода(H2), азота(N2),
кислорода(O2), фтора(F2), хлора(Cl2), брома(Br2), йода(I2)
состоят из двух атомов!
3.
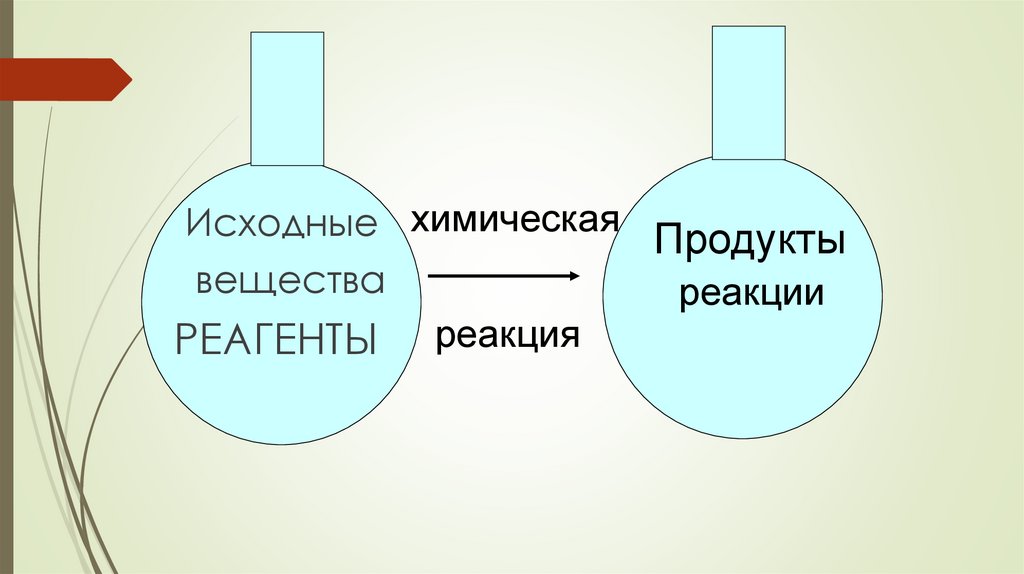
Исходные химическая Продуктывещества
реакции
РЕАГЕНТЫ реакция
4.
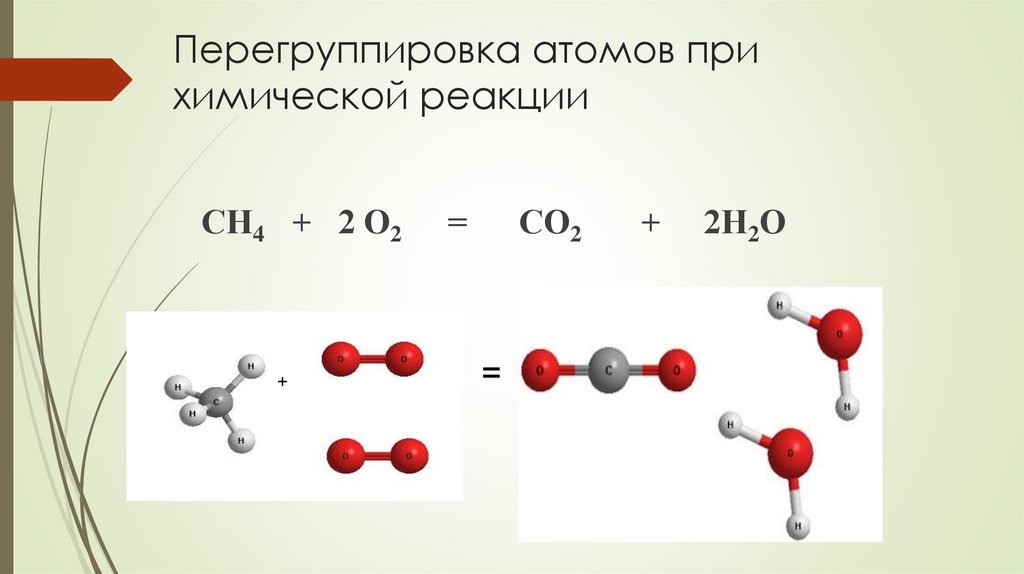
Перегруппировка атомов прихимической реакции
+
=
СО2
=
СН4 + 2 О2
+
2Н2О
5.
Алгоритм составления уравнений химических реакцийобразования бинарных соединений
Последовательность действий
1. Записать формулы исходных веществ и соединить их
знаком «+». Это левая часть уравнения.
2. Следом за формулами исходных веществ записать знак
« », а справа от него – формулу продукта (бинарного
соединения), учитывая валентность элементов. Это –
правая часть уравнения
Выполнение действий
Na + S
Mg + N2
Al + O2
Na + S
Mg + N2
Al + O2
3. Расставить коэффициенты перед формулами так, чтобы
уравнять число атомов каждого элемента в левой и правой
частях уравнения, заменить знак « » на знак « = »
I II
Na2S
II III
Mg3N2
III II
Al2O3
2 Na + S = Na2S
3 Mg + N2 = Mg3N2
4 Al + 3 O2 = 2 Al2O3
6.
Правила составления химическихуравнений
1. В левой части уравнения
записать формулы реагентов.
Затем поставить стрелку.
а) N2 + H2 →
б) Al(OH)3 →
в) Mg + HCl →
г) СaO + HNO3→
7.
2. В правой части (после стрелки)записать формулы веществ,
образующихся в результате
реакции (продуктов)
а) N2 + H2 → NH3
б) Al(OH)3 → Al2O3 +H2O
в) Mg + HCl → MgCl2 + H2
г) СaO + HNO3→ Ca(NO3)2 +H2O
8.
Алгоритм расстановкикоэффициентов в уравнении
химической реакции.
1. Подсчитать количество атомов каждого элемента в
правой и левой части.
2. Определить, у какого элемента количество атомов
меняется, найти Н.О.К.
3. Разделить Н.О.К. на индексы – получить
коэффициенты. Поставить коэффициенты перед
формулами.
9.
4. Пересчитать количество атомов, принеобходимости действия повторить.
5. Начинать лучше с атомов О или любого
другого неметалла (если только О не
находится в составе нескольких веществ).
10.
Выводы:Новые вещества не получаются из ничего
и не могут обратиться в ничто.
При химических реакциях происходит
перегруппировка атомов
Масса веществ, вступивших в реакцию
равна массе образовавшихся веществ
При составлении уравнений нужно
соблюдать закон сохранения массы веществ
11.
1.Составьте уравнения химических реакций по описанию и расставьтекоэффициенты:
серная кислота взаимодействует с гидроксидом калия с образованием
сульфата калия и воды;
хлорид серебра разлагается на свету и при этом образуются серебро и хлор
(Cl2);
магний взаимодействует с соляной кислот с образованием хлорида магния и
газа водорода (H2↑);
натрий активно реагирует с водой и при этом образуются гидроксид натрия
и газ-водород;
хлорид меди(II) взаимодействует с железом с образованием хлорида железа
(II) и меди;
гидроксид железа (III) разлагается при нагревании на оксид железа (III) и
воду;
сульфат лития реагирует с хлоридом бария и при этом получается хлорид
лития и сульфат бария;
12.
оксид азота (V) реагирует с водой и получается азотная кислота;нитрат калия разлагается при нагревании с образованием нитрита калия и
кислорода-газа (O2↑);
сульфид натрия + азотная кислота ─ сероводород + нитрат натрия;
оксид кальция + оксид кремния (IV) ─ силикат кальция;
фосфорная кислота + гидроксид лития ─ вода + фосфат лития;
силикат калия + азотистая кислота ─ кремниевая кислота + нитрит калия;
сернистая кислота + гидроксид цинка ─ вода + сульфит цинка;
сульфат железа (III) ─ оксид железа (III) + оксид серы (VI);
бромид бария + нитрит серебра ─ бромид серебра + нитрит бария.
13.
2.Расставьте коэффициенты в уравнениях реакций:1) NO + O2 ─ NO2;
2) HCl + O2 ─ H2O + Cl2;
3) PCl3 + Cl2 ─ PCl5;
4) Fe + H2O ─ Fe3O4 + H2;
5) CH4 + I2 ─ CH3I + HI ;
6) Zn + HCl ─ H2↑ + ZnCl2;
7) CaCl2 + Na2CO3 ─ CaCO3 + NaCl;
8) NaBr + Cl2 ─ NaCl + Br2;
9) Ca + HCl ─ CaCl2 + H2↑ ;
10) Mg + O2 ─ MgO;
11) H2S + O2 ─ H2O + SO2 ;
14.
12) Fe2O3 + H2 ─ Fe + H2O13) CaCl2 + NaOH ─ Ca(OH)2 + NaCl;
14) H2 + O2 ─ H2O;
15) Zn + CuCl2 ─ Cu + ZnCl2 ;
16) NH3 ─ N2 + H2 ;
17) Cu + S ─ CuS ;
18) AgF + NaCl ─ AgCl + NaF ;
19) CaCO3 ─ CaO + CO2↑;
20) CuBr2 + NaOH ─ Cu(OH)2 + NaBr ;
21) Fe + H2O ─ H2↑ + Fe2O3












 chemistry
chemistry








