Similar presentations:
Закон сохранения массы веществ. Уравнения химических реакций
1.
Закон сохранениямассы веществ.
Уравнения
химических реакций
2. Назовите химические явления. Каковы признаки химических реакций?
скисание молока,
подгорание пищи на сковороде,
испарение жидкой ртути,
почернение серебряных изделий,
образование тумана,
испарение воды,
образование ржавчины,
горение древесины,
таянье льда,
кипение воды,
3. Условия хим.реакций
измельчение1. Соприкосновение,
или перемешивание
2. Нагревание (t)
3. Увеличение или уменьшение
давления(p) (вакуум)
4. Облучение (hv)
5. Электрический ток или разряд
6. Катализ (kat)
4. Признаки хим.реакций
1. Выделяется газ2. Выпадет осадок
3. Происходит изменение окраски
веществ
4. Выделяется или поглощается тепло,
свет
5. Появление запаха (иногда резкого,
ядовитого)
5. Основные понятия для повторения
Химический знакХимическая формула
Атом
Молекула
Коэффициент
Индекс
Химическая реакция
6. Химическая реакция
Химическими реакциями называютсяявления,
в процессе которых происходит
образование
новых веществ – продуктов реакции
называются явления,
7. Новые понятия
Закон сохранения массы веществУравнение химической реакции
Реагенты
Продукты
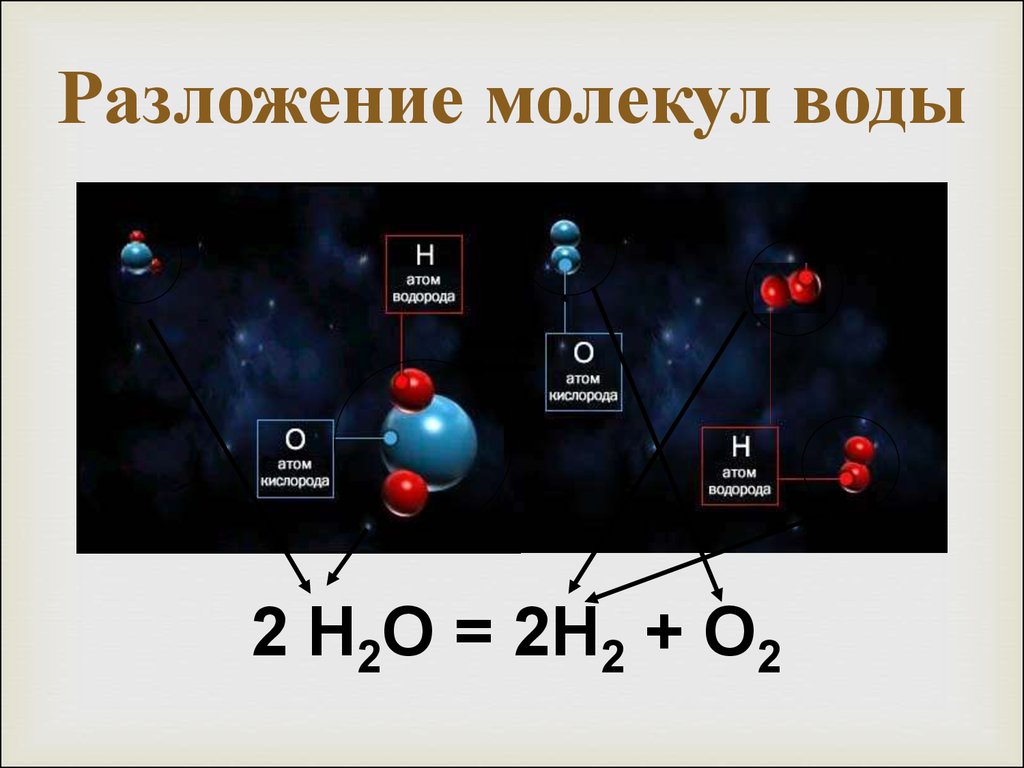
8. Разложение молекул воды
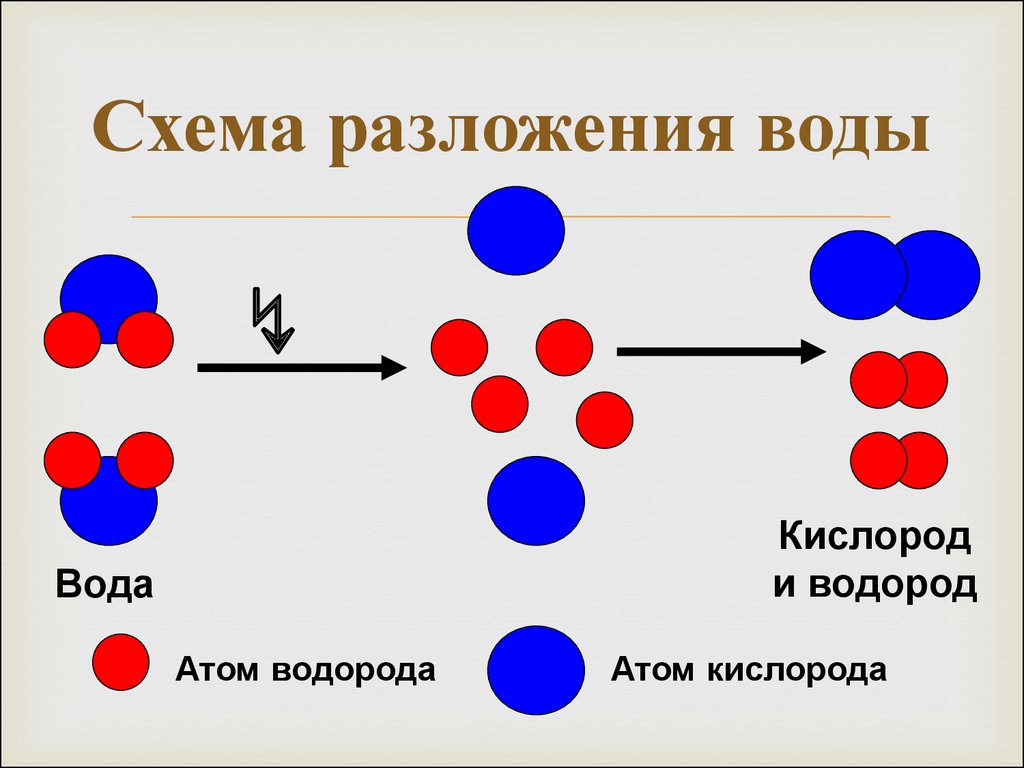
2 Н2О = 2Н2 + О29. Схема разложения воды
↯Кислород
и водород
Вода
Атом водорода
Атом кислорода
10.
При химических явленияхпроисходит разрушение молекул
исходных веществ и образование
новых молекул из тех же атомов, из
которых состояли исходные
вещества.
11. Формулировка закона сохранения массы веществ
Массавеществ,
вступивших в
реакцию
Масса веществ,
получившихся в
результате
реакции
Число атомов каждого элемента должно
быть одинаково до и после реакции
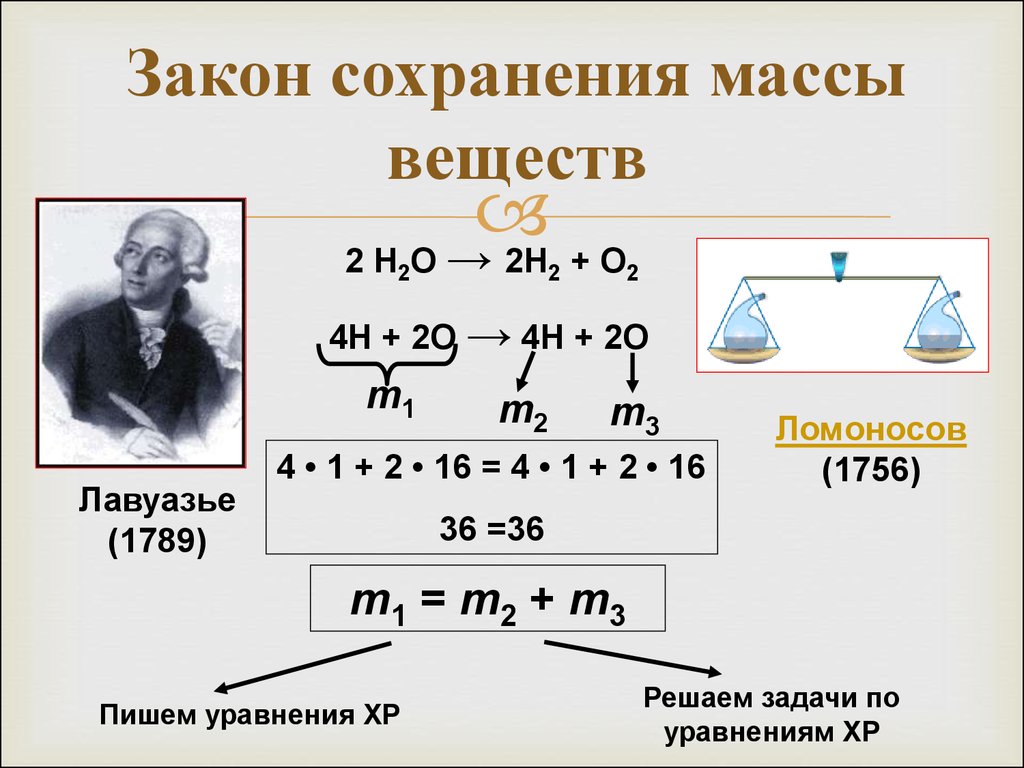
12. Закон сохранения массы веществ
2 Н О → 2Н + О2
2
2
4Н + 2О → 4Н + 2О
m1
Лавуазье
(1789)
m2
m3
4 • 1 + 2 • 16 = 4 • 1 + 2 • 16
Ломоносов
(1756)
36 =36
m1 = m2 + m3
Пишем уравнения ХР
Решаем задачи по
уравнениям ХР
13. Михаил Васильевич Ломоносов (1711 – 1765)
1. Родился в 1711 году в России2. Русский ученый – природовед
3. Основатель первого в России Московского университета
4. Развивал атомно-молекулярные представления о строении веществ
5. Открыл закон
массы веществ
сохранения
14. Значение закона
Способствует дальнейшему развитию химииПозволяет производить важные вычисления
стр 39
На основе данного закона составляют
уравнения химических реакций!
15. Решите задачки
Медь соединяется с серой в массовом отношении 2:1. Дляприготовления 21г сульфида меди (II) сколько
потребуется меди, а сколько серы.
a) Cu – 14 г, S – 7 г
c) Cu – 7 г, S – 14 г
b) Cu – 12 г, S – 9 г
d) Cu – 16 г, S – 5 г
При разложении 4,34 г оксида ртути () образовалось 4,02
г ртути. Масса выделившегося при этом кислорода
равна?
16.
Метан, сгорая в кислороде, образуетуглекислый газ и воду.
Эта фраза описывает химическую реакцию
– реакцию горения. Прочитать её может
только умеющий читать по-русски.
Можно ли сократить запись?
Можно ли сделать запись
понятной для не знающего
русского языка?
Так ли это необходимо?
17.
Давайте подчеркнём в исходной фразеназвания веществ.
Метан сгорая в кислороде образует
углекислый газ и воду.
Вместо названий мы можем использовать
химические формулы и тогда каждый знающий
химию поймёт, о каких веществах идёт речь.
метан – СН4
углекислый газ – СО2
кислород – О2
вода – Н2О
18. Метан, сгорая в кислороде, образует углекислый газ и воду.
Этого недостаточно. Остались слова,которые тоже требуют замены.
Метан, сгорая в кислороде, образует
углекислый газ и воду.
Язык какой науки Вы бы предложили для
использования?
Какие знаки этого языка Вы бы отобрали
для решения поставленной перед Вами
проблемы?
19.
Язык науки математикисгорая в означает «взаимодействует» –
«+»
образует означает «получается» –
«=»
и – это перечисление, веществ может быть и больше
двух –
«+»
На основе того, что вы знаете о
математических уравнениях,
попробуйте записать
химическое
20.
кислороде,Метан,
сгорая в
СН4
+
углекислый газ
образует
О2
=
воду
и
СО2
+ Н2О
Всё ли мы учли? Проведите вычисления, чтобы
проверить, выполняется ли закон сохранения массы
веществ!
21.
Мr(СН4 ) = 12 + 4*1 = 16Mr(О2 ) = 2*16 = 32
Mr(СО2 ) = 12 + 2*16 = 44
Mr(Н2О ) = 2*1 + 16 = 18
СН4 + О2 = СО2 + Н2О
16 + 32 = 44
+ 18
?
22.
СН4 + 2О2 = СО2 + 2Н2ОПолученная нами краткая
запись химической реакции
называется уравнением
химической реакции.
23.
Уравнением химической реакции называютусловную запись химической реакции с
помощью химических формул, коэффициентов и
математических знаков.
А почему запись условная?
Запись отражает только какие вещества
вступают в реакцию и какие образуются,
но не учитывает как протекает процесс
превращения.
24.
Вместо знака равенства иногдаиспользуется стрелка:
Например, если не расставлены коэффициенты:
СН4 + О2
СО2 + Н2О
Такую запись называют СХЕМОЙ реакции.
25.
На основе услышанногосоставьте уравнение реакции
26.
Красный фосфор энергично сгорает вкислороде. Подожжем порошок фосфора и
опустим в колбу с кислородом.
В кислороде фосфор горит ослепительным белым пламенем.
Выделяется белый дым - это оксид фосфора пэ-двао-пять или фосфорный ангидрид (оксид фосфора V).
Фосфорный ангидрид (оксид фосфора V) в виде порошка
оседает на стенках колбы.
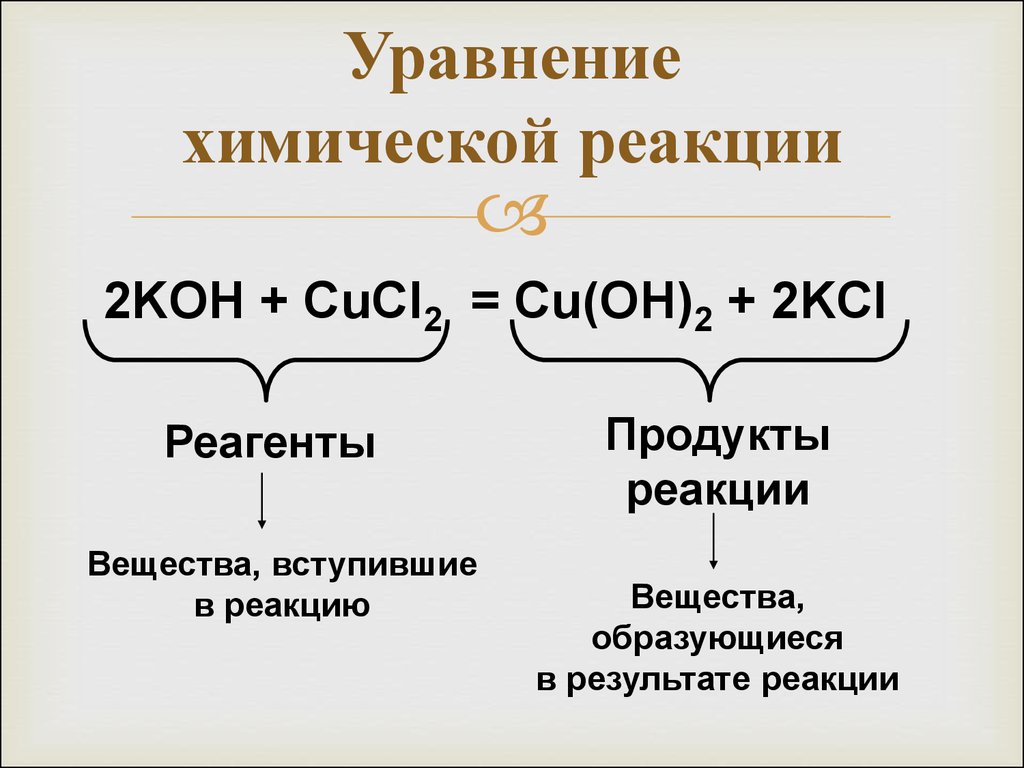
27. Уравнение химической реакции
2KOH + CuCl2 = Cu(OH)2 + 2KClРеагенты
Вещества, вступившие
в реакцию
Продукты
реакции
Вещества,
образующиеся
в результате реакции
28. Запишите названия исходных веществ и продуктов реакции для следующих уравнений химических реакций:
а) Fe + S = FeS,Исходные вещества ____________________,
Продукты реакции _____________________;
б) Cu (OH)2 = CuO + H2O,
Исходные вещества ____________________,
Продукты реакции _____________________;
в) HCl + NaOH = NaCl + H2O
Исходные вещества ____________________,
Продукты реакции _____________________;
29. Алгоритм составления уравнений химических реакций
1. В левой части записываются формулы веществ,которые вступают в реакцию:
2. В правой части (после стрелки) – формулы
веществ, которые получаются в результате реакции:
3. Затем с помощью коэффициентов уравнивается
число атомов одинаковых химических элементов в
правой и левой частях уравнения :
30. Основные правила расстановки коэффициентов
Расстановку коэффициентов начинают с элемента, чьихатомов в реакции участвует больше.
Количество атомов кислорода до и после реакции в
большинстве случаев должно быть четным.
Если в реакции (обмена) участвуют сложные вещества, то
расстановку коэффициентов начинают с атомов металлов
или с кислотных остатков.
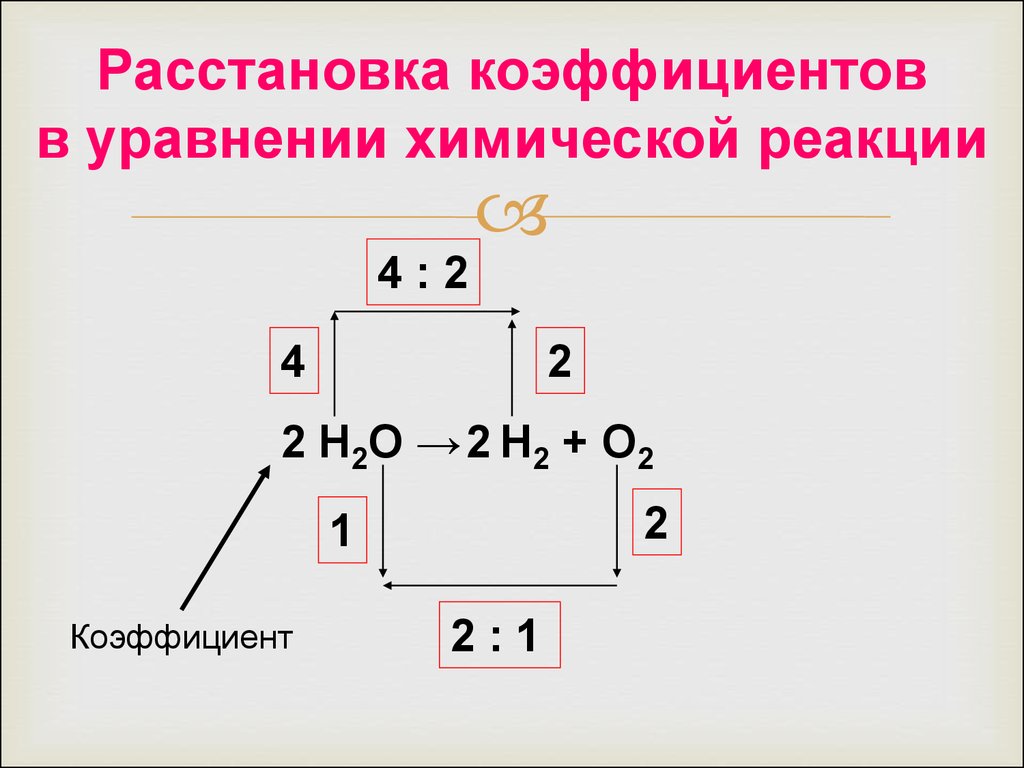
31.
Расстановка коэффициентовв уравнении химической реакции
4:2
4
2
2 Н2О → 2 Н2 + О2
2
1
Коэффициент
2:1
32. Что показывает химическое уравнение
Какие вещества вступают в реакцию.Какие вещества образуются в результате реакции.
Массу реагирующих веществ и веществ, образующихся
в результате химической реакции.
Отношение масс реагирующих веществ и веществ,
образующихся в результате химической реакции.
33. Расставьте коэффициенты в уравнениях реакции.
1. Cu + O2 CuO2. HCl H2 +Cl2
3. Ag2O + C Ag +CO2
4. ZnO + HNO3 Zn(NO3)2 + H2O
34. Домашнее задание
Расставьте коэффициенты в следующих уравнениях химических реакций:N2 + H2 → NH3,
MnO2 + H2 → Mn + H2O,
Al + Cl2 → AlCl3,
CaO + P2O5 → Ca3(PO4)2,
KOH + H2SO4 → K2SO4 + H2O,
ZnS + O2 → ZnO + SO2.
35. Домашнее задание
1. При взаимодействии цинка массой 65 г с серойобразовался сульфид цинка (ZnS) массой 97 г. Какая
масса серы вступила в реакцию?
2. В реакцию вступило 9 г алюминия и 127 г йода. Какая
масса йодида алюминия (AlI3) при этом образуется?
36. Составьте уравнения реакций по названию веществ. Расставьте коэффициенты.
1.2.
3.
4.
5.
Цинк + хлорид водорода = хлорид цинка + водород
Железо + хлор = хлорид железа (II)
Калий + сера = сульфид калия
Оксид углерода (II) + кислород = оксид углерода (IV)
Хлорид алюминия = алюминий + хлор
Обратите внимание, что газы
записываются с индексом 2! Стр 39
37.
Нефть – эточистое вещество
Горение свечи –
химическая реакция
Соль – сложное
вещество
С УХР
ФИНИШ
Составление
уравнений
химических реакций
Фосфор – металл
Кальций – метал
Плавление сахара –
химическое явление
Формула
воды – Н2О
Сера имеет
постоянную
валентность
СТАРТ
Атом химически
делим
Сложное вещество
состоит из разных
веществ
Сложное вещество
состоит из разных хим.
элементов
Снег – это тело
Валентность
водорода
равна I
Кислород –
простое вещество
Морская вода –
чистое вещество
Да
Нет
38.
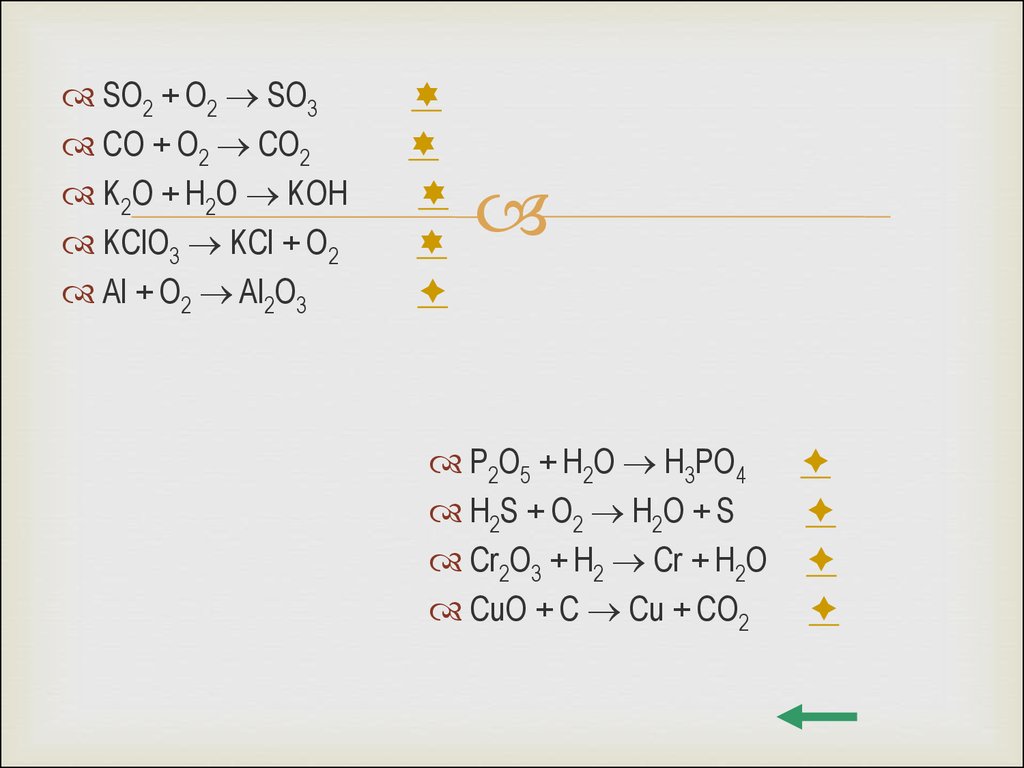
SO2 + O2 SO3CO + O2 CO2
K2O + H2O KOH
KClO3 KCl + O2
Al + O2 Al2O3
P2O5 + H2O H3PO4
H2S + O2 H2O + S
Cr2O3 + H2 Cr + H2O
CuO + C Cu + CO2
39.
H2S + O2 H2O + SO2C2H4 + O2 CO2 + H2O
Mg + H3PO4 Mg3(PO4)2 + H2
Al2O3 + HCl AlCl3 + H2O
CaO + H3PO4 Ca3(PO4)2 + H2O
Ba(OH)2 + HCl BaCl2 + H2O
KOH + H2SO4 K2SO4 + H2O
NaOH + H3PO4 Na3PO4 + H2O
Al2O3 + H2SO4 Al2(SO4)3 + H2O
NH3 + O2 N2 + H2O
40.
HI H2 + I2Мg + O2 MgO
Na + S Na2S
HgO Hg + O2
Al + S Al2S3
Ag2O Ag + O2
P + Cl2 PCl5
Pb + O2 PbO
CH4 C + H2
Al + Br2 AlBr3
Fe + O2 Fe3O4
Na + Cl2 NaCl


































 chemistry
chemistry








