Similar presentations:
Понятие о химическом равновесии. Факторы, влияющие на скорость химической реакции и положение равновесия
1. Понятие о химическом равновесии. Факторы, влияющие на скорость химической реакции и положение равновесия
2. Обратимые и необратимые химические реакции
Химические реакции, протекающиев одном направлении, называются
необратимыми
Химические реакции, протекающие
при одних и тех же условиях
одновременно в двух
противоположных направлениях,
называются обратимыми
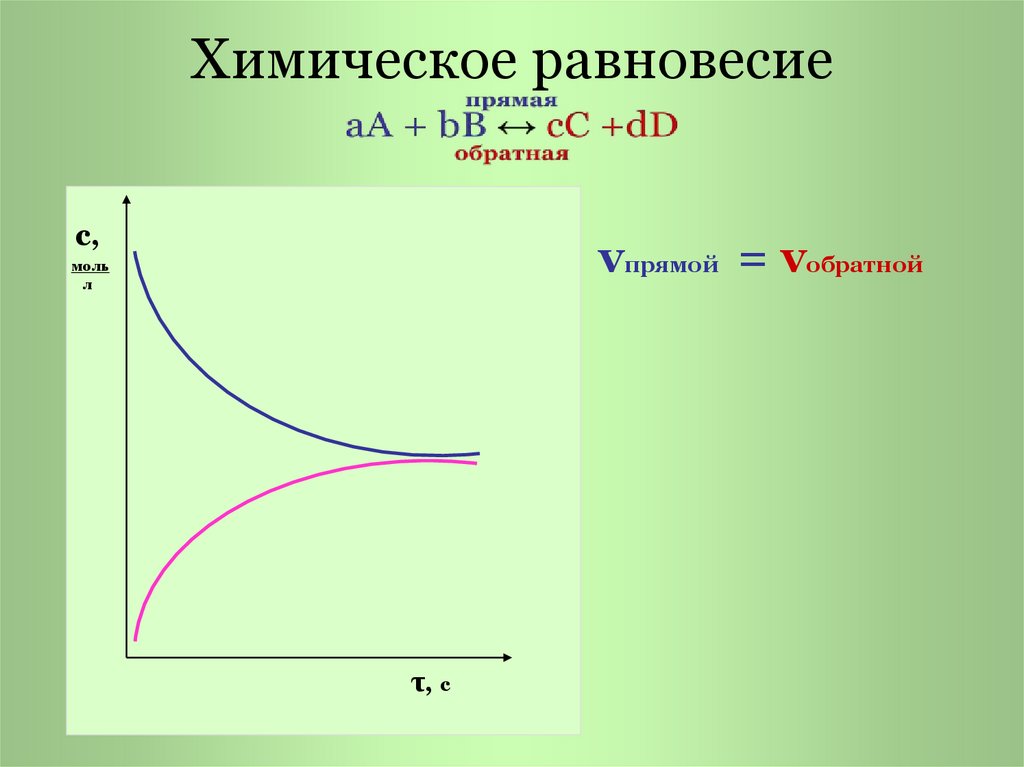
3. Химическое равновесие
с,vпрямой = vобратной
моль
л
τ, с
4.
Химическое равновесие состояние системы, прикотором скорость прямой
реакции равна скорости
обратной реакции.
!
Химическое равновесие –
подвижное (динамическое)
состояние
5. Принцип Ле-Шателье:
Если на систему, находящуюся в равновесии, производитсявнешнее воздействие (изменяются концентрация,
температура, давление), то равновесие смещается в
сторону той реакции, которая ослабляет это воздействие
1. Концентрация:
а) при увеличении концентрации исходных веществ равновесие
смещается в сторону прямой реакции (вправо);
б) при увеличении концентрации продуктов реакции равновесие
смещается в сторону обратной реакции (влево).
2. Температура:
При увеличении температуры равновесие всегда смещается в
сторону эндотермической реакции. А при понижении в сторону
экзотермической.
3. Давление:
При увеличении давления равновесие смещается в сторону той
реакции, которая приводит к уменьшению объёмов газообразных
веществ.
6.
Ле -Шателье Анри Луи(8.10.1850–7.09.1936)
Французский физикохимик и
металловед. Сформулировал (1884)
общий закон смещения химического
равновесия, согласно которому при
внешнем воздействии на равновесную
систему химическое равновесие
смещается в сторону, противоположную этому воздействию
(принцип Ле Шателье). Изучал
химические процессы в металлургии.
Сконструировал термоэлектрический
пирометр. Создал металлографический
микроскоп и усовершенствовал
методику исследования строения
металлов и сплавов. Изучал свойства и
способы приготовления цементов.
Изобрел платинородиевую термопару.
Независимо от Ф. Габера нашел (1901)
условия синтеза аммиака.
7.
В каком направлении сместится химическоеравновесие в системе
1) SO3(г) ↔ SO2(г) + O2(г) – Q
2) Fe3O4(тв) + CO(г) ↔ Fe(тв) + CO2(г) – Q
3) CO2(г) + C(тв) ↔ CO(г) + Q
4) CO(г) + H2O(г) ↔ CO2(г) + H2(г) + Q
а) при увеличении концентрации;
б) при нагревании;
в) при уменьшении давления?
8. Укажите условия смещения химического равновесия в сторону прямой реакции
1) N2(г) + H2(г) ↔ NH3(г) + Q2) Zn(тв) + Н2О(г) ↔ ZnO(тв) +
Н2(г)
3) HI(г) ↔ H2(г) + I2(г) - Q
4) CO(г) +Cl2(г) ↔ COCl2(г)
5) NO(г) + O2(г) ↔ NO2(г) + Q







 chemistry
chemistry








