Similar presentations:
Понятие о химическом равновесии. Факторы, влияющие на скорость химической реакции и положение химического равновесия (9 класс)
1.
Химия 9 классурок №8
Дата 27.09.2024г
Понятие о химическом равновесии.
Факторы, влияющие на скорость
химической реакции и положение
химического равновесия
2.
Факторы, влияющие на скорость химическойреакции
• природа реагирующих веществ;
• концентрация реагирующих веществ
• поверхность соприкосновения
реагирующих веществ (в гетерогенных
реакциях).
• температура;
• действие катализаторов.
3.
1. Природа реагирующих веществ.Под природой реагирующих веществ понимают
их состав, строение, взаимное влияние атомов в
неорганических и органических веществах.
4.
5.
2. Концентрации реагирующих веществ.• На основе большого экспериментального материала в
1867 г. норвежские учёные К. Гульдберг, и П Вааге и
независимо от них в 1865 г. русский учёный Н.И.
Бекетов сформулировали основной закон химической
кинетики, устанавливающий зависимость скорости
реакции от концентраций реагирующих веществ.
6.
3.Поверхность соприкосновенияреагирующих веществ.
• Скорость реакции увеличивается благодаря:
-увеличению площади поверхности соприкосновения
реагентов (измельчение);
-повышению реакционной способности частиц на поверхности
образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу
продуктов с поверхности, где идёт реакция.
• Фактор связан с гетерогенными реакциями, которые
протекают на поверхности соприкосновения реагирующих
веществ: газ - твердое вещество, газ - жидкость, жидкость твердое вещество, жидкость - другая жидкость, твердое
вещество - другое твердое вещество, при условии, что они не
растворимы друг в друге.
7.
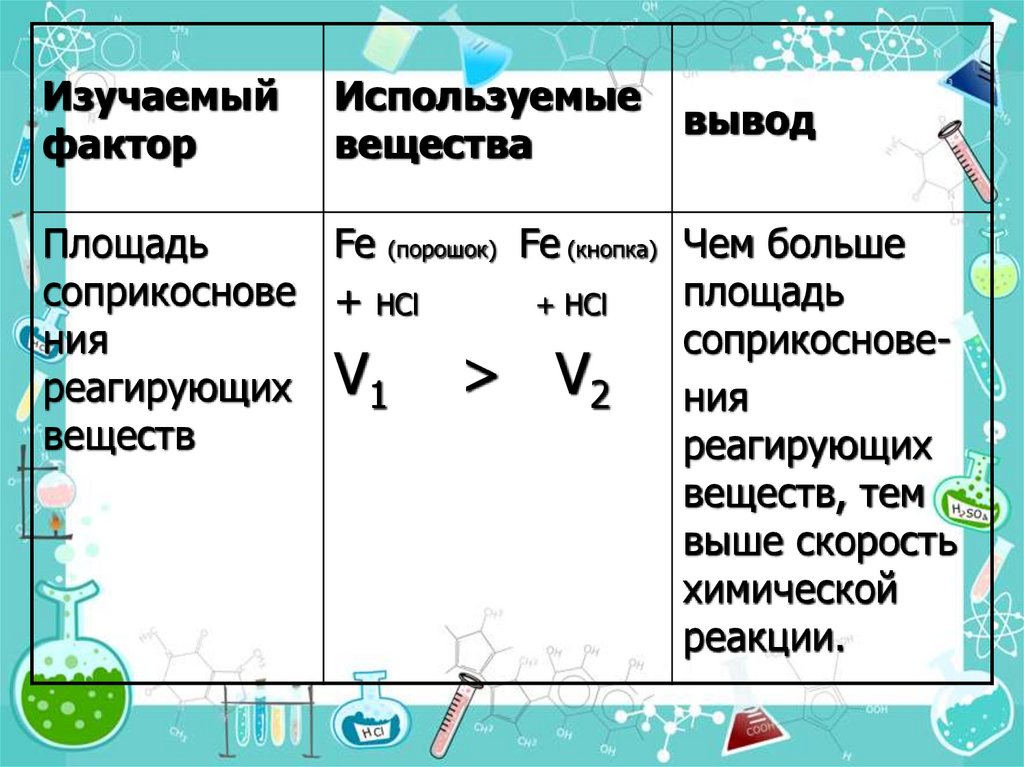
Изучаемыйфактор
Используемые
вещества
вывод
Площадь
Fe (порошок) Fe (кнопка) Чем больше
соприкоснове + НCl
площадь
+ НCl
ния
соприкоснове> V2 ния
реагирующих V1
веществ
реагирующих
веществ, тем
выше скорость
химической
реакции.
8.
4. Температура• При увеличении температуры на каждые 10° С
общее число столкновений увеличивается только
на ~ 1,6 %, а скорость реакции увеличивается в 2-4
раза (на 100-300%).
• Число, показывающее, во сколько раз
увеличивается скорость реакции при повышении
температуры на 10° С, называют температурным
коэффициентом.
9.
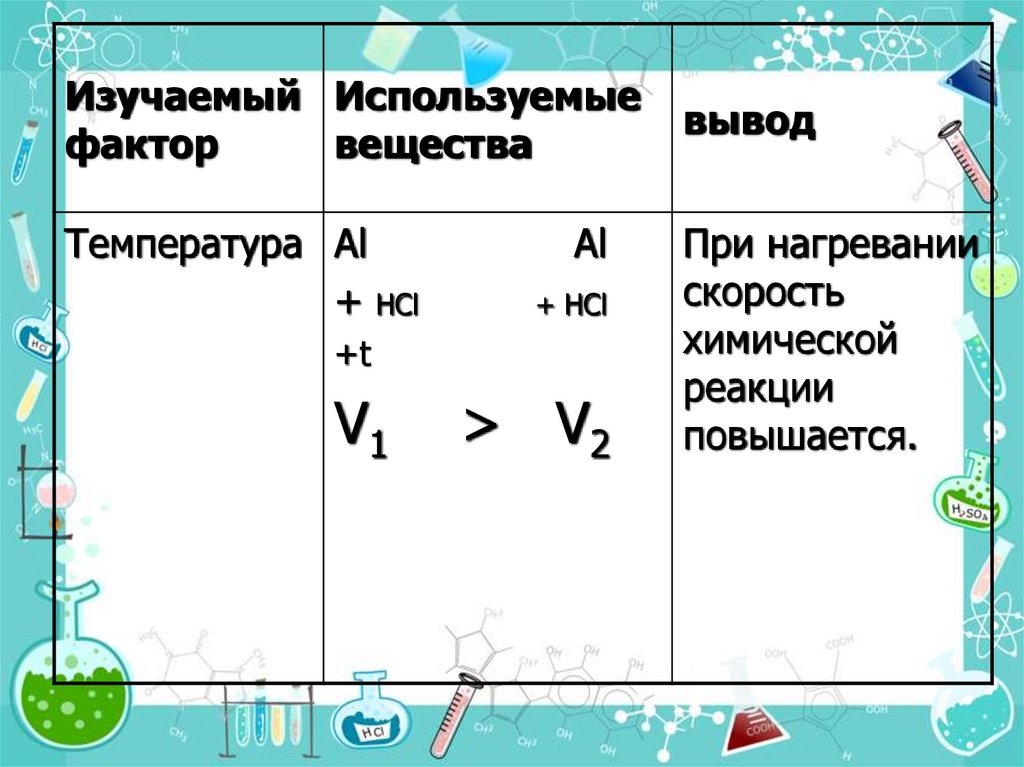
Изучаемый Используемыефактор
вещества
Температура Al
+ НCl
Al
+ НCl
+t
V1
> V2
вывод
При нагревании
скорость
химической
реакции
повышается.
10.
5. Действие катализатораМожно изменить скорость реакции, используя
специальные вещества, которые изменяют механизм
реакции и направляют ее по энергетически более
выгодному пути с меньшей энергией активации.
• Катализаторы – это вещества, участвующие в
химической реакции и увеличивающие ее скорость, но
по окончании реакции остающиеся неизменными
качественно и количественно.
• Ингибиторы – вещества, замедляющие химические
реакции.
Изменение скорости химической реакции или ее
направления с помощью катализатора называют
катализом.
11.
Различают два вида катализа:• Гомогенный катализ, при котором и катализатор, и
реагирующие вещества находятся в одном агрегатном
состоянии (фазе).
– Например, ферментативно-каталитические реакции в клетках
организма проходят в водном растворе.
Гетерогенный катализ, при котором катализатор и
реагирующие вещества находятся в разных фазах.
– Например, разложение пероксида водорода в присутствии твердого
катализатора оксида марганца(IV):
MnO2(т)
2H2O2(ж)
2H2O(ж) + O2↑(г)
12.
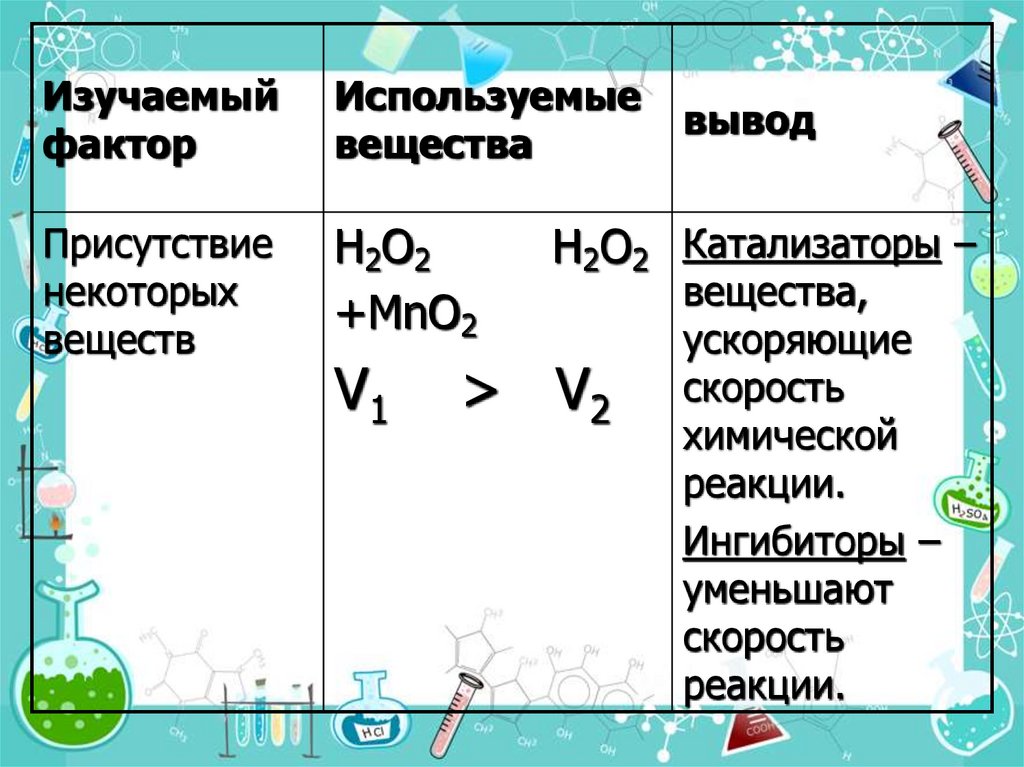
Изучаемыйфактор
Используемые
вещества
Присутствие
некоторых
веществ
H2O2
+MnO2
V1
вывод
H2O2 Катализаторы –
> V2
вещества,
ускоряющие
скорость
химической
реакции.
Ингибиторы –
уменьшают
скорость
реакции.
13.
14.
15.
16.
Обратимые реакции - это реакции,протекающие одновременно в прямом и
обратном направлениях.
( реагенты- продукты)
Необратимые- реакции, протекающие
только в одном направлении.
(осадок, газ, вода, тепло)
17.
18.
19.
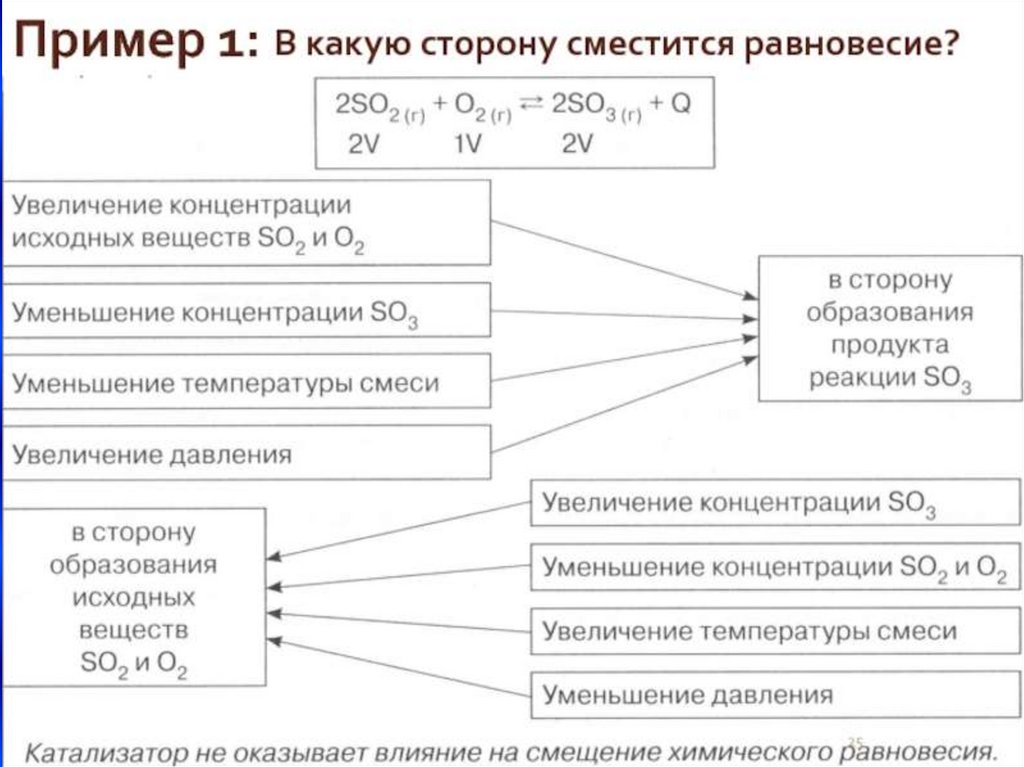
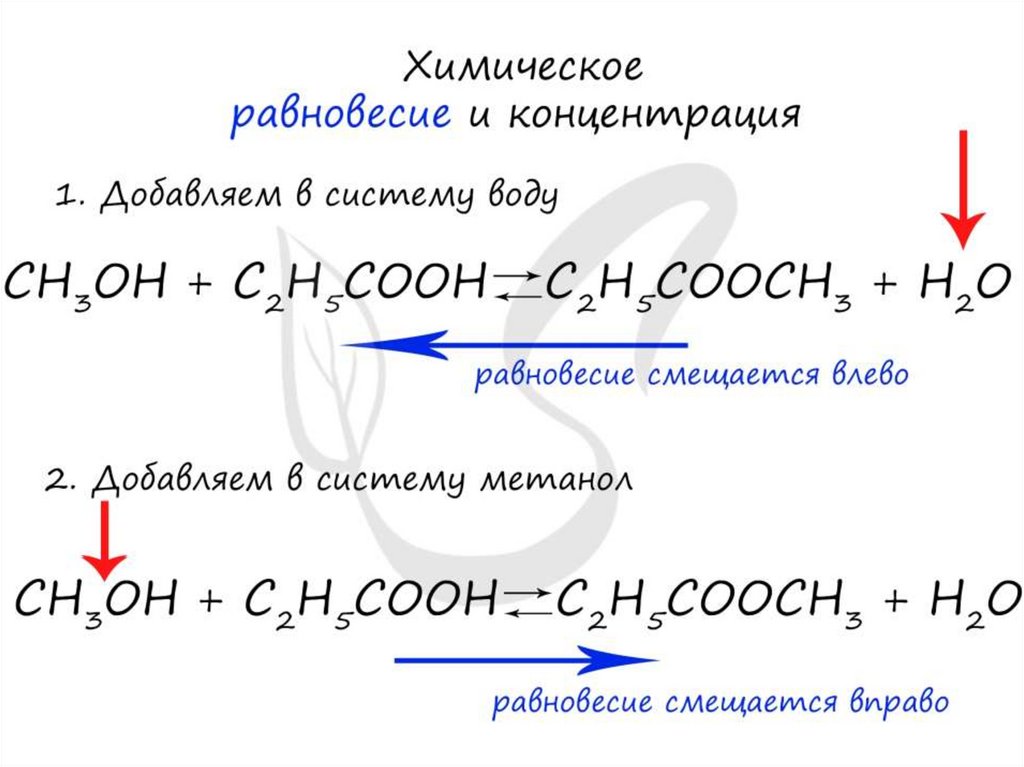
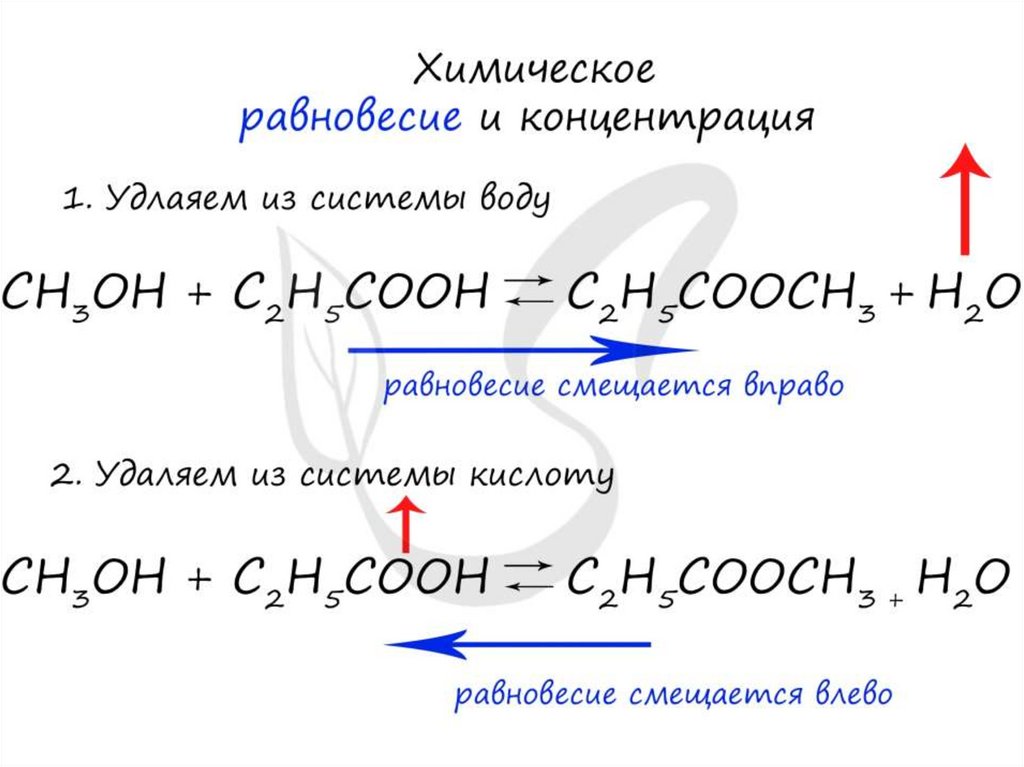
• Условия смещения химического равновесия(принципЛе Шателье)
• Если на систему, находящуюся в равновесии,
производится внешнее воздействие (t, p, c), то
равновесие смещается в сторону той реакции,
которая ослабляет это воздействие.
• 2SO2 +O2 ↔2SO3 +Q
• для смещения равновесия в сторону образования
SO3 необходимо:
• 1) понизить t (т.к. прямая реакция экзотермическая);
• 2) повысить Р (т.к. прямая реакция протекает с
уменьшением V);
• 3) увеличить С реагентов (SO2 и O2) или из зоны
реакции отводить SO3.
20.
21.
• В случае, если слева и справаколичество молекул газа
одинаково, например, в реакции:
• H2(г) + I2(г) ⇄ 2HI(г) - Q
• Слева - 2 газа, и справа - 2. В
такой реакции увеличение или
уменьшение давления не повлияет
на химическое равновесие.
22.
23.
24.
25.
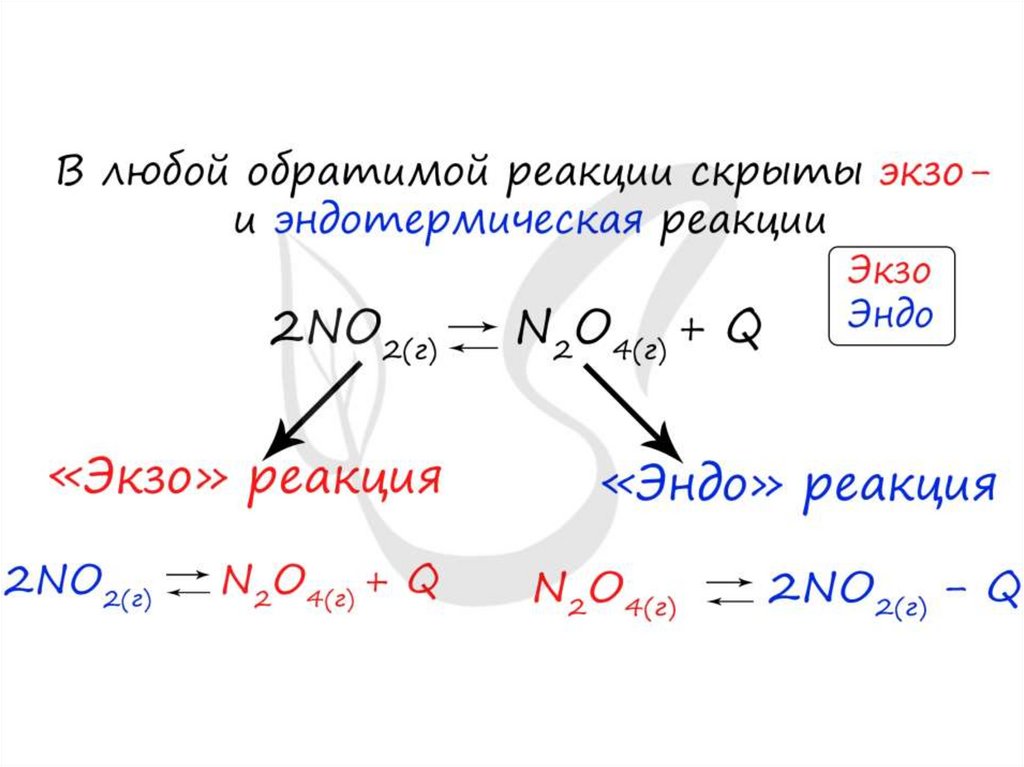
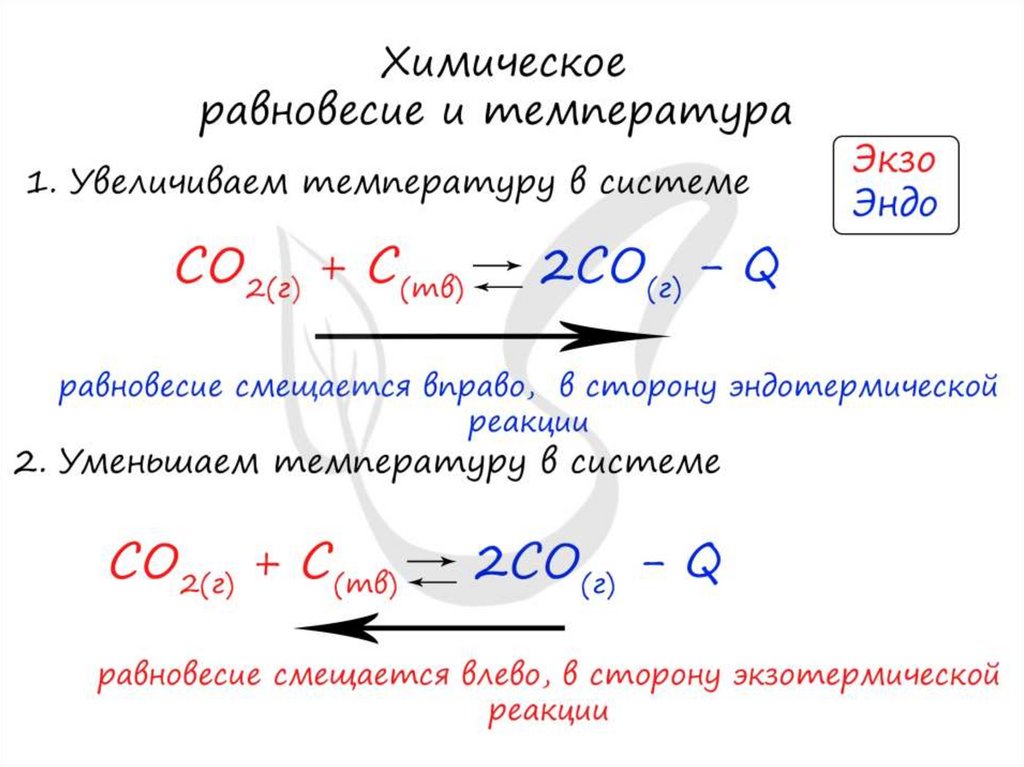
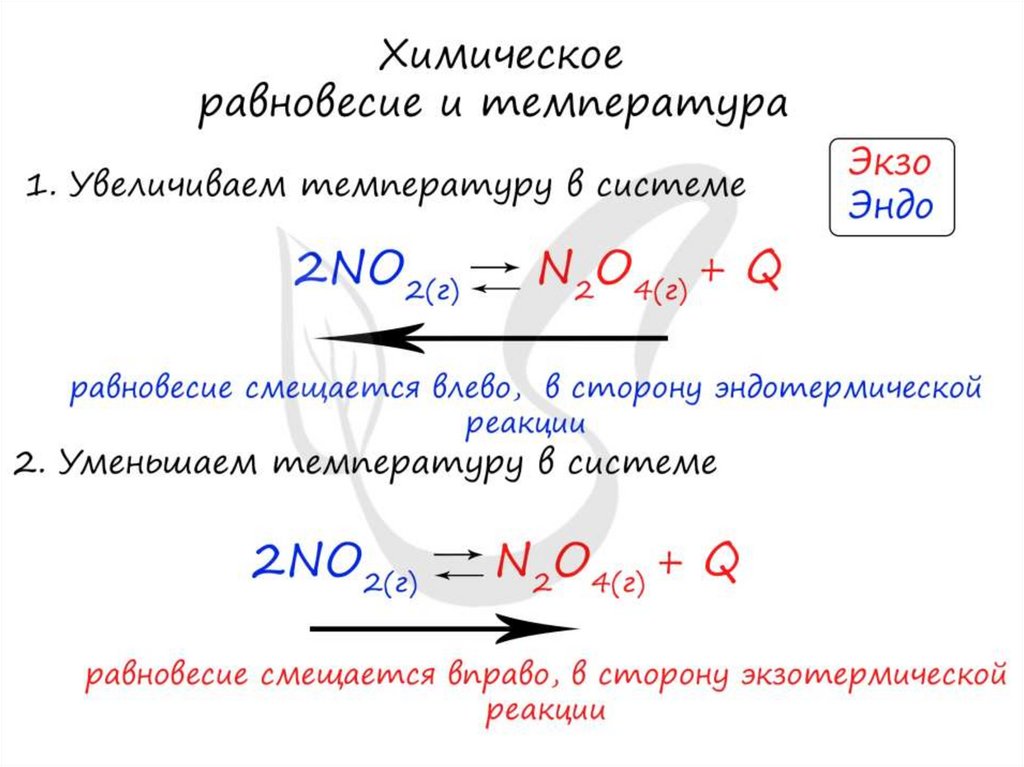
Изменение температурыи химическое равновесие
• Если в задании увеличивают или уменьшают
температуру, то первое, что вы должны оценить:
экзотермическая это реакция или
эндотермическая.
• Следуйте следующему правилу: "При
увеличении температуры равновесие смещается
в сторону эндотермической реакции, при
уменьшении - в сторону экзотермической
реакции". У любой обратимой реакции есть
экзо- и эндотермические части:
26.
27.
28.
29.
Катализатор и ингибитор• Действие катализатора и ингибитора
соответственно касается только ускорения и
замедления химической реакции. Они никоим
образом не влияют на равновесие.
30.
31.
Домашнее задание• Параграф 3.
• Изучить материал урока. Сделать опорный
конспект.
• Пройти онлайн тест по ссылке. Результат
сообщить учителю.
• https://onlinetestpad.com/ru/testview/38071khimicheskoe-ravnovesie






















 chemistry
chemistry








