Similar presentations:
Электронное строение атома (11 класс)
1.
11 классбазовый уровень
16.09.2024
1
2.
Семейства элементов:деление на семейства зависит от того,
какой подуровень у элемента
заполняется последним:
S-элементы
элементы
главных подгрупп
p-элементы
d-элементы
элементы
побочных подгрупп
f-элементы
16.09.2024
2
3.
Расположение ē-ов поорбиталям в атомах I периода
1 уровень содержит 1-S-подуровень max 2ē
1S1
H
1S2
семейство S-элементов
He
http://www.xumuk.ru/esa/fs.html
16.09.2024
3
4.
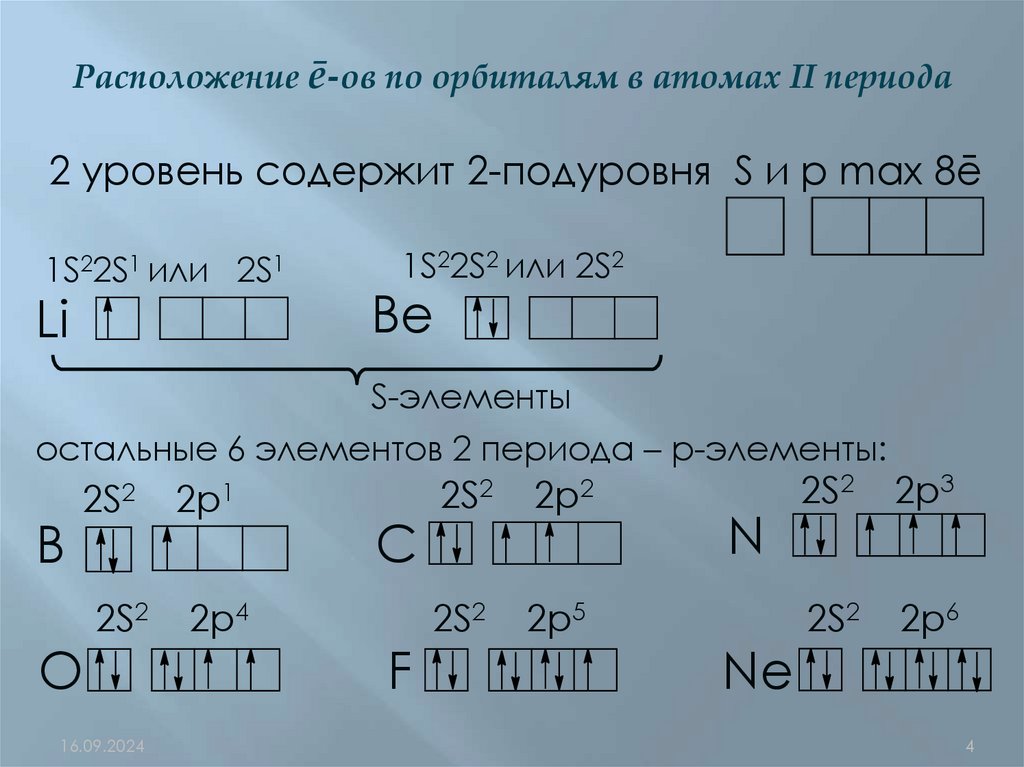
Расположение ē-ов по орбиталям в атомах II периода2 уровень содержит 2-подуровня S и р max 8ē
1S22S1 или 2S1
Li
1S22S2 или 2S2
Be
S-элементы
остальные 6 элементов 2 периода – р-элементы:
B
2S2
2p1
2S2
2p4
O
16.09.2024
C
F
2S2
2p2
2S2
2p5
N
Ne
2S2
2p3
2S2
2p6
4
5.
Расположение ē-ов по орбиталям в атомах III периода3 уровень содержит 3-подуровня S, р и d max 18ē
Na
3S1
Mg
2 S-элемента
3S2
остальные 6 элементов 3 периода – р-элементы:
Al
S
3S2
3p1
3S2
3p4
16.09.2024
Si 3S2 3p2
P 3S2 3p3
Cl 3S2 3p5
Ar 3S2 3p6
5
6.
S-элементыэто первые два элемента в каждом
периоде, расположены в I и II группе, глав.
подгруппе (искл. Не)
I группа
II группа
H
Li
1S1
He
2S1
Be
1S2
(исключение)
2S2
Mg
3S1
3S2
Na
электронные аналоги – это элементы со
сходным строением внешнего
1 – Cs
….6S
энергетического уровня;
16.09.2024
….4S2 – Ca
6
7.
р-элементыэто последние шесть элементов в каждом
периоде, кроме 1 и последнего;
расположены в III-VIII группах, глав.
подгруппах (искл. Не)
элементы – электронные аналоги
III
группа
IV
группа
V
группа
VI
группа
VII
группа
VIII
группа
2S2 2p1
2S2 2p2
2S2 2p3
2S2 2p4
2S2 2p5
2S2 2p6
B
3S2 3p1
Al
C
Si
3S2 3p2
N
P
3S2 3p3
….5p1 – In
16.09.2024
O
S
3S2 3p4
F
3S2 3p5
Cl
Ne
3S2 3p6
Ar
….4p5 – Br
7
8.
Расположение ē-ов по орбиталям в атомах IV периода4 уровень содержит 4-подуровня S, р, d и f
max 32ē
затем
10элементы
элементов
IV период
– d-элементы:
6 р–элементов:
2 завершают
первыхглавных
подгрупп S-элементы:
Ga
K
Sc
104p1
4S23d
4S213d1
4S
As
Ca
Mn
3
4S24S
3d210
4p
4S23d5
KrZn
6
23d
4S23d
4p10
4S10
16.09.2024
8
9.
d-элементыэто 10 элементов в больших периодах,
расположены во всех группах, побочных
подгруппах между S и р- элементами;
у d-элементов на внешнем уровне, как
правило, 2 ē, реже 1-0;
заполняется предвнешний уровень
(d-подуровень) – с 8 до 18 ē;
элементы – электронные аналоги
….3d6 – Fe
….5d2 – Hf
16.09.2024
....4d3 – Nb
9
10.
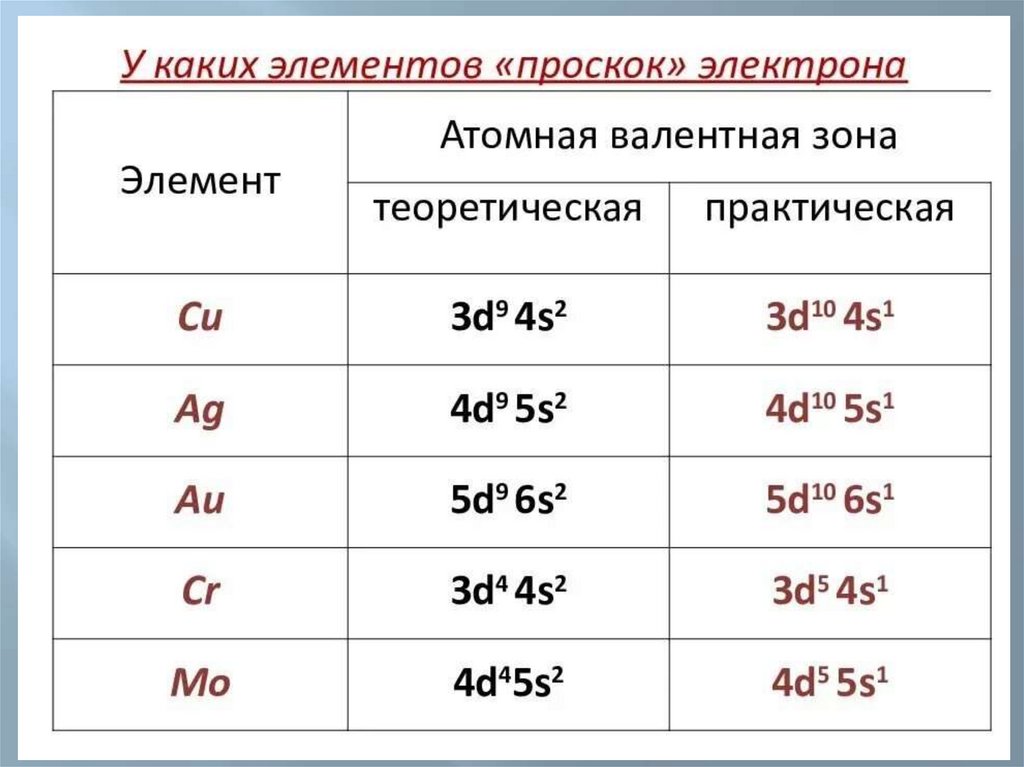
Некоторые аномалии электронногостроения атомов
установлено, что у d–орбиталей особо
4S23d4
Cr
устойчивыми конфигурациями являются d5 и
d10 , а у f–орбиталей f 7 и f 14;
4S13d5
в связи с этим в основном состоянии атома
наблюдается «провал» (проскок) ē с
23d9
4S
Cu
внешнего
S–подуровня на предвнешний d–
подуровень.
4S13d10
«провал» происходит у элементов:
16.09.2024
10
№ 29, 47, 79(1 группа); № 24, 42 (6 группа) и др.
11.
12.
Упражнение 1:Назовите элементы:
а) 5p3;
б)4S2;
в) 4d55S1;
г)4р1;
д) 3d8;
16.09.2024
е) 3d6;
ж)5d4;
з) 7S2;
и)6d6
к) 3d54S1;
л) 6p4;
м) 5d106S1;
н) 5S2
о) 4p6
п) 4S1;
12










 chemistry
chemistry








