Similar presentations:
Состояние электронов в атомах
1. Тема урока
Состояние электронов в атоме.Периодическое изменение свойств
химических элементов в периодах и в
главных подгруппах.
2. Внимание, вопрос:
1.Простое или сложное строение имеет атом? Чем этоможно подтвердить?
2.Из каких частей состоит атом? Какие частицы
образуют эти части?
3.Как определить заряд ядра атома и число электронов
этого атома?
4. Что называют энергетическим уровнем? Как
определить число энергетических уровней в атоме
химического элемента?
5.Как определить, сколько электронов может
максимально находиться на том, или ином
энергетическом уровне?
3. Внимание, вопрос:
6. Правильно ли записано распределениеэлектронов по энергетическим уровням
у указанных элементов? Почему?
Мg ) ) )
K )))
C ))
+ 12 2 8 2
+ 19
2 8 9
+6 3 3
4. Подумайте!
Почему на энергетических уровнях,содержащих довольно большое число
электронов, электроны не сталкиваются
между собой?
5. Движение электрона вокруг ядра в атоме водорода
6. Формы электронных облаков
7.
S8. Схематическое изображение электронных орбиталей
Sd
p
f
9. Заполненная электронами s- орбиталь
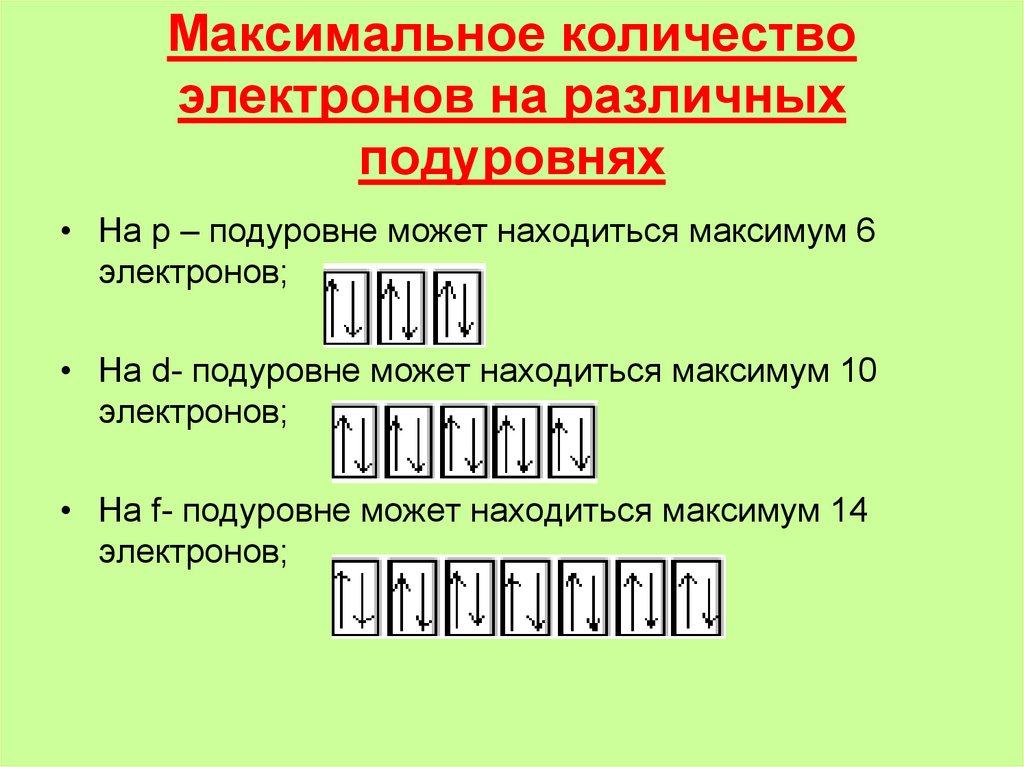
10. Максимальное количество электронов на различных подуровнях
• На р – подуровне может находиться максимум 6электронов;
• На d- подуровне может находиться максимум 10
электронов;
• На f- подуровне может находиться максимум 14
электронов;
11. Деление энергетических уровней на подуровни
Номер энергетическогоуровня
Виды подуровней
Первый уровень
s
Второй уровень
s; p
Третий уровень
s; p; d
Четвёртый и
последующие уровни
s; p; d; f
12. Прочтите и укажите, что это означает.
53р ;
4s1;
3d7;
5f12
13. Заполнение электронами первого энергетического уровня
1s1Н )
+1
1
2s2
He )
+2 2
14. Заполнение электронами s- подуровня второго энергетического уровня
Заполнение электронами sподуровня второгоэнергетического уровня
1s2 2s1
Li ) )
+3 2 1
1s2 2s2
Be ) )
+4
2 2
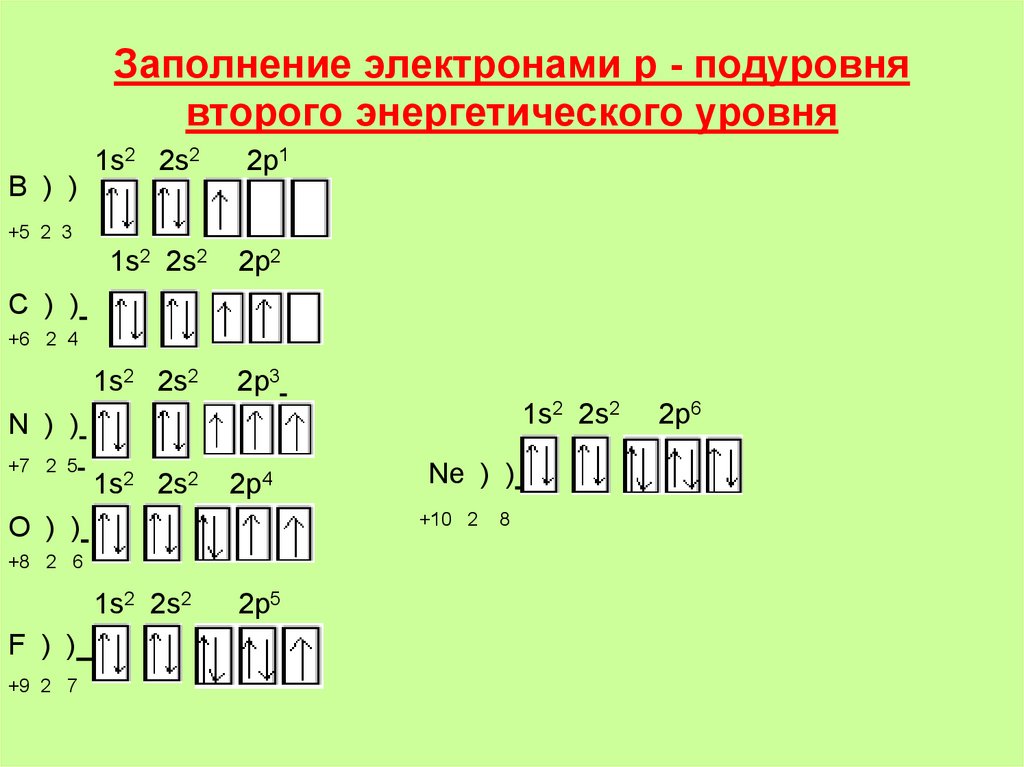
15. Заполнение электронами р - подуровня второго энергетического уровня
B ) )1s2 2s2
2p1
1s2 2s2
2p2
1s2 2s2
2p3
+5 2 3
C ) )
+6 2 4
1s2 2s2
N ) )
+7 2 5
1s2 2s2
2p4
+10 2
O ) )
+8 2 6
1s2 2s2
F ) )
+9 2 7
Ne ) )
2p5
8
2p6
16. Электронная конфигурация атома натрия
1s2 2s2 2p6 3s1Na ) ) )
+11
2 8 1
17. Продолжение заполнения электронами третьего энергетического уровня.
1s2 2s22p6
1s2 2s2
3s2
Ar ) ) )
Mg ) ) )
+12
+18 2 8 8
2 8 2
1s2 2s2
2p6
3s2
1s2 2s2
2p6
3s2
1s2 2s2
2p6
3p1
Al ) ) )
+13 2 8 3
Si ) ) )
3p2
+ 14 2 8 4
P )))
+15 2 8 5
S )))
1s2 2s2
2p6
1s2 2s2
2p6
3s2
3s2
3p3
3p4
+16 2 8 6
Cl ) ) )
+17 2 8 7
3s2
3p5
2p6
3s2
3p6
18. Электронная конфигурация атомов калия и кальция
К ))))+19
2p6
1s2 2s2
2p6
3s2
3p6
3d0
4s1
2 8 8 1
Са ) ) ) )
+20
1s2 2s2
2 8 8 2
3s2
3p6
3d0
4s2
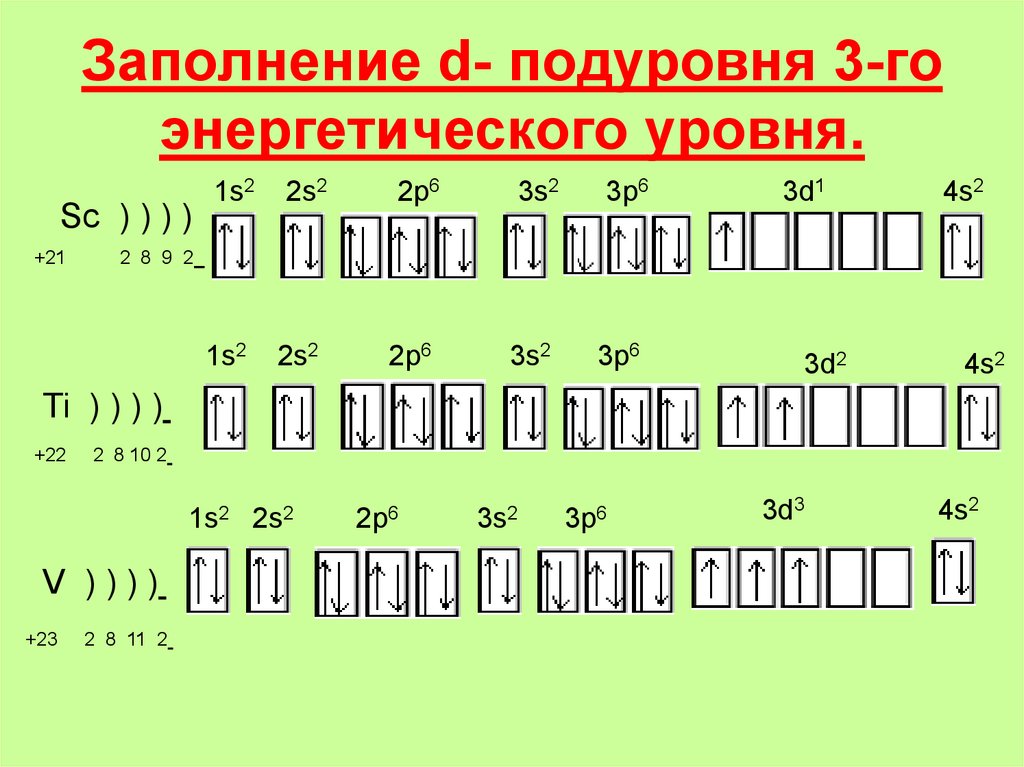
19. Заполнение d- подуровня 3-го энергетического уровня.
Sc ) ) ) )+21
1s2
2s2
2p6
3s2
3p6
1s2
2s2
2p6
3s2
3p6
3d1
4s2
2 8 9 2
3d2
4s2
Ti ) ) ) )
+22
2 8 10 2
1s2 2s2
V ))))
+23
2 8 11 2
2p6
3s2
3p6
3d3
4s2
20. Заполнение р - подуровня 4-го энергетического уровня
1s2 2s22p6
3s2
3p6
1s2 2s2
2p6
3s2
3p6
1s2 2s2
2p6
3d10
4s2
4p1
3d10
4s2
4p2
3d10
4s2
4p6
Ga ) ) ) )
+31
2 8 18 3
Ge ) ) ) )
+32
2 8 18 4
Kr ) ) ) )
+36
2 8 18 8
3s2
3p6
21. Электронная конфигурация атома
1s2 2s22p6
3s2
3p6
3d10
4s2
Kr ) ) ) )
+36
2 8 18 8
Kr 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
+ 36
4p6
22. Электронные конфигурации элементов первой группы главной подгруппы
H 1s1Li 1s2 2s1
Na 1s2 2s2 2p6 3s1
K 1s2 2s2 2p6 3s2 3p6 3d0 4s1
Rb 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d0 4f0 5s1
Cs 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d104f0 5s2 5p6 5d0 5f0 6s1
Fr 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f0 6s2 6p6 6d0 6f07s1
23. Заполнение электронами второго энергетического уровня
Li 1s2 2s1 2p0
Be 1s2 2s2 2p0
B 1s2 2s2 2p1
C 1s2 2s2 2p2
N 1s2 2s2 2p3
O 1s2 2s2 2p4
F 1s2 2s2 2p5
Ne 1s2 2s2 2p6
24. Назовите элемент электронную конфигурацию которого вы видите на экране
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d104f14 5s2 5p6 5d10 5f0 6s2 6p2
25.
«Периодическому закону будущее негрозит разрушением, а только
надстройка и развитие обещаются.»





















 chemistry
chemistry








